用CIA模型探討壯醫(yī)滾克陽證與陰證動物模型的建立
梁江洪 李鳳珍 龍朝陽 鐘麗雁 柏春暉 梁 艷 蔣桂江 王苑儷
廣西壯族自治區(qū)民族醫(yī)藥研究院,廣西 南寧 530001
?
實驗研究
用CIA模型探討壯醫(yī)滾克陽證與陰證動物模型的建立
梁江洪李鳳珍*龍朝陽鐘麗雁柏春暉梁艷蔣桂江王苑儷
廣西壯族自治區(qū)民族醫(yī)藥研究院,廣西南寧530001
目的:以膠原誘導(dǎo)性關(guān)節(jié)炎(CIA)模型為基礎(chǔ),附加模擬的風(fēng)、寒、濕、熱環(huán)境,建立符合壯醫(yī)病因理論的動物模型。方法:將40只雌性Wistar大鼠隨機(jī)分為空白組、模型組、陽證組與陰證組每組各10只,除空白外均采用弗氏不完全佐劑和牛II型膠原蛋白誘導(dǎo)大鼠CAI模型,陽證組在每天附加風(fēng)、濕、熱刺激持續(xù)1h,條件控制:風(fēng)速5m/s,相對濕度90%,溫度(37±1)℃;陰證組每天附加風(fēng)、寒、濕刺激持續(xù)1h,條件控制:風(fēng)速5m/s,相對濕度90%,溫度(8±1)℃。比較各組大鼠關(guān)節(jié)炎-體長溫度差值、計算關(guān)節(jié)炎癥積分以及ELISA只測定TNF-α、IL-1β水平的差異結(jié)果:陰證組關(guān)節(jié)-體表溫度差值、炎癥指數(shù)方面均低于陽證組,差異有統(tǒng)計學(xué)意義(P<0.05);陰證組大鼠血清TNF-α、IL-1β水平均低于陽證組,差異有統(tǒng)計學(xué)意義(P<0.05)。結(jié)論:通過風(fēng)、寒、濕刺激的CIA大鼠可做為陰證模型的參考,通過風(fēng)、濕、熱刺激的CIA大鼠可做為陽證模型的參考。同時也存在造模復(fù)雜化、大鼠死亡率增的缺點,有待進(jìn)一步完善。
動物模型;滾克;類風(fēng)濕關(guān)節(jié)炎;陽證與陰證;壯醫(yī)
類風(fēng)濕關(guān)節(jié)炎是臨床常見的自身免疫性疾病,其發(fā)病機(jī)制非常復(fù)雜,主要的病理表現(xiàn)為滑膜增生、炎癥細(xì)胞浸潤、血管翳形成并造成軟骨和骨質(zhì)破壞[1-2]。目前常用CIA模型來研究類風(fēng)濕關(guān)節(jié)炎的發(fā)病機(jī)制,但該模型的發(fā)生機(jī)制目前尚無定論,可以肯定:免疫系統(tǒng)對CⅡ的高度敏感性是該模型建立的主要原因[3],細(xì)胞和體液免疫均參與了病理過程[4-5]。類風(fēng)濕關(guān)節(jié)炎在壯醫(yī)的病名為滾克,緣由風(fēng)、寒、濕、熱毒侵襲人體,阻滯三道兩路而致病,臨床辨證分為陽證、陰證。本研究嘗試以CIA模型為基礎(chǔ),附加模擬的風(fēng)、寒、濕、熱環(huán)境,建立符合壯醫(yī)病因理論的動物模型,為后續(xù)相關(guān)動物實驗提供參考。
1 材料和造模
1.1實驗材料SPF級雌性Wistar大鼠(生產(chǎn)許可證:SCXK2014-0002),體重(110±20)g,購自廣西中醫(yī)藥大學(xué)實驗動物中心。牛Ⅱ型膠原蛋白(批號:150230)、弗氏不完全佐劑(批號:150207)、IL-1β(批號:1006-63)、TNF-α試劑盒(批號:1100-86)購于北京博蕾德生物科技有限公司。
1.2造模箱制作參考文獻(xiàn)[6]自制造模箱,以自行改裝的空調(diào)系統(tǒng)控制箱內(nèi)溫度,以超聲霧化器霧化滅菌水控制箱內(nèi)濕度,以鼓風(fēng)機(jī)提供風(fēng)源。1.3CIA大鼠造模方法在無菌條件下,用0.1mol/L冰醋酸充分溶解牛II型膠原蛋白,制成濃度為4mg/L溶液,再按1∶1體積與弗氏不完全佐劑混合、震蕩并充分乳化,制成CII乳劑,保存于4℃冰箱備用。試驗時每只大鼠CII乳劑0.25mL于頸、背、尾部分多點皮內(nèi)注射致炎(初次免疫),于7d后按上述方法再次免疫。
2 實驗分組及方法
40只大鼠,適應(yīng)性飼養(yǎng)7d后,隨機(jī)選30只按上述方法造模,造模成功后再隨機(jī)分為模型組、陽證組、陰證組,每組10只;余下10只未造模大鼠為空白組。均于室溫(恒溫(20±2)℃,相對濕度50%~60%)下正常喂養(yǎng)。陽證組在首次接受膠原蛋白注射開始同時每天給予風(fēng)、濕、熱刺激持續(xù)1h,條件控制:風(fēng)速5m/s,相對濕度90%,溫度(37±1)℃;陰證組在首次接受膠原蛋白注射開始同時每天給予風(fēng)、寒、濕刺激持續(xù)1h,條件控制:風(fēng)速5m/s,相對濕度90%,溫度(8±1)℃。
3 觀察和指標(biāo)
3.1關(guān)節(jié)-體表溫度差值各組大鼠以最腫脹關(guān)節(jié)體表溫度與腹部體表溫度差值進(jìn)行比較。體表溫度測量方法,于室溫下,相同時間點用非接觸式紅外測溫儀在相同的距離內(nèi)測量。
3.2關(guān)節(jié)炎癥積分采用關(guān)節(jié)炎指數(shù)積分法評定,評定依據(jù)為關(guān)節(jié)紅腫程度和范圍以及關(guān)節(jié)腫大和變形情況[7]。0分:無關(guān)節(jié)炎;1分:有紅色斑點或輕度腫脹;2分:關(guān)節(jié)部位中度腫脹;3分:關(guān)節(jié)嚴(yán)重腫脹;4分:關(guān)節(jié)嚴(yán)重腫脹且不能負(fù)重。每個肢體最高積分為4分,每只鼠最高積分為16分。3.3血清TNF-α、IL-1β含量于第1次膠原蛋白注射后的第22天,水合氯醛麻醉各組大鼠,腹主動脈采血,分離血清待測,未測的血清放入-4℃低溫冰箱保存。IL-1β、TNF-α均采用ELISA法,按照試劑盒說明書進(jìn)行。
4 統(tǒng)計學(xué)處理
5 結(jié)果
5.1關(guān)節(jié)表面-體表溫差關(guān)節(jié)表面-體表溫差(簡稱差值)比較,空白組大鼠膝關(guān)節(jié)表面溫度均低于體表溫度,與模型組比較,差值明顯增高,差異有統(tǒng)計學(xué)意義(P<0.01)。陰證組差值小于模型組,差異有統(tǒng)計學(xué)意義(P<0.01),表明陰證組關(guān)節(jié)表面溫差低于模型組;陽證組差值與模型組比較,差異無統(tǒng)計學(xué)意義(P>0.05),表明陽證組關(guān)節(jié)表面溫差與模型組相當(dāng);陰證組差值與陽證組比較,差異有統(tǒng)計學(xué)意義(P<0.05),表明陰證組關(guān)節(jié)表面溫差低于陽證組。見表1。5.2關(guān)節(jié)炎癥指數(shù)空白組炎癥指數(shù)為0,與模型組比較,炎癥指數(shù)增高,差異有統(tǒng)計學(xué)意義(P<0.01)。與模型組比較,陽證組關(guān)節(jié)炎癥指數(shù)差異無統(tǒng)計學(xué)意義(P>0.05),陰證組關(guān)節(jié)炎癥指數(shù)小于模型組,差異具有統(tǒng)計學(xué)意義(P<0.05),表明陰證組關(guān)節(jié)炎癥程度低于模型組。與陽證組比較,陰證組關(guān)節(jié)炎癥指數(shù)小于陽證組,差異有統(tǒng)計學(xué)意義(P<0.05),表明陰證組關(guān)節(jié)炎癥指數(shù)小于陽證組。見表1。

表1 關(guān)節(jié)表面-體表溫度差、炎癥指數(shù) ±s)
注:與空白組比較,*P<0.01;與模型組比較,△P<0.01,#P<0.05;與陽證組比較,△△P<0.05。
5.3炎癥因子與空白組比較,模型組TNF-α、IL-1β值均明顯升高,差異有統(tǒng)計學(xué)意義(P<0.01)。與模型組比較,陽證組TNF-α、IL-1β統(tǒng)計學(xué)差異(P>0.05),陰證組TNF-α、IL-1β值小于模型組,差異有統(tǒng)計學(xué)意義(P<0.05),表明陰證組TNF-α、IL-1β水平低于模型組。與陽證組比較,陰證組TNF-α、IL-1β值小于陽證組,差異有統(tǒng)計學(xué)意義(P<0.01),表明陰證組TNF-α、IL-1β水平明顯低于陽證組。見表2。
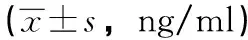
表2 血清中TNF-α、IL-1β含量
注:與空白組比較,*P<0.01;與模型組比較,△P<0.05;與陽證組比較,##P<0.01。
6 結(jié)論
本研究結(jié)果表明,陰證組關(guān)節(jié)-體表溫度差值、炎癥指數(shù)方面均低于陽證組(P<0.05),陰證組大鼠血清TNF-α、IL-1β水平均低于陽證組(P<0.05)。表明在比較成熟的CIA模型基礎(chǔ)上,附加風(fēng)、寒、濕、熱等外界刺激,會對模型大鼠產(chǎn)生影響:通過風(fēng)、寒、濕刺激的模型大鼠可做為陰證模型的參考;通過風(fēng)、濕、熱刺激的模型大鼠可做為陽證模型的參考。同時,結(jié)果表明,陽證組與模型組在表溫度差值、炎癥指數(shù)、血清TNF-α和IL-1β水平方面無統(tǒng)計學(xué)意義(P>0.05),可說明CIA急性期多表現(xiàn)為陽證。本研究探索在CIA模型基礎(chǔ)上建立壯醫(yī)滾克病因?qū)W說中的陰、陽兩證模型取得初步成效,同時也存在造模復(fù)雜化、大鼠死亡率增高的缺點,有待進(jìn)一步完善。
[1]ScottDL, Wolfe F, Huizinga TW, et al. Rheumatoid arthritis[J].Lancet, 2010,376(9746),1094-1108.
[2]Kourilovitch M, Galarza-Maldonado C, Ortiz-Prado E3.Diagnosis and classification of rheumatoid arthritis[J]. Journal of Autoimmunity, 2014,48-49:26-30.
[3]Trentham D E,Townes A S,Kang A H.Autoimmunity to typeⅡcolla-gen:an experimental model of arthritis[J].J Exp Med,1977,146:857-866.
[4]湯文璐,李俊,徐叔云.Ⅱ型膠原性關(guān)節(jié)炎動物模型的研究概況[J].中國藥理學(xué)通報,1998,14(6):495-498.
[5]陳柏松,徐玉東,鐘淑琦,等.大鼠佐劑性關(guān)節(jié)炎模型的建立與評價[J].哈爾濱醫(yī)科大學(xué)學(xué)報,2005,39(6):489-491.
[6]肖長虹,顧為望,李留洋,等.類風(fēng)濕性關(guān)節(jié)炎風(fēng)寒濕痹與風(fēng)濕熱痹動物模型的研究[J].中醫(yī)雜志,1996,37(8):492-496.
[7]張鈞用.現(xiàn)代藥理實驗方法[M].北京:北京大學(xué),中國協(xié)和醫(yī)科大學(xué)聯(lián)合出版社,1998:1383.
(編輯:梁志慶)
2016-06-23
廣西科學(xué)研究與技術(shù)開發(fā)計劃課題(桂科攻13349006)。
梁江洪(1962-),女,壯族,大學(xué)本科,副主任醫(yī)師,從事風(fēng)濕病的壯醫(yī)診治研究,E-mail:gxzyyyfsk2006@163.com
李鳳珍(1967-),女,壯族,大學(xué)本科,主任醫(yī)師,從事風(fēng)濕病的壯醫(yī)診治研究,E-mail:lifengzhen2005@163.com
R965.1
A
1007-8517(2016)17-0025-02

