中和劑對大腸桿菌工程菌HBUT-L16發酵產L-乳酸的影響
文 瑤,周 瑋,劉 棗,王永澤*,王金華
(湖北工業大學 發酵工程教育部重點實驗室 工業發酵湖北省協同創新中心,湖北 武漢 430068)
中和劑對大腸桿菌工程菌HBUT-L16發酵產L-乳酸的影響
文瑤,周瑋,劉棗,王永澤*,王金華
(湖北工業大學 發酵工程教育部重點實驗室 工業發酵湖北省協同創新中心,湖北 武漢 430068)
該文對前期構建的產高光學純度L-乳酸的大腸桿菌工程菌HBUT-L進行了耐乳酸鈉的馴化,并對馴化前后菌株發酵產L-乳酸的中和劑進行了選擇和對比。結果表明,經過28代馴化后的菌株HBUT-L16以Ca(OH)2作中和劑時發酵效果較NaOH為中和劑時效果好,L-乳酸產量、糖酸轉化率及生產強度分別提高了6.6%、5.6%、44.4%。與馴化前菌株HBUT-L的發酵結果相比,HBUT-L16以Ca(OH)2為中和劑進行發酵時,乳酸產量提高了4.4%,糖酸轉化率提高了2.8%,生產強度增加了26.71%;而以NaOH為中和劑時,對馴化前后菌株的發酵效果影響不大,由此推測耐乳酸鈉的馴化主要通過提高工程菌對乳酸根的耐受性而非鈉離子的耐受性,來提高L-乳酸的產量。
大腸桿菌工程菌;L-乳酸;馴化;中和劑
目前,L-乳酸及其衍生物廣泛應用于食品行業和醫藥行業,而且L-乳酸作為生物降解材料聚乳酸的單體越來越受到人們的重視,極具應用前景。大腸桿菌(Escherichiacoli)具有遺傳背景清楚、易于進行基因工程改造、發酵周期較短和營養要求簡單等優點,近年來,在L-乳酸生產中扮演了重要角色[1-2]。
前期已構建成功一批大腸桿菌工程菌用于L-乳酸的發酵,并研究了不同中和劑對其發酵產乳酸的影響[3-5]。在此基礎上,擬進一步通過耐乳酸鹽的馴化,提高菌株對發酵產物的耐受性,達到提高發酵乳酸的產量、糖酸轉化率及生產強度的目的。但高濃度乳酸鹽除了乳酸根以外,還存在陽離子,因此在馴化大腸桿菌其耐受性時,到底是提高了菌株耐乳酸根的能力,還是提升了菌株耐陽離子的能力不容易判斷。這個問題關系到乳酸發酵中和劑的選擇,這是因為在乳酸發酵過程中,不同中和劑會帶來一些不同濃度的離子而影響發酵。如以氨水作為中和劑時,發酵液中NH4+濃度積累到一定程度,就開始抑制菌體的生長及代謝產酸的能力[6]。研究表明,以Ca(OH)2為中和劑時,Ca2+的存在對菌體的生長有促進作用[7],以NaOH作中和劑,會帶來一定濃度的鈉離子[8]。如能判斷出馴化后菌株對離子的耐受性,無疑對中和劑的選擇有較大的幫助。
本研究擬對大腸桿菌工程菌HBUT-L進行了耐乳酸鈉的馴化后,再對馴化前后菌株發酵產L-乳酸的中和劑進行了選擇和對比,以期了解乳酸鈉馴化對大腸桿菌發酵產L-乳酸時中和劑的選擇帶來影響。
1 材料與方法
1.1材料與試劑
1.1.1菌株
實驗菌株大腸桿菌(Escherchia coli)HBUT-L,為本實驗室構建并保藏于-80℃冰箱。以D-乳酸工程菌HBUT-D為出發菌株[9],敲除其D-乳酸脫氫酶基因,同時插入帶有自身啟動子序列的L-乳酸脫氫酶基因,具有良好的L-乳酸發酵特性[10]。
1.1.2培養基
乳酸鈉馴化培養基:參照文獻[11]配制NBS培養基,按實驗設計添加0~14%的乳酸鈉和20 g/L的葡萄糖。發酵種子培養基:含有20 g/L葡萄糖的NBS培養基。搖瓶發酵培養基:150 mL NBS培養基,40 g/L碳酸鈣,70 g/L葡萄糖。
發酵培養基:3 L NBS培養基,100 g/L葡萄糖。
1.1.3主要試劑
蛋白胨(生化試劑):上海盛思生化科技有限公司;酵母粉(生化試劑):安琪酵母股份有限公司;氯化鈉、碳酸鈣、乳酸鈉、Ca(OH)2、NaOH(分析純):國藥集團化學試劑有限公司;葡萄糖(分析純):山東祥瑞藥業有限公司;瓊脂(生化試劑):上海拜力生物科技有限公司;D-乳酸鈉和L-乳酸鈉(色譜級):美國SIGMA-ALORICH公司;葡萄糖標準樣:山東省科學院生物研究所。
1.2儀器與設備
7 L發酵罐:德國貝朗醫療有限公司;SBA-40D生物傳感儀:山東省科學院生物研究所;e2695高效液相色譜:美國Waters公司。
1.3實驗方法
1.3.1HBUT-L的適應性馴化及搖瓶驗證
挑取活化好的平板單菌落4~6個接種至150 mL含有2%乳酸鈉的馴化培養基的250 mL錐形瓶中,于37℃、200 r/min條件下培養24 h后轉代培養,每代測菌體生物量(OD600nm),當連續數代OD600nm值變化較小時,按2%的接種量轉接至150 mL含4%乳酸鈉的新鮮馴化培養基中,繼續傳代培養,依此類推,逐漸將乳酸鈉含量提高至12%,并在此濃度條件下反復馴化培養直至OD600nm值趨于平穩,對馴化后的菌株命名為HBUT-L16。
分別對HBUT-L和HBUT-L16進行搖瓶發酵。挑取LB平板上活化好的單菌落4~6個,接種至含有150 mL新鮮NBS培養基的250 mL錐形瓶中,37℃、200 r/min培養7~8 h后,獲得種子液。按2%的接種量接種至搖瓶發酵培養基中,發酵條件為:37℃,200 r/min。定時取樣,檢測樣品中菌體生物量(OD600nm值)、殘留葡萄糖濃度、L-乳酸含量及其光學純度。
1.3.2中和劑對HBUT-L發酵效果的影響
分別對馴化前的菌株和馴化后的菌株在7 L發酵罐中進行發酵。挑取LB平板上活化好的單菌落4~6個,接種至含有300mL新鮮NBS培養基的1L錐形瓶中,37℃、200 r/min培養7~8 h后,獲得種子液。發酵罐中初始裝液體積為3 L,接種量為10%。發酵條件為:37℃,200 r/min,中和劑分別采用3 mol/L Ca(OH)2和6 mol/L NaOH,通過自動流加中和劑的方式控制發酵液pH在7.0左右。定時取樣,檢測樣品中菌體生物量(OD600nm值)、殘留葡萄糖濃度、L-乳酸含量。
1.3.3測定方法
樣品中菌體生物量(OD600nm值)、殘留葡萄糖濃度、L-乳酸含量參照文獻[10-11]的方法進行;發酵液中有機酸副產物乙酸、琥珀酸的測定按照參考文獻[9-10]的方法進行。
2 結果與分析
2.1HBUT-L在乳酸鈉中適應性馴化的結果
為了提高HBUT-L在較高濃度乳酸鹽條件下的生長能力,采用一定濃度梯度的乳酸鈉對其進行了長期的適應性馴化,馴化后的菌株命名為HBUT-L16。
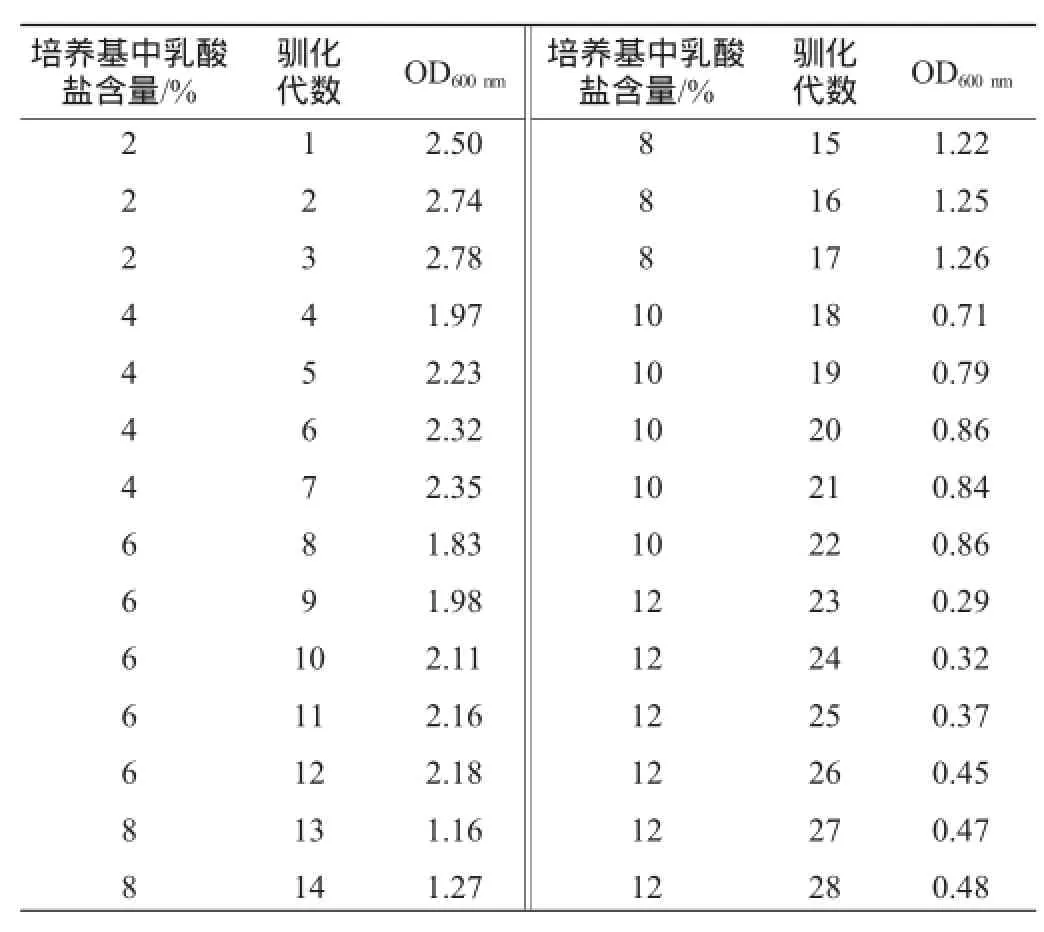
表1 大腸桿菌HBUT-L在乳酸鹽中的適應性馴化結果Table 1 Adaptive domestication results ofE.coliHBUT-L in lactate
本研究在對菌株HBUT-L進行傳代培養時,逐漸提高乳酸鈉的含量,來緩解乳酸根對大腸桿菌HBUT-L菌體生長的抑制。從表1的結果可知,馴化28代后的菌株HBUT-L16在12%乳酸鹽含量條件下培養所得OD600nm值為0.48,與馴化前OD值相比有較大的降低。但與一些在乳酸根濃度在10%以上就停止生長的菌株[13]相比,經過28代馴化得到的菌株HBUT-L16具有較好的生長特性。
為了驗證乳酸鈉對HBUT-L的馴化效果,對馴化前后的菌株在搖瓶中的發酵結果進行了對比分析,結果如表2所示。
由表2可知,經過馴化,殘糖由馴化前的10.23 g/L降低至3.34 g/L,乳酸產量提高了15.29%。
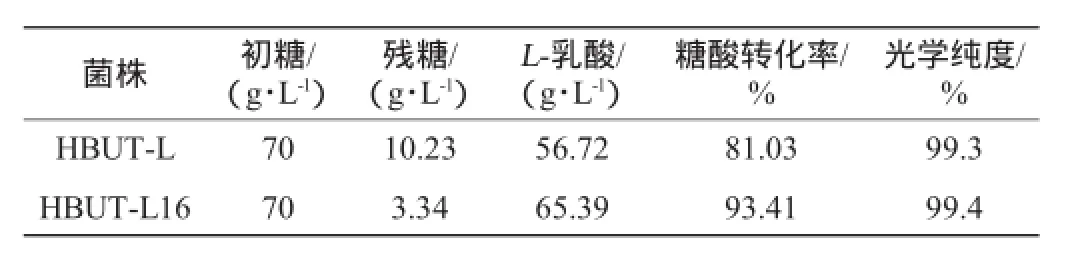
表2 馴化前后搖瓶發酵效果的比較Table 2 Results of fermentation in shake flask before and after domestication
2.2馴化前菌株在不同中和劑中的發酵效果
為了研究馴化前菌株在不同中和劑中的發酵效果,試驗中分別采用3mol/LCa(OH)2和6mol/LNaOH作為中和劑對菌株HBUT-L進行發酵研究,發酵結果分別如圖1、圖2所示。
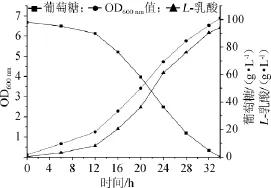
圖1 菌株HBUT-L以Ca(OH)2為中和劑發酵動力學曲線Fig.1 Fermentation kinetic curve of strain HBUT-L using Ca(OH)2as neutralizer
從圖1可以看出,以Ca(OH)2為中和劑進行L-乳酸發酵時,在發酵初期0~12 h,菌體以生長為主,12 h以后菌體生長迅速,發酵到24 h,菌體生長趨于緩慢;從糖耗來看,發酵初期0~12h,葡萄糖消耗較為緩慢,12 h后發酵液中葡萄糖含量急劇下降,34 h后未檢測到殘糖;與生長相對應,發酵到12 h,L-乳酸合成速率加快,發酵至32 h,乳酸產量為94.05 g/L。
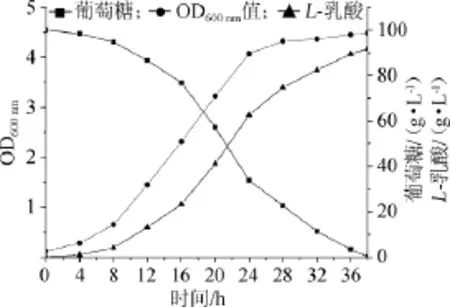
圖2 菌株HBUT-L以NaOH為中和劑發酵動力學曲線Fig.2 Fermentation kinetic curve of strain HBUT-L using NaOH as neutralizer
從圖2可以看出,菌株HBUT-L以NaOH為中和劑發酵乳酸時,發酵初期0~4 h,菌體生長緩慢,4 h以后菌體快速生長,發酵到24 h,菌體生長進入穩定期;發酵4 h后葡萄糖消耗速率明顯加快,24 h后葡萄糖消耗速率開始減慢,38 h達到發酵終點,殘留葡萄糖僅為0.23 g/L;與菌體生長相對應,L-乳酸的產量在發酵4 h后就快速增加,發酵24 h后產量增加幅度變緩,乳酸最終產量為91.72 g/L。
2.3馴化后菌株在不同中和劑中發酵效果
為了研究馴化后菌株在不同中和劑的發酵效果,試驗中分別采用3 mol/L Ca(OH)2和6 mol/L NaOH為中和劑對HBUT-L16進行發酵研究,發酵結果分別如圖3、圖4所示。
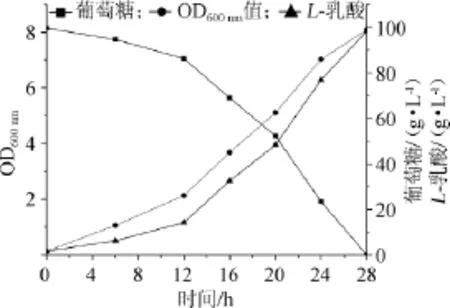
圖3 菌株HBUT-L16以Ca(OH)2為中和劑發酵動力學曲線Fig.3 Fermentation kinetic curve of strain HBUT-L16 using Ca(OH)2as neutralizer
從圖3可以看出,菌株HBUT-L16以Ca(OH)2為中和劑進行L-乳酸發酵時,發酵初期0~12 h,菌體生長較為緩慢,12h以后菌體生長迅速,發酵到24h,菌又體生長趨于緩慢;糖耗和菌體生長的趨勢基本相關,發酵12 h后葡萄糖消耗急劇增加,發酵到28 h,已檢測不到發酵液中的殘糖;L-乳酸的合成也和菌體的生長同步,12 h以后乳酸產量增長迅速,28 h達到發酵終點,乳酸產量98.23 g/L。
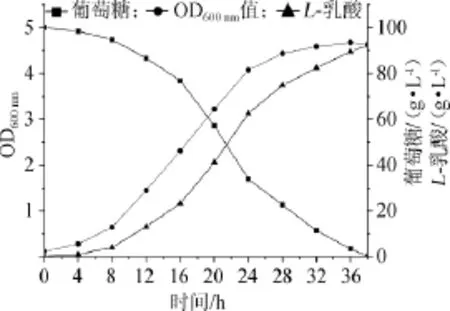
圖4 菌株HBUT-L16以NaOH為中和劑發酵動力學曲線Fig.4 Fermentation kinetic curve of strain HBUT-L16 using NaOH as neutralizer
由圖4可以看出,菌株HBUT-L16以NaOH為中和劑發酵乳酸時,發酵到8h,菌體就進入生長對數期,發酵到24 h,菌體生長趨于平穩;葡萄糖消耗在前8 h也較為緩慢,8 h后消耗開始快速增加;同樣,乳酸生成與菌體生長存在相關性,進入對數生長后(8 h后)乳酸產量不斷增加,一直發酵到38 h,加堿停止,發酵結束,殘糖為0.23 g/L,乳酸產量達到92.19 g/L。
2.4乳酸鈉馴化對中和劑選擇的影響
為了研究乳酸鈉馴化對中和劑選擇的影響,對馴化前后菌株利用不同中和劑的發酵結果進行了對比。
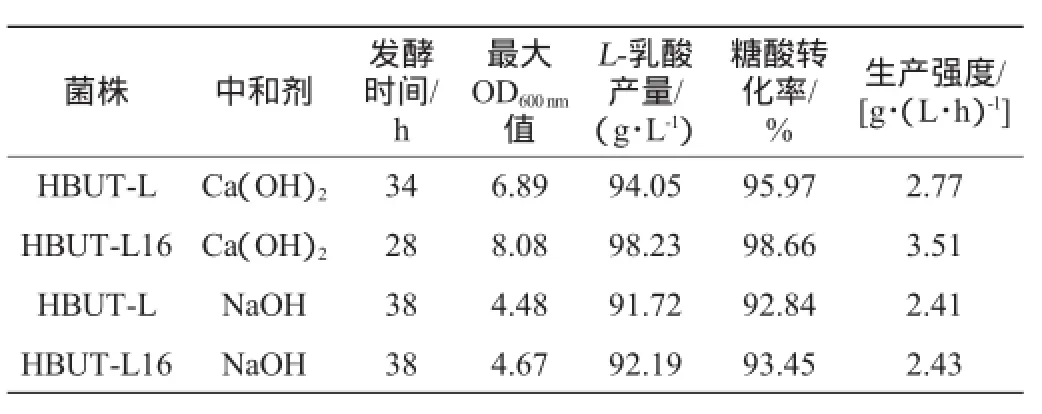
表3 菌株HBUT-L和菌株HBUT-L16利用不同中和劑發酵效果的比較Table 3 Fermentation comparison between strains HBUT-L and HBUT-L16 with different neutralizers
由表3可知,馴化前菌株HBUT-L或馴化后的菌株HBUT-L16在以Ca(OH)2作中和劑時,L-乳酸產量、糖酸轉化率及生產強度等指標均比NaOH作中和劑時要高。HBUT-L16以Ca(OH)2為中和劑時,L-乳酸產量、糖酸轉化率及生產強度分別為98.23 g/L、98.66%和3.51 g/(L·h),比以NaOH作為中和劑的發酵結果相比,分別提高了6.6%、5.6%、44.4%。
究其原因,可能在于以下兩點:首先,以Ca(OH)2作為中和劑時,能為菌體生長提供Ca2+,使菌體快速進入生長對數期,縮短發酵周期,因而能獲得較大的生產強度[3.51g/(L/h)]。而以NaOH作為中和劑時,發酵罐中OD600nm值達到4.67,菌體密度相對較低,發酵周期延長了10 h,大大影響了乳酸的生產強度。其次,從理論進行分析,1分子的Ca(OH)2可以中和2分子的乳酸,而1分子的NaOH只能中和1分子的乳酸。因此,Ca(OH)2相對NaOH來說具有更強的中和能力,生產相同量的L-乳酸,中和劑Ca(OH)2的用量相對較少,那么發酵液中的滲透壓小,更適合菌體的生長和發酵。
由表3還可知,馴化后的菌株,在以Ca(OH)2作中和劑時,相比馴化前的菌株,乳酸產量提高了4.4%,糖酸轉化率提高了2.8%,生產強度增加了26.71%;而以NaOH為中和劑進行發酵時,馴化前后菌株的發酵結果相差不大。這可能是由于以NaOH作為中和劑進行發酵時,生成的鈉鹽均能完全溶解,導致發酵液中滲透壓偏高,因此發酵液中高濃度可溶物質(如鈉鹽)的存在對發酵有不利影響[14-15],菌體生長和發酵都比較緩慢。雖然通過乳酸鈉的馴化,馴化后菌株產L-乳酸能力未見大的提升,可能原因是馴化后菌株鈉離子耐受性仍未提高。而馴化后菌株以Ca(OH)2為中和劑進行發酵時,與馴化前相比表現出較好的發酵性能。因此,采用乳酸鈉對菌體進行長期馴化,主要是提高了菌體對乳酸根的耐受性。
3 結論
菌株HBUT-L經過28代馴化,搖瓶中乳酸產量提高了15.29%。不論是馴化前的菌株HBUT-L還是馴化后的菌株HBUT-L16,以Ca(OH)2作中和劑時,L-乳酸產量、糖酸轉化率及生產強度等指標均比氫氧化鈉作中和劑時要高。菌株HBUT-L16以Ca(OH)2為中和劑時,乳酸產量、糖酸轉化率和生產強度分別提高了6.6%、5.6%、44.4%。
與馴化前菌株HBUT-L的發酵結果相比,菌株HBUT-L16以Ca(OH)2為中和劑進行發酵時,乳酸產量提高了4.4%,糖酸轉化率提高了2.8%,生產強度增加了26.71%;而以NaOH為中和劑時,對馴化前后菌株的發酵效果影響不大。結果表明,采用乳酸鈉對菌體進行長期馴化,主要是提高了菌體對乳酸根的耐受性。
[1]趙筱,李坤朋,趙錦芳,等.高光學純度L-乳酸工程菌的構建及其蔗糖發酵[J].食品與發酵科技,2012,48(5):40-45.
[2]ZHOU S,SHANMUGAM K T,INGRAM L O.Functional replacement of theEscherichia coliD-(-)-lactate dehydrogenase gene(ldhA)with the L-(+)-lactate dehydrogenase gene(ldhL)fromPediococcus acidilactici[J].Appl Environ Microbiol,2003,69(4):2237-2244.
[3]趙錦芳,許麗媛,王永澤,等.利用五碳糖產高純度L-乳酸的大腸桿菌基因工程菌的構建[J].微生物學報,2013,53(4):328-337.
[4]李坤朋.大腸桿菌工程菌HBUT-L的構建,發酵及其乳酸分離研究[D].武漢:湖北工業大學,2013.
[5]熊圓圓,盧傳東,陶冶,等.重組大腸桿菌利用廢紙水解液發酵產L-乳酸[J].中國生物工程雜志,2015,35(5):49-54.
[6]管釗,吳明科,陳吳方,等.進化代謝選育高濃度NH4+耐受型產丁二酸大腸桿菌[J].生物加工過程,2015,13(6):55-60.
[7]姜紹通,張巧蘭,吳學鳳,等.不同中和劑對米根霉發酵產L-乳酸的影響[J].食品科學,2010,31(23):114-117.
[8]楊卓娜,姜岷,李建,等.不同pH調節劑對產琥珀酸放線桿菌NJ113發酵產丁二酸的影響[J].生物工程學報,2010,26(11):1500-1506.
[9]WANG Y Z,TIAN T,ZHAO J F,et al.Homofermentative production of d-lactic acid from sucrose by a metabolically engineeredEscherichia coli[J].Biotechnol Lett,2012,34(11):2069-2075.
[10]李坤朋,許雅潔,趙錦芳,等.大腸桿菌工程菌利用玉米漿發酵產L-乳酸的研究[J].中國釀造,2012,31(12):64-67.
[11]ZHOU S,YOMANO L P,SHANMUGAM K T,et al.Fermentation of 10%(w/v)sugar to D(-)-lactate by engineeredEscherichia coliB[J]. Biotechnol Lett,2005,27(23-24):1891-1896.
[12]TIAN K M,CHEN X Z,SHEN W,et al.High-efficiency conversion of glycerol to D-lactic acid with metabolically engineeredEscherichia coli[J].Afr J Biotechnol,2014,11(21):4860-4867.
[13]馮文婧,杜宇輝,劉家亨,等.一株耐受低pH、高濃度乳酸及琥珀酸菌株的篩選與鑒定[J].微生物學通報,2014,41(11):2171-2181.
[14]SENTHURAN A,SENTHURAN V,HATTI-KAUL R,et al.Lactic acid production by immobilizedLactobacillus caseiin recycle batch reactor:a step towards optimization[J].J Biotechnol,1999,73(1):61-70.
[15]TIMBUNTAM W,SRIROTH K,TOKIWA Y.Lactic acid production from sugar-cane juice bya newly isolatedLactobacillussp.[J].Biotechnol Lett,2006,28(11):811-814.
Effects of neutralizers on L-lactic acid yield byEscherichia coliHBUT-L16 fermentation
WEN Yao,ZHOU Wei,LIU Zao,WANG Yongze*,WANG Jinhua
(Hubei Cooperative Innovation Center for Industrial Fermentation,Key Laboratory of Fermentation Engineering Ministry of Education,Hubei University of Technology,Wuhan 430068,China)
A previously engineeredEscherichia coliwith high yield of optical purity L-lactic acid was domesticated to resist sodium lactate,and neutralizer that evolved in strain fermentation for L-lactic acid production before and after domestication was selected and compared.Results showed that the strain HBUT-L16 which was adaptively evolved for 28 generation had a better fermentation effect with Ca(OH)2as neutralizer comparing with that of NaOH as neutralizer,the L-lactic acid yield,sugar-acid conversion rate and productivity increased 6.6%,5.6%and 44.4%,respectively.Comparing with the results of undomesticated strain HBUT-L,the strain HBUT-L16 produced 4.4%more L-lactic acid,2.8%more conversion rate and 26.71%more productivity in the fermentation with Ca(OH)2as neutralizer.While there was no obvious influence on the results using NaOH as neutralizer.So it suggested that the L-lactic acid yield was improved mainly by improving the tolerance of engineered strain for lactate but not for Na+.
engineeredEscherichia coli;L-lactic acid;domestication;neutralizer
Q815
0254-5071(2016)09-0043-04doi:10.11882/j.issn.0254-5071.2016.09.010
2016-04-16
湖北省自然科學基金項目(No.2011CDB076);湖北省教育廳項目(No.B20121402);國家級本科教學質量與教學改革工程項目(No.201210500032)
文瑤(1991-),女,碩士研究生,研究方向為發酵工程。
王永澤(1976-),男,副教授,博士,研究方向為生物質能利用與酶工程。

