皮質醇和11βHSD mRNA在OSAHS中表達的研究
何豐 葉進
?
·臨床研究論著·
皮質醇和11βHSD mRNA在OSAHS中表達的研究
何豐葉進
目的探討OSAHS患者外周血皮質醇和單個核細胞(PBMC)中11β類固醇羥化脫氫酶(11βHSD)mRNA的表達及其意義。方法采用ELISA法和實時熒光定量PCR(RT-PCR)檢測30例中重度男性OSAHS患者和27名正常男性外周血中皮質醇濃度和PBMC中11βHSD mRNA的表達,分析它們與OSAHS患者臨床參數間的關系。結果OSAHS組和對照組外周血皮質醇濃度無顯著差異(t=-0.69,P=0.50)。OSAHS組的PBMC中11βHSD1 mRNA相對表達水平較對照組低(t=2.35,P=0.02);11βHSD2 mRNA在2組人群中均無表達。在OSAHS組中并未發現11βHSD1 mRNA的表達與外周血皮質醇、TNF-α和其他臨床參數之間存在相關性。結論中重度男性OSAHS患者PBMC中11βHSD1 mRNA的表達水平較對照組低,這種改變的機制目前尚不清楚;但外周血皮質醇濃度較正常人并無明顯改變。
睡眠呼吸暫停,阻塞性;單個核細胞;11β類固醇羥化脫氫酶
11β-hydroxysteroid dehydrogenase
OSAHS是一種最常見的睡眠呼吸障礙疾病,它可能引起體內的炎癥狀態改變[1]。糖皮質激素(GC)具有抗炎及調節免疫的作用[2]。OSAHS患者體內是否存在下丘腦-垂體-腎上腺(HPA)軸興奮狀態及內源性皮質醇濃度的改變目前仍存在爭議[3-5]。組織細胞內活性皮質醇的水平受到11β類固醇羥化脫氫酶(11βHSD)的調節。11βHSD 酶主要有11βHSD1和11βHSD2兩種類型,其中11βHSD1可以使無活性的皮質醇轉變為有活性的皮質醇,而11βHSD2的作用則相反[6-7]。而炎癥因子TNF-α可以調節11βHSD酶的表達和活性[8]。OSAHS患者外周血單個核細胞(PBMC)中是否存在11βHSD酶的改變目前不清楚。為此我們采用實時熒光定量PCR(RT-PCR)檢測中重度男性OSAHS患者外周血中皮質醇、TNF-α的水平和PBMC中11βHSD mRNA的表達,并分析它們與OSAHS患者臨床參數之間的關系。
對象與方法
一、研究對象
1. OSAHS組
2013年11月至2015年5月在我院睡眠中心,經夜間至少7 h多導睡眠監測確診為中重度OSAHS的男性患者30例。入選標準參照2011年中華醫學會耳鼻咽喉科學會頒布的《阻塞性睡眠呼吸暫停低通氣綜合征診療指南2011修訂版》。以呼吸暫停低通氣指數(AHI)<5次/小時為正常,5~15次/小時為輕度,15~30次/小時為中度,≥30次/小時為重度。入選患者年齡均大于18歲。排除標準包括:①合并可能影響GC水平的疾病,如庫欣綜合征、糖尿病、甲狀腺功能亢進和甲狀腺功能減低等內分泌疾病;②服用影響GC分泌的藥物;③嚴重心腦血管疾病;④其他全身炎癥性疾病、感染性疾病、自身免疫性疾病;⑤從事工作為晝夜顛倒性質;⑥正在或已經進行持續正壓通氣或其他治療;⑦腫瘤;⑧精神神經性疾病等。OSAHS組包含中度患者12例和重度患者18例,年齡20~63歲。
2.對照組
選取體檢合格的正常男性27名作為對照組,并經多導睡眠監測(PSG)檢查,AHI<5次/小時,年齡18~62歲。
二、臨床資料收集
1.測量空腹時身高、體質量、腰圍、和頸圍
BMI是由體質量/身高2(kg/m2)計算(BMI≥28 kg/m2即為肥胖患者)。測量時,被測量者立正,腰圍在肚臍水平進行的測量,頸圍在環甲膜上緣水平進行測量。所有測量均由同一人進行的,數據精確到cm。
2.觀察指標
采用Monet32導聯多導睡眠呼吸監測系統進行整夜PSG檢查。檢查前1天內,受試者禁止飲酒、茶和咖啡及服用安眠藥等。整晚監測不少于7 h。記錄AHI、夜間最低血氧飽和度(LSaO2)、SaO2等指標。血壓等均在PSG結束當天清晨的8點(未進食)進行測量。
三、實驗方法
1.樣本收集
經所有參與者同意后,所有參與者均在行PSG結束后8點左右使用EDTA抗凝管抽取空腹靜脈血4 ml,暫存于4℃冰箱中,并于2 h內完成血漿和PBMC的分離,血漿置于1.5 ml EP管中,立即放入-80℃冰箱中保存;每5×106~8×106個細胞加入1 ml Trizol(美國invitrogen公司)裂解細胞,也放入-80℃冰箱中保存。
2.血漿中皮質醇和TNF-α濃度的ELISA測定
皮質醇按照美國Cayman公司的試劑盒說明進行;TNF-α按照美國BD的試劑盒進行。之后均在酶標儀中進行讀數。
3.提取總RNA及逆轉錄合成cDNA
按照Trizol試劑說明書提取PBMC中的總RNA。將已加入Trizol裂解細胞的EP管從-80℃冰箱中取出放置室溫,然后以等體積的氯仿萃取總RNA并以異丙醇將總RNA析出后,加入DEPC水溶解。逆轉錄合成cDNA按照TaKaRa逆轉錄試劑盒說明書進行。
4. RT-PCR反應
目的基因11βHSD1 mRNA和11βHSD2 mRNA及內參基因β-actin的引物序列分別如下:11βHSD1 mRNA的上游引物序列為5′-GCTCTGTAGGTTCTCTCTGTG-3′,下游引物序列為5′- GTCTGAATTCCTGTTTGCAG-3′;11βHSD2 mRNA的上游引物序列為5′-TCGCGCGGTGCTCATCAC-3′,下游引物序列為5′-GTACGCAGCTCGATGGCACC-3′;β-actin的上游引物序列為5′-GCCGATCCACACGGAGTACTT-3′,下游引物序列為5′-TTGCCGACAGGATGCAGAA-3′。PCR反應體系20 μl,反應條件:預變性95℃ 15 s,變性95℃ 3 s,退火及延伸60℃ 1 min,共45個循環。每個樣品均平行做3個復孔。應用ABI 7500 fast RT-PCR儀實時監測整個PCR進程。
5. 結果分析
PCR產物的特異性根據熔解曲線來判定,基因的相對表達量采用2-ΔCt法進行分析。
四、統計學處理
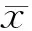
結 果
一、OSAHS組和對照組的臨床資料比較
OSAHS組和對照組中AHI、BMI、頸圍、腰圍、LSaO2、SaO2、收縮壓、舒張壓比較差異均有統計學意義(P均<0.05),而2組年齡比較差異無統計學意義(P>0.05),見表1。

表1 OSAHS組和對照組一般資料的比較
注:1 mm Hg=0.133 kPa
二、OSAHS組和對照組皮質醇、TNF-α和11βHSD1 mRNA的比較
皮質醇在OSAHS組和對照組中分別為(142.94±30.25)ng/ml和(133.80±63.07)ng/ml,2組比較差異無統計學意義(t=-0.69,P=0.50,圖1A);TNF-α在OSAHS組和對照組中分別為(4.92±0.92)ng/ml和(4.44±0.52)ng/ml,2組比較差異有統計學意義(t=-2.44,P=0.02,圖1B);11βHSD1 mRNA在OSAHS組和對照組中的相對表達量分別為(1.03±0.21)×10-4和(1.33±0.15)×10-4,2組比較差異亦有統計學意義(t=2.35,P=0.02,圖1C);11βHSD2 mRNA在2組中均無表達。
三、OSAHS組中11βHSD1 mRNA與皮質醇、TNF-α和臨床資料之間的相關性分析結果
11βHSD1 mRNA并未發現與皮質醇和TNF-α之間存在顯著相關性;11βHSD1 mRNA也并未發現與AHI、BMI、LSaO2、SaO2、收縮壓、舒張壓等臨床參數間存在顯著相關性,見表2。

表2 11βHSD1 mRNA與各參數之間
四、OSAHS組中根據BMI分組情況的各參數間的比較
OSAHS組中有20例非肥胖伴OSAHS患者(BMI<28 kg/m2)和10例肥胖OSAHS患者(BMI≥28 kg/m2)。2組的皮質醇、TNF-α和11βHSD1 mRNA等參數比較差異無統計學意義,見表3。

圖1 OSAHS組和對照組皮質醇、TNF-α、11βHSD1 mRNA的比較

表3 OSAHS組中非肥胖組患者和肥胖患者的各參數比較
討 論
皮質醇作為HPA軸的終末產物之一,具有晝夜生物節律,表現為在午夜12點左右水平最低、而晨起8點左右水平最高[9-10]。血漿中皮質醇濃度可作為評價HPA軸興奮性的指標。OSAHS患者夜間睡眠片段化、微覺醒、間歇性缺氧及炎癥反應等病理狀態可作為應激源,并刺激機體,可能使HPA軸興奮和外周血皮質醇濃度分泌增加。關于OSAHS患者體內是否有HPA軸興奮性改變的研究存在爭議。Vgontzas等[ 3]和Bratel等[ 11]通過測定OSAHS患者體內皮質醇的水平后認為HPA軸的興奮性是升高的。但是仍然有一些研究結果與之相悖,如Lanfranco等[ 12]、Panaree等[ 13]和Grunstein等[14]認為OSAHS患者體內不存在皮質醇水平的升高。Karaca等[15]的結果甚至認為OSAHS患者體內的皮質醇水平是降低的。出現這樣不一致的研究結果可能與標本采集時間點、方法不同,以及所選取的實驗對象納入標準不一致等因素有關。
我們通過測定外周靜脈血中皮質醇的水平后發現OSAHS患者在早上8點左右皮質醇的濃度較正常組并無升高,這與Lanfranco等[12]的結論相同。但是由于人體內的皮質醇分泌是連續的,并不能排除其他時間點或(段)存在皮質醇水平升高的可能。盡管OSAHS組和對照組中BMI并不匹配,但通過BMI將OSAHS組分為OSAHS伴肥胖組和OSAHS伴非肥胖組后,發現2組皮質醇水平并無不同,這可能由于選取的實驗對象并非屬于變態肥胖患者,因此他們的體質量對體內皮質醇水平并無明顯影響。
細胞內11βHSD酶的表達對細胞內活性皮質醇的水平有重要調節作用。免疫細胞也具有調節內源性活性皮質醇水平的能力[6]。已有文獻認為在單核細胞、淋巴細胞等免疫細胞中存在11βHSD1酶的表達,但是卻并無11βHSD2酶的表達;并且認為可以通過作用11βHSD1酶來影響細胞內活性皮質醇的水平進而調節免疫[6, 16-17]。D′Attilio等[16]對結核性胸膜炎患者PBMC中11βHSD1 mRNA和11βHSD2 mRNA進行檢測,發現11βHSD1 mRNA有表達,而11βHSD2 mRNA無表達,認為這是由于11βHSD2主要表達于鹽皮質激素靶器官中,而PBMC不屬于這類組織細胞[16, 18]。我們發現11βHSD1 mRNA在2組中均有表達,表達率為100%,而11βHSD2 mRNA并沒發現表達,與D′Attilio等[16]的研究結果一致。Thieringer等[17]關于單核細胞的研究中也同樣發現存在11βHSD 1 mRNA的表達而無11βHSD2 mRNA的表達。另外,Zhang等[6]也在小鼠CD4+、CD8+和B220+等淋巴細胞中發現存在11βHSD1 mRNA的表達,而無11βHSD2的表達。
有研究發現超重或肥胖患者的脂肪組織或者肝臟中11βHSD1含量表達升高;并且認為在成骨細胞中,TNF-α能增強11βHSD1的活性及使其mRNA的表達增加[7-8]。盡管我們的實驗對象中重度OSAHS患者較正常對照組有較高的BMI,我們的實驗結果發現中重度OSAHS患者體內存在炎癥因子TNF-α的升高,但在中重度OSAHS患者PBMC中11βHSD1 mRNA的表達是降低的,并且11βHSD1 mRNA的表達降低與TNF-α之間并不存在顯著相關性。這或許是由于我們研究的組織細胞不一樣所導致的;脂肪細胞、肝細胞和成骨細胞等都不屬于免疫細胞,而PBMC由單核細胞和淋巴細胞組成,它們屬于免疫細胞。PBMC中11βHSD1 mRNA表達的降低使細胞內的活性皮質醇水平降低,從而降低皮質醇對免疫細胞的調節及抗炎作用。
OSAHS的病理機制較為復雜,目前還不是非常清楚,可能是由多種機制作用的結果。我們的研究結果發現OSAHS患者PBMC中11βHSD mRNA的表達水平存在著改變,但這種改變的具體機制有待進一步研究。
[1]Steiropoulos P, Papanas N, Nena E, Antoniadou M, Serasli E, Papoti S, Hatzizisi O, Kyriazis G, Tzouvelekis A, Maltezos E, Tsara V, Bouros D. Inflammatory markers in middle-aged obese subjects: does obstructive sleep apnea syndrome play a role? Mediators Inflamm,2010, 2010: 675320.
[2]Baxter JD. Glucocorticoid hormone action. Pharmacol Ther B,1976, 2(3): 605-669.
[3]Vgontzas AN, Pejovic S, Zoumakis E, Lin HM, Bentley CM, Bixler EO, Sarrigiannidis A, Basta M, Chrousos GP. Hypothalamic-pituitary-adrenal axis activity in obese men with and without sleep apnea: effects of continuous positive airway pressure therapy. J Clin Endocrinol Metab,2007, 92(11): 4199-4207.
[4]Edwards KM, Kamat R, Tomfohr LM, Ancoli-Israel S, Dimsdale JE. Obstructive sleep apnea and neurocognitive performance: the role of cortisol. Sleep Med,2014, 15(1): 27-32.
[5]Parlapiano C, Borgia MC, Minni A, Alessandri N, Basal I, Saponara M. Cortisol circadian rhythm and 24-hour Holter arterial pressure in OSAS patients. Endocr Res, 2005, 31(4): 371-374.
[6]Zhang TY, Ding X, Daynes RA. The expression of 11 beta-hydroxysteroid dehydrogenase type I by lymphocytes provides a novel means for intracrine regulation of glucocorticoid activities. J Immunol,2005, 174(2): 879-889.
[7]Asensio C, Muzzin P, Rohner-Jeanrenaud F. Role of glucocorticoids in the physiopathology of excessive fat deposition and insulin resistance. Int J Obes Relat Metab Disord,2004, 28 Suppl 4: S45-S52.
[8]Cooper MS, Bujalska I, Rabbitt E, Walker EA, Bland R, Sheppard MC, Hewison M, Stewart PM. Modulation of 11beta-hydroxysteroid dehydrogenase isozymes by proinflammatory cytokines in osteoblasts: an autocrine switch from glucocorticoid inactivation to activation. J Bone Miner Res,2001, 16(6): 1037-1044.
[9]Chrousos GP. The hypothalamic-pituitary-adrenal axis and immune-mediated inflammation. N Engl J Med,1995, 332(20): 1351-1362.
[10]Kino T, Chrousos GP. Acetylation-mediated epigenetic regulation of glucocorticoid receptor activity: circadian rhythm-associated alterations of glucocorticoid actions in target tissues. Mol Cell Endocrinol,2011, 336(1-2): 23-30.
[11]Bratel T, Wennlund A, Carlstr?m K. Pituitary reactivity, androgens and catecholamines in obstructive sleep apnoea. Effects of continuous positive airway pressure treatment (CPAP). Respir Med,1999, 93(1): 1-7.
[12]Lanfranco F, Gianotti L, Pivetti S, Navone F, Rossetto R, Tassone F, Gai V, Ghigo E, Maccario M. Obese patients with obstructive sleep apnoea syndrome show a peculiar alteration of the corticotroph but not of the thyrotroph and lactotroph function. Clin Endocrinol (Oxf),2004, 60(1): 41-48.
[13]Panaree B, Chantana M, Wasana S, Chairat N. Effects of obstructive sleep apnea on serum brain-derived neurotrophic factor protein, cortisol, and lipid levels. Sleep Breath,2011, 15(4): 649-656.
[14]Grunstein RR, Handelsman DJ, Lawrence SJ, Blackwell C, Caterson ID, Sullivan CE. Neuroendocrine dysfunction in sleep apnea: reversal by continuous positive airways pressure therapy. J Clin Endocrinol Metab,1989, 68(2): 352-358.
[15]Karaca Z, Ismailogullari S, Korkmaz S, Cakir I, Aksu M, Baydemir R, Tanriverdi F, Bayram F. Obstructive sleep apnoea syndrome is associated with relative hypocortisolemia and decreased hypothalamo-pituitary-adrenal axis response to 1 and 250mug ACTH and glucagon stimulation tests. Sleep Med,2013, 14(2): 160-164.
[16]D'Attilio L, Díaz A, Santucci N, Bongiovanni B, Gardeez W, Marchesini M, Bogué C, Dídoli G, Bottasso O, Bay ML. Levels of inflammatory cytokines, adrenal steroids, and mRNA for GRalpha, GRbeta and 11betaHSD1 in TB pleurisy. Tuberculosis (Edinb),2013, 93(6): 635-641.
[17]Thieringer R, Le Grand CB, Carbin L, Cai TQ, Wong B, Wright SD, Hermanowski-Vosatka A. 11 Beta-hydroxysteroid dehydrogenase type 1 is induced in human monocytes upon differentiation to macrophages. J Immunol,2001, 167(1): 30-35.
[18]Draper N, Stewart PM. 11beta-hydroxysteroid dehydrogenase and the pre-receptor regulation of corticosteroid hormone action. J Endocrinol,2005, 186(2): 251-271.
Study of expression levels of cortisol and 11βHSD mRNA in patients with obstructive sleep apnea hypopnea syndrome
HeFeng,YeJin.
DepartmentofOtolaryngology-HeadandNeckSurgery,theThirdAffiliatedHospitalofSunYat-senUniversity,Guangzhou510630,China
Correspondingauthor,YeJin,E-mail:yejin_sums@aliyun.com
ObjectiveTo investigate the expression and significance of cortisol in the peripheral blood and 11 β-hydroxy steroid dehydrogenase(11βHSD) mRNA in the peripheral blood mononuclear cell(PBMC) in patients with obstructive sleep apnea hypopnea syndrome (OSAHS). MethodsEnzyme-linked immunoadsordent assay (ELISA) and real-time fluorescent quantitative PCR (RT-PCR) were utilized to detect the concentration of cortisol in the peripheral blood and the expression level of 11βHSD mRNA in the PBMC from 30 patients with moderate and severe OSAHS and 27 healthy male individuals. The relationship between the levels of cortisol and 11Βhsd mRNA, and clinical parameters was analyzed. ResultsThe concentration of cortisol in the peripheral blood did not significantly differ between two groups (t=-0.69,P=0.50). Compared with the control group, the expression level of 11βHSD1 mRNA in the OSAHS group was significantly down-regulated (t=2.35,P=0.02). However, 11βHSD2 mRNA was not expressed in either group. In the OSAHS group, no significant correlation was observed between the expression of 11βHSD1 mRNA and clinical parameters such as peripheral blood cortisol, TNF-α, et al. ConclusionsThe expression of 11βHSD1 mRNA in the PBMC from male patients with moderate to severe OSAHS was significantly down-regulated compared with that in their healthy counterparts. The underlying mechanism remains unclear. Nevertheless, the concentration of cortisol in OSAHS patients did not significantly differ from that in the healthy controls.
Sleep apnea,Obstructive; Peripheral blood mononuclear cell;
10.3969/j.issn.0253-9802.2016.09.008
510630 廣州,中山大學附屬第三醫院耳鼻咽喉頭頸外科
,葉進,E-mail:yejin_sums@aliyun.com
2016-04-06)(本文編輯:楊江瑜)

