冬春季海岸濱麥碳水化合物變化差異性與其環境異質性的關系
張婷鳳,周瑞蓮,*,張 玥,王艷芳,賈有余
1 魯東大學生命科學學院,煙臺 264025 2 內蒙古農牧科學院資源環境與檢測技術研究所,呼和浩特 010030
?
冬春季海岸濱麥碳水化合物變化差異性與其環境異質性的關系
張婷鳳1,周瑞蓮1,*,張 玥1,王艷芳1,賈有余2
1 魯東大學生命科學學院,煙臺264025 2 內蒙古農牧科學院資源環境與檢測技術研究所,呼和浩特010030
以煙臺海岸不同生態斷帶自然生長的濱麥(Leymusmollis(Trin.) Hara)為試驗材料,通過在晚秋氣溫降低和冬季冷凍和春季氣溫回升過程中濱麥葉片和地下各器官可溶性糖、淀粉和纖維素含量的測定以探討不同生態斷帶濱麥在其含量上的差異與環境異質性關系及在濱麥抗鹽抗風中作用。結果表明,處在近高潮線(10m)高鹽、高水分、強風和低溫環境的濱麥根莖和芽粗壯、地上枝葉低矮,春季返青晚;隨遠離高潮線(50m)土壤鹽濃度和海風風速降低,溫度增高, 濱麥根莖變細,地上枝葉細長,春季返青早,其不同生態斷帶濱麥形態可塑性與環境異質性相關。隨晚秋氣溫下降不同生態斷帶濱麥地上部非結構碳水化合物向地下轉移,地下繁殖器官根莖和芽成為了非結構性碳水化合物的“庫”。在莖和根中可溶性糖向頂芽轉移同時淀粉下降,纖維素含量增加。但近高潮線10m處的濱麥,冬季地上非結構性碳水化合物向地下轉移較早,芽中儲存了較多的非結構碳水化合物,春季返青晚但葉中積累較多的纖維素與其抗凍和抗風相關;而生活在遠離高潮線50m處的濱麥晚秋生活期略有加長,冬季轉移到地下部的非結構碳水化合物較少,儲存量較低,返青較早,其葉片和地下部非結構碳水化合物含量較高與其環境低鹽、弱海風及其快速生長相關。因此,不同生態斷帶濱麥在入冬和春季地上和地下碳水化合物轉移和轉化上的差異在其適應異質環境、產生形態可塑性、形成多抗逆性中起重要作用。
海岸; 濱麥; 碳水化合物; 環境異質性; 冬春季
植物均生長在環境異質的空間中,這種環境異質性給植物生長、生理、繁殖帶來不可避免的影響[1]。而植物表型可塑性是植物適應環境異質性的一個潛在策略[2],也是生物體在其生長環境發生改變的條件下,可以改變其表型的一種內在能力,是物種具有更寬的生態幅和更好的耐受性的基本因素[3]。
研究發現,外來入侵種喜旱蓮子草(Alternanthera philaxeroides (Mart) Griseb) 分枝強度、莖節長度隨土壤氮含量升高而增加,在氮養分最高時根系生物量最低[4];日本忍冬在有支撐物的條件下,節間長度縮短了15.3%,節間數目增加了一倍,枝條的生物量增加了43%[5]。植物通過個體各器官生物量投資的優化配比來適應多樣化環境,以增強其入侵能力[4- 5]。有研究發現,生態因子對植物體表型可塑性影響是有針對性的,其中土壤水分主要影響植物體構件數目,土壤鹽分主要影響生物量,光照條件影響植物的物候表性特征[6- 8]。金戴戴隨著鹽分濃度的增加植株干重、總葉面積、分株數和總匍匐莖長度顯著減小[8]。森林中處于競爭力強的樹種遮蔭下的樹木,一般會積極地伸長莖或枝來決定其最佳的葉片高度,盡可能地截獲光能,以達到植物的上層[9]。廣幅種桃葉蓼(Polygonum persicaria)在土壤水澇脅迫時能通過快速重新調整根系使之向表土層分布以保持較高的生長速率[10]。耐陰性不同的種,其生長更直接與凈同化率相關,耐陰種相對生長率、凈同化率在光照條件下明顯提高,但在低光照條件下沒有變化,但種間可塑性差異在高營養條件下變小[10- 13]。異質環境是表型可塑性產生的根源[9]。目前對植物表型可塑性研究,就試驗方法而言大都采用人工控制生態因子的方法;就研究內容大多集中在植物結構特征、功能可塑性上;研究材料均采用植物的生活早期。由于可塑性響應包括環境限制對植物生長和生理的影響, 目前關于植物對環境適應在生長可塑性上研究較多, 而對生理可塑性研究較少。
濱麥(Leymusmollis(Trin.) Hara)是一種可在海岸不同生態斷帶上生存的多年生草本植物。它即可在近高潮線高鹽度土壤上生存,又能在遠離高潮線土壤鹽度降低區域生長,但不清楚其生理可塑性調控機理。碳水化合物是植物進行各項生命活動的能源物質,參與植物形態構建,影響植株的生長[14]、作為低溫保護物質與植物抗冷力相關[15- 16]、作為可儲存和轉移的物質在植物適應逆境脅迫起關鍵作用[16- 18]。有研究發現,假儉草[19]和多年生牧草[20]秋季匍匐莖和根中大量積累碳水化合物是其能忍耐嚴寒的重要原因。那么處于不同生態斷帶土壤鹽度、海風強度、微環境不同的濱麥在冬季越冬中,根葉碳水化合物轉移和重新分配上是否有差異?這種差異在濱麥適應不同鹽和海風環境中的作用,目前國內外尚未見報道。本試驗以煙臺不同生態斷帶濱麥為材料,通過對其在冬季降溫和春季升溫過程中,其根、莖、葉中結構和非結構碳水化合物含量的分析,以探討氣溫變化過程中不同生態斷帶濱麥不同器官間碳水化合物含量變化與氣溫變化關系、不同生態斷帶濱麥在碳水化合物轉移上表現差異性與土壤鹽和海風強度的關系及它們對鹽適應的生理可塑性。從碳水化合物能量的儲存和轉移揭示濱麥對微環境差異的適應機理。
1 材料與方法
1.1樣地自然概況
試驗材料來源于煙臺市西泊子海岸沙地。煙臺市地處山東半島中部,位于東經119°34′—121°57′,北緯36°16′—38 °23′。該地區屬于溫帶季風氣候,年平均降水量為651.9 mm,主要集中在7 — 8月,占年降雨量的49%;年平均氣溫11.8 ℃,最熱月為8月(24.6 ℃),歷年極端最高氣溫38.4 ℃,土壤pH值為4.22—6.79。西泊子海岸沙地土壤多為風沙土。年平均風速內陸地區3—4 m/s,沿海地區4—6 m/s。 西泊子研究區天然群落主要有篩草(Carexkobomugi)、砂引草(MesserschmidiasibiricaLinn)、腎葉打碗花(Calystegiasoldanella(L.) R. Br)和濱麥(Leymusmollis(Trin.) Hara)等。
1.2試驗地和試驗材料的選擇
試驗在煙臺西泊子海岸沙丘上進行。選隨遠離高潮線沙地地勢逐漸增高、生境呈梯度變化(本文稱不同生態斷帶)的沙丘為試驗地。選不同生態斷帶上生長的濱麥為試驗材料,各生態斷帶位點上濱麥均為在自然條件下生長多年而形成的自然種群,無年齡差異。具體做法是,在2013年秋季,在西泊子海岸沙丘上選植物生長健壯、無動物侵襲、無污染物侵染、無人為干擾的地段為試驗地,并做標記。并將該地海岸高潮線定位0 m, 將遠離高潮線10 m(由于濱麥在距高潮線10m處開始出現)、30 m和50 m處設為植物和土壤樣品的采集點并做標記。
1.3試驗地取樣
(1)取材時間分為晚秋、冬季和春季3個階段。晚秋階段氣溫下降迅速,故試驗地取樣密度加大, 從2013年11月1日到11月30日,每10 d取樣1次; 冬季冷凍穩定期僅在2013年12月10日和2014年1月10日取樣;春季氣溫升高期,由于氣溫升高迅速,故試驗地取樣密度也加大,從 2014年4月1日開始,每10 d取樣一次到4月30日為止。
取樣方法:在每個取樣位點畫出一條與海平行的線, 每次取樣均在平行線附近并挨著順次取樣。取樣具體做法是:每次在上一次取樣的樣地旁,用小鐵锨垂直向下挖取一個約30 cm × 30cm× 30cm的土柱,同時用手將多余的沙子掏出,并小心盡量不傷及根莖。將挖出的根莖上沙子小心清理后,將整株濱麥帶回實驗室。每次挖取3個土柱為3個重復。在實驗室小心將植株上的干枯葉片和沙子清除,然后將清理好的整株材料分為根(須根)、根莖、頂芽、葉片。具體做法:用剪刀將葉片和根部剪開,清理除去枯死葉片,剩余為葉片實驗材料;接著處理根部,將根莖最前端頂部白色嫩芽(約5—7 cm)剪下,這部分為頂芽;最后用剪刀將根莖上須根剪下為根,剩余的為根莖部。將所有材料先在烘箱105 ℃殺青,然后在65 ℃烘至恒重,最后將其粉碎成粉末,用于碳水化合物含量測定。
1.4測定方法
參考張志良版的《植物生理學實驗指導》[21]測定碳水化合物的方法,對濱麥可溶性糖,淀粉,纖維素進行測定。每次測定重復3次。淀粉含量測定是將提取過可溶性糖的殘渣先用高氯酸水解后用蒽酮比色法進行測定,纖維素含量的測定是將提取過淀粉的殘渣用硫酸水解后用蒽酮比色法進行測定。
1.5數據處理
用Microsoft Office Excel 2003對數據進行處理并作圖。實驗數據3個以上重復的平均值±標準差(mean±SD, standard deviation)。
2 結果與分析
2.12013秋季到2014春季氣溫變化

圖1 2013秋冬—2014春季最高和最低氣溫變化 Fig.1 Changes in maximum and minimum temperature from winter,2013 to spring, 2014
可以將晚秋冬季和春季氣溫變化分為3個階段(圖1)。第1階段晚秋入冬,氣溫下降期,從10月底到12月,這時最高平均氣溫由10月底的20 ℃降至12月的4 ℃,但最低氣溫均在零度以上;第2階段冬季,氣溫持續冷凍期,從2013年12月到2014年 2月間,3個月最高平均氣溫均保持約4 ℃,最低溫度在零下3 ℃; 第3階段春季,氣溫上升階段,自3月初氣溫快速上升, 3月最高平均氣溫上升到13 ℃,4月升高至19 ℃,3月最低平均氣溫也上升至5 ℃, 4月升至10 ℃。煙臺海岸晚秋冬春季氣溫變化明顯,季節分明。
2.2冬春季不同生態斷帶濱麥生長狀況分析
在距高潮線10、30、50 m處的濱麥形態有較明顯差異(表1)。近高潮線(10 m)沙地較為濕潤、風力較大、日平均氣溫較低,濱麥植株低矮、根莖肥碩且在沙下約20 cm,須根也較粗壯。在距高潮線30 m處,沙地平緩、沙地濕度降低、風力減小、濱麥植株較高、根莖較細且位于沙下10—15 cm,須根也較細。在距高潮線50 m處,沙地較為干旱、風力較小,濱麥種群密度增大、植株最高、根莖干細,節間特別明顯,須根細長。研究表明, 隨遠離高潮線土壤濕度降低、土壤鹽度下降、海風風力減小,濱麥生長勢加大、根系發育變弱,濱麥形態可塑性與環境變化相關。
表1海岸不同生態斷帶環境溫度、濕度、風速以及植株高度比較
Table 1Comparions of air temperature, huminity, wind rate and plant height growing on coastal dunes at different zone far from the high tide

距高潮線距離/mDistancefromhightideline月份Month溫度/℃Temperature濕度/%Huminity風速/(m/s)Windrate早中晚早中晚早中晚株高/cmPlantheight10735.442.836.545.757.848.81.91.71.143.8±7.5924.531.923.261.439.178.51.31.93.130734.745.336.650.250.149.41.61.10.644.6±6.2928.338.324.352.528.473.80.71.82.250738.745.737.137.548.946.50.40.80.558.8±10.7927.841.551.651.625.876.50.31.31.1
2.3冬春季不同生態斷帶濱麥各部位可溶性糖含量變化
煙臺海岸冬初地上葉片開始枯黃,而在入秋地下根莖頂部開始膨脹形成大量白色稚嫩的芽,并在春季氣溫上升向上生長形成新的植株。研究表明,在入冬、冬季和春季不僅不同生態斷帶濱麥可溶性糖含量不同, 而且隨溫度的變化濱麥各器官可溶性糖含量也不相同(圖2)。
晚秋隨氣溫下降,不同生態斷帶地上葉片開始變黃,葉中可溶性糖含量大幅度下降。在距高潮線10、30、50 m處的濱麥葉片可溶性糖含量在降溫期分別下降64%、44% 和48%; 在冷凍期分別降低65%、31% 和26%。 同時,隨氣溫降低濱麥地下部(根+根莖+芽)總可溶性糖含量趨于增加(圖2, 圖3),在11月底達到最高值,但增加幅度不大。然而,地下不同器官可溶性糖含量變化不同。 隨氣溫下降頂芽和根莖可溶性糖含量趨于上升,位于10、30、50 m處濱麥芽中可溶性糖含量在降溫期分別增加了30%、22% 和31%,在冷凍期增加19%、 8% 和6%; 根莖中可溶性糖含量趨于緩慢下降,在降溫期和冷凍期,10、30、50 m僅分別下降12%、22% 和35%;不同生態斷帶根中糖含量變化不明顯(圖 2)。然而冬季位于50 m處的濱麥,其芽、根莖、根和葉片中可溶性糖含量均最低,并與10 m和30 m的差異顯著(P<0.05)(圖2, 圖3)。 就同一植株, 濱麥將大量可溶性糖儲存在芽和根莖中,例如在30 m處濱麥芽和根莖中可溶性糖含量分別較根高384%和505%。
隨春季氣溫增高(圖1),不同生態斷帶濱麥開始返青,但50m處濱麥返青較早,10 m處濱麥返青較晚。隨著植株萌動生長,不同生態斷帶濱麥地下和地上部可溶性糖含量均增高,但絕對量上仍以30 m和50 m處濱麥較高(圖2)。

圖2 冬春季不同生態斷帶濱麥葉片和地下各器官可溶性糖含量變化Fig.2 Changes in the contents of soluble sugar in the leaves and different parts of roots of Leymus mollis growing on coastal dunes at different zone far from the high tide in winter, and spring
2.4不同生態斷帶濱麥各部位淀粉含量變化
研究表明,在入冬、冬季和春季不僅不同生態斷帶濱麥淀粉含量不同, 而且隨溫度的變化各器官淀粉含量也不相同(圖3,圖4)。晚秋隨氣溫下降,地上葉片開始變黃,地上葉片淀粉含量大幅度下降,在降溫期下降幅度最大,冷凍期下降幅度減小。不同生態斷帶上,10 m處濱麥葉片淀粉降幅(87%)明顯高于30 m(60%)

圖3 冬季不同生態斷帶濱麥芽中可溶性糖、淀粉和纖維素含量的變化Fig.3 Changes in the contents of soluble sugar, starch, and cellulose in the buds of Leymus mollis growing on coastal dunes at different zone far from the high tide during winter
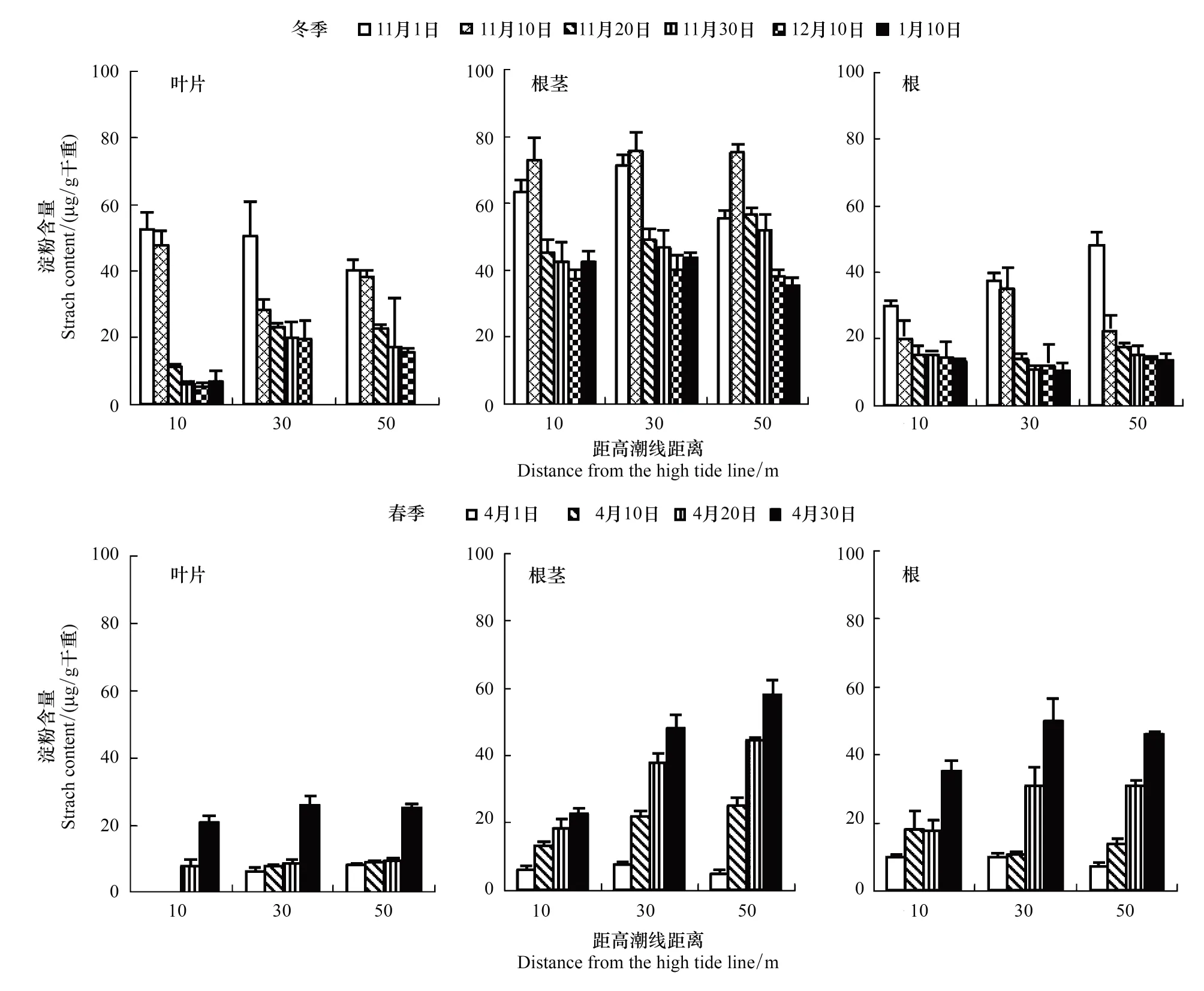
圖4 冬春季不同生態斷帶濱麥葉片和地下各器官淀粉含量變化Fig.4 Changes in the starch content in the leaves and different parts of roots of Leymus mollis growing on coastal dunes at different zone far from the high tide in winter, and spring
和50 m(61%)。同時,隨晚秋氣溫下降,不同生態斷帶濱麥地下部(根+根莖+芽)平均淀粉含量差異不顯著,但均趨于下降(圖3,圖4)。值得注意的是,不同生態斷帶濱麥地下部淀粉含量變化時間上略有差異,位于50 m處的濱麥芽和根莖淀粉含量在降溫期下降幅度略低于30 m和10 m, 但在冷凍期芽和根莖中淀粉含量下降幅度(30%、32%)明顯大于30 m(7%、7.2%)和10 m(10%、1%)。冬季濱麥將大量淀粉儲存在芽和根莖中,例如在30 m處濱麥芽和根莖中淀粉含量較根高170%和175%。
隨春季氣溫增高(圖1),濱麥返青生長,地上葉片和地下部各器官淀粉含量迅速增高,尤其根莖增長顯著(圖4)。不同生態斷帶地上葉片淀粉含量平均增加2—3倍,地下根莖平均增加4—5倍。但不同生態斷帶濱麥地上和地下積累量有差異,10 m處濱麥地上葉片因生長略晚淀粉積累較晚,但積累迅速;30 m和50 m處濱麥返青早,地下根莖中淀粉積累量較高。不同生態斷帶濱麥根莖中淀粉含量最高,10、30、50 m處濱麥根莖中淀粉含量分別較根高50%、127%、170%。研究表明,生長中的濱麥會將較多的淀粉儲存在根莖中。
2.5不同生態斷帶濱麥各部位纖維素含量變化
研究表明,在降溫期、冷凍期和春季升溫過程中不同生態斷帶濱麥地上和地下器官中纖維素含量均發生不同變化(圖3,圖5)。在晚秋隨葉片開始變黃,葉片中纖維素含量略有增加,在降溫期和冷凍期,位于10、30、50 m的濱麥葉片中纖維素含量分別增加33%、10%、20%,其中10 m處濱麥葉片纖維素含量增加幅度較大,且絕對含量高于50 m 處濱麥(圖5)。
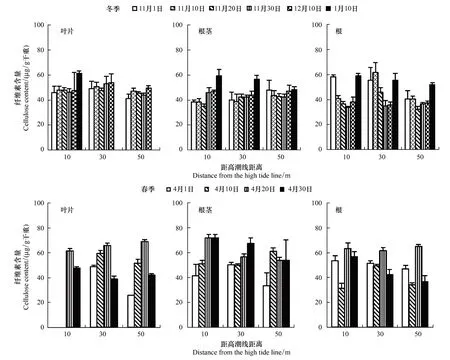
圖5 冬春季不同生態斷帶濱麥葉片和地下各器官纖維素含量變化Fig.5 Changes in the cellulose content in the leaves and different parts of roots of Leymus mollis growing on coastal dunes at different zone far from the high tide in winter, and spring
隨氣溫下降不同生態斷帶濱麥地下部纖維素含量在降溫期趨于緩慢下降,在冷凍期增加,但不同生態斷帶濱麥地下部纖維素含量的變化幅度不同(圖3,圖5)。其中,10 m處濱麥地下部纖維素含量在降溫期下降(10%),在冷凍期大幅增加(44%)。而50 m處濱麥在降溫期變化不明顯,在冷凍期增加(18%),但其增幅低于10 m處濱麥。地下部各器官纖維素含量在降溫期變化略有不同。在降溫期根中纖維素含量下降,芽和根莖中纖維素含量增加。而且,不同生態斷帶濱麥地下部纖維素對降溫和冷凍期響應不同,10 m處濱麥芽和根莖中纖維素含量在降溫期增幅較小(9%,19%),冷凍期增幅較大(38%,30%),50 m處的濱麥芽纖維素在降溫期增幅較大(55%),冷凍期增幅較小。
隨春季氣溫升高,不同生態斷帶濱麥地上部和地下部纖維素對溫度變化響應一致,均在生長初期上升,在快速生長期降低(圖5)。其中10 m濱麥地上和地下部纖維素含量和增加幅度均高于遠離高潮線濱麥,兩者差異顯著(P<0.05)。
3 討論與結論
結果表明,海岸不同生態斷帶濱麥生活在異質環境中(表1),隨遠離高潮線土壤鹽度下降,濱麥地下根莖和芽由粗壯變細小、地上枝葉由低矮變細長。不同生態斷帶濱麥形態可塑性差異與環境異質性相關。這不僅表明濱麥具有很大的生態幅,還說明其有很強的適應和利用環境維持最大生產量的能力。濱麥是多年生植物,成功越冬是其延續生存的關鍵。大量研究表明,碳水化合物是植物越冬的主要能源物質[22- 23]。盡管不同生態斷帶濱麥在形態可塑性上存在差異,那么濱麥在冬季越冬體內碳水化合物轉移和轉化分配上是否存在差異呢?以及形態可塑性和生理可塑性間是否有密切關系,目前尚不清楚。
結果表明,隨晚秋氣溫下降,不同生態斷帶濱麥地上葉片平均可溶性糖含量大幅度下降,而地下部(根+根莖+芽)總可溶性糖含量增加了12.4%(圖2, 圖3)。同時,在降溫期不同生態斷帶地上葉片淀粉平均含量下降幅度(69%)大于地下部(36%),在冷凍期,無論地上還是地下部淀粉含量下降幅度減小(圖3,圖4)。隨春季氣溫增高(圖1),濱麥萌動生長,地上和地下部根莖中淀粉含量迅速增高(圖4)。這是由于大多數多年生草本植物生活型為地面芽植物,其越冬的生長點位于地下,它們通過在冬季來臨前,將地上葉片儲存的養分轉移至地下根部,以葉片枯死減少養分消耗這種逃避方式越過寒冷的冬季。所以秋季降溫成了這種物質轉移的信號。轉移到地下根際的非結構性碳水化合物在維護根際細胞滲透勢、持水力、根際細胞呼吸代謝、春季的返青生長有重要作用[24]。
另外,濱麥的地下器官包括:根莖、芽、根。但研究發現入冬濱麥非結構碳水化合物的轉移在地下各器官間不均衡,而且地下各器官中結構性碳水化合物變化不同。例如,首先隨氣溫下降,頂芽可溶性糖平均含量趨于上升(降溫期平均增加28%,在冷凍期增加了11%)、同時淀粉下降(30%、16%)、纖維素含量增加(24%、15%)(圖3);而根莖可溶性糖(10%、16%)和淀粉(32%、13%)下降和纖維素含量增加(圖2,圖4,圖5)。但是就地下各器官結構和非結構碳水化合物絕對值而言,芽和根莖中可溶性糖含量較高,根中較低(圖2,圖3),芽、根莖和根可溶性糖分別占地下部器官總糖的44%、47%和9%; 淀粉占地下部器官總淀粉的42%、42%和16%;纖維素占地下部器官總纖維素的37%、32%、31%。研究表明,(1)冬季地下芽和根莖是非結構性碳水化合物的“庫”,是碳水化合物的主要貯藏部位[25]。有研究發現,根莖型的羊草以無性克隆生長為主, 每年將大量的營養物質貯存在根莖等地下器官中,以利于繁殖和種群擴張生長[26]。越冬的紫花苜蓿地下根莖粗度、體內營養物質的積累量與根莖耐寒力和越冬力呈正相關[27]。濱麥屬于根莖型多年生牧草,其地下部分包括芽、根莖和不定根。其中,根莖頂部芽是分生組織具有持續的強烈分裂的能力,這里既是植物芽產生的部位,也是未來枝葉和植物繼續生存的保證。因此將較多的非結構性碳水化合物轉移至此在提高該組織抗凍力、維護其安全越冬和再生是十分重要的,也是其成為入冬后營養“庫”端的原因。而地下根莖是不定根和地上枝條產生的部位也是植株持續生活的載體,故可能成為第2個營養輸入的“庫”。在冬季冷凍期芽中可溶性糖增加,而根莖中可溶性糖和淀粉含量均趨于下降,這進一步表明根莖中可溶性糖和淀粉向芽轉移。根莖頂部的芽是濱麥越冬生存的重要部位,是營養輸送的重要“庫”,其“庫”中非結構碳水化合物作為滲透調節物質可增加細胞濃度、降低冰點、維護細胞水分;作為營養物質為地下芽和根莖呼吸提供能量[15,28- 29]。(2)地下器官間結構和非結構碳水化合物間發生轉移和轉化。不僅根莖和根中可溶性糖向頂芽轉移,而且該部位的淀粉下降。淀粉的下降可能一部分轉化為可溶性糖用于呼吸、滲透調節, 另外合成纖維素用于增加芽和根莖機械能力以利于其在土壤中穿行和種群的擴展。為此,入秋氣溫下降時,濱麥通過將地上部葉中非結構碳水化合物向生命活躍的芽和根莖中轉運為冬季海岸濱麥安全越冬提供了物質保障。
本研究還發現,不同生態斷帶環境影響海岸濱麥非碳水化合物在地上地下轉移和結構和非結構碳水化合物轉化。生活在近高潮線10 m處的濱麥,冬季地上非結構性碳水化合物轉移地下較早,地下部儲存了較多的非結構碳水化合物, 春季返青晚,根葉中積累較多的結構性碳水化合物。而生活在遠離高潮線50 m處的濱麥,冬季轉移到地下部芽、根莖、根中的可溶性糖均較少(圖2,圖3),濱麥芽和根莖淀粉含量在冷凍期下降幅度大,而10 m和30 m處則在低溫期下降幅度大。在春季50 m處濱麥生長返青較早,濱麥葉片和地下部非結構性碳水化合物含量較高(圖 2,圖4),纖維素含量較低(圖 5)。結果表明:不同生態斷帶濱麥碳水化合物轉移存在的差異。有研究發現,植物的養分含量即受自身生理特性作用,又受生長地環境條件的制約。其中生態過程決定著植物體內物質和能量的轉化[30- 31]。長期生活在低溫環境的植物進化出一系列適應機制,其中包括降低結構性碳水化合物含量并提高可溶性碳水化合物含量,而較溫暖的地區則相反[32- 33]。而且有研究發現,隨著草地產草量的增加,粗纖維含量上升[34- 35]。在海岸近高潮線處土壤Na+含量很高, 此處生長的濱麥根葉中Na+較高, 而且可溶性糖含量也較高[36- 37]。隨著植物生長和干物質的不斷積累,機械組織不斷增長導致機械組織中纖維素含量較多[38]。本實驗中,近高潮線10 m處的濱麥是生活在迎風坡上,這里海風強度高、土壤鹽濃度高、相對溫度較低(表1)。因而在冬季較早地將地上葉片中非結構性碳水化合物養分轉移至地下器官并儲存起來,并將其主要轉運到與繁殖生長相關的地下根莖和芽中導致地下根莖和芽粗壯。而大量非結構碳水化合物在其提高細胞持水力、降低冰點、作為滲透調節劑維護地下器官的水分平衡起重要作用;同時維持較高的淀粉含量和穩定的纖維素為地下器官冬季呼吸消耗提供能源,提高其抗凍力和耐鹽性。在春季由于受海風和氣溫較低影響而返青生長較晚。但在返青生長后,其葉片將大量可溶性糖和淀粉用于纖維素合成可能是導致非結構性碳水化合物含量較低的原因,而葉片中較高的纖維素含量在增強葉片機械組織提高其抗風能力是有利的。因此在10 m處生長的濱麥冬季維持地下部較高的可溶性糖,春季返青葉片中維持較高的纖維素含量與其抗凍、抗鹽、抗風密切相關。隨著遠離高潮線,海風風力減小、地勢平坦、溫度提高,生長在50 m處的濱麥晚秋生活期略有加長,不僅冬季地上非結構碳水化合物向地下轉移的晚,并且儲存量較低,導致根莖細長,芽短而細,且春季返青生長較早使葉片和地下部非結構碳水化合物含量較高。50 m處生長的濱麥冬季地下部較少的可溶性糖含量與土壤較低的鹽度呈正相關,春季返青早也與微環境溫度較10 m高有關。由此可見,在越冬和返青生長過程中,不同生態斷帶濱麥地上和地下部非結構碳水化合物轉移和轉化上的差異與其適應異質環境、維持較高的生態幅和形成多抗逆性有關。
綜上所述,生活在海岸帶的濱麥主要是通過營養繁殖擴大種群,其地下根莖的延伸生長在維持植物的延續生長中起重要作用。在冬季不同生態斷帶濱麥隨溫度降低將大量非結構性碳水化合物轉移至地下繁殖器官根莖和芽中以維持其滲透勢和水分平衡,淀粉和纖維素為越冬呼吸消耗提供能量而在越冬生存中起重要作用。但處于高鹽土壤和受海風影響大的近高潮線濱麥冬季較早地將可溶性糖轉移至地下器官,并維持地下部較高的可溶性糖,春季返青葉片中維持較高的纖維素含量與其抗凍、抗鹽、抗風密切相關。而生活在遠離高潮線土壤鹽度低、海風強度變小環境的濱麥(50 m處),冬季地下部較少的可溶性糖含量與土壤較低的鹽度呈正相關,春季返青早也與微環境溫度較高有關。因此,而不同生態斷帶濱麥冬季地下部非結構性碳水化合物儲存量的多寡和春季葉片結構性碳水化合量的多少與其生活環境的異質性相關。濱麥較強的生理可塑性可能是其可適應不同鹽度土壤、不同海風風力、不同溫度環境而具有抗鹽耐風沙和較大生態幅的關鍵。 為此,濱麥較大的生理可塑性為其開發利用提供了可能性,也為提高其生產力制定合理的耕作措施提供了依據。
[1]Hutchings M J, De Kroom H. Foraging in plants the role of morphological plasticity in resource acquisition. Advances in Ecological Research, 1994, 25(1): 159- 238.
[2]Poor A, Hershock C, Rosella K, Goldberg D E. Do physiological integration and soil heterogeneity influence the clonal growth and foraging of Schoenoplectus pungens?. Plant Ecology, 2005, 181(1): 45- 56.
[3]Zhai Y, Lv Y F, Li X, Wu W M, Bo W H, Shen D F, Xu F, Pang X M, Zheng B S, Wu R L. A synthetic framework for modeling the genetic basis of phenotypic plasticity and its costs. New Phytologist, 2014, 201(1): 357- 365.
[4]許凱揚, 葉萬輝, 李靜, 李國民. 入侵種喜旱蓮子草對土壤養分的表型可塑性反應. 生態環境, 2005, 14(5): 723- 726.
[5]耿宇鵬, 張文駒, 李博, 陳家寬. 表型可塑性與外來植物的入侵能力. 生物多樣性, 2004, 12(4): 447455.
[6]申時才, 徐高峰, 李天林, 張付斗, 張玉華. 5種入侵植物補償反應及其形態可塑性比較. 西北植物學報, 2012, 32(1): 173- 179.
[7]郭立冬, 何興東. 不同氣溫與土壤濕度條件下籽蒿幼苗的表型可塑性. 中國沙漠, 2011, 31(4): 987- 991.
[8]于海飛, 董鳴, 張稱意, 張淑敏. 匍匐莖草本金戴戴對基質鹽分含量的表型可塑性. 植物生態學報, 2002, 26(2): 140- 148.
[9]胡啟鵬, 郭志華, 李春燕, 馬履一. 植物表型可塑性對非生物環境因子的響應研究進展. 林業科學, 2008, 44(5): 135- 142.
[10]Bell D L, Sultan S E. Dynamic phenotypic plasticity for root growth in Polygonum: a comparative study. American Journal of Botany, 1999, 86(6): 807- 819.
[11]Portsmuth A, Niinemets ü. Structural and physiological plasticity in response to light and nutrients in five temperate deciduous woody species of contrasting shade tolerance. Functional Ecology, 2007, 21(1): 61- 77.
[12]Niinemets ü. Photosynthesis and resource distribution through plant canopies. Plant, Cell and Environment, 2007, 30(9): 1052- 1071.
[13]張治安, 楊福, 陳展宇, 徐克章. 菰葉片凈光合速率日變化及其與環境因子的相互關系. 中國農業科學, 2006, 39(3): 502- 509.
[14]Loewe A, Elinig W, Shi L B, Dizengremel P, Hampp R. Mycorrhiza formation and elevated CO2both increase the capacity for sucrose synthesis in source leaves of spruce and aspen. New Phytologist, 2000, 145(3): 565- 574.
[15]周瑞蓮, 張普金. 春季高寒草地牧草根中營養物質含量和保護酶活性的變化及其生態適應性研究. 生態學報, 1999, 16(4): 402- 407.
[16]江志堅, 黃小平, 張景平. 環境脅迫對海草非結構性碳水化合物儲存和轉移的影響. 生態學報, 2012, 32(19): 6242- 6250.
[17]Turner L R, Donaghy D J, Lane P A, Rawnsley R P. Patterns of leaf and root regrowth, and allocation of water-soluble carbohydrate reserves following defoliation of plants of prairie grass (Bromus willdenowii Kunth.). Grass and Forage Science, 2007,62(4): 497- 506.
[18]Alcoverro T, Zimmerman R C, Kohrs D G, Alberte R S. Resource allocation and sucrose mobilization in light-limited eelgrass Zostera marina. Marine Ecology Progress Series, 1999, 187: 121- 131.
[19]Cai Q S, Wang S Z, Cui Z P, Sun J H, Ishii Y. Changes in freezing tolerance and its relationship with the contents of carbohydrates and proline in overwintering centipedegrass (Eremochloaophiuroides(munro) hack.). Plant Production Science, 2004, 7(4): 421- 426.
[20]Gaudet D A, Laroche A, Yoshida M. Low temperature wheat fungal interactions: A carbohydrate connection. Physiologia Plantarum, 1999, 106(4): 437- 444.
[21]張志良, 瞿偉菁. 植物生理學實驗指導 (第三版). 北京: 高等教育出版社, 2003: 127- 133.
[22]潘慶民, 白永飛, 韓興國, 楊景成. 植物非結構性貯藏碳水化合物的生理生態學研究進展. 植物學通報, 2002, 19(1): 30- 38.
[23]高英志, 王艷華, 王靜婷, 劉鞠善, 王德利. 草原植物碳水化合物對環境脅迫響應研究進展. 應用生態學報, 2009, 20(11): 2827- 2831.
[24]Shi C G, Silva L C R, Zhang H X, Zheng Q Y, Xiao B X, Wu N, Sun G. Climate warming alters nitrogen dynamics and total non-structural carbohydrate accumulations of perennial herbs of distinctive functional groups during the plant senescence in autumn in an alpine meadow of the Tibetan Plateau, China. Agricultural and Forest Meteorology, 2015, 200: 21- 29.
[25]白永飛, 許志信, 段淳清, 李德新. 典型草原主要牧草植株貯藏碳水化合物分布部位的研究. 中國草地, 1996, (1): 7- 9.
[26]張光輝, 李增嘉, 潘慶民, 寧堂原, 楊景成. 內蒙古典型草原羊草和大針茅地下器官中碳水化合物含量的季節性變化. 草業學報, 2006, 15(3): 42- 49.
[27]孫啟忠, 王育青, 侯向陽.紫花苜蓿越冬性研究概述. 草業學報, 2004, 21(3): 21- 25.
[28]周瑞蓮, 趙哈林. 高寒山區牧草生長過程中低溫保護物質的作用. 中國草地, 2001, 23(5): 19- 26.
[29]周瑞蓮, 趙哈林. 春季高寒山區牧草低溫保護物質變化與其脫凍適應間系研究. 西北植物學報, 2004, 24(2): 199- 204.
[30]Aerts R, Chapin F S III. The mineral nutrition of wild plants revisited: a re-evaluation of processes and patterns. Advances in Ecological Research, 1999, 30: 1- 67.
[31]Kerkhoff A J, Fagan W F, Elser J J, Enquist B J. Phylogenetic and growth form variation in the scaling of nitrogen and phosphorus in the seed plants. The American Naturalist, 2006, 168(4): E103-E122.
[32]Xu S X, Zhao X Q, Sun P, Zhao T B, Zhao W, Xue B. A simulative study on effects of climate warming on nutrient contents and in vitro digestibility of herbage grown in Qinghai-Xizang Plateau. Acta Botanica Sinica, 2002, 44(11): 1357- 1364.
[33]K?rner C. Alpine Plant Life: Functional Plant Ecology of High Mountain Ecosystems. Berlin: Springer-Verlag, 2003.
[34]Surprenant J, Barnes D K, Busch R H, Marten G C. Bidirectional selection for neutral detergent fiber and yield in reed canarygrass. Canadian Journal of Plant Science, 1988, 68(3): 705- 712.
[35]Cusicanqui J A, Lauer J G. Plant density and hybrid influence on corn forage yield and quality. Agronomy Journal, 1999, 91(6): 911- 915.
[36]周瑞蓮, 王相文, 左進城, 楊潤亞, 黃清榮, 劉怡. 海岸不同生態斷帶植物根葉抗逆生理變化與其Na+含量的關系. 生態學報, 2015. DOI:10.5846/stxb201310032406.
[37]Zhang J X, Nguyen H T, Blum A. Genetic analysis of osmotic adjustment in crop plants. Journal of Experimental Botany, 1999, 50(332): 291- 302.
[38]Niklas K J. Plant allometry, leaf nitrogen and phosphorus stoichiometry, and interspecific trends in annual growth rates. Annals of Botany, 2006, 97(2): 155- 163.
Relationship between the changes of carbohydrate metabolism inLeymusmollis(Trin.) Hara and the environmental heterogeneties on coast during winter and spring
ZHANG Tingfeng1, ZHOU Ruilian1,*, ZHANG Yue1, WANG Yanfang1, JIA Youyu2
1SchoolofLifeScience,LudongUniversity,Yantai264025,China2InnerMongoliaAcademyofAgricultureandAnimalHusbandrySciencesandInstituteofResourcesEnvironmentandDetectionTechnology,Hohhot010030,China
Leymusmollis(Trin.) Hara growing on coastal dunes at different zones from the high tide in Yantai, China, was used as a study material. The contents of soluble sugar, starch, and cellulose in the leaves and various sections of the root ofL.molliswere measured during late fall and winter when the temperature decreased to below 0℃, and in the spring when the temperatures started rising, in order to understand the correlation between changes of carbohydrate levels and environmental heterogeneity and to elucidate the role of physiological plasticity inL.mollisin the adaptation to wind and salt. The results showed thatL.mollisgrown on dunes near to the high tide line (10 m), characterized by higher salt concentration in the soil, higher moisture level, higher wind speed, and lower temperatures had stronger and thicker rhizomes and shoots, foliage grew closer to the groud, and sprouting commenced later in spring. In contrast,L.mollisgrowing away from the high tide line (50 m), in the zone characterized by lower soil salinity, lower wind speed, and higher temperature, had thinner roots, slender branches and leaves, and sprouting occurred in early spring. These results indicate that morphological plasticityofL.mollisgrowingoncoastal dunes was associated with environmental heterogeneity. With the drop of temperature in late fall, the non-structural carbohydrates in the leaves ofL.molliswere transported to the roots, buds, and rhizome, stored in these organs as a carbohydrate pool. As the soluble sugars were removed from the roots and rhizomes to the buds, the starch content decreased and cellulose content increased in the roots and the rhizome. A difference was detected in the carbohydrate transfer and conversion inL.mollisgrowingoncoastal dunes at different distance from the high tide.L.mollisat the zone near to the high tide line (10 m) transferred the non-structural carbohydrates from the leaves to the roots earlier in the winter, stored more non-structural carbohydrates in the roots, and sprouted later in the spring. However, they accumulated more cellulose in the leaves, which was correlated with higher resistance to low temperature and sea wind.L.mollisgrowing 50 m away from the high tide line had a longer living cycle extending into late fall, they transferred less non-structural carbohydrates from the leaves to the roots in winter, stored less non-structural carbohydrates in the roots, and earlier sprouting root in spring. These results indicate that at 50m the content of nonstructural carbohydrates in leaves and roots was highly associated with plant′s rapid growth and adaptation to lower salinity and wind speed. The results suggested that the physiological plasticity of carbohydrate metabolism inL.mollisgrowing on coastal dunes at different distance from the high tide line played an important role in its adaptation to heterogeneous environment, resulting in morphological plasticity, maintaining high ecological amplitude, and formation of resistance to salt and sea wind.
coastal dune;Leymusmollis(Trin.) Hara; carbohydrate content; environmental heterogeneity; winter-spring
國家自然科學基金資助項目(31270752);煙臺市科技局資助項目(2013ZH351)
2015- 01- 26; 網絡出版日期:2015- 12- 01
Corresponding author.E-mail: zhour726@163.com
10.5846/stxb201501260207
張婷鳳,周瑞蓮,張玥,王艷芳,賈有余.冬春季海岸濱麥碳水化合物變化差異性與其環境異質性的關系.生態學報,2016,36(16):5182- 5192.
Zhang T F, Zhou R L, Zhang Y, Wang Y F, Jia Y Y.Relationship between the changes of carbohydrate metabolism inLeymusmollis(Trin.) Hara and the environmental heterogeneties on coast during winter and spring.Acta Ecologica Sinica,2016,36(16):5182- 5192.

