FoxO1轉錄因子在巨噬細胞中的表達與炎癥的關系
張娜,張紫燕,趙凌霞,姚怡,楊瑩,張建林,鄭國平
山西醫科大學基礎醫學院,山西太原 030000
FoxO1轉錄因子在巨噬細胞中的表達與炎癥的關系
張娜,張紫燕,趙凌霞,姚怡,楊瑩,張建林,鄭國平
山西醫科大學基礎醫學院,山西太原030000
目的通過研究叉頭框蛋白1(forkhead transcription factors of O class 1,FoxO1)轉錄因子mRNA水平和蛋白水平在巨噬細胞的表達以及檢測Foxo1干擾和過表達后巨噬細胞分泌的炎癥因子含量,從炎癥進展的角度探討FoxO1轉錄因子與炎癥之間的關系。方法①利用脂多糖(lipopolysaccharide,LPS)刺激巨噬細胞Ana-1制作炎癥模型,ELISA測炎癥因子IL-6、TNF-α的濃度;②采用Real-Time PCR,Western Blot測FoxO1轉錄因子在mRNA水平以及蛋白水平的含量;③利用脂質體2 000將FoxO1 siRNA轉染Ana-1細胞,采用ELISA檢測對照組和干擾組分泌的炎癥因子IL-6、TNF-α的含量;④利用脂質體2 000將FoxO1過表達質粒轉染Ana-1細胞,采用ELISA檢測LPS組和過表達組炎癥因子IL-6、TNF-α的含量。結果①ELISA實驗顯示,在LPS的濃度為50 ng/mL時巨噬細胞分泌的炎癥因子IL-6、TNF-α含量分別為2190、1124ng/mL,干預時間為36h時分別為2190、1995 ng/mL。此條件下炎癥因子含量最高;②Real-Time PCR實驗和Western blot實驗結果顯示,在LPS組FoxO1轉錄因子mRNA水平是對照組的0.36倍,蛋白水平的表達量是對照組的0.58倍;③Foxo1 siRNA干擾實驗結果顯示,與對照組相比,干擾組巨噬細胞分泌炎癥因子TNF-α含量從782 ng/mL上升到1 290 ng/mL,IL-6的含量從161 ng/mL上升到251 ng/mL;4.脂質體轉染過表達FoxO1質粒實驗顯示,與LPS組相比,過表達組巨噬細胞分泌炎癥因子TNF-α的含量從1 785 ng/mL下降到1 329 ng/mL,IL-6含量從486 ng/mL下降到317 ng/mL。結論LPS刺激巨噬細胞Ana-1產生炎癥反應,導致炎癥因子的釋放,同時下調Foxo1轉錄因子在mRNA水平和蛋白水平的含量,特異性FoxO1基因沉默可上調炎癥因子的釋放。過表達FoxO1可以使炎癥反應減輕,證明Foxo1轉錄因子參與巨噬細胞引起的炎癥反應。
FoxO1轉錄因子;巨噬細胞;炎癥反應
炎癥是臨床上常見的病理生理反應過程,任何能夠引起組織損傷的因素都可能誘發炎癥反應,而且持續的炎癥會導致器官和組織的功能障礙,因此如何控制炎癥是目前醫學界的一個難題。在炎癥過程中巨噬細胞扮演著比較重要角色。雖然巨噬細胞在損傷和組織修復中起著重要的保護作用,但是它的持續激活會促進機體的病理狀態。研究表明巨噬細胞可根據接收的不同微環境信號被誘導成為不同極化狀態的巨噬細胞,從而執行多種多樣的功能比如炎癥、細菌吞噬、免疫調節等[1]。FoxO1是Fox轉錄家族的重要成員,廣泛分布于機體的各類組織和細胞中,其在胞漿內的存在形式為磷酸化的FoxO1,上游主要受到PI3K/Akt信號傳導通路調控,活化后的Akt可使FoxO1轉錄因子發生磷酸化由核內轉移至細胞胞漿而失去轉錄活性[2]。羅丹等[3]的研究顯示FoxO1轉錄因子在mRNA水平的表達在膽汁淤積性肝纖維化的肝性炎癥中有低表達現象,因此該研究想探討在巨噬細胞引起的炎癥反應中Foxo1的變化情況以及Foxo1的變化對炎癥的影響情況。
1 資料與方法
1.1一般資料
1.1.1試劑改良型RPMI-1640培養基,胎牛血清,ELISA試劑盒,Trizol Reagent、反轉錄試劑盒、Lipo2 000,SYBR GREEN實時PCR預混液,凝膠制備試劑盒、ECL化學發光液,Phospho-FoxO1 Rabbit mAb、FoxO1 Rabbit mAb、siRNA FoxO1,羊抗兔IgG。
1.1.2細胞巨噬細胞Ana-1(中國科學院細胞庫)。
1.2實驗方法
1.2.1實驗分組共分為4組。對照組為正常Ana-1細胞;LPS組為Ana-1細胞中加入LPS;干擾組為用FoxO1 siRNA轉染Ana-1細胞;過表達組為用過表達質粒pcDNA-FoxO1轉染Ana-1細胞。
1.2.2利用LPS刺激Ana-1細胞制作炎癥模型ELISA法檢測炎癥因子IL-6、TNF-α的濃度:將細胞鋪六孔板,按LPS濃度0、10、50、100、500、1 000 ng/mL加入培養基,刺激時間按16、24、36、48 h處理,收上清。相同標本3個復孔,重復3次,在酶標儀450 nm測定吸光度值,根據ELISA軟件繪制標準曲線,計算各樣本濃度。
1.2.3Real-Time PCR檢測FoxO1基因的變化:收集對照組和LPS組Ana-1細胞,加1 mL Trizol RNA提取試劑,提取Ana-1細胞總RNA,根據反轉錄試劑盒將提取的總RNA反轉錄成cDNA,最后使用大連Takara公司SYBR GREEN試劑盒說明書進行下一步操作。
1.2.4Western雜交分析收集對照組和LPS組Ana-1細胞,加入細胞裂解液,在冰上放置2 h裂解細胞,離心機4℃12 000×g離心5 min,提取上清液用BCA法測蛋白含量。按30 ug蛋白經煮沸10 min后,開始10%SDS-PAGE凝膠電泳,隨后濕轉將蛋白質轉到PVDF膜上。膜在5%脫脂奶粉中封閉,室溫1h。而后分別與不同一抗(1:1 000)孵育(anti-phospho-FoxO1、anti-FoxO1和GAPDH抗體),4℃搖床過夜,第二日PBST洗膜,15 min,洗3次,然后使用對應的二抗雜交,室溫1 h,PBST洗膜3次后在,將PVDF膜放入凝膠成像儀內,膜上滴ECL發光液,A液:B液= 1:1,30 s曝光。
1.2.5siRNA FoxO1轉染轉染的前24 h在培養皿中培養Ana-1細胞,細胞數量適中,用MEM稀釋好Lipo2 000和siRNA,將兩者輕輕搖晃至均勻,然后在室溫條件下孵育20 min使之形成siRNA-Lipo2 000混合液,添加到24 h前已經在培養皿中培養的Ana-1細胞中。36 h后收集細胞以及上清液,利用細胞做普通PCR檢測FoxO1轉錄因子mRNA水平的表達量,上清液做ELISA測炎癥因子的含量[4]。
1.2.6過表達質粒轉染將過表達質粒pcDNA-Fox-O1轉染入巨噬細胞Ana-1細胞中。轉染步驟同上[5-6]。
1.3統計方法
使用SPSS 16.0統計軟件包對數據進行分析,實驗數據以(±s)表示,采用t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1ELISA檢測炎癥因子IL-6、TNF-α的濃度
LPS濃度從0 ng/mL增加到50 ng/mL的時候,Ana-1細胞分泌的炎癥因子IL-6和TNF-α的含量逐漸升高。當濃度為50 ng/mL時,此時炎癥因子的含量是最高的,炎癥因子IL-6、TNF-α的含量分別為1 124、2 241 ng/mL。從LPS加到100 ng/mL開始,Ana-1細胞分泌的炎癥因子IL-6、TNF-α的含量開始緩慢降低趨于平穩。當LPS濃度固定在50 ng/mL,隨著時間的變化,炎癥因子的含量也在變化,從16 h炎癥因子的含量逐漸上升,到36 h達到高峰,然后緩慢下降。因此,LPS刺激巨噬細胞Ana-1的濃度為50 ng/mL,時間為36 h。見圖1。

圖1 不同濃度LPS以及時間下炎癥因子的濃度
2.2Real-Time PCR測得FoxO1 mRNA水平的含量變化
用Real-Time PCR方法檢測對照組Ana-1細胞以及LPS組Ana-1細胞中FoxO1轉錄因子mRNA水平的含量表達。結果顯示,與對照組Ana-1細胞相比,在LPS組中FoxO1轉錄因子在mRNA水平的表達量下降,是對照組的0.36倍,因此差異有統計學意義(P<0.05)。說明在LPS刺激會引起炎癥因子的含量的升高,同時引起FoxO1 mRNA水平的下降,可以推斷出炎癥反應確實和FoxO1轉錄因子有關。見圖2。

圖2 FoxO1的實時熒光定量PCR擴增結果
2.3Western Blotting測得FoxO1蛋白水平含量變化
Western Blotting結果表明,巨噬細胞Ana-1磷酸化FoxO1蛋白在對照組細胞的表達量和LPS組細胞差異無統計學意義(P>0.05),但是FoxO1蛋白在LPS組的表達量是對照組的0.58倍,差異有統計學意義(P<0.05)。反映了FoxO1轉錄因子在基因水平和蛋白水平的同步。見圖3。

圖3 western blot檢測FoxO1蛋白水平的表達
2.4Foxo1 siRNA轉染后測炎癥因子含量變化
Ana-1細胞進行Foxo1 siRNA轉染后,用普通PCR檢測轉染成功。ELISA實驗檢測出炎癥因子的含量,轉染組相比于對照組,細胞炎癥因子TNF-α含量從782 ng/mL上升到1 290 ng/mL,IL-6的含量從161 ng/mL上升到251 ng/mL,炎癥因子含量顯著上升,此結果提示Foxo1轉錄因子mRNA水平在正常巨噬細胞中表達下降會誘導細胞分泌炎癥因子,因此可以推測FoxO1轉錄因子在炎癥反應過程中確實發揮很重要的作用。見圖4。

圖4 Foxo1 siRNA轉染后炎癥因子的含量
2.5脂質體2 000轉染過表達質粒檢測炎癥因子含量
利用脂質體2 000將過表達質粒pcDNA-FoxO1轉染進入LPS組細胞中,普通PCR檢測轉染成功。ELISA檢測炎癥因子含量,過表達組Ana-1細胞相比于LPS組細胞,細胞炎癥因子TNF-α的含量從1 785 ng/mL下降到1 329 ng/mL,IL-6含量從486 ng/mL下降到317 ng/mL,炎癥因子含量顯著下降。此結果可以推測,過表達FoxO1可以抑制炎癥因子的釋放,對炎癥反應起到抑制作用。見圖5。
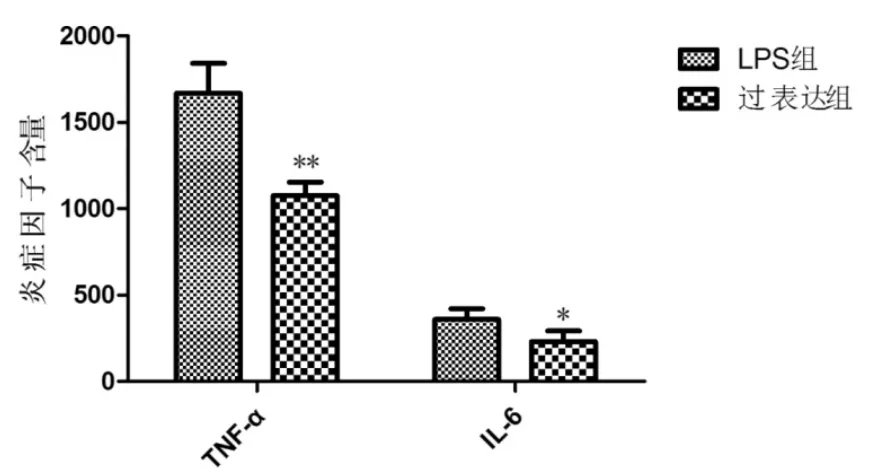
圖5 過表達質粒轉染后炎癥因子的含量
3 討論
炎癥是免疫反應中的一個重要概念,指的是病原微生物或組織損傷引起的機體的局部和全身發生的一系列復雜的免疫應答過程。急性炎癥反應是機體自身防御感染以及修復損傷的保護性反應,當炎癥持續進展變成慢性時,就會造成組織細胞的損傷,引發多種疾病[7]。在炎癥反應過程中巨噬細胞扮演著重要角色,它通過吞噬以及分泌多種炎癥因子對炎癥反應發揮重要的調節作用[8]。巨噬細胞分泌的炎癥因子中TNF-α、IL-6是比較經典的炎性因子,它們的分泌進一步導致血管內皮損傷、炎癥細胞的募集和粘附等,加重炎癥。如果能控制炎性因子的分泌,就能夠極大減輕炎癥反應。
Fox(forkhead/winged helix transcription factor)基因家族具有高度保守的Forkhead結構域,同時還有DNA結合、轉錄活化和轉錄抑制等功能。轉錄因子FoxO家族成員包括FoxO1、FoxO4、FoxO3a、FoxO6等。FoxO1在胞漿內的存在形式為磷酸化的FoxO1,活化的Akt能夠使FoxO1發生磷酸化從核內轉移至細胞胞漿,失去轉錄活性[9]。楊雙雙等[10]研究發現在小鼠肝臟結扎至肝膽管致纖維化的模型中,有關炎癥和增殖的Fox轉錄因子明顯下降,提示Fox轉錄因子有可能參與了肝臟炎癥以及肝臟纖維化的發生。羅丹[3]研究在膽汁淤積性肝纖維化的肝性炎癥中,應用realtime PCR測出模型組小鼠肝組織FoxO1在4個時間點(1、3、7、14 d)mRNA水平的表達全部低于陰性對照組。這些實驗結果暗示也許FoxO1是炎癥過程中一個重要轉錄因子。因此該研究在細胞水平觀察FoxO1轉錄因子的變化探討其與炎癥的關系。
本研究首先是制作炎癥模型,利用LPS刺激巨噬細胞Ana-1分泌促炎性細胞因子建立體外炎癥模型,雖然是體外模型,但是可以模擬體內的炎癥反應過程[11]。采用ELISA技術測出炎癥模型分泌的炎癥因子TNF-α和IL-6的濃度,結果顯示:在LPS的濃度為50 ng/mL時巨噬細胞分泌的炎癥因子IL-6、TNF-α含量分別為2 190、1 124 ng/mL,干預時間為36 h時炎癥因子IL-6、TNF-α含量分別為2 190 ng/mL、1 995 ng/mL。此條件下炎癥因子含量最高,提示我們此時炎癥模型的效果最佳。其次應用Real-Time PCR以及Western blotting檢測對照組Ana-1細胞和LPS組Ana-1細胞FoxO1轉錄因子在mRNA以及蛋白的表達水平。結果顯示:與對照組Ana-1細胞比較,FoxO1轉錄因子在mRNA水平是對照組的0.36倍,蛋白水平是對照度的0.58倍,表達含量均下降(P<0.05),提示FoxO1轉錄因子在巨噬細胞引起的炎癥反應中有含量變化,可能參與炎癥反應。最后觀察FoxO1 siRNA以及過表達質粒pcDNA-FoxO1轉染Ana-1細胞后炎癥因子的分泌量,結果顯示:siRNA下調Fox O1轉錄因子mRNA水平的含量后,與對照組Ana-1細胞相比,干擾組Ana-1細胞分泌的炎癥因子TNF-α含量從782 ng/mL上升到1 290 ng/mL,IL-6的含量從161 ng/mL上升到251 ng/mL;過表達質粒pcDNA-FoxO1轉染Ana-1細胞上調FoxO1轉錄因子mRNA水平的表達后,與LPS組細胞相比,過表達組細胞分泌炎癥因子TNF-α的含量從1 785 ng/mL下降到1 329 ng/mL,IL-6含量從486 ng/mL下降到317 ng/mL。結果提示:FoxO1轉錄因子參與由巨噬細胞引起的炎癥反應。
這個實驗初步探討了在單一環境中巨噬細胞引起的炎癥改變FoxO1轉錄因子在mRNA水平和蛋白水平的表達以及兩者之間的關系,下一步我們將在動物體內觀察FoxO1轉錄因子是否具有同樣的功效,為臨床控制炎癥反應提供初步的理論基礎。
[1]Biswas SK,Mantovani A.Macrophage plasticity and interaction with Lymphocy-te subsets:Cancer as a paradigm[J]. Nat Immunol,2010,11:889-896.
[2]黃寧,李佳文,安利國,等.FoxO1的功能及其與人類疾病的關系[J].生命科學.2012,4(21):35-37.
[3]羅丹.膽汁淤積性肝纖維化時的肝性炎癥及Foxo基因表達的意義初探[D].重慶:重慶醫科大學,2009:39-44.
[4]孟祥斌.NF-kB p65 siRNA轉染體外抑制VSMC增殖和放置抑制靜脈內膜增生的實驗研究[D].濟南:山東大學,2015:16-17.
[5]楊碩,金玉懷.PcDNA3/PD-L1及pcDNA3/B7.1真核表達質粒構建以及免疫作用的初步研究[D].石家莊:河北醫科大學,2013:34-42.
[6]Karlowicz A,Wegrzyn K.Proteolysis in plasmid DNA stable maintenance in bacterial cell[J].Plasmid,2016(5):1-7.[7]Kitamura T,Kitamura Y.The roles of FOXO1 in various metabolic organs[J].Seikagaku,2015,87(2):176-182.
[8]楊琴,張志仁,姜曼,等.小鼠巨噬細胞功能極化可塑性的初步探討[J].免疫學雜志,2013(2):24-27.
[9]Lars-Oliver Klotz,et al.Redox regulation of FoxO transcription fators[J].Redox Biology.2015,6:51-72.
[10]楊雙雙,黃世峰,張莉萍,等.Fox轉錄因子家族在正常和膽道結扎小鼠肝臟中的動態表達[J].國際檢驗醫學雜志,2010,6(31):533-535.
[11]余功旺,黃文浩,劉愛梅,等.小鼠腹腔巨噬細胞炎癥模型的建立[J].廣東藥學院學報,2014,30(6):766-770.
The Content Change Of FoxO1 Transcription Factor in Macrophages and the Relationship with Inflammation
ZHANG Na,ZHANG Zi-yan,ZHAO Ling-xia,YAO Yi,YANG Ying,ZHANG Jian-lin,ZHENG Guo-ping Basic medical,Shanxi Medical University,Taiyuan,Shanxi Province,030000 China
Objective Through study the content changes of FoxO1 transcription factor in the level of mRNA and protein in Macrophage as well as after the interference of the Foxo1 siRNA detective the content of inflammatory factors.From the perspective of inflammation progress to discuss the relationship between Foxo1 transcription factor and inflammation.Methods①Used LPS stimulate the Macrophage(Ana-1 cell)to product model of inflammation,then detected the inflammatory factor with ELISA.②Used Real-Time PCR、Western blotting to detect the content of FoxO1 transcription factor in level of mRNA and protein.③Used Lipo2 000 put FoxO1 siRNA in Ana-1 cell Media,We utilized ELISA to detect the concentration of the inflammation factor IL-6,TNF-α in control group and interference group.4. Used Lipo2 000 put FoxO1 over-expression plasmid in Ana-1 cell,We utilized ELISA to detect the concentration of the inflammation factor IL-6,TNF-α in LPS group and over-expression group.Results①Elisa test showed:when the concentration of LPS was 50 ng/mL,the content of inflammatory factor TNF-α、IL-6 is factor IL-6、TNF-α is 2 190、1 995 ng/mL.In this condition,the content of inflammatory factor was the maximum;②Real-Time PCR and Western blot test showed:The content of FoxO1 transcription factor in level of mRNA in the interference group was 0.36 times as much as the control group,the content of FoxO1 transcription factor in level of protein was 0.58 times as much as the control group;③Foxo1 siRNA interference test showed:compared with the control group,the interference group Ana-1cell secreted the content of inflammatory factors TNF-α was increased from 782 ng/mL to 1 290 ng/mL、IL-6 was increased from 161 ng/mL to 251 ng/mL;④Using Lipo 2 000 transfect the over-expreesion plasmid test showed:Compared with LPS group,the over-expression group Ana-1 cell secreted the content of inflammatory factors TNF-αwas dropped from 1 785 ng/mL to 1 329 ng/mL,IL-6 was dropped from 486 ng/mL to 317 ng/mL.Conclusion LPS stimulate the Ana-1 cell,then cause the inflammatory reaction,inducing the release of inflammation factor,meanwhile down-regulate the Foxo1 transcription factor in level of mRNA.Specific gene sliencing can up-regulate the release of inflammatory factors.Foxo1 transcription factor indeed participate in the progress of inflammatory reaction.
FoxO1 transcription factor;Macrophage;Inflammatory reaction
R36
A
2096-1782(2016)09-0001-06
10.19368/j.cnki.2096-1782.2016.09.001
2016-06-15)
張娜(1989.11-),女,陜西西安人,碩士研究生,研究方向:生物化學與分子生物學。
鄭國平(1962.6-),男,澳大利亞人,博士,教授,研究方向:腎臟纖維化,E-mail:guoping.zheng@sydney.edu. au。

