人參總皂苷對β-淀粉樣蛋白25~35誘導的海馬神經(jīng)細胞毒性的保護作用
張國雙 王志濤 趙 琦 尋知元
(天津市安定醫(yī)院,天津 300222)
?
人參總皂苷對β-淀粉樣蛋白25~35誘導的海馬神經(jīng)細胞毒性的保護作用
張國雙王志濤1趙琦2尋知元
(天津市安定醫(yī)院,天津300222)
目的探討人參總皂苷對β-淀粉樣蛋白(Aβ25~35)誘導的海馬神經(jīng)細胞毒性的保護作用。方法建立大鼠海馬神經(jīng)細胞Aβ25~35損傷模型。通過Neurofilament染色,測定細胞毒性以及乳酸脫氫酶(LDH)活性考察人參總皂苷對Aβ25~35誘導的海馬神經(jīng)細胞毒性的保護作用;利用Hoechst33258進行免疫熒光染色實驗,觀察細胞形態(tài),檢測細胞凋亡情況;通過Fluo-3AM熒光探針技術(shù)在共聚焦顯微鏡下測定細胞內(nèi)鈣離子濃度 (〔Ca2+〕i)的變化情況。結(jié)果1.5 μmol/L Aβ25~35為造成神經(jīng)細胞毒性的最佳濃度。人參總皂苷50 mg/L,100 mg/L以及200 mg/L對Aβ25~35誘導的海馬神經(jīng)細胞具有良好保護作用,呈現(xiàn)出一定的劑量依賴性。人參總皂苷100 mg/L可顯著降低Aβ25~35誘導的神經(jīng)細胞凋亡,可明顯抑制Aβ25~35誘導的海馬神經(jīng)細胞〔Ca2+〕i的升高。結(jié)論人參總皂苷可有效保護海馬神經(jīng)細胞免受Aβ25~35毒性損傷,其作用機制與降低〔Ca2+〕i有關(guān)。
人參總皂苷;β-淀粉樣蛋白(Aβ)25~35;海馬神經(jīng)細胞;細胞內(nèi)鈣離子濃度〔Ca2+〕i
阿爾茨海默病(AD)主要表現(xiàn)為記憶力減退、認知功能障礙、分析判斷能力的下降、意識模糊和智力逐漸喪失、甚至人格改變,最終導致生活不能自理〔1〕。在65歲以上人群中,AD是繼心血管病、腫瘤、腦卒中之后的第4位死亡原因〔2,3〕。AD發(fā)病早期的關(guān)鍵性環(huán)節(jié)是β-淀粉樣前體蛋白(APP)分解代謝和β-淀粉樣蛋白(Aβ)的異常釋放和沉積〔4〕。目前,獲得批準治療AD的藥物主要是有益于記憶和思維的,并不能夠針對疾病的病因來治療〔5〕。因此尋找從發(fā)病機制上能改善AD的藥物非常有現(xiàn)實意義。體外原代培養(yǎng)海馬細胞,采用Aβ25~35損傷海馬細胞,可一定程度上模擬在體AD的發(fā)生機制。本實驗旨在探討人參總皂苷對Aβ25~35誘導的海馬神經(jīng)細胞毒性的保護作用。
1 資料與方法
1.1實驗試劑Aβ25~35購自Sigma(美國)人參總皂苷購買于成都普瑞法生物有限公司(成都,中國)。
1.2動物、給藥及分組雌性SD大鼠,體重200~220 g,孕期18 d,由天津大學動物實驗中心提供。海馬細胞生長至第7天后,取出海馬細胞進行分別處理:①正常組,不加任何處理因素,換上同體積的新鮮的無血清DMEM培養(yǎng)基;②模型組,在每孔中加入Aβ25~35終濃度為1.5 μmol/L無血清DMEM培養(yǎng)基;③人參總皂苷組(含Aβ25~351.5 μmol/L)。每小組藥物均用無血清DMEM培養(yǎng)液配制。置于37℃,5% CO2培養(yǎng)箱中培養(yǎng)24 h。
1.3細胞活性以及乳酸脫氫酶(LDH)活性測定向96孔板的每孔加入20 μl MTT(3 mg/ml)繼續(xù)培養(yǎng),4 h后吸棄上清,加入150 μl二甲基亞砜,充分振蕩至晶體完全溶解,于酶標儀490 nm波長下測各孔的光密度值(OD),并計算相對生存率。取各孔的細胞培養(yǎng)基,按照南京建成LDH試劑盒說明書操作,并在450 nm處測定各組吸光度值,計算各組培養(yǎng)基中LDH活性。
1.4Hoechst33258 染色方法培養(yǎng)海馬神經(jīng)細胞于第7天給藥處理,分為正常組,模型組(Aβ25~351.5 μmol/L),人參總皂苷組(20 μmol/L)給藥處理24 h后開始免疫染色。按章立等〔6〕等方法操作,冷PBS清洗,4%多聚甲醛固定1 h。PBS清洗3次后,加5 mg/L Hoechst33258染色液染色30 min,PBS液清洗,封片液封片,在倒置熒光顯微鏡下觀察。細胞核固縮或碎片分裂視為凋亡。于64× 鏡下每片玻璃片隨機取5個不同視野,計算細胞凋亡率(凋亡細胞數(shù)/總細胞數(shù))。
1.5激光共聚焦測定細胞內(nèi)鈣離子(〔Ca2+〕i)濃度根據(jù)報道的實驗方法測定海馬細胞內(nèi)鈣離子濃度〔6〕。采用Fluo-3 AM熒光染色鈣離子,激發(fā)光波長為488 nm左右,發(fā)射波長為525~530 nm測定〔Ca2+〕i。激光共聚焦皿培養(yǎng)神經(jīng)細胞7 d,棄去培養(yǎng)液,PBS洗兩遍,加入終濃度為5 μmol/L Fluo-3AM與D-Hank(無Ca2+)的混合液,負載45 min后,測定F值;加入Ionomycin終濃度為5 μmol/L測定Fmax;加入MnCl2終濃度為2 mmol/L測定Fmin,計算〔Ca2+〕i濃度。
1.6統(tǒng)計學處理采用SPSS17.0軟件包進行t檢驗。
2 結(jié) 果
2.1Aβ25~35造成海馬神經(jīng)細胞損傷海馬神經(jīng)細胞在加入1.5 μmol/L Aβ25~355 h后,利用MTT法檢測細胞相對生存率為(78.9±6.3)%。綜合細胞形態(tài)學觀察結(jié)果(圖1),選定Aβ25~351.5 μmol/L為神經(jīng)細胞毒性模型的造模濃度。
2.2人參總皂苷對Aβ25~35誘導的海馬神經(jīng)細胞影響
2.2.1細胞形態(tài)學檢測正常細胞核呈圓形或橢圓形;凋亡細胞核固縮或裂片。模型Aβ25~35組可見較多的細胞表現(xiàn)為核染色質(zhì)凝集,致密濃染,細胞核染色質(zhì)固縮或碎裂成2塊以上。與模型組比較,人參皂苷保護組可以顯著降低Aβ25~35處理后海馬神經(jīng)元的損傷,細胞形態(tài)有較好的恢復,呈現(xiàn)出與正常細胞類似的形態(tài)學(圖2)。
2.2.2細胞凋亡率檢測如圖3所示:Hoechst33258熒光染色結(jié)果顯示,正常細胞熒光著色淺;凋亡細胞呈強熒光反應(yīng)。模型組可見熒光增強。與正常組細胞凋亡率〔(5.2±0.4)%〕及LDH活性〔(100.2±11.3)%〕相比,模型組細胞凋亡率〔(29.6±1.1)%〕以及LDH活性〔(259.3±19.2)%〕顯著增加;由Aβ25~35所誘導的細胞凋亡以及LDH活性可顯著地被100 mg/L人參總皂苷抑制。與模型組比較,人參總皂苷可以顯著降低Aβ25~35處理后海馬神經(jīng)元的凋亡率〔(13.2±0.6)%〕和LDH活性〔(149.6±9.5)%〕。
2.2.3〔Ca2+〕i檢測圖4所示,與正常組比較〔(100.2±9.8)%〕1.5 μmol/L Aβ25~35使Fluo-3-Ca熒光顯著增強〔(328.7±29.6)%〕,而人參總皂苷處理顯著抑制了這種熒光增強〔(261.3±19.6)%〕。模型組對細胞損害較大,造成〔Ca2+〕i增高,而人參總皂苷能對Aβ25~35誘導神經(jīng)細胞的損害具有較好的保護作用。
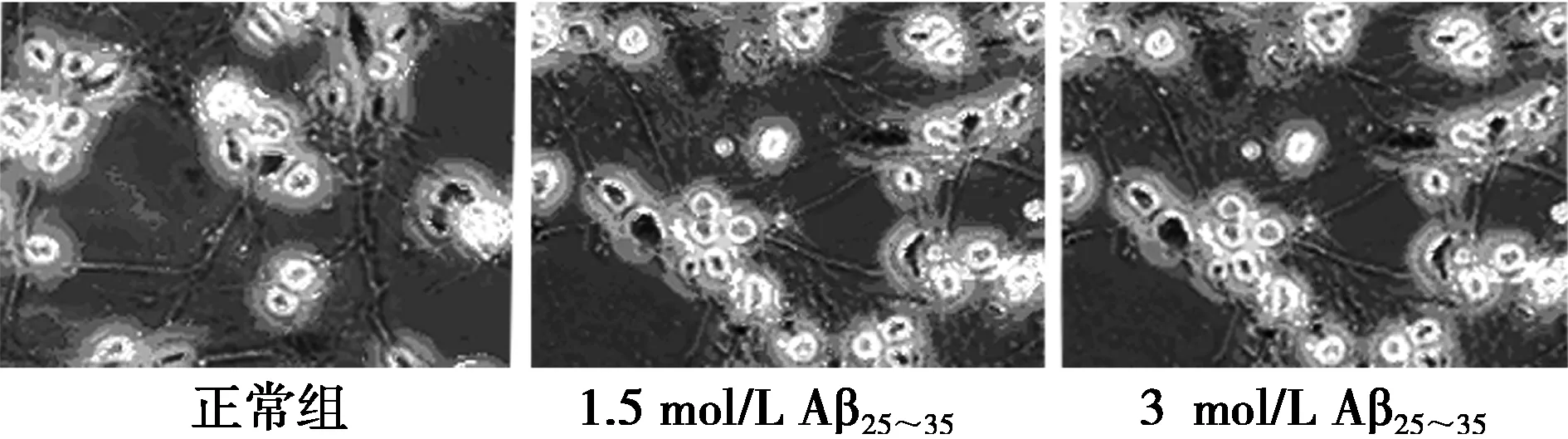
圖1 Aβ25~35對海馬神經(jīng)細胞的損傷作用(Hoechst 33258染色,×64)
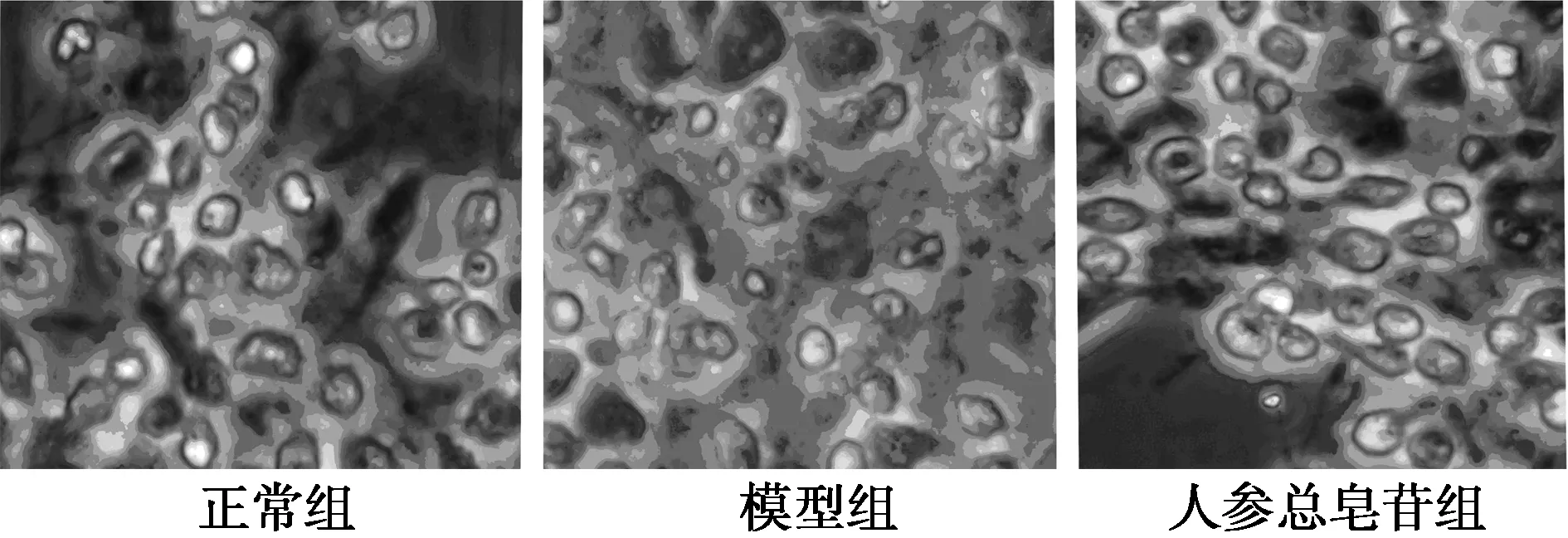
圖2 人參總皂苷緩解Aβ25~35誘導的海馬神經(jīng)細胞損傷(Hoechst33258染色,×64)
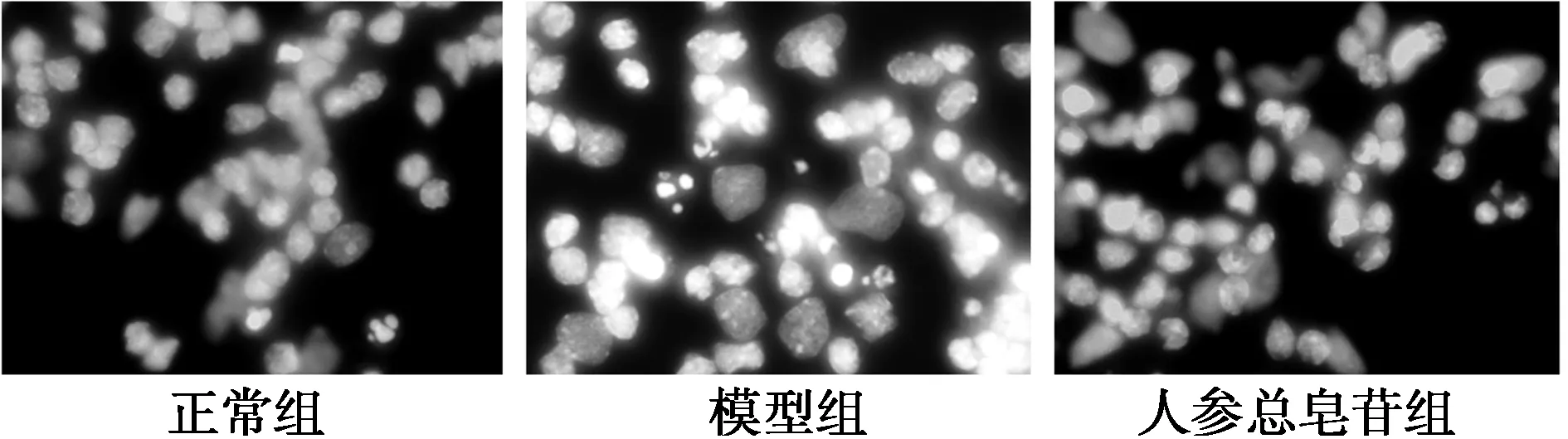
圖3 人參總皂苷對Aβ25~35誘導的海馬神經(jīng)細胞凋亡的影響(Hoechst 33258熒光染色,×64)
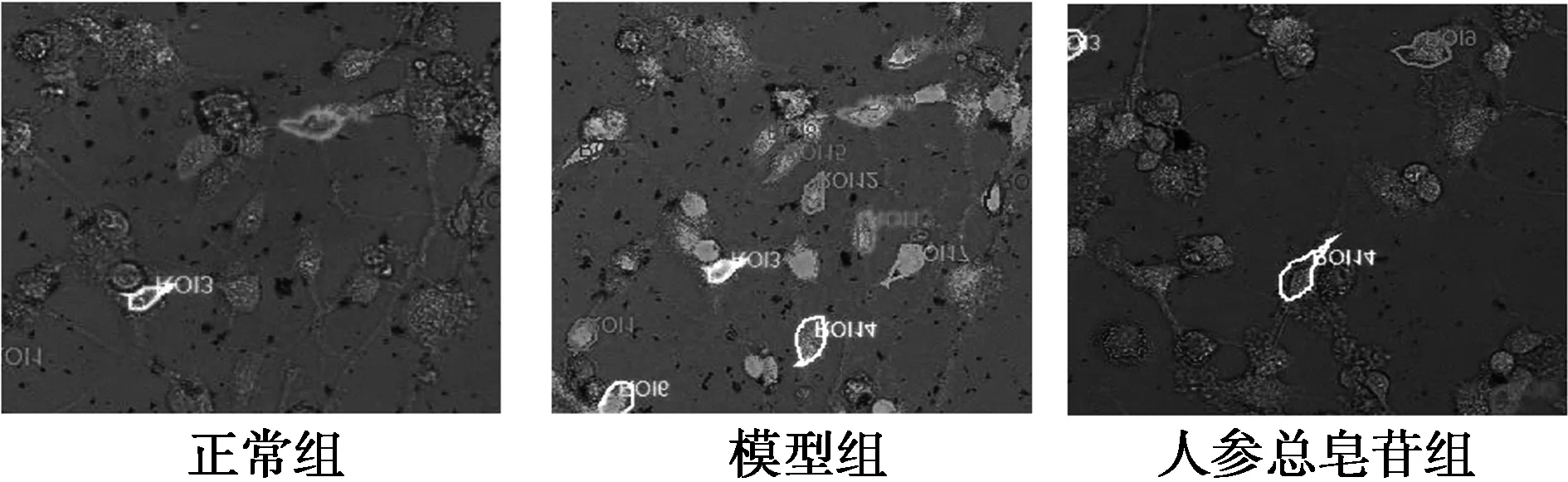
圖4 人參總皂苷對Aβ25~35誘導的海馬神經(jīng)細胞〔Ca2+〕i的影響
3 討 論
人參Panax ginseng C.A.Mey和西洋參P.quinquefolium L.是五加科人參屬植物,具有“除邪氣、補五臟、安精神、定魂魄、止驚悸、開心、益智”等功效〔7,8〕。人參總皂苷是人參、西洋參的主要活性提取組分,具有抗腫瘤、抗氧化、延緩衰老和治療老年性疾病引起的認知功能障礙等作用〔4,9,10〕。
AD發(fā)病早期的關(guān)鍵性環(huán)節(jié)是APP分解代謝和Aβ的異常釋放和沉積〔4〕。Aβ25~35可造成DNA損傷等凋亡特征,因此選擇Aβ25~35造成海馬細胞毒性具有重要意義。染色質(zhì)染色劑Hoechst33258熒光染色證明,1.5 μmol/L 的Aβ25~35使培養(yǎng)的海馬神經(jīng)細胞出現(xiàn)凋亡特征。人參總皂苷能有效地減少由Aβ25~35毒性產(chǎn)生的DNA碎片發(fā)生,降低神經(jīng)細胞的凋亡率,對神經(jīng)細胞具有保護作用。本實驗結(jié)果提示人參總皂苷可通過抑制海馬神經(jīng)細胞的凋亡而降低Aβ25~35對海馬神經(jīng)細胞的毒性作用。〔Ca2+〕i濃度的升高被認為是凋亡的重要信號,研究表明抑制〔Ca2+〕i濃度的升高一定程度上可以防止細胞凋亡〔11,12〕。本研究表明人參總皂苷可平衡神經(jīng)細胞內(nèi)〔Ca2+〕i濃度,降低Aβ25~35誘導的海馬神經(jīng)細胞凋亡。
1宋曉征,李成杰,張子寅,等.維生素E對阿爾茨海默病患者血清中CD8/CD28表達水平的影響〔J〕.中國實用神經(jīng)疾病雜志,2013;16(20):48-9.
2Glenner GG,Wong CW.Alzheimer's disease and Down's syndrome:sharing of a unique cerebrovascular amyloid fibril protein〔J〕.Biochem Biophy Res Commun,1984;122(3):1131-5.
3Miller DL,Papayannopoulos IA,Styles J,etal.Peptide compositions of the cerebrovascular and senile plaque core amyloid deposits of Alzheimer's disease〔J〕.Arch Biochem Biophy,1993;301(1):41-52.
4蘇心,張文治,吳劍娟.β-淀粉樣蛋白對培養(yǎng)胎鼠大腦神經(jīng)干細胞作用的研究〔J〕.中華老年心腦血管病雜志,2005;7(3):192-5.
5Wang JZ,Grundke-Iqbal I,Iqbal K.Glycosylation of microtubule-associated protein tau:an abnormal posttranslational modification in Alzheimer's disease〔J〕.Nature Med,1996;2(8):871-5.
6章立,李新榮,徐蘅,等.用Fluo3-AM測定2型糖尿病患者淋巴細胞內(nèi)Ca2+濃度及藥物對患者胞內(nèi)Ca2+濃度的影響〔J〕.中國藥科大學學報,1999;30(6):451-5.
7譚世強,張愛華,許永華,等.人參總皂苷對粘蟲體內(nèi)蛋白質(zhì)含量及消化酶活性的影響〔J〕.中國中藥雜志,2013;38(11):1692-6.
8魏建華,楊文志,劉強,等.人參餅干中人參總皂苷、人參單體皂苷Rb1及Re+Rg1含量測定及人參餅干中人參皂苷的定性鑒別〔J〕.人參研究,2013;(1):31-3.
9潘愛珍,易偉民,余曉娟,等.人參總皂苷對脾虛模型大鼠的保護作用研究〔J〕.中國藥房,2013;24(39):3682-4.
10呂昕瞳,楊丹莉,鄧江,等.人參總皂苷對血管緊張素Ⅱ所致乳大鼠心肌細胞肥大的抑制作用〔J〕.中國藥理學與毒理學雜志,2013;27(4):641-5.
11Emilsson L,Saetre P,Jazin E.Alzheimer′s disease:mRNA expression profiles of multiple patients show alterations of genes involved with calcium signaling〔J〕.Neurobiol Dis,2006;21(3):618-25.
12Poon HF,Shepherd HM,Reed TT,etal.Proteomics analysis provides insight into caloric restriction mediated oxidation and expression of brain proteins associated with age-related impaired cellular processes:mitochondrial dysfunction,glutamate dysregulation and impaired protein synthesis〔J〕.Neurobiol Aging,2006;27(7):1020-34.
〔2014-12-29修回〕
(編輯趙慧玲/曹夢園)
張國雙(1979-),男,副主任醫(yī)師,主要從事精神醫(yī)學臨床研究。
R743
A
1005-9202(2016)18-4438-02;doi:10.3969/j.issn.1005-9202.2016.18.015
1天津醫(yī)科大學總醫(yī)院2天津市人民醫(yī)院

