組氨酸三聚體核苷結合蛋白1在黑素瘤組織中的表達及其基因啟動子甲基化水平研究
溫斯健 倪娜娜 張韡 宋昊 王小坡 邵雪寶 李阿梅 程偉 孫建方
210042南京,中國醫學科學院 北京協和醫學院 皮膚病研究所病理科(溫斯健、張韡、宋昊、王小坡、邵雪寶、李阿梅、程偉、孫建方),中心實驗室(倪娜娜)
組氨酸三聚體核苷結合蛋白1在黑素瘤組織中的表達及其基因啟動子甲基化水平研究
溫斯健 倪娜娜 張韡 宋昊 王小坡 邵雪寶 李阿梅 程偉 孫建方
210042南京,中國醫學科學院 北京協和醫學院 皮膚病研究所病理科(溫斯健、張韡、宋昊、王小坡、邵雪寶、李阿梅、程偉、孫建方),中心實驗室(倪娜娜)
目的檢測組氨酸三聚體核苷結合蛋白1(HINT1)在黑素瘤中的表達和HINT1基因啟動子甲基化狀態,探討HINT1啟動子甲基化與臨床病理參數的關系。方法采用甲基化特異性PCR(MSP)法檢測56例黑素瘤及瘤旁組織和51例色素痣組織中HINT1基因啟動子區甲基化水平,免疫組化法檢測56例黑素瘤和51例色素痣組織中HINT1蛋白的表達。結果MSP顯示,黑素瘤組織、瘤旁組織及色素痣組織中HINT1基因啟動子區甲基化率分別為76.8%(43/56)、33.9%(19/56)和35.3%(18/51),黑素瘤組HINT1基因啟動子區甲基化率明顯高于瘤旁組織組和色素痣組,且差異有統計學意義(χ2=20.810、18.749,均P<0.05),瘤旁組織組與色素痣組間差異無統計學意義(χ2=0.022,P>0.05)。免疫組化顯示,56例黑素瘤和51例色素痣組織中分別有12例(21.4%)和42例(82.4%)HINT1蛋白陽性表達,兩組陽性率差異有統計學意義(χ2=39.633,P<0.01)。12例HINT1蛋白陽性的黑素瘤組織中,有6例HINT1基因啟動子甲基化,而在44例HINT1蛋白陰性的癌組織中HINT1啟動子甲基化率高達84.1%(37/44),兩組差異有統計學意義(χ2=6.147,P=0.013)。56例黑素瘤中,HINT1基因啟動子區甲基化率在Clark分級Ⅰ~Ⅱ級組(59.1%,13/22)與Ⅲ ~Ⅴ級組(88.2%,30/34)間差異有統計學意義(χ2=6.365,P=0.012)。結論HINT1在黑素瘤組織中低表達,其機制可能與啟動子區發生高甲基化有關;HINT1啟動子區高甲基化可能參與黑素瘤的發生及發展。
黑色素瘤;甲基化;痣,色素;HINT1基因
組氨酸三聚體核苷結合蛋白1(histidine triad nucleotide?binding protein 1,HINT1)又稱蛋白激酶C相 互 作 用 蛋 白 1(Protein kinase C?interacting protein1,PKCI?1),屬于組氨酸三聚體蛋白超家族,是一種新近發現的抑癌基因,目前多認為HINT1失活的主要機制是啟動子甲基化等[1]。鑒于HINT1蛋白在組織中的表達及其啟動子甲基化狀態與黑素瘤臨床、病理參數的關系尚不清楚,本文應用甲基化特異性PCR(methylation?specific PCR,MSP)法檢測56例黑素瘤和瘤旁組織及51例色素痣組織中HINT1基因啟動子區甲基化水平,應用免疫組化法檢測HINT1蛋白水平,分析其與臨床病理參數的關系,探討HINT1啟動子甲基化在黑素瘤中的作用。
材料與方法
1.標本來源:所有標本均來自于中國醫學科學院北京協和醫學院皮膚病研究所病理科2013—2014年存檔的組織蠟塊或4%甲醛浸泡新鮮組織,其中黑素瘤56例,色素痣51例,均經常規HE染色和(或)免疫組化標記后組織病理確診。
2.主要試劑:兔抗人HINT1抗體(英國abcam公司),DAB酶底物顯色試劑盒和即用型快捷免疫組化試劑盒(福州邁新生物技術開發有限公司),TIANquick FFPE DNA Kit石蠟包埋組織DNA快速提取試劑盒(離心柱型)[天根生化科技(北京)有限公司],高保真熱啟動酶(日本TaKaRa公司),EZ DNA甲基化試劑盒?Gold、人HCT116 DKO甲基化DNA、人 HCT116 DKO非甲基化 DNA(美國ZymoResearch公司)。
3.標本處理:所有4%甲醛固定液中的黑素瘤、瘤旁組織和色素痣標本各取30 mg,用手術刀切為數塊,置于1.5 ml離心管中,按照TIANquick FFPE DNA Kit石蠟包埋組織DNA快速提取試劑盒說明書操作,提取基因組DNA,紫外分光光度儀檢測其含量和純度,A260/A280均為1.8~2.0,-20℃保存備用。相應的黑素瘤和色素痣組織蠟塊以4 μm厚切片,敷貼于10%多聚賴氨酸預先處理的載玻片上,用于免疫組化實驗。
4.免疫組化法:石蠟切片脫蠟至水,檸檬酸高壓修復6 min,室溫自然冷卻,置于10%過氧化氫溶液中,37℃水浴24 h脫色素。然后按試劑盒說明依次加入一抗HINT1單克隆抗體(工作濃度為1∶250)、二抗孵育反應,DAB顯色,蘇木素復染。觀察指標和結果判定:以細胞核和(或)細胞質出現棕黃色顆粒為陽性。已知人結腸組織陽性片作陽性對照,磷酸鹽緩沖液(PBS)代替一抗作陰性對照。
5.甲基化修飾和MSP擴增:取400 ng提取的DNA入EP管并用無核酶水補至20 μl,加CT轉換試劑 130 μl,然后參照 EZ DNA Methylation 試劑盒說明進行亞硫酸氫鹽修飾甲基化處理,修飾后的DNA于-20℃保存,1個月內進行檢測。在http://genome.ucse.edu網站上查找基因啟動子區序列,用CpG Island searcher查找CpG島,用Methyl Primer Express軟件設計引物。甲基化引物:MF:5′?GTTGGTCGTATTCGTAGTTTAGGTC ?3′,MR:5?AATAATCTTCCCAAAAATCGTATCG?3′;未甲基化引物:UF:5′?GTTGGTTGTATTTGTAGTTTAGGTTGT?3′,UR:5′?AATAATCTTCCCAAAAATCATATCACC?3′,目的片段大小均為240 bp,由生工生物工程(上海)股份有限公司設計合成。對照組設置:用已知發生完全甲基化的DNA(Human HCT116 DKO methylated DNA)為陽性對照,已知完全非甲基化DNA(Human HCT116 DKO Non?methylated DNA)為陰性對照。PCR反應體系:上、下游引物各1 μl,甲基化修飾后的 DNA 4 μl,DNA 熱啟動酶 0.25 μl,10 × Buffer 2.5 μl,MgCl21.5 μl,dNTP 2 μl,用無核酶水補至25 μl。擴增條件:94℃預變性1 min;94℃變性15 s,57℃退火20 s,72℃延伸20 s,共37個循環;72℃后延伸1 min。PCR產物經2%瓊脂糖凝膠電泳,用凝膠成像分析系統觀察、記錄。僅有甲基化引物擴增出相應片段即為完全甲基化,僅非甲基化引物擴增出相應片段為甲基化陰性,甲基化與非甲基化引物均擴增出相應片段為不完全甲基化,完全甲基化和不完全甲基化均計為甲基化檢測陽性。
6.統計學分析:用SPSS 16.0軟件進行統計學處理,計數資料組間比較采用χ2檢驗,P<0.05為差異有統計學意義。
結 果
1.HINT1基因啟動子區甲基化:56例黑素瘤組織中HINT1啟動子區甲基化陽性率為76.8%(43/56),其中20例發生完全甲基化,23例發生不完全甲基化,見圖1。56例瘤旁組織中甲基化率為33.9%(19/56),其中8例發生完全甲基化,11例發生不完全甲基化。51例色素痣組織中甲基化率為35.3%(18/51),其中6例發生完全甲基化,12例發生不完全甲基化。黑素瘤組HINT1基因啟動子區甲基化率明顯高于瘤旁組織組和色素痣組,差異有統計學意義(χ2=20.810、18.749,均P< 0.05),而瘤旁組織組與色素痣組間差異無統計學意義(χ2=0.022,P> 0.05)。
2.免疫組化HINT1蛋白的表達:56例黑素瘤組織中HINT1陽性12例(21.4%)。12例原位黑素瘤組織中5例HINT1陽性,41例侵襲性黑素瘤組織中7例HINT1陽性,3例轉移性黑素瘤組織未見HINT1陽性。51例色素痣中HINT1陽性42例(82.4%)。HINT1在黑素瘤組織中的表達陽性率顯著低于色素痣組,差異有統計學意義(χ2=39.633,P< 0.01)。見圖2。
3.HINT1基因啟動子甲基化與其蛋白表達的關系:56例黑素瘤組織中,12例HINT1蛋白陽性組有6例HINT1基因啟動子甲基化,而44例HINT1蛋白陰性組HINT1啟動子甲基化率高達84.1%(37/44),兩組甲基化率差異有統計學意義(χ2=6.147,P=0.013)。
4.HINT1啟動子甲基化與臨床及病理參數的關系:56例黑素瘤中,Clark分級Ⅰ~Ⅱ級組與Clark分級Ⅲ~Ⅴ級組間HINT1基因啟動子區甲基化狀態差異有統計學意義(χ2=6.365,P=0.012)。不同性別、有無潰瘍、有無炎癥細胞浸潤組間HINT1基因甲基化狀態差異均無統計學意義(P>0.05)。見表1。
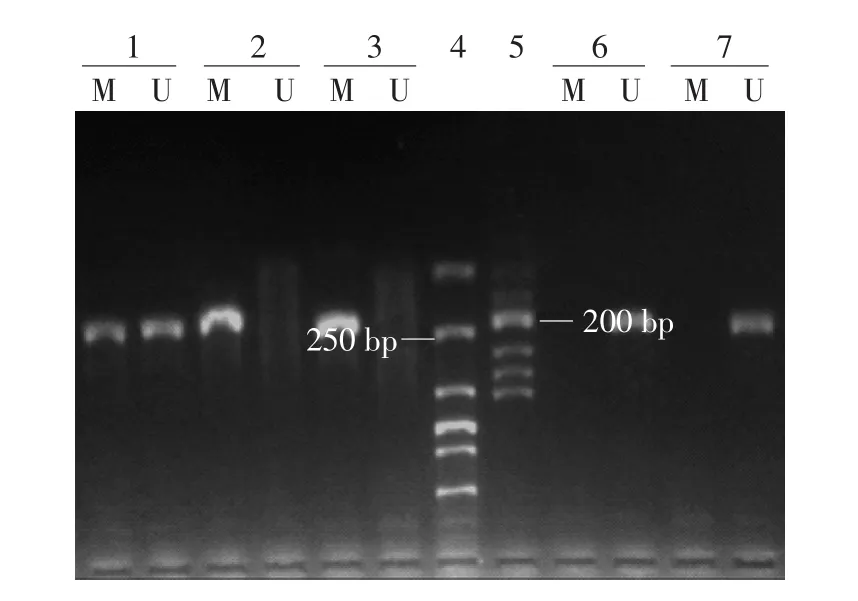
圖1 黑素瘤HINT1啟動子區甲基化特異性PCR產物2%瓊脂糖凝膠電泳 M:甲基化引物;U:非甲基化引物;1:標本1(不完全甲基化);2:標本2(完全甲基化);3:陽性對照組;4:DNA Marker1;5:DNA Marker2;6:標本3(非甲基化);7:陰性對照組
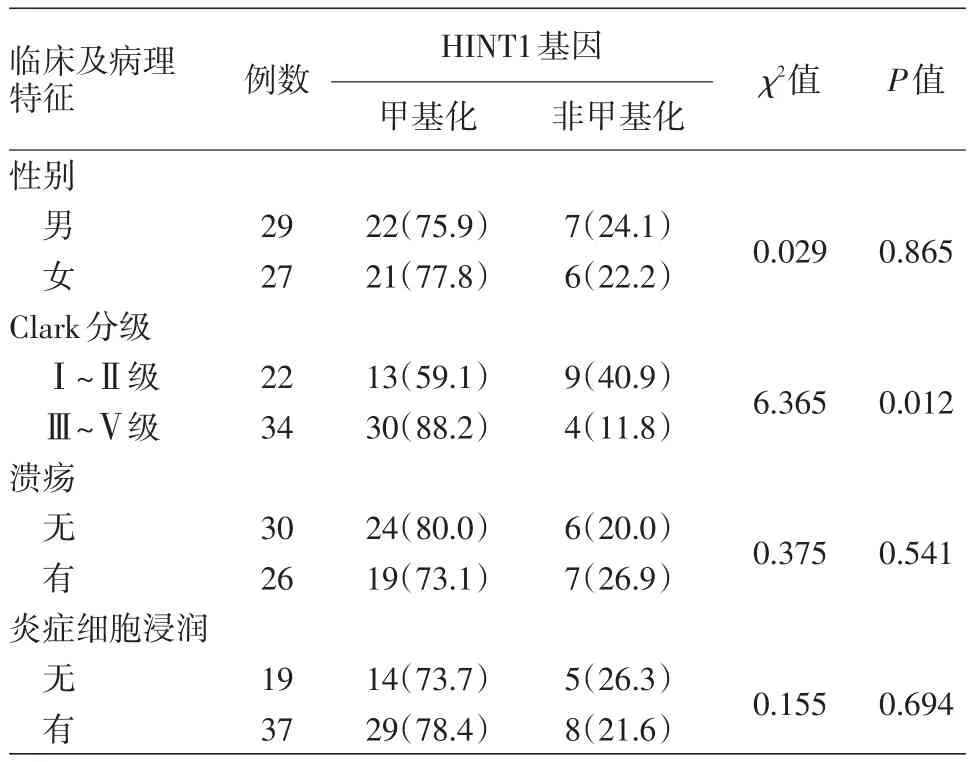
表1 黑素瘤HINT1基因甲基化狀態與臨床及病理參數的關系[例(%)]
討 論
表觀遺傳是一種不涉及核苷酸序列變化、可遺傳的基因表達調控方式,是較遺傳學更為常見的基因表達調控機制,主要包括DNA甲基化、組蛋白修飾、染色體重構和非編碼RNA等[2]。其中啟動子區CpG島異常高甲基化是多種抑癌基因失活的重要機制。黑素瘤中啟動子過甲基化多引起細胞黏附、促細胞凋亡、抗細胞增殖和DNA錯配修復相關基因的表 達 減 少[3],如 MGMT[4]、RUNX3[5]、ATG5[6]、RASSF1A[7]等。提示啟動子區CpG島異常高甲基化是黑素瘤發病的一個重要分子機制。
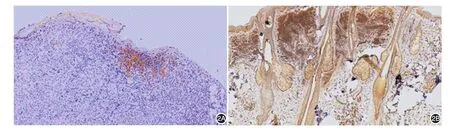
圖2 HINT1在黑素瘤和色素痣中的表達 2A:在黑素瘤組織中HINT1僅在真皮淺層腫瘤細胞散在灶狀弱陽性表達(免疫組化×200);2B:在皮內痣中HINT1呈團塊狀強陽性表達(免疫組化×100)
HINT1蛋白共126個氨基酸,表達于細胞質與細胞核,迄今為止的研究均提示它是一個腫瘤抑制基因。2004年,林彤和孫建方[8]通過cDNA芯片技術發現,HINT1基因表達在黑素瘤患者組織中明顯下調。隨后,陳柳青等[9]擴大組織樣本量并經半定量RT?PCR及原位雜交技術進一步證實,HINT1在黑素瘤中的表達顯著下調,初步提示該基因可能與人黑素瘤的發生有關。HINT1對腫瘤的生物學行為影響機制尚不十分明確,多數研究認為,HINT1通過抑制基因轉錄調控通路而發揮腫瘤抑制作用,與CDK7、USF、Pontin/Reptin/β連環素/TCF4復合物、AP1相互作用并抑制其活性,從而發揮抑制腫瘤細胞生長、促進腫瘤細胞凋亡、影響信號轉導作用[10]。
免疫組化分析顯示,HINT1在51例色素痣中陽性率(82.4%)顯著高于56例黑素瘤中陽性率(21.4%)。HINT1 mRNA和蛋白表達水平在黑素瘤中均下降,表達趨勢一致[9],提示HINT1表達異常可能與翻譯水平之前調控異常有關。進一步采用MSP分析發現,76.8%黑素瘤組織檢測到HINT1基因啟動子區的異常甲基化,高于相應的瘤旁組織和正常的色素痣組織。而HINT1蛋白陰性的黑素瘤中啟動子甲基化率(84.1%)高于HINT1蛋白陽性的黑素瘤組織(50%),HINT1基因甲基化與其蛋白表達可能呈負相關。此結果與Zhang等[1]在原發性肝癌中和Huang等[11]在胃癌細胞株及人胃癌組織中對HINT1的研究結果相似。推測DNA甲基化是一可逆過程,是腫瘤發生過程中的早期事件,可能是因為該基因啟動子區高甲基化,導致該基因轉錄受阻,進一步影響到蛋白的表達,是黑素瘤中HINT1蛋白失活的重要機制。
本研究還發現,HINT1的甲基化與黑素瘤患者的病理Clark分級密切相關。Clark分級Ⅲ~Ⅴ級的黑素瘤組織中HINT1基因啟動子區甲基化率(88.2%)顯著高于Clark分級Ⅰ~Ⅱ級的黑素瘤組織(59.1%)。Clark分級是黑素瘤預后因素中的重要部分,該結果提示,HINT1基因啟動子甲基化可能與黑素瘤進展有關,或可作為黑素瘤預后評估的指標之一。此外,不同性別、有無潰瘍、有無炎細胞浸潤與HINT1基因甲基化無關。黑素瘤組織HINT1的陽性率21.4%,表達顯著下調,陽性病例少,因此未對陽性病例按腫瘤細胞陽性率及染色強度行半定量分析以及相關臨床病理分析,下一步可考慮擴大樣本后再深入分析。
總之,HINT1在黑素瘤組織中低表達,與其啟動子區發生高甲基化有關,HINT1啟動子區高甲基化可能參與黑素瘤的發生發展。
[1] Zhang YJ,Li H,Wu HC,et al.Silencing of Hint1,a novel tumor suppressor gene,by promoter hypermethylation in hepatocellular carcinoma[J].Cancer Lett,2009,275(2):277 ?284.DOI:10.1016/j.canlet.2008.10.042.
[2]Kubota T,Miyake K,Hirasawa T,et al.Novel etiological and therapeutic strategies for neurodiseases:epigenetic understanding of gene?environment interactions[J].J PharmacolSci,2010,113(1):3?8.
[3]Greenberg ES,Chong KK,Huynh KT,et al.Epigenetic biomarkers in skin cancer[J].Cancer Lett,2014,342(2):170 ?177.DOI:10.1016/j.canlet.2012.01.020.
[4]Hassel JC,Sucker A,Edler L,et al.MGMT gene promoter methylation correlates with tolerance of temozolomide treatment in melanoma but not with clinical outcome[J].Br J Cancer,2010,103(6):820?826.DOI:10.1038/sj.bjc.6605796.
[5]Kitago M,Martinez SR,Nakamura T,et al.Regulation of RUNX3 tumor suppressor gene expression in cutaneous melanoma[J].Clin Cancer Res,2009,15(9):2988?2994.DOI:10.1158/1078?0432.CCR?08?3172.
[6]Liu H,He Z,von Rütte T,et al.Down?regulation of autophagy?related protein 5(ATG5)contributes to the pathogenesis of early?stage cutaneous melanoma[J].SciTransl Med,2013,5(202):202ra123.DOI:10.1126/scitranslmed.3005864.
[7]Yi M,Yang J,Chen X,et al.RASSF1A suppresses melanoma development by modulating apoptosis and cell?cycle progression[J].J Cell Physiol,2011,226(9):2360?2369.DOI:10.1002/jcp.22568.
[8]林彤,孫建方.運用cDNA芯片技術對惡性黑素瘤相關基因的研究[J].中華皮膚科雜志,2004,37(2):65?67.DOI:10.3760/j.issn.0412?4030.2004.02.001.Lin T,Sun JF.Study on melanoma gene expression profile by cdnamicroarray[J].Chin J Dermatol,2004,37(2):65?67.DOI:10.3760/j.issn.0412?4030.2004.02.001.
[9]陳柳青,林彤,曾學思,等.組氨酸三聚體核苷結合蛋白1 mRNA在良惡性黑素細胞腫瘤中的表達[J].中華皮膚科雜志,2006,39(3):134?136.DOI:10.3760/j.issn.0412?4030.2006.03.005.Chen LQ,Lin T,Zeng XS,et al.Expression of HINT/PKCI?1 mRNA in patients with malignant melanoma and nevus[J].Chin J Dermatol,2006,39(3):134?136.DOI:10.3760/j.issn.0412?4030.2006.03.005.
[10]黨永輝,劉仲偉,陳峰,等.三聯組氨酸核苷酸結合蛋白1與人類疾病[J].中國醫學科學院學報,2014,36(4):454?460.DOI:10.3881/j.issn.1000?503X.2014.04.019.Dang YH,Liu ZW,Chen F,et al.Histidine triad nucleotide?binding protein 1 and human diseases[J].ActaAcad Med Sin,2014,36(4):454?460.DOI:10.3881/j.issn.1000?503X.2014.04.019.
[11]Huang H,Wei X,Su X,et al.Clinical significance of expression of Hint1 and potential epigenetic mechanism in gastric cancer[J].Int J Oncol,2011,38(6):1557?1564.DOI:10.3892/ijo.2011.994.
HINT1 protein expression and gene promoter methylation in melanoma tissue
Wen Sijian,Ni Nana,Zhang Wei,Song Hao,Wang Xiaopo,Shao Xuebao,Li Amei,Cheng Wei,Sun Jianfang
Department of Pathology,Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China(Wen SJ,Zhang W,Song H,Wang XP,Shao XB,Li AM,Cheng W,Sun JF);Central Laboratory,Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China(Ni NN)
ObjectiveTo measure histidine triad nucleotide?binding protein 1(HINT1)protein expression and gene promoter methylation,and to analyze the relationship between HINT1 gene promoter methylation and clinical pathological features of melanoma.MethodsFifty?six patients with melanoma and 51 patients with nevus were enrolled as subjects and controls,respectively.Methylation?specific PCR(MSP)was performed to measure the methylation of HINT1 gene promoter in lesional and paratumoral tissue specimens from the patients with melanoma,as well as in lesional specimens from the patients with nevus.Immunohistochemistry was carried out to quantify the expression of HINT1 protein in these tissue specimens.ResultsMSP showed that the methylation rate of HINT1 gene promoter was significantly higher in melanoma tissues than in paratumoral and nevus tissues(76.8%[43/56]vs.33.9%[19/56]and 35.3%[18/51],χ2=20.810 and 18.749,respectively,bothP< 0.05),but was insignificantly different between paratumoral and nevus tissues(χ2=0.022,P> 0.05).Immunohistochemistry revealed that the expression rate of HINT1 was 21.4%(12/56)in melanoma tissues,compared to 82.4%(42/51)in nevus tissues(χ2=39.633,P<0.01).There was a significant difference in the methylation rate of HINT1 promoter between HINT1?positive and ?negative melanoma tissues(6/12vs.37/44[84.1%],P< 0.05),and between Clark levelⅠ-Ⅱ andⅢ-Ⅴ melanoma tissues(59.1%[13/22]vs.88.2%[30/34],χ2=6.365,P=0.012).Conclusions HINT1 protein is lowly expressed in melanoma,which may be associated with high methylation of its gene promoter.Moreover,the high methylation of HINT1 gene promoter may be involved in the initiation and progression of melanoma.
Melanoma;Methylation;Nevus,pigmented;Gene,HINT1
s:Sun Jianfang,Email:fangmin5758@aliyun.com;Zhang Wei,Email:ifmtjoel@163.com
孫建方,Email:fangmin5758@aliyun.com;張韡,Email:ifmtjoel@163.com
10.3760/cma.j.issn.0412?4030.2016.07.007
國家自然科學基金(81272992);2012年高等學校博士學科點專項科研基金(20121106110040);江蘇省自然科學基金(BK20131063);江蘇省臨床醫學科技專項(BL2012003)
Fund programs:National Natural Science Foundation of China(81272992);Research Fund for the Doctoral Program of Higher Education of China(20121106110040);Natural Science Foundation of Jiangsu Province of China(BK20131063);Jiangsu Provincial Special Program of Medical Science(BL2012003)
2015?11?09)
(本文編輯:周良佳 顏艷)

