芳姜黃酮衍生物對A375人黑素瘤細胞增殖及凋亡作用的機制研究
涂云華 康穎倩 李明娥 周英 薛月萃 葉振源 榮冬蕓 昝雪娟 潘軍玲 陸洪光 曹煜
550004貴陽,貴州醫科大學附屬醫院皮膚性病科(涂云華、李明娥、薛月萃、葉振源、榮冬蕓、昝雪娟、潘軍玲、陸洪光、曹煜);貴州醫科大學微生物學教研室(康穎倩);貴州大學生命科學學院貴州省中藥(民族藥)創制工程中心(周英)
芳姜黃酮衍生物對A375人黑素瘤細胞增殖及凋亡作用的機制研究
涂云華 康穎倩 李明娥 周英 薛月萃 葉振源 榮冬蕓 昝雪娟 潘軍玲 陸洪光 曹煜
550004貴陽,貴州醫科大學附屬醫院皮膚性病科(涂云華、李明娥、薛月萃、葉振源、榮冬蕓、昝雪娟、潘軍玲、陸洪光、曹煜);貴州醫科大學微生物學教研室(康穎倩);貴州大學生命科學學院貴州省中藥(民族藥)創制工程中心(周英)
目的研究一種芳姜黃酮衍生物(ATD)對人皮膚黑色素瘤A375細胞增殖及凋亡的影響。方法不同濃度(5、10、20、40、80 μmol/L)ATD、長春新堿及芳姜黃酮體外作用A375及人皮膚成纖維細胞(HSF)48 h。CCK?8法檢測細胞增殖抑制率;吖啶橙/溴化乙錠(AO/EB)染色,倒置顯微鏡觀察細胞凋亡形態;DNA片段化檢測細胞凋亡;比色法檢測半胱氨酸天冬氨酸蛋白酶3(caspase?3)活性;流式細胞儀檢測細胞凋亡及周期。結果ATD、長春新堿及芳姜黃酮對A375細胞有抑制增殖作用,且呈劑量依賴性(ATD:R2=0.99,F=340.96;長春新堿:R2=0.99,F=349.19;芳姜黃酮:R2=0.89,F=25.41,均P< 0.05),三者IC50分別為(15.96± 0.02)、(77.00±0.04)及(356.95±0.01)μmol/L。當藥物濃度為5 μmol/L及10 μmol/L時,ATD對HSF增殖抑制率分別為(8±0.06)%和(25±0.02)%,長春新堿為(33±0.04)%和(29±0.08)%,芳姜黃酮為(49±0.09)%和(34±0.07)%;ATD對A375細胞抑制率分別為(26±0.06)%和(39±0.02)%,長春新堿為(8±0.04)%和(17±0.08)%,芳姜黃酮為(6±0.09)%和(10±0.07)%,與二甲基亞砜相比,差異均有統計學意義(P<0.05),且ATD對A375細胞增殖抑制活性強于長春新堿及芳姜黃酮(P<0.05),但對HSF細胞毒性卻明顯低于長春新堿及芳姜黃酮(P<0.05)。ATD、長春新堿及芳姜黃酮均可誘導A375細胞凋亡,caspase?3活性隨3種藥物濃度增加而增強,且藥效為ATD>長春新堿>芳姜黃酮。流式細胞儀檢測證實,3種藥物都能誘導細胞發生不同程度凋亡,同芳姜黃酮及長春新堿相比,ATD能顯著誘導細胞凋亡,且以晚期凋亡為主。隨藥物濃度增加,ATD組G1期A375細胞逐漸增多,G2期及S期細胞數明顯減少。結論ATD對A375細胞有抑制增殖及促凋亡作用,該作用明顯強于芳姜黃酮及長春新堿,其機制可能是激活caspase?3,使細胞周期阻滯在G1期,進而抑制腫瘤細胞分化與增殖。
黑色素瘤,實驗性;細胞系,腫瘤;姜黃酮;長春新堿;細胞增殖;細胞凋亡;芳姜黃酮衍生物
芳姜黃酮是中藥姜黃的主要成分之一[1],具有抗腫瘤、抗血小板、抗細菌、抗真菌、抗氧化、抗老年癡呆及抗代謝綜合征等藥理作用[2-3]。近年來,芳姜黃酮在抗腫瘤方面已被廣泛研究,但其溶解性較低,且對正常細胞有影響[4]。為尋求抗腫瘤活性更高的藥物,我們運用芳姜黃酮衍生物作用A375及人皮膚成纖維細胞(HSF),觀察其對細胞增殖及凋亡的影響,探討其作用機制。
材料與方法
一、材料與試劑
芳姜黃酮衍生物,由潘博文等合成[5],化學名1?(4?氟苯基)?1?(1H?吲哚?3?烷基)?5?甲基?4?己烯?3?酮,由貴州大學生命科學院中藥創制工程中心提供,含藥溶液的總體積與二甲基亞砜(DMSO)的體積以10∶0.1的比例混合,用完全培養基稀釋成10 mol/L作為母液,濾過除菌,4℃冰箱保存備用,芳姜黃酮(美國Cayman Chemical公司),長春新堿(浙江海正藥業股份有限公司),A375細胞(廣州吉妮歐生物科技有限公司),HSF細胞(CCC?HSF?1細胞,上海信則生物科技有限公司),Gibco胎牛血清(美國Life Technologies公司),DMEM、青霉素、鏈霉素及磁珠法基因組DNA抽提試劑盒[上海生工生物工程(上海)股份有限公司],CCK?8試劑盒(日本同仁化學公司),細胞周期試劑盒(江蘇碧云天生物技術研究所),AnnexinⅤ?FITC細胞凋亡檢測試劑盒及吖啶橙/溴化乙錠(AO/EB)凋亡染色試劑盒(上海貝博生物公司),半胱氨酸天冬氨酸蛋白酶3(caspase?3)活性檢測試劑盒(南京建成生物工程研究所),ELX800酶聯免疫檢測儀(美國寶特公司),E?Gel?Imager(美國 Life Technologies公司),BD FACS Verse流式細胞儀(美國BD Biosciences公司)。
二、方法
1.細胞培養:A375貼壁細胞及CCC?HSF?1用完全培養基(含DMEM、10%胎牛血清及1%青霉素和1%鏈霉素)置37℃、5%CO2培養箱中培養,0.25%胰酶消化傳代,每2~3 d傳代1次,取對數生長期細胞進行實驗。
2.細胞增殖抑制率測定:CCK?8法檢測增殖抑制率[6]。芳姜黃酮的36個衍生物,經過CCK?8增殖抑制作用初篩,選擇一種抗腫瘤活性較強的芳姜黃酮衍生物。取對數生長期A375及HSF細胞,調整密度為1.2 × 105個/ml,按50 μl/孔接種于96孔板,培養12 h,實驗組加入不同體積ATD、芳姜黃酮及長春新堿母液,用完全培養基補足至總體積為100 μl/孔,使其終濃度分別為 5、10、20、40、80 μmol/L;設細胞對照組[不加藥物,僅加入DMSO(體積分數10∶1 000)和培養液,其他處理同實驗組]、空白組(不加DMSO、藥物及細胞,余處理同前),每一濃度設6孔,培養48 h。培養結束前1.5 h,每孔加入10 μl CCK?8溶液孵育,酶標儀測定波長450 nm處吸光度(A)值。細胞增殖抑制率=(細胞對照A450?實驗孔A450)/(細胞對照A450-空白孔A450)×100%。
3.細胞形態學觀察:調整A375細胞密度為1.5×104個/ml,接種到 6孔板,培養 12 h,實驗組加入ATD、芳姜黃酮及長春新堿,使終濃度分別為5、10、20、40、80 μmol/L,設不加藥物細胞對照組,培養48 h,AO/EB染色,倒置顯微鏡觀察細胞形態。
4.DNA片段化檢測:調整A375細胞密度為1.4×105個/ml,按1 ml/孔接種于6孔板,培養12 h,實驗組加入不同體積ATD、芳姜黃酮及長春新堿母液,補充完全培養基至總體積為2 ml/孔,使其終濃度為5、10、20、40、80 μmol/L,設不加藥物細胞對照組,繼續培養48 h,離心收集細胞。提取全基因組DNA,參考Hassan等[7]的方法,行瓊脂糖凝膠電泳,凝膠成像儀下觀察并拍照。
5.Caspase?3活性檢測:A375細胞培養方法同“DNA片段化檢測”,按照caspase?3活性檢測試劑盒步驟操作,酶標儀檢測波長405 nm處吸光度(A值)。Caspase?3活化程度=實驗組A405/細胞對照組A405。
6.細胞凋亡檢測:A375細胞培養方法同“DNA片段化檢測”,用不含乙二胺四乙酸(EDTA)的胰酶消化,參考Jiang等[8]實驗方法,按Annexin V?FITC凋亡檢測試劑盒染色,然后上機檢測。
7.細胞周期檢測:取對數生長期A375細胞,參照Wu等[9]的實驗方法,調整細胞密度為1.5 × 105個/ml,按1 ml/孔接種于6孔板,培養12 h,實驗組加入不同體積ATD母液,使其終濃度分別為5、10、20、40、80 μmol/L,設不加藥物細胞對照組,繼續培養48 h,用不含EDTA的胰酶消化,1 000×g離心5 min,收集細胞,乙醇固定細胞1 h,按照周期試劑盒操作步驟加入PI染色液后上機檢測。
三、統計學處理
采用SPSS13.0,結果以x±s表示,同一時間段不同濃度組間采用單因素方差分析,兩兩比較用LSD檢驗;藥效-劑量關系運用曲線估計,用R2及F值來表示。P<0.05為差異有統計學意義。
結 果
一、ATD、長春新堿及芳姜黃酮對A375細胞增殖的影響
見圖1。3種藥物對A375細胞有抑制增殖作用,且呈劑量依賴性(ATD:R2=0.99,F=340.96,P<0.05;長春新堿:R2=0.99,F=349.19,P<0.05;芳姜黃酮:R2=0.89,F=25.41,P<0.05),各濃度下3種藥物組細胞的增殖抑制程度與細胞對照組相比差異均有統計學意義(均P<0.05)。ATD、長春新堿及芳姜黃酮IC50分別為(15.96±0.02)、(77.00± 0.04)及(356.95 ± 0.01)μmol/L。當藥物濃度為5、10 μmol/L時,ATD對A375細胞增殖抑制率分別為(26±0.06)%及(39±0.02)%,長春新堿為(8±0.04)%及(17±0.08)%,芳姜黃酮為(6±0.09)%及(10±0.07)%;ATD對A375細胞增殖抑制率與芳姜黃酮及長春新堿相比,差異均有統計學意義(P<0.05)。
二、ATD、長春新堿及芳姜黃酮對HSF增殖的影響
見圖2。當藥物濃度為5、10 μmol/L時,ATD對HSF增殖抑制率分別為(8±0.06)%及(25±0.02)%,長春新堿為(33±0.04)%及(29±0.08)%,芳姜黃酮為(49±0.09)%及(34±0.07)%;與細胞對照組相比,3種藥物對細胞增殖的抑制作用差異均有統計學意義(P<0.05)。當藥物濃度增高至20、40、80 μmol/L時,ATD對HSF的抑制作用明顯強于長春新堿及芳姜黃酮(均P<0.05)。
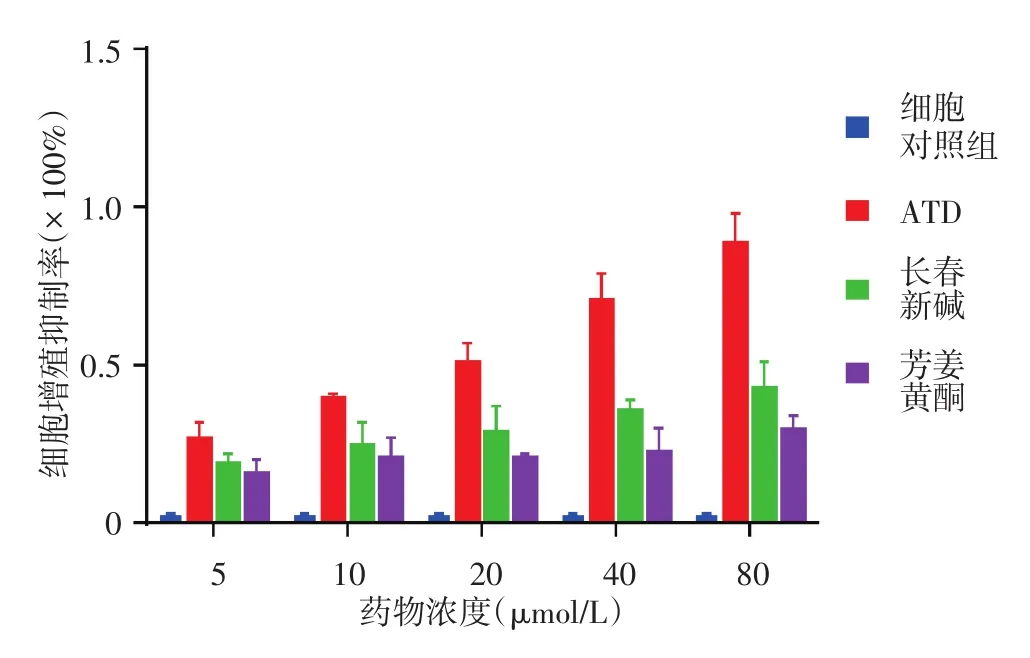
圖1 芳姜黃酮衍生物(ATD)、長春新堿及芳姜黃酮作用48 h對A375細胞增殖的抑制率(n=6)
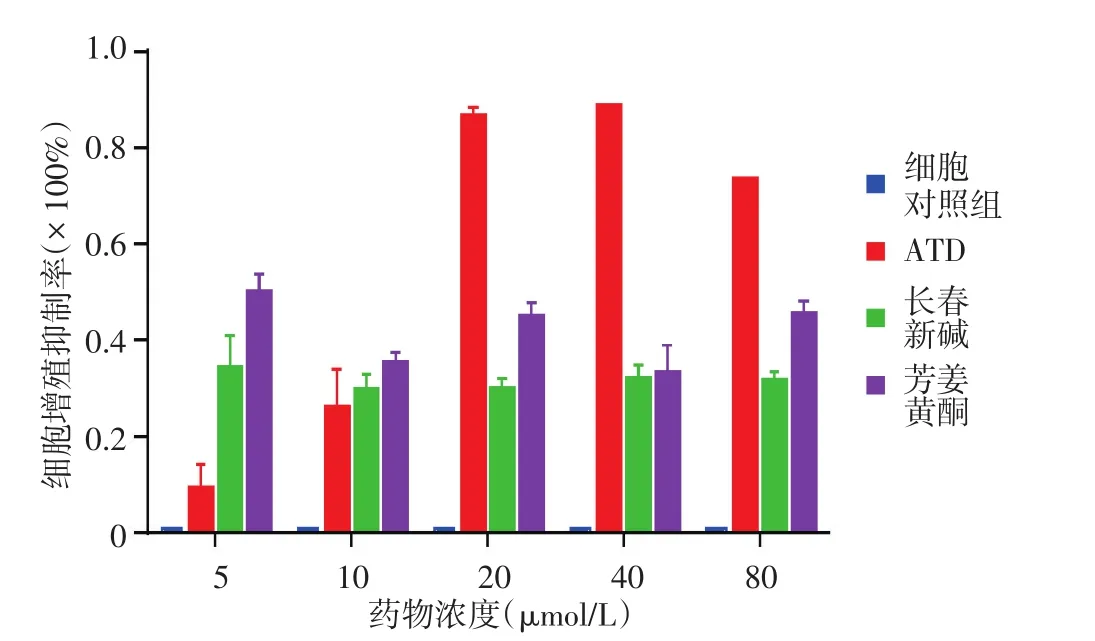
圖2 芳姜黃酮衍生物(ATD)、長春新堿及芳姜黃酮作用48 h對人皮膚成纖維細胞增殖的抑制率(n=6)

圖3 不同濃度芳姜黃酮衍生物、芳姜黃酮、長春新堿作用A375細胞48 h后DNA片段化電泳圖 M:標準參照物;1~5:分別為80、40、20、10、5 μmol/L 藥物組;6:細胞對照組
三、ATD、長春新堿及芳姜黃酮對A375細胞形態的影響
對照組細胞呈多角形或梭形,緊密排列,生長活躍,呈現致密的綠色熒光;不同濃度ATD、長春新堿及芳姜黃酮組可見數量不等的黃綠色熒光,由低濃度至高濃度,黃綠色熒光逐漸減少,而桔黃色熒光逐漸增多,細胞逐漸變圓,貼壁性降低,細胞間隙增大,并有大量漂浮壞死細胞及細胞碎片,以ATD誘導細胞凋亡最為顯著。
四、ATD、長春新堿及芳姜黃酮對A375細胞DNA片段化影響
作用A375細胞48 h后,5~ 80 μmol/L ATD組、20~ 80 μmol/L芳姜黃酮組、10~ 80 μmol/L長春新堿組均見明顯DNA片段化,且隨濃度升高片段化程度增強。5~80 μmol/L濃度范圍內,對DNA片段化的誘導作用為ATD>長春新堿>芳姜黃酮。見圖3。
五、ATD、長春新堿及芳姜黃酮對A375細胞caspase?3活性的影響

圖4 芳姜黃酮衍生物(ATD)、長春新堿及芳姜黃酮作用48 h后A375細胞caspase?3活性
見圖4。ATD、長春新堿及芳姜黃酮均不同程度活化A375細胞caspase?3,其中以ATD組最為明顯。隨藥物濃度增加,caspase?3活性逐漸增加,且呈劑量依賴性(ATD:R2=0.98,F=162.30,P<0.05;長春新堿:R2=0.96,F=94.39,P<0.05;芳姜黃酮:R2=0.95,F=57.35,P<0.05)。在濃度為10、20、40及80 μmol/L時,各藥物組與細胞對照組相比,差異均有統計學意義(P<0.05),ATD組與長春新堿及芳姜黃酮組比較,差異亦有統計學意義(均P<0.05)。
六、ATD、長春新堿及芳姜黃酮對A375細胞凋亡的影響
見表1。3種藥物作用A375細胞48 h后,細胞出現不同程度凋亡。隨藥物濃度遞增,ATD組晚期凋亡細胞逐漸增多,早期凋亡細胞呈現先增多后減少趨勢;芳姜黃酮組早期凋亡及晚期凋亡不明顯;長春新堿組晚期凋亡細胞逐漸增多,早期凋亡細胞亦呈現先增多后減少趨勢。藥物濃度為5~80 μmol/L時,3種藥物組早期凋亡率及晚期凋亡率同對照組相比,差異均有統計學意義(均P<0.05)。而且,隨藥物濃度增加,ATD組發生壞死逐漸增多,與長春新堿組及芳姜黃酮組壞死率相比,差異均有統計學意義(P<0.05),見表2。
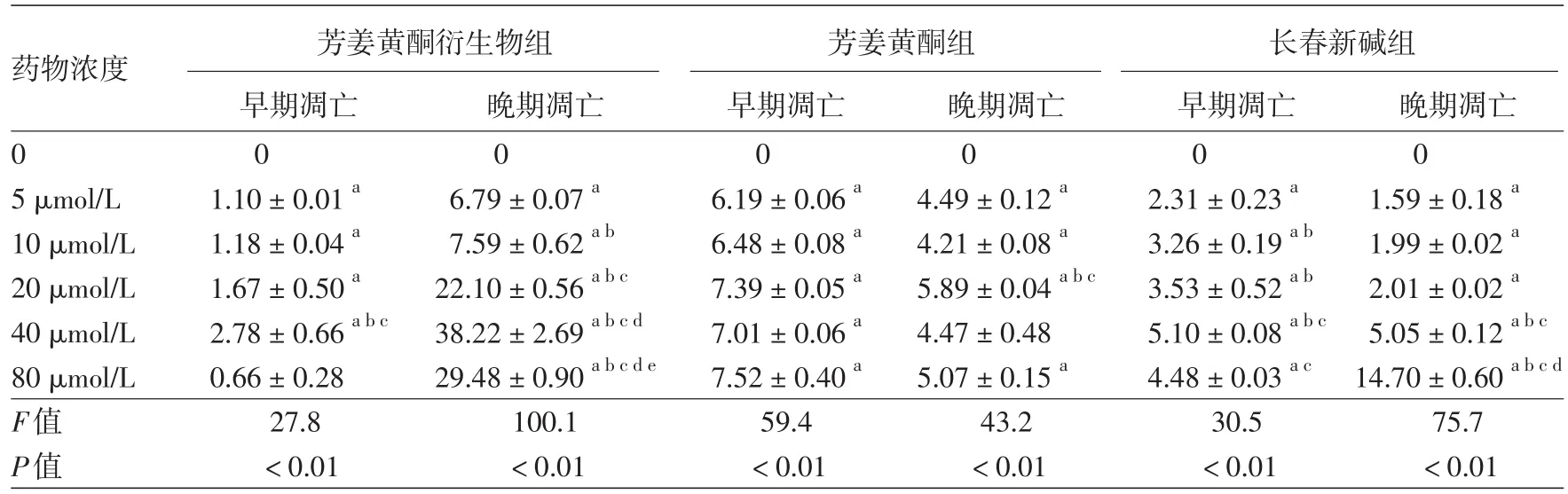
表1 不同濃度芳姜黃酮衍生物、芳姜黃酮及長春新堿作用48 h后A375細胞凋亡率比較(%,x±s)
七、ATD對A375細胞周期的影響
隨ATD濃度增加,G1期細胞比例逐漸增高多,與對照組相比,差異均有統計學意義(P<0.05);但G2期及S期細胞逐漸減少,濃度為80 μmol/L時,G2期及S期細胞比例均降至0。見表3。
討 論
我們曾對以芳姜黃酮為主要成分的姜黃揮發油進行抗腫瘤活性研究,發現其對人急性單核細胞白血病THP?1細胞株具有較好的抗腫瘤活性[10],芳姜黃酮通過誘導細胞凋亡及免疫激活等不同作用方式發揮抗癌活性,但其作用與化療藥物相比較弱。為尋求抗腫瘤活性更高而毒性更低的藥物,我們選擇ATD行抗黑素瘤活性研究,發現ATD通過影響凋亡相關分子而對黑素瘤細胞發揮抑制增殖及促凋亡作用。
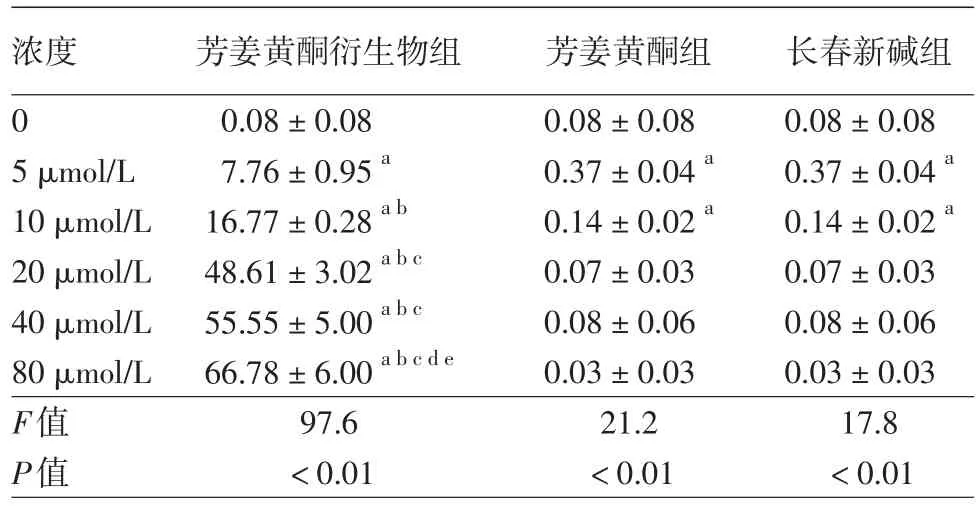
表2 不同濃度芳姜黃酮衍生物、芳姜黃酮及長春新堿作用48 h后A375細胞死亡率比較(%,x±s)
本研究結果顯示,ATD、芳姜黃酮及長春新堿都不同程度抑制A375細胞增殖,隨藥物劑量增加,增殖抑制作用增強,且為劑量依賴性,抗腫瘤活性ATD>長春新堿>芳姜黃酮。但3種藥物對HSF有不同程度的影響,隨藥物濃度增加,ATD對HSF的作用明顯增加,芳姜黃酮組及長春新堿組增加不明顯。但當藥物濃度為5及10 μmol/L時,ATD毒性明顯小于芳姜黃酮及長春新堿,且在此濃度范圍內,ATD抗腫瘤活性明顯強于芳姜黃酮及長春新堿。
凋亡是由特定基因調控的細胞自殺過程,本實驗中,隨ATD、芳姜黃酮及長春新堿濃度增加,A375貼壁性能下降,并見數量不等的漂浮細胞及細胞碎片,說明3種藥物都不同程度誘導細胞凋亡,當藥物濃度為20、40及80 μmol/L時,可見ATD組細胞明顯減少,細胞變圓,細胞間隙明顯增寬,且見大量壞死細胞,而芳姜黃酮組及長春新堿組仍然可見到數目較多的貼壁細胞,且細胞形態較正常,說明ATD具有顯著誘導A375細胞凋亡的作用,其作用強于芳姜黃酮及長春新堿。
聚腺苷二磷酸?核糖聚合酶(poly ADP?ribose polymerase,PARP)是caspase?3的主要底物之一,參與DNA修復及維持基因完整性[11]。凋亡啟動時,PARP被caspase?3剪切成85 000和31 000兩個片段,使PARP中與DNA結合的2個鋅指結構與羧基端的催化區域分離,最終使受PARP負調控的Ca2+/Mg2+依賴性核酸內切酶活性增高,裂解核小體間DNA,引起細胞凋亡[12]。本研究結果顯示,隨ATD、芳姜黃酮及長春新堿濃度增加,caspase?3活性逐漸增高,且為劑量依賴性,以ATD組caspase?3活化程度最為明顯。DNA片段化亦證實,ATD、芳姜黃酮及長春新堿誘導A375細胞凋亡,電泳見典型DNA梯狀條帶,為凋亡時激活Ca2+或Mg2+依賴性核酸內切酶,致DNA鏈斷裂形成50 000~300 000 bp DNA片段所致[13],且以ATD作用較為明顯。
流式細胞儀檢測顯示,ATD、芳姜黃酮及長春新堿均可不同程度誘導細胞凋亡,隨藥物濃度增加,凋亡作用增強,但三者致使細胞發生凋亡的時期不一致。ATD主要使細胞發生晚期凋亡,早期凋亡變化不明顯,隨劑量增加,細胞凋亡率明顯上升,壞死細胞亦顯著增多。芳姜黃酮組以早期凋亡較為明顯,長春新堿組以晚期凋亡較為明顯,但長春新堿誘導細胞凋亡作用明顯弱于ATD。

表3 不同濃度芳姜黃酮衍生物作用48 h后A375細胞周期分布(%,x±s)
本實驗中,ATD由低濃度至高濃度,A375細胞G1期逐漸增多,G2期及S期細胞數明顯減少,細胞周期被阻滯在G1期,細胞DNA合成受阻,阻斷了細胞的有絲分裂,從而對A375細胞起到增殖抑制作用。
綜上所述,ATD對A375細胞具有抑制增殖及促凋亡作用,且其作用強度明顯強于芳姜黃酮及長春新堿。當藥物濃度為10 μmol/L時,ATD毒性明顯小于芳姜黃酮及長春新堿,但抗腫瘤活性明顯強于芳姜黃酮及長春新堿。
[1]Malasoni R,Naqvi A,Srivastava A,et al.An improved HPLC method for simultaneous estimation of isocurcumenol,ar?turmerone and alpha,beta?turmerone in hexane soluble fraction of curcuma longa and its formulations[J].J Biomater Tiss Eng,2014,4(5):405?410.DOI:10.1166/jbt.2014.1175
[2]Prakash P,Misra A,Surin WR,et al.Anti?platelet effects of Curcuma oil in experimental models of myocardial ischemia?reperfusion and thrombosis[J].Thromb Res,2011,127(2):111?118.DOI:10.1016/j.thromres.2010.11.007.
[3]Kim D,Suh Y,Lee H,et al.Immune activation and antitumor response of ar?turmerone on P388D1 lymphoblast cell implanted tumors[J].Int J Mol Med,2013,31(2):386?392.DOI:10.3892/ijmm.2012.1196.
[4]Mehrotra N,Sabarinath S,Suryawanshi S,et al.LC?UV assay for simultaneous estimation of aromatic turmerone, α/β ?turmerone and curlone:major bisabolane sesquiterpenes of turmeric oil in rabbit plasma for application to pharmacokinetic studies[J].Chromatographia,2009,69(9):1077?1082.DOI:10.1365/s10337?009?1007?1.
[5]潘博文,石洋,劉雄偉,等.姜烯衍生物的合成及其與吲哚類化合物的 Friedel?Crafts反應[J].合成化學,2013,21(4):400?405.DOI:10.3969/j.issn.1005?1511.2013.04.004.Pan BW,Shi Y,Liu XW,et al.Synthesis and friedel?crafts reaction with indole derivatives of zingiberene derivatives[J].Chin J Synthetic Chem,2013,21(4):400?405.DOI:10.3969/j.issn.1005?1511.2013.04.004.
[6]Song M,Park DK,Park HJ.Antrodia camphorata grown on germinated brown rice suppresses melanoma cell proliferation by inducing apoptosis and cell differentiation and tumor growth[J].Evid Based Complement Alternat Med,2013,2013:321096.DOI:10.1155/2013/321096.
[7] Hassan AM,Abdel?Aziem SH,El?Nekeety AA,et al.Panax ginseng extract modulates oxidative stress,DNA fragmentation and up?regulate gene expression in rats sub chronically treated with aflatoxin B1 and fumonisin B 1[J].Cytotechnology,2015,67(5):861?871.DOI:10.1007/s10616?014?9726?z.
[8] Jiang AJ,Jiang G,Li LT,et al.Curcumin induces apoptosis through mitochondrial pathway and caspases activation in human melanoma cells[J].Mol Biol Rep,2015,42(1):267?275.DOI:10.1007/s11033?014?3769?2.
[9] Wu Z,Liu B,E C,et al.Resveratrol inhibits the proliferation of human melanoma cells by inducing G1/S cell cycle arrest and apoptosis[J].Mol Med Rep,2015,11(1):400 ?404.DOI:10.3892/mmr.2014.2716.
[10]涂云華,康穎倩,周英,等.姜黃揮發油對THP?1細胞增殖及凋亡的影響[J].山東大學學報(醫學版),2015,5:46?51.DOI:10.6040/j.issn.1671?7554.0.2014.731.Tu YH,Kang YQ,Zhou Y,et al.Effect of turmeric volatile oil on the proliferation and apoptosis of human leukemia cell line THP?1[J].J Shandong Univ(Health Sci),2015,5:46?51.DOI:10.6040/j.issn.1671?7554.0.2014.731.
[11]Rouleau M,Patel A,Hendzel MJ,et al.PARP inhibition:PARP1 and beyond[J].Nat Rev Cancer,2010,10(4):293 ?301.DOI:10.1038/nrc2812.
[12]龍建飛,張弛,張秋霞,等.黃連解毒湯有效部位對腦缺血大鼠半暗帶神經元NeuN、Caspase?3、PARP表達的影響[J].北京中醫藥大學學報,2014,37(2):90?93,98,后插1.DOI:10.3969/j.issn.1006?2157.2014.02.005.Long JF,Zhang C,Zhang QX,et al.Active fraction of Huanglian Jiedu Tang affecting expression of penumbra neurons NeuN,Caspase?3 and PARP in rats after cerebral ischemia[J].Journal of Beijing University of Traditional Chinese Medicine,2014,37(2):90?93,98,back insert page 1.DOI:10.3969/j.issn.1006?2157.2014.02.005.
[13] Joshi N,Grant SG.Pulsed?field gel electrophoresis analysis of multicellular DNA double?strand break damage and repair[J].Methods Mol Biol,2014,1105:193?202.DOI:10.1007/978?1?62703?739?6_16.
Effects of an ar?turmerone derivative on the proliferation and apoptosis of A375 human melanoma cells and their mechanisms
Tu Yunhua,Kang Yingqian,Li Ming′e,Zhou Ying,Xue Yuecui,Ye Zhenyuan,Rong Dongyun,Zan Xuejuan,Pan Junling,Lu Hongguang,Cao Yu
Department of Dermatology and Venereology,Affiliated Hospital of Guizhou Medical University,Guiyang 550004,China(Tu YH,Li ME,Xue YC,Ye ZY,Rong DY,Zan XJ,Pan JL,Lu HG,Cao Y);Department of Microbiology,Guizhou Medical University,Guiyang 550004,China(Kang YQ);Guizhou Provincial Chinese Medicine(Ethnic Medicine)Creation Engineering Center,College of Life Sciences,Guizhou University,Guiyang 550025,China(Zhou Y)
ObjectiveTo investigate the effects of an ar?turmerone derivative(ATD)on the proliferation and apoptosis of A375 human melanoma cells.MethodsBoth A375 cells and human skin fibroblasts(HSFs)were cultured with different concentrations(5,10,20,40 and 80 μmol/L)of ATD,vincristine and ar?turmerone,separately,for 48 hoursin vitro.Subsequently,cell counting kit?8(CCK ?8)was used to evaluate cell proliferation,inverted microscopy to observe cell morphology after acridine orange/ethidium bromide(AO/EB)staining,and a colorimetric method to estimate caspase?3 activity.DNA fragmentation assay and flow cytometry were performed to assess cell apoptosis,and flow cytometry was conducted to analyze cell cycle.ResultsATD,vincristine and Ar?turmerone all inhibited the proliferation of A375 cells in a dose?dependent manner(ATD:R2=0.99,F=340.96,P< 0.05;vincristine:R2=0.99,F=349.19,P< 0.05;ar?turmerone:R2=0.89,F=25.41,P< 0.05).The fifty percent inhibitory concentra?tions(IC50s)of ATD,vincristine and ar?turmerone against A375 cells were 15.96 ± 0.02 μmol/L,77.00 ± 0.04 μmol/L and 356.95 ± 0.01 μmol/L respectively.When the drug concentrations were 5 and 10 μmol/L,the proliferation of HSFs was inhibited by 8%±0.06%and 25%±0.02%respectively by ATD,by 49%±0.09%and 34%±0.07%respectively by ar?turmerone,and by 33% ± 0.04%and 29% ± 0.08%respectively by vincristine,and the proliferation of A375 cells was inhibited by 26%±0.06%and 39%±0.02%respectively by ATD,by 6%±0.09%and 10%±0.07%respectively by ar?turmerone,and by 8% ± 0.04%and 17% ± 0.08%respectively by vincristine,with the inhibitory effects of the three drugs being significantly different from that of dimethyl sulfoxide(allP< 0.05).ATD showed stronger inhibitory effects on the proliferation of A375 cells,but weaker cytotoxic effects on HSFs compared with ar?turmerone and vincristine(allP< 0.05).Meanwhile,ATD,vincristine and ar?turmerone all induced the apoptosis of A375 cells(P<0.05),and caspase?3 activity increased with the increase in drug concentrations(ATD:R2=0.98,F=162.30,P< 0.05;vincristine:R2=0.96,F=94.39,P< 0.05;ar?turmerone:R2=0.95,F=57.35,P< 0.05).The effect of ATD on caspase?3 activity was strongest,followed by that of vincristine and ar?turmerone.As flow cytometry showed,all the three drugs induced cell apoptosis to different degrees,and ATD showed a relatively strong effect on cell apoptosis,especially late apoptosis,compared with the other two drugs.In the ATD group,the number of A375 cells in G1 phase gradually increased,while that in G2 phase and S phase significantly decreased with the increase in drug concentrations.Conclusions ATD exhibited proliferation?inhibiting and apoptosis?inducing effects on A375 cells,and the effects were stronger than those of vincristine and ar?turmerone.It is quite possible that ATD affects cell proliferation and differentiation by activating caspase?3 and arresting cell cycle in the G1 phase.
Melanoma,experimental;Cell line,tumor;Turmerone;Vincristine;Cell proliferation;Apoptosis;Ar?turmerone derivatives
Cao Yu,Email:382541077@qq.com
曹煜,Email:382541077@qq.com
10.3760/cma.j.issn.0412?4030.2016.07.012
貴州省中藥現代化專項項目[黔科合中藥字(2012)5018號];貴陽市科技局科技創新平臺項目[筑科合同(2012303)號];貴州省中藥民族藥創制工程中心[黔教合字(2012)018號]
Fund programs:Modernization of Traditional Chinese Medicine Program of Guizhou Province(Grant No.[2012]5018);Science and Technology Innovation Platform Project of Guiyang Municipal Science and Technology Bureau(Grant No.2012303);Pharmaceutical Engineering Center for Traditional Chinese Medicine and National Medicine of Guizhou Province(Guizhou Education Grant No.[2012]018)
2015?07?31)
(本文編輯:尚淑賢)

