不同聚合物配方的硝苯地平緩釋片體外釋放差異研究
楊繼榮,嚴文偉,肖勇翔,朱穎,陳飛
(1.上海卡樂康包衣技術有限公司,上海201108;2.陶氏化學<中國>投資有限公司藥品與食品解決方案事業部,上海201203)
不同聚合物配方的硝苯地平緩釋片體外釋放差異研究
楊繼榮1,嚴文偉1,肖勇翔1,朱穎1,陳飛2
(1.上海卡樂康包衣技術有限公司,上海201108;2.陶氏化學<中國>投資有限公司藥品與食品解決方案事業部,上海201203)
目的優化緩、控釋制劑常用親水凝膠骨架材料羥丙甲纖維素(HPMC)和海藻酸鈉(SA)的臨床應用。方法以硝苯地平為模型藥物,分別使用羥丙甲纖維素和海藻酸鈉制備親水凝膠骨架片劑,檢測并比較2種高分子聚合物片劑在體外不同條件下的釋放差異。結果在不同體外檢測條件下,非離子型的羥丙甲纖維素骨架配方釋放結果的差異更小;在不同pH檢測條件下,離子型的海藻酸鈉骨架配方釋放結果差異較顯著;在離子強度的影響研究中,海藻酸鈉骨架配方隨鈣離子強度的變化表現出明顯的釋放變化。結論非離子型骨架材料羥丙甲纖維素的骨架配方比離子型骨架材料海藻酸鈉配方更穩健,可抵御體內不同胃腸道位置的環境變化,優選前者用于制備緩、控釋制劑對保證藥物的臨床療效有積極影響。
硝苯地平緩釋片;羥丙甲纖維素;海藻酸鈉;親水凝膠骨架
目前,市售硝苯地平緩、控釋制劑主要采用親水凝膠骨架系統。該藥物的親水凝膠緩釋骨架片制劑中主流的緩釋功能性輔料有羥丙甲纖維素(HPMC)和海藻酸鈉(SA)2種。本研究中比較了2種不同聚合物配方在體外不同條件下的釋放行為差異,為合理應用輔料提供理論依據和藥學指導。
1 儀器與試藥
1.1儀器
Bio-Dis緩釋測試工作站(上海魅元科學儀器有限公司);Varian VK7000型溶出儀(包括Varian Cary 50型紫外分光光度計,安捷倫科技有限公司);1260-infinity型高效液相色譜儀(安捷倫科技有限公司);8沖旋轉式壓片機(mini press-ⅡSF,Rimek,Cabb Karnavati Rasyan Ltd,India)。
1.2試藥
硝苯地平(上海玉瑞生物科技藥業有限公司,批號為20150608);海藻酸鈉(SA,國藥集團化學試劑有限公司,批號為20150709);羥丙甲纖維素(HPMC,美多秀TMK100LV CR,美國陶氏化學藥品與食品解決方案業務部,批號為2H170112N21);乳糖(Granulac誖200,德國美劑樂集團,批號為L1335);硬脂酸鎂(湖州展望藥業股份有限公司,批號為20150403);全安素(雅培貿易<上海>有限公司,批號為20150402);無水氯化鈣(國藥集團化學試劑有限公司,批號為20150806);胃蛋白酶(生化試劑,上海展云化工有限公司,批號為20150701);胰酶粉(生化試劑,北京奧博星生物技術有限公司,批號為20150910);十二烷基硫酸鈉(SLS,西安悅來醫藥科技有限公司,批號為20150506);吐溫-80(南京威爾化工有限公司,批號為20150705);其余試劑均為分析純。
2 方法與結果
2.1硝苯地平緩釋片制備
將硝苯地平原料與乳糖及緩釋材料(HPMC和SA)混合均勻,采用適量85%乙醇制粒,過20目篩,55℃干燥60 min,取出。過20目篩,打碎大的顆粒,加入適量潤滑劑硬脂酸鎂,再混合1 min,壓片。壓片力為800~1 000 kg,所得片劑硬度約為5 kg。
2.2藥物釋放度檢測
2.2.1不同檢測條件
按《美國藥典》溶出度測定法中的Ⅲ法(USPⅢ法),采用Bio-Dis方法,分別使用模擬胃腸液模擬飽腹和空腹狀態下,分別檢測SA和HPMC作為緩釋材料的配方樣品[1]。每個溶出介質的量為220 mL,浸入頻率為10次/分。介質的配制及樣品的采集時間點見表1。
因介質組成復雜,可能對硝苯地平釋放度的檢測有較大干擾,故參照硝苯地平滲透泵片的檢測標準,采用高效液相色譜(HPLC)法對硝苯地平進行檢測[2]。填充劑為十八烷基硅烷鍵合硅膠,流動相為乙腈-甲醇-水(20∶30∶50),檢測波長為265 nm。稱取硝苯地平對照品16.50 mg,精密稱定,置50 mL棕色容量瓶中,加乙腈-甲醇(50∶50)25 mL使溶解,再加水適量至刻度,搖勻,靜置15 min,用水稀釋至刻度。取釋放度檢測中不同時間點的介質作為供試品溶液,分別計算溶出量。采用USPⅢ法對SA配方及HPMC配方的硝苯地平緩釋片檢測結果見圖1。可見,在模擬胃腸液條件下,模擬飽腹及空腹條件下藥物的釋放度變化較大。其中,模擬空腹條件下SA配方的緩釋片釋放快于HPMC配方。模擬飽腹條件下SA配方和HPMC配方中藥物的釋放均變慢,且前者相對更慢。可見,SA配方中藥物釋放度的變化受食物影響更敏感。
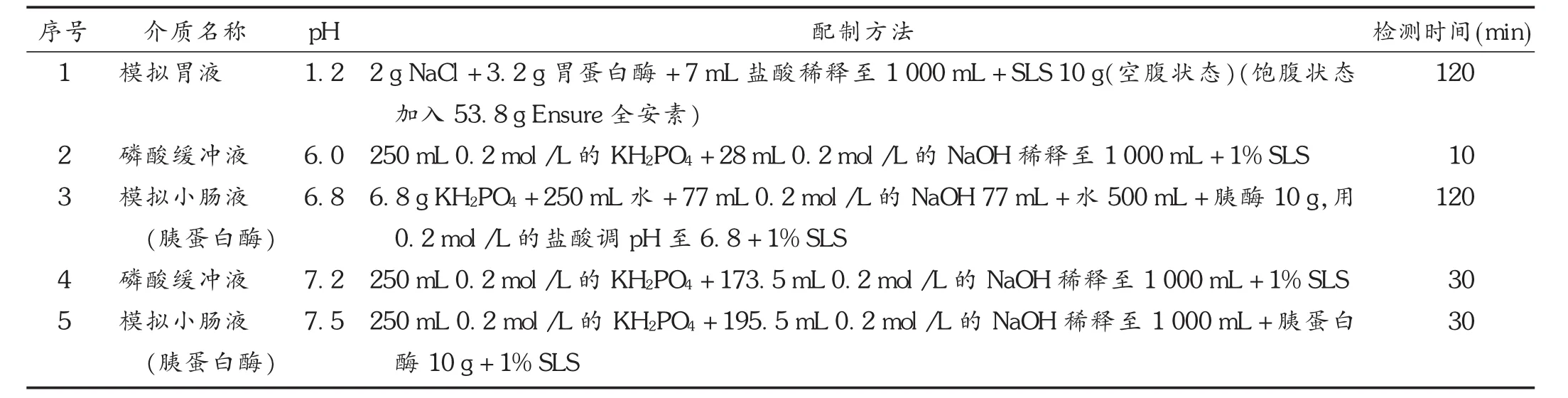
表1 USPⅢ法溶出的配制及取樣時間點的設定
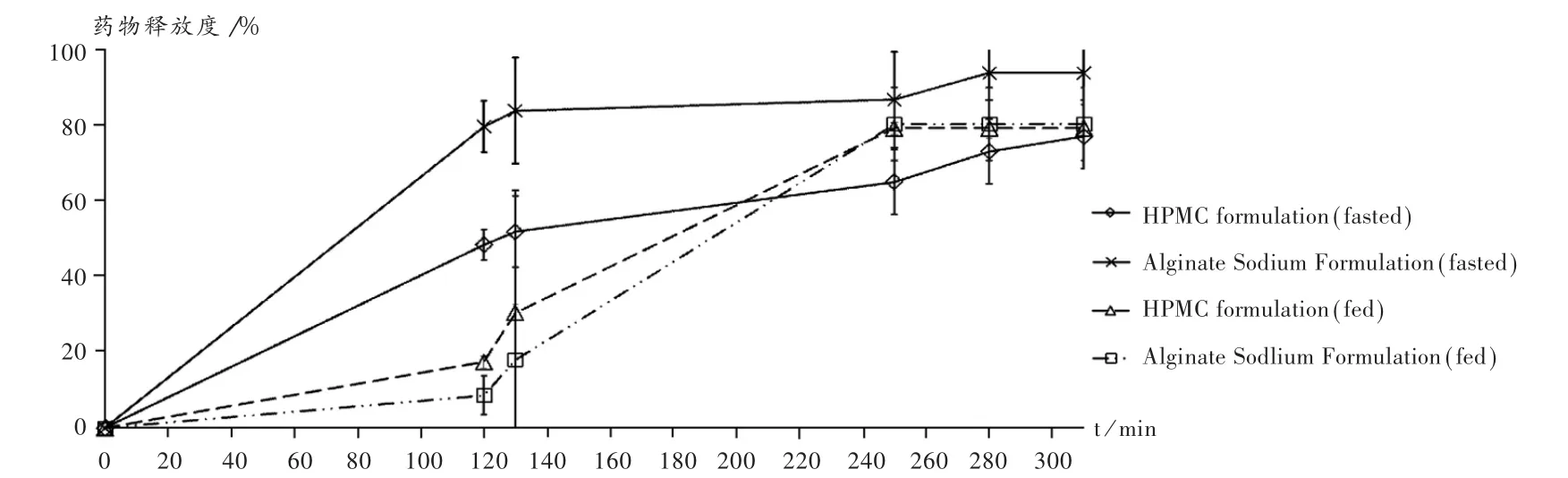
圖1 使用USPⅢ法檢測的藥物釋放曲線(n=3)
2.2.2不同離子強度條件
使用氯化鈣分別配制成不同離子強度(0.01,0.03,0.05 mol/L)的水溶液1 000 mL作為溶出介質。介質中加入0.5%的吐溫-80以增加硝苯地平的溶解度,使之滿足漏槽條件。按2015年版《中國藥典(四部)》0931溶出度與釋放度測定法中第二法(槳法)[3],于波長333 nm、轉速100 r/min條件下檢測,采用紫外-可見分光光度法進行檢測,并計算溶出量。結果見圖2和圖3。可見,在4種不同離子強度的溶出介質中,以HPMC為緩釋材料的配方釋放度一致,而以SA為緩釋材料的配方溶出度變化較大。在較低離子強度(0.01 mol/L)時,SA與少量鈣離子結合形成不溶性物質,片劑崩解,形成不溶性大顆粒;而在較高離子強度(0.03,0.05 mol/L)時,整個片劑與鈣離子結合形成不溶性結合物,片劑膨脹成整個大團塊,藥物的溶出受到嚴重影響。
2.2.3不同攪拌槳轉速條件
分別于50,75,100 r/min條件下,以加入0.5%吐溫-80的純水1 000 mL作為溶出介質,于333 nm波長條件下采用紫外-可見分光光度法進行檢測,并計算溶出量。結果見圖4。可見,盡管2個配方的釋放速率有差異,但在不同攪拌槳轉速檢測條件下,相同緩釋材料配方的釋放曲線總體變化不大。
2.2.4不同pH
分別于pH=1.0,4.5,6.8及水為溶出介質的條件下[4],于波長333 nm、轉速100 r/min條件下,采用紫外-可見分光光度法進行檢測,并計算溶出量。結果見圖5和圖6。HPMC由于是非離子型聚合物,在不同pH介質中,藥物的釋放僅受自身在不同介質中溶解度的影響;而SA是離子型聚合物,由圖6可見,隨著pH的變化,由其配方的藥物從凝膠骨架中的釋放情況也有顯著變化,在pH=1.0的鹽酸中藥物釋放不完全,而在pH=4.5的醋酸緩沖液中,SA骨架不能很好地形成凝膠,骨架在30 min內破碎,藥物發生突釋。當pH=6.8時,藥物釋放速率先慢后快。

圖2 離子強度對HPMC為緩釋材料的配方藥物釋放的影響(n=3)

圖3 離子強度對SA為緩釋材料的配方藥物釋放的影響(n=3)
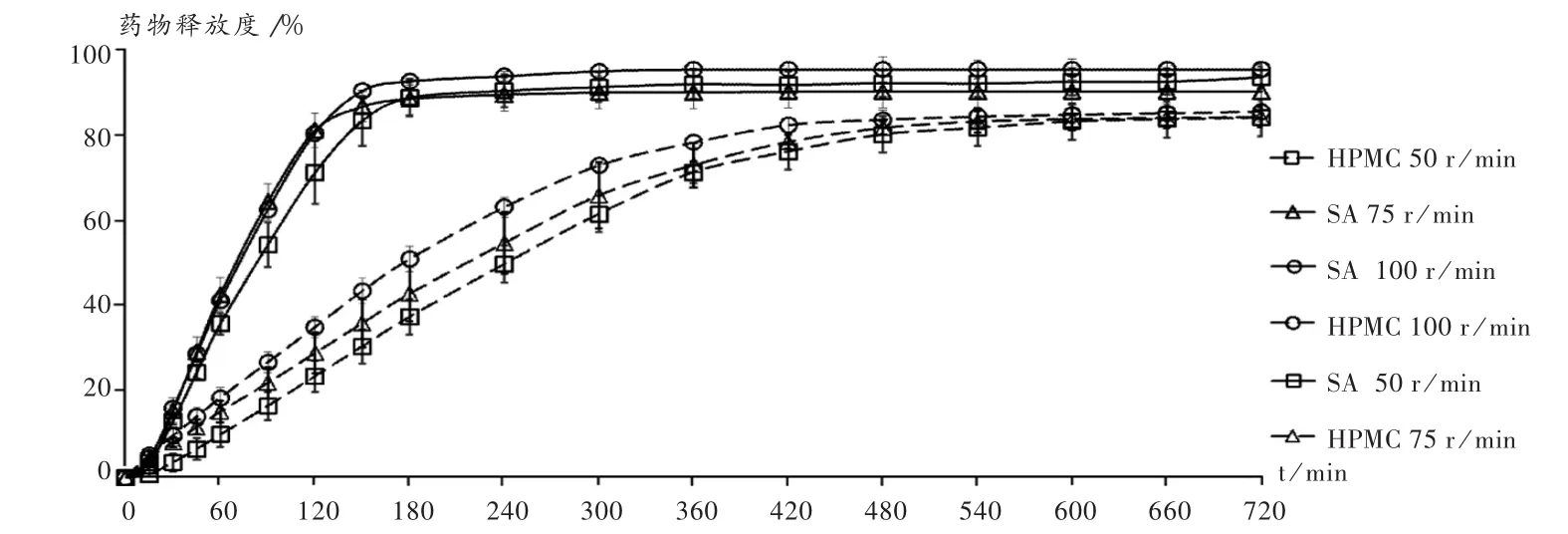
圖4 攪拌槳轉速對2種緩釋材料配方藥物釋放的影響(n=3)
3 討論
HPMC是一種非離子型纖維素醚類聚合物,通過化學修飾天然纖維素制得。HPMC廣泛應用于親水凝膠骨架片中,以HPMC為骨架的緩、控釋片劑遇水后可快速形成凝膠層并具有穩健的釋放性能,且對于溶解度為非pH依賴性的藥物(如硝苯地平),HPMC所組成的親水凝膠骨架片劑的釋放行為不受體內pH影響。
海藻酸鈉(SA)是海藻酸的水溶性鈉鹽,為天然支鏈多糖聚合物,由褐藻中提取而得,主要由β-D-甘露糖醛酸(M)和α-L-古洛糖醛酸(G)2種片段組合而成[5-6]。由于2種片段上的羧酸基團在pH變化過程中可獲得或釋放氫離子,導致SA對pH敏感。當環境pH低于M pKa(3.38)和G pKa(3.65)時,溶解的海藻酸鈉鹽就轉化為不溶于水的海藻酸鹽。在親水凝膠骨架片中,pH敏感的SA在胃腸道不同位置藥物釋放速率將顯著變化[7]。低溫電鏡顯示SA在模擬胃液中形成的是顆粒狀和多孔狀的凝膠層。因此SA凝膠骨架片在胃液中會產生裂縫與斷層,這會破壞緩釋骨架的整體結構,使片層崩解,導致藥物突釋,失去緩控釋效果的骨架片會給患者帶來安全風險[8-9]。SA的另一特性是會與二價陽離子(特別是鈣離子)結合形成水不易溶解的凝膠。這種凝膠的物理特性與SA多糖結構中M與G的比例和排列有關。一般來說,含G比例高的SA與鈣離子形成的凝膠強度大,但較脆;而含M比例高的SA形成的凝膠強度弱,但較柔韌。因此,當SA制備的親水凝膠骨架片在遇到鈣鹽,且在胃液中與鈣補充劑或牛奶接觸時,就會形成上述不易溶于水的凝膠,導致骨架中藥物的釋放行為不可預知且不穩定,影響藥物療效[10]。
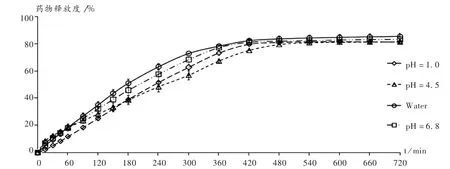
圖5 不同pH介質對HPMC配方藥物釋放的影響(n=3)

圖6 不同pH介質對SA配方藥物釋放的影響(n=3)
HPMC和SA是硝苯地平緩釋骨架片中常見的2種緩釋高分子聚合物,在以前的文獻中有關于2種聚合物緩釋性能的全面比較。HPMC是一種非離子型聚合物,有化學惰性,在不同pH和不同離子強度介質的條件下,均可更好地保護藥物的緩釋性不受影響。因為難溶性藥物HPMC骨架片的釋放主要受骨架溶蝕為主和藥物擴散為輔的協同控制,而HPMC在生理pH范圍內性質穩定,即骨架溶蝕不受pH的影響,故在不同的pH溶出介質中,硝苯地平表現出相似的藥物釋放。至于不同介質間一定程度的差異,主要是由于硝苯地平本身為難溶性藥物,在不同pH溶出介質中溶解性不同,造成藥物從骨架片擴散到介質中的驅動力也不同,從而表現出釋藥速率的變化[11-12]。SA也是緩釋骨架中經常用到的緩釋材料,在國內外的文獻中也有不少關于SA應用于緩釋骨架的研究[13-14]。而以SA為緩釋骨架的配方受外界因素影響,釋放變化較大。這是因為SA是離子型的聚合物,在不同pH或不同鈣離子強度條件下會形成不溶性凝膠,其骨架的強度及溶蝕程度受到影響而產生較大差異,導致骨架中藥物釋放行為的不可預知和不穩定。這與文獻報道的SA的特征一致。比較而言,HPMC配方則更穩健。在不同條件下能保持相對穩定的藥物釋放,藥物的體外釋放有更好的一致性表現,更適合用作穩健的親水凝膠骨架片劑的緩釋材料,以得到更好的體內預期療效。
[1]Klein S,Rudolph MW,Dressman JB,et al.Drug release characteristics of different mesalazine products using USP apparatus 3 to simulate passage through the GI tract[J].Dissolution Technologies,2002,9(9):6-12.
[2]JX20000463,硝苯地平滲透泵片注冊標準[S].
[3]WS1-(X-058)-2004Z,硝苯地平緩釋片Ⅱ注冊標準[S].
[4]國家藥典委員會.中華人民共和國藥典(四部)[M].北京:中國醫藥科技出版社,2015:324.
[5]Lee KY,Mooney DJ.Alginate:properties and biomedical applications[J].Prog Polym Sci,2012,37:106-126.
[6]Augst AD,Kong HJ,Mooney DJ.Alginate hydrogels as biomaterials[J].Macromol Biosci,2006(6):623-633.
[7]Tiwari SB,DiNunzio J,Rajabi-Siahboomi A.Drug-polymer matrices for extended release.In:Wilson CG,Crowley PJ,editors.Advances in delivery science and technology:controlled release in oral drug delivery[M].New York:Springer,2011:131-160.
[8]Hodsdon AC,Mitchell JR,Davies MC,et al.Structure and behaviour in hydrophilic matrix sustained release dosage forms:3.the influence of pH on the sustained-release performance and internal gel structure of sodium alginate matrices[J].J Control Release,1995,33:143-152.
[9]Ching AL,Liew CV,Chan LW,et al.Modifying matrix microenvironmental pH to achieve sustained drug release from highly laminatingalginatematrices[J].EurJPharmSci,2008,33:361-370.
[10]GacesaP.Alginates[J].CarbohydratePolymer,1988,8:161-182.
[11]徐翔,田國祥,許東航,等,不同pH的溶出介質對HPMC骨架片釋藥的影響[J].中國現代應用藥學,2004,21(2):108-110.
[12]Richard S,Ramona K.The effects of pH,ionic concentration and ionic species of dissolution media on the release rates of quinidine gluconate sustained release dosage forms[J].Drug Dev Ind Pharm,1991,17(1):113.
[13]仲靜潔,王東凱,張翠霞,等.海藻酸鈉在藥物制劑中的研究進展[J].中國新藥雜志,2007,16(8):591-594.
[14]Mandal S,Basu SK,Sa B.Ca2+ion cross-linked interpenetrating network matrix tablets of polyacrylamide-grafted-sodium alginate and sodium alginate for sustained release of diltiazem hydrochloride[J].Carbohydr Polym,2010,82(3):867-873.
In-Vitro Drug Release Difference of Extended Release Nifedipine Tablets in Different Polymer Formulations
Yang Jirong1,Yan Wenwei1,Xiao Yongxiang1,Zhu Ying1,Chen Fei2
(1.ShanghaiColorcon Co.,Ltd.,Shanghai,China201108;2.Pharma&Food Solutions,Dow Chemical<China>Investment Co.,Ltd.,Shanghai,China201203)
ObjectiveTo optimize the clinical application of the hydrophilic gel matrix material hydroxypropyl methylcellulose(HPMC)and sodium alginate(SA)that werecommonly usedin slow,controlled release formulations.M ethodsNifedipine was taken as model drug and two different matrix tablets were formulated using HPMC and SA as hydrophilic matrix polymers,respectively.Thein-vitro drug release difference of those two different tablets was compared.ResultsThe result showed that drug release variation of the non-ionic polymer HPMC matrix formulation was smaller than that of ionic polymer SA formulation in different in-vitro test conditions.The release results the ionic SA formulation showed more significant difference at different pH testing conditions.The SA formulation displayed significant release variance along with the change of calcium ion strength in the influence study of ion strength.ConclusionThis study indicates that compared with ionic SA formulation,the non-ionic HPMC formulation is more robust in terms of drug release.HPMC is a better choice of hydrophilic matrix polymer in nifedipine matrix tablet,which can resist the influence of different pH conditions in GI tract and bring the positive impact on the efficacy of clinical therapy.
nifedipine release tablets;HPMC;sodium alginate;hydrophilic gel matrix
FQ460.6;R927.11;R972+.4
A
1006-4931(2016)18-0043-05
楊繼榮,男,執業藥師,研究方向為藥用輔料的應用技術支持和緩釋藥物的配方,(電子信箱)yangjirong2004@126.com。
(2016-06-01;
2016-07-15)

