納豆激酶高產菌株的選育及固態發酵技術
張 杰,葛武鵬,*,陳 瑛,張 悅,劉李婷
(1.西北農林科技大學食品科學與工程學院,陜西 楊凌 712100;2.陜西省質量技術監督局,陜 西 西安 710068;3.陜西省產品質量監督檢驗研究院,陜西 西安 710068)
納豆激酶高產菌株的選育及固態發酵技術
張 杰1,葛武鵬1,*,陳 瑛2,張 悅3,劉李婷3
(1.西北農林科技大學食品科學與工程學院,陜西 楊凌 712100;2.陜西省質量技術監督局,陜 西 西安 710068;3.陜西省產品質量監督檢驗研究院,陜西 西安 710068)
以枯草芽孢桿菌為出發菌株,選用超聲波和紫外線進行誘變處理,根據致死率、突變率與誘變劑量的關系選擇合適的誘變劑量,以篩選高產納豆激酶的優勢菌株。實驗表明:最佳誘變條件為:超聲波45 kHz、2 80 W,時間60 min,紫外線照射距離30 cm,時間120 s。經多次初篩、復篩,選育出一株命名為BSCZ-4 的優勢菌株,其納豆激酶酶活力為原始菌株的1.96 倍。對該菌種進行連續20 代培養,測得其溶解圈直徑穩定在18~19 mm之間,表明該突變株遺傳特性穩定。并采用Box-Behnken響應曲面法優化其固態發酵工藝條件,結果為:魔芋精粉添加量5%、接種量8%,34 ℃發酵24 h,納豆激酶活力可達(4 087.83±93.75) U/g。
誘變;枯草芽孢桿菌;響應面;工藝
納豆是一種有著幾千年歷史的傳統發酵食品,具有很多保健功能,如抗腫瘤、溶血栓、抗氧化、抗菌、防治骨質疏松、降血壓、美容等[1]。納豆枯草芽孢桿菌是納豆的生產菌種,屬于細菌科、芽孢桿菌屬[2],是革蘭氏陽性菌[3],具有分解蛋白質、碳水化合物、脂肪等大分子物質的能力[4],其代謝產物納豆激酶(nattokinase,NK)是一種絲氨酸蛋白酶[5],由275 個氨基酸殘基組成,分子質量約為28 kD。納豆激酶較穩定,50 ℃處理或經5 次反復凍融仍能保持活性。在pH 6~12條件下穩定存在,在酸性條件下無活性[6]。經大量文獻證實納豆激酶具有多種功能[7-10],其溶栓及抑制血栓形成效果較為突出[11-14]。
近幾年,世界很多國家也都加入到納豆的研究工作中,而國內的研究重點主要集中在通過對發酵條件的優化,從而提高納豆激酶的活力值[15-17]。然而在此基礎上得到的酶活力值并不理想,整體水平上仍有待提高。傳統的誘變技術是大多數微生物育種的重要手段[18],誘變育種通常使用兩種或兩種以上的手段進行復合處理,根據其復合處理的協調作用以提高誘變效應。本研究從生產菌種出發,通過對納豆枯草芽孢桿菌菌體進行超聲波和紫外線復合誘變處理,篩選出納豆激酶產量明顯提高的突變株,并經傳代20 次證明其遺傳穩定性,可作為發酵的優良菌種。并采用Box-Behnken響應曲面法優化其固態發酵工藝條件,得到高產納豆激酶的工藝參數,以期為納豆菌高產納豆激酶提供科學依據。
1 材料與方法
1.1 菌種與試劑
枯草芽孢桿菌枯草亞種BS21076 中國工業微生物菌種保藏管理中心。
尿激酶 北京雅安達生物技術有限公司;凝血酶(1 000 U/支)、牛纖維蛋白原 美國Sigma公司。
1.2 培養基
牛奶初篩培養基:脫脂奶粉60 g、牛肉膏5 g、蛋白胨5 g、NaCl 5 g、瓊脂15 g,蒸餾水1 L,pH 7.0。
液體種子培養基:牛肉膏5 g、蛋白胨5 g、NaCl 5 g,蒸餾水1 L,pH 7.0。
發酵基礎培養基[19]:葡萄糖15 g、蛋白胨15 g、Na2HPO42 g、NaH2PO42 g、MgSO40.5 g、CaCl20.2 g,蒸餾水1 L,pH 7.2~7.4。
1.3 儀器與設備
DRP-9162電熱恒溫培養箱 上海森信實驗儀器有限公司;SW-CJ-2D型(實用垂直新穎)雙人凈化工作臺蘇州凈化設備有限公司;ES-315高壓蒸汽殺菌鍋 上海博迅實業有限公司;精密pH儀 德國賽多利斯公司;SPH-200B搖床 西安禾普生物科技有限公司;HC-3018高速離心機 安徽中科中佳科學儀器有限公司;SB-5200DT超聲波清洗機 寧波新芝生物科技股份有限公司。
1.4 方法
1.4.1 菌懸液的制備[20]
用接種環挑取斜面菌種兩環,接種于裝有100 mL液體種子培養基的250 mL三角瓶中,37 ℃、150 r/min搖床培養15 h。將制備好的種子液裝入離心管5 000 r/min離心20 min,倒去上清液,將菌泥用滅菌的生理鹽水洗2~3 次,然后調整菌懸液濃度為106~107個/mL。
1.4.2 超聲波處理
將20 mL的菌懸液置于50 mL三角瓶中,放入超聲波清洗機。超聲波工作條件為 45 kHz、280 W、220 V,對菌懸液依次誘變處理0、10、20、30、40、50、60、70、80 min,取誘變后的菌懸液將其稀釋涂布于固體培養基平板上,每組2 個平行,培養24 h,統計菌落,計算致死率。
1.4.3 紫外誘變處理
將菌懸液稀釋后均勻地涂布在固體培養基上,紫外燈(照射距離為30 cm)預熱30 min后,照射涂布了枯草芽孢桿菌懸液的固體培養基[21]。照射時間分別為0、30、60、90、120、150、180、210、240 s。照射結束后用黑布包裹,37 ℃培養24 h,統計菌落總數,計算致死率。
1.4.4 致死率的計算
致死率的計算見式(1)[22]。

式中:A為未經處理的平板菌落數/(CFU/mL);B為與A平行經誘變處理后的再生菌落數/(CFU/mL)。1.5 菌種誘變流程
出發菌→超聲波處理→初篩→復篩→紫外照射→初篩→復篩→高產納豆激酶菌株
1.6 篩選方法
1.6.1 初篩
將誘變菌株和原始菌株分別培養后,用接種環點樣于脫脂牛奶初篩培養基上,于37 ℃培養18 h后,以原始菌株作為對照組,測定并計算溶解圈直徑與菌落直徑的比值,選取正突變株(即牛奶初篩平板溶解圈直徑與菌落直徑比值比對照菌株溶解圈直徑與菌落直徑比值增大10%的菌株),計算正突變率。正突變率的計算見式(2)[23]。

式中:A為點樣菌落數/(CFU/mL);B為突變株菌落數/(CFU/mL)。
1.6.2 復篩
將通過初篩方法所得到的突變菌株經種子液培養(37 ℃、150 r/min、15 h)后,按4%的接種量轉入10 mL的液體發酵培養基中,在37 ℃、150 r/min條件下搖瓶培養72 h后,分別經瓊脂糖-纖維蛋白平板測量溶解圈直徑并計算納豆激酶活力。
1.7 遺傳穩定性測定
經過初篩、復篩實驗結束后,將篩選得到的最優突變菌株進行傳代實驗,傳20 代并每隔2代進行搖床發酵實驗(37 ℃、150 r/min條件下搖瓶培養72 h),然后采用瓊脂糖-纖維蛋白平板法測定納豆激酶酶活力以考察突變菌種的遺傳穩定性。
1.8 納豆激酶活性測定
納豆激酶活性測定參照Astrup等[24]的方法,制備纖維蛋白平板并進行改進。取3 mL配制好的纖維蛋白原溶液放入長試管中于37 ℃保存備用。在直徑9 cm培養皿中,用1 000 μL的移液槍加入1 mL 20 U/mL凝血酶,再加入2 mL工作液,搖勻。將配制好的瓊脂糖溶液取10 mL加入放有纖維蛋白原溶液的試管中,搖晃幾下倒入培養皿中,按逆時針方向勻速轉圈搖晃培養皿,以確保溶液充分混合均勻,并保持無氣泡。將尿激酶標準品用生理鹽水配制成200、400、600、800、1 000 U/mL 5 個濃度梯度,分別取5 μL加入已制備好的瓊脂糖-纖維蛋白原平板中,放入恒溫培養箱中37 ℃孵育18 h,測量溶解圈垂直直徑,計算溶解圈面積。以溶解圈面積為縱坐標,酶活力為橫坐標做標準曲線。取樣品5 μL加入纖維蛋白平板中,37 ℃孵育18 h,測量溶解圈垂直直徑,根據標準曲線測定樣品酶活力。
1.9 固態發酵最佳條件確定
1.9.1 產酶條件單因素試驗
以篩選出高產納豆激酶的突變株為生產菌株,采用固態發酵方式進行發酵條件優化,包括發酵溫度、發酵時間、接種量、魔芋精粉添加量。
1.9.2 Box-Behnken響應面設計
在單因素試驗的基礎上選擇發酵溫度、發酵時間、魔芋精粉添加量作為3 個顯著影響因素,采用Box-Behnken響應面試驗設計方法,以納豆激酶酶活力為響應值對顯著因素進行優化。
2 結果與分析
2.1 超聲波誘變
任何誘變劑都具有致死和誘變的雙重效應[25],因此測定枯草芽孢桿菌經超聲波處理后的致死率曲線,以確定最佳誘變時間,根據超聲波處理后菌落生長狀況測得菌體的致死率見圖1。隨著超聲波時間的延長,枯草芽孢桿菌的致死率相應提高,當誘變時間80 min時,致死率達到91.00%,同時計算不同誘變處理下的正突變率。由圖1可知,當超聲波誘變時間在60 min時,正突變率明顯高于其他值,達到44.66%,這可能是由于誘變時間延長,超聲波對細胞的作用增加,使得突變率提高。根據致死率和突變率兩個指標,確定超聲波誘變時間為60 min。
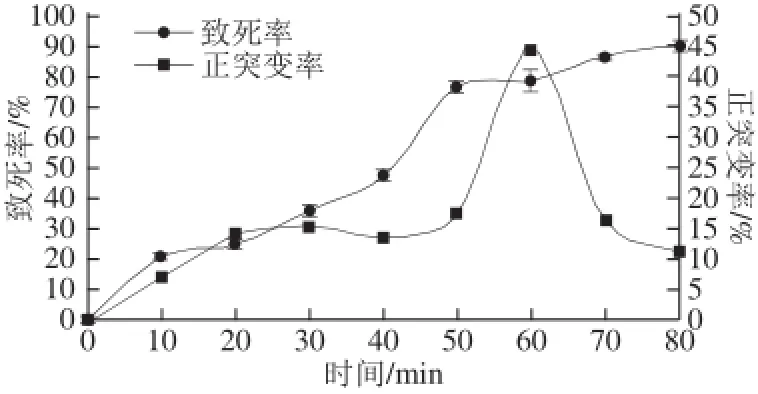
圖1 BS21076超聲波誘變致死曲線Fig.1 Death and mutation rates of BS21076 subjected to ultrasonic treatment
2.2 超聲波誘變下突變株的篩選
2.2.1 初篩
將103 株突變菌株與原始菌株點樣于牛奶初篩平板上,37 ℃培養18 h,測定并計算其溶解圈直徑與菌落直徑的比值,經過與原始菌株的比較選取正突變株,最終得到46 株。為了確保正突變株能生產高活力的納豆激酶,對46 株突變株進行復篩。
2.2.2 復篩
采用搖床發酵法并結合瓊脂糖-纖維蛋白平板法測定,將初篩得到的46 株菌株經37 ℃、150 r/min的搖瓶發酵72 h后,采用瓊脂糖-纖維蛋白平板法測定納豆激酶活力,以原始菌株的發酵液中酶活力為對照,篩選出酶活力最高的菌株,最終確定編號BSC-2菌株活力最高。
2.3 紫外誘變

圖2 BSC-2紫外誘變致死曲線Fig.2 Death and mutation rates of BSC-2 subjected to UV treatment
將篩選的突變株BSC-2進行紫外線誘變處理,結果見圖2。隨著紫外照射時間延長,致死率逐漸增大,較超聲波致死曲線相比,增加速率較為平緩。當照射時間為150 s時,致死率達到了90.31%。計算不同紫外線處理時間下正突變率,結果見圖2。120 s時正突變率為49.33%,明顯高于其他誘變劑量,故采用120 s作為紫外誘變最佳處理時間。
2.4 紫外誘變下突變株的篩選
將BSC-2經紫外誘變處理后的突變株,用接種環點樣于牛奶初篩平板上,通過與原始菌株BSC-2對比,最終從75 株突變株中篩選出37 株,然后對其進行搖瓶復篩。通過比較溶解圈直徑計算出納豆激酶酶活力,最終確定1 株產酶活力較高的菌株,編號為BSCZ-4。
2.5 遺傳穩定性
經過初篩、復篩實驗最終得到一株產酶活性較高的菌株,為了驗證突變株的遺傳穩定性,將產酶活力較高的1 株突變株BSCZ-4連續傳代20 次,采用瓊脂糖-纖維蛋白平板法每隔2 代測定其產酶活力。由圖3可知,突變株的每代產生的溶解圈直徑比較穩定,基本維持在18~19 mm之間,說明突變株BSCZ-4具有良好的遺傳穩定性,可作為優勢菌株進行后續發酵。

圖3 突變株遺傳穩定性Fig.3 Genetic stability of mutant strain BSCZ-4
2.6 固態發酵最佳工藝條件優化
2.6.1 不同發酵溫度對納豆激酶酶活性的影響
微生物在發酵過程中適宜的溫度也是保證酶活力的一個主要因素,因此研究不同發酵溫度對納豆激酶酶活力的影響,結果見圖4。發酵溫度對其產酶活力影響顯著,隨著發酵溫度的升高,所產生的納豆激酶酶活力呈現先升高后減小的趨勢。當溫度達到37 ℃時,所得到的納豆激酶酶活力達到最大,為(3 414.97±16.25) U/g。由多重比較分析結果可知,各因素間存在顯著性差異。
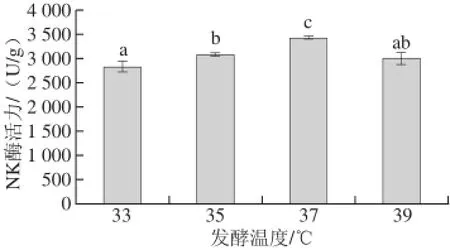
圖4 不同發酵溫度對納豆激酶酶活力的影響Fig.4 Effect of fermentation temperature on the activity of nattokinase
2.6.2 不同發酵時間對納豆激酶酶活力的影響
由圖5可知,隨著發酵時間的延長,產生的納豆激酶酶活力呈現先增大后減小的趨勢。當發酵時間為24 h時,納豆激酶酶活力明顯高于其他值,為(3 413.71±45.53) U/g。這是由于在發酵過程中,首先微生物數量不斷增長,隨后代謝產物將不斷積累。但隨著菌體的不斷衰老,其代謝產物相對比較復雜,當發酵時間繼續延長時,代謝產物酶活力有下降趨勢。

圖5 不同發酵時間對納豆激酶酶活力的影響Fig.5 Effect of fermentation time on the activity of nattokinase
2.6.3 不同接種量對納豆激酶酶活力的影響

圖6 不同接種量對納豆激酶酶活力的影響Fig.6 Effect of inoculums amount on the activity of nattokinase
由圖6可知,當接種量過低時(≤4%),納豆激酶酶活力相對較小;而當接種量過大時(10%),納豆激酶酶活力也呈現較低的趨勢。這可能是由于當接種量過低時,菌種生長繁殖相對較慢,代謝產物積累較少;而當接種量過大時,菌種繁殖快,密度過大,同時由于納豆發酵表面產生黏狀物質影響氧氣供應,使得代謝產物較少。由多重比較分析結果可知,接種量4%、6%、8%、10%各因素無顯著性差異,因此在響應面試驗中,確定接種量為4%。
2.6.4 不同魔芋精粉添加量對納豆激酶酶活力的影響
為了確保菌體生長以及積累更多的所需要的代謝產物,需要向納豆固態發酵中添加碳源。由圖7可知,當魔芋精粉添加量為4%時,納豆激酶酶活力達到最大為(3 748.43±99.28) U/g。這是由于當碳源少時,影響菌體的生長及其代謝;當碳源過量時,整個發酵體系呈現低pH值的狀態,影響代謝產物的積累。由多重比較分析結果可知,因素間存在顯著性差異。
2.6.5 Box-Behnken響應面試驗設計
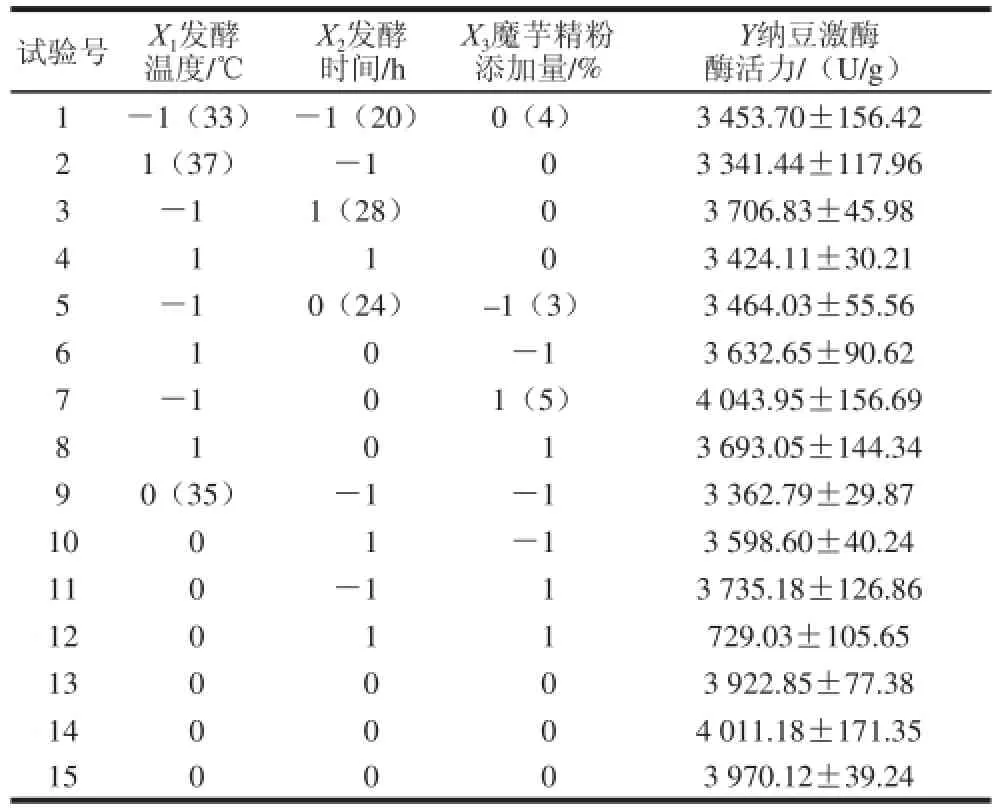
表1 Box-Behnken響應面試驗設計方案及結果Table1 Experimental design and results for Box-Behnken response surface analysis
對上述試驗結果進行二次回歸擬合,建立的回歸方程如下:


表2 二次響應面模型方差分析Table2 Analysis of variance (ANOVA) for response surface quadratic mooddeell
由表2方差分析結果可看出,模型極顯著(P=0.000 7<0.01),失擬項不顯著(P=0.405 6>0.05),說明該模型擬合程度良好,可用于納豆激酶發酵工藝條件的分析和預測。對回歸系數顯著性檢驗可知,一次項X3、二次項之間的交互作用對納豆激酶酶活力的影響極顯著,X1、X2對納豆激酶酶活力的影響顯著,而X1X2、X32、X2X3之間的交互作用對納豆激 酶酶活力的影響均不顯著。

圖8 發酵溫度與魔芋精粉添加量的交互作用對納豆激酶酶活力的影響Fig.8 Interactive effects of fermentation temperature and kjonjac powder concentration on the activity of nattokinase

圖9 發酵時間與魔芋精粉添加量的交互作用對納豆激酶酶活力的影響Fig.9 Interactive effect of fermentation time and konjac powder concentration on the activity of nattokinase
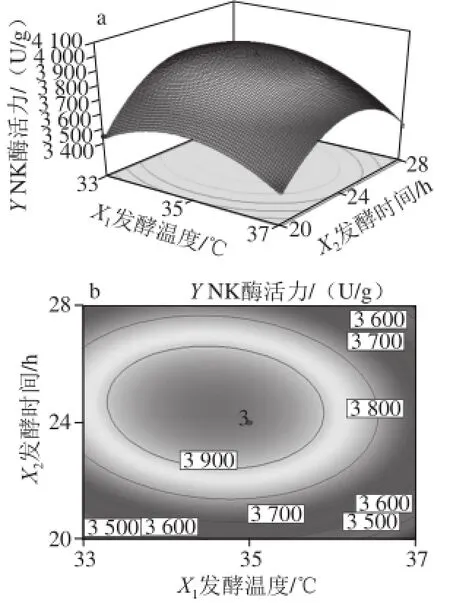
圖10 發酵溫度與發酵時間的交互作用對納豆激酶酶活力的影響Fig.10 Interactive effects of fermentation temperature and time on the activity of nattokinase
根據回歸方程得出不同因素的響應面分析圖及等高線圖結果見圖8~10。各參數間的等高線呈橢圓形,響應值存在最大值。利用Design-Expert 8.0.5.0軟件求解方程最大值,當發酵溫度為34 ℃、發酵時間為24 h、魔芋精粉添加量為5%時,納豆激酶酶活力最高為4 066.0 U/g。為了檢驗模型的準確性,在最佳發酵條件下進行發酵實驗,兩次實驗得納豆激酶酶活力平均值為(4 087.83±93.75) U/g,表明所得的模型具有一定的實驗指導意義。
3 結 論
采用超聲波與紫外線對枯草芽孢桿菌進行誘變處理,超聲波處理條件為45 kHz、280 W,處理時間60 min,紫外線處理條件為照射距離為30 cm,照射時間120 s。經平板初篩和搖床復篩,并進行遺傳穩定性實驗,最終選育出一株產納豆激酶活力較高的菌株BSCZ-4。
利用響應面設計優化了納豆固態發酵工藝條件,建立了固態發酵工藝數學模型,得到了較合適的工藝條件為發酵溫度為34 ℃、發酵時間為24 h、魔芋粉添加量為5%時,納豆激酶酶活力最高為(4 087.83±93.75) U/g。驗證實驗發酵得到的納豆激酶酶活力與模型預測值4 066.0 U/g基本一致,證明該模型的可靠性良好。
[1] SUMI H, HAMADA H, TSUSHIMA H, et al. A novel fibrinolytic enzyme (nattokinase) in the vegetable cheese natto; atypical and popular soy-bean food in the Japanese diet[J]. Experientia, 1987, 43(10): 1110-1111. DOI:10.1007/BF01956052.
[2] 布坎南R E, 吉本斯N E. 伯杰氏細菌鑒定手冊[M]. 8版. 中國科學院微生物研究所《伯杰氏細菌鑒定手冊》翻譯組, 譯. 北京: 科學出版社, 1984: 712-735.
[3] 陳建軍, 黃純純, 張巧央, 等. 微波等離子體選育高抗菌活性納豆桿菌研究[J]. 食品與發酵科技, 2012, 48(2): 20-22. DOI:10.3969/ j.issn.1674-506X.2012.02-006.
[4] 關志煒, 李志香, 孫洪濤, 等. 鹽酸羥胺和紫外線復合誘變選育納豆激酶高產菌株[J]. 食品與發酵工業, 2009, 35(6): 71-74. DOI:3995/ j.cnki.11-1802/ts.2009.06.007.
[5] HUANG S H, PAN S H, CHEN G G, et al. Biochemical characteristics of a fibrinolytic enzyme purified from a marine bacterium, Bacillus subtilis HQS-3[J]. International Journal of Biological Macromolecules, 2013, 62: 124-130. DOI:016/j.ijbiomac.2013.08.048.
[6] 李淑英, 趙仲麟, 聶瑩, 等. 納豆激酶研究進展[J]. 中國農業科技導報, 2013, 15(4): 139-143. DOI:10.3969/j.issn.1008-0864.2013.04.21.
[7] KOTB E. Fibrinolytic bacterial enzymes with thrombolytic activity[M]. New York: Springer Briefs in Microbiology, 2012: 35-43. DOI:10.1007/978-3-642-24980-8.
[8] 王常蘇, 孫曉彤, 余潔, 等. 納豆激酶高活性菌株BN-05鑒定及發酵工藝優化[J]. 中國釀造, 2014, 33(1): 91-95. DOI:10.3969/ j.issn.0254-5071.2014.01.022.
[9] 李妍, 吳慶紅, 陳義倫, 等. 一株納豆芽孢桿菌的產酶條件優化[J].食品科學, 2013, 34(3): 179-183.
[10] 董超, 史延茂, 田智斌, 等. 納豆發酵及后處理生產工藝對納豆激酶活性的影響[J]. 中國釀造, 2013, 32(5): 38-41. DOI:10.3969/ j.issn.0254-5071.2013.05.011.
[11] FUJITA M, OHNISH K, TAKAOKA S. Antihypertensive effects of continuous oral administration of nattokinase and its fragments in spontaneously hypertensive rats[J]. Biological Pharmaceutical Bulletin, 2011, 34(11): 1696-1701.
[12] KAMIYA S, HAGIMORI M, OGASAWARA M, et al. In vivo evaluation method of the effect of nattokinase on carrageenan induced tail thrombosis in a rat model[J]. Acta Haematologica, 2010, 124: 218-224. DOI:10.1159/000321518.
[13] FUJITA M, HONG K, ITO Y, et a1. Thrombolytic effect of nattokinase on a chemically induced thrombosis model in rat[J]. Biological Pharmaceutical Bulletin, 1995, 18(10): 1387-1391. DOI:10.1248/ bpb.18.1387.
[14] PYLAEV T E, KHANADEEV V A, KHLEBTSOV B N, et al. Colorimetric and dynamic light scattering detection of DNA sequences by using positively charged gold nanospheres: a comparative study with gold nanorods[J]. Nanotechnology, 2011, 22(28): 285501. DOI:10.1088/0957-4484/22/28/285501.
[15] 董超, 史延茂, 田智斌, 等. 納豆發酵及后處理生產工藝對納豆激酶活性的影響[J]. 中國釀造, 2013, 32(5): 38-41. DOI:10.3969/ j.issn.0254-5071.2013.05.011.
[16] 侯銀臣, 惠明, 杜小波, 等. 納豆發酵原料和工藝技術研究[J]. 農產品加工(學刊), 2012(11): 119-121. DOI:10.3969/j.issn.1671-9646(X).2012.11.032.
[17] 甘露, 崔松松, 倪敬田, 等. 納豆固態發酵條件優化[J]. 食品工業科技, 2013, 34(17): 210-213. DOI:10.13386/ j.issn1002-0306.2013.17.087.
[18] LI X, YANG H, ROY B, et al. Enhanced cellulase production of the Trichoderma viride mutated by microwave and ultraviolet[J]. Microbiological Research, 2010, 165(3): 190-198. DOI:10.1016/ j.micres.2009.04.001.
[19] 王成濤, 籍保平, 張麗萍. 納豆激酶高活性菌株的篩選及其發酵條件的優化[J]. 食品科學, 2004, 25(4): 71-74. DOI:10.3321/ j.issn:1002-6630.2004.04.015.
[20] 柴虹宇, 張莉力, 王玉田. 苯乳酸高產菌株的誘變育種[J]. 食品工業科技, 2010, 31(8): 154-156.
[21] 張祝蘭, 唐文力, 楊煌建, 等. UV與NTG復合誘變選育咪唑立賓高產菌[J]. 微生物學通報, 2010, 37(6): 857-860. DOI:10.13344/ j.microbiol.china.2010.06.030.
[22] 張瑩, 郭琛琛, 黑東燕, 等. 復合誘變法選育谷氨酰胺轉胺酶高產菌株[J]. 食品科學, 2014, 35(11): 139-142. DOI:10.7506/spkx1002-6630-201411028.
[23] 劉桂君, 孟佑婷, 楊素玲, 等. 枯草芽孢桿菌NCD-2 γ射線輻射誘變研究[J]. 安徽農業科學, 2011, 39(36): 22198-22200; 22273. DOI:10.13989/j.cnki.0517-6611.2011.36.212.
[24] ASTRUP T, MULLER S. The fibrin plate method for estimating fibrinolytic activity[J]. Archives of Biochemistry and Biophysics, 1995, 40: 346-351.
[25] 李麗娜, 湯華成, 于長青. 深黃被孢霉高產花生四烯酸菌株的微波誘變育種[J]. 食品與生物技術學報, 2009, 28(1): 117-119. DOI:10.3321/j.issn:1673-1689.2009.01.024.
Strain Improvement of Bacillus subtilis for Enhanced Production of Nattokinase and Optimization of Solid-State Fermentation Conditions
ZHANG Jie1, GE Wupeng1,*, CHEN Ying2, ZHANG Yue3, LIU Liting3
(1. College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China; 2. Shaanxi Bureau of Quality and Technical Supervision, Xi’an 710068, China; 3. Shaanxi Product Quality Supervision and Inspection Research Institute, Xi’an 710068, China)
In this study, the nattokinase-producing capacity of Bacillus subtilis subsp. subtilis BS21076 was improved by sequential mutagenization with ultrasonic followed by UV light at the appropriate doses determined according to death and mutation rates. The optimal mutation conditions of strain BS21076 were established as 60 min ultrasonic treatment at 45 kHz and 280 W followed by 120 s UV irradiation at a distance of 30 cm. A high nattokinase-producing mutant strain named BSCZ-4, producing 1.96 times higher nattokinase than BS21076, was obtained after several rounds of primary and secondary screening. After 20 consecutive passages, the diameter of the zone of dissolution produced by BSCZ-4 remained stable in the range of 18–19 mm, suggesting good genetic stability. Using Box-Behnken response surface methodology, the optimal culture conditions for the enhanced production of nattokinase by BSCZ-4 in solid-state fermentation were determined as addition of 5% konjac power to the culture medium, an inoculum size of 8%, and 24 h culture at 34 ℃, resulting in a nattokinase activity of (4 087.83 ± 93.75) U/g.
mutation; Bacillus subtilis; response surface methodology; process
10.7506/spkx1002-6630-201603028
TS201.3
A
1002-6630(2016)03-0151-06
張杰, 葛武鵬, 陳瑛, 等. 納豆激酶高產菌株的選育及固態發酵技術[J]. 食品科學, 2016, 37(3): 151-156. DOI:10.7506/ spkx1002-6630-201603028. http://www.spkx.net.cn
ZHANG Jie, GE Wupeng, CHEN Ying, et al. Strain improvement of Bacillus subtilis for enhanced production of nattokinase and optimization of solid-state fermentation conditions[J]. Food Science, 2016, 37(3): 151-156. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201603028. http://www.spkx.net.cn
2015-03-19
國家重點星火計劃項目(2013GA850003)
張杰(1989—),女,碩士研究生,研究方向為生物技術。E-mail:zjzj89zjzj@163.com
*通信作者:葛武鵬(1965—),男,副教授,博士,研究方向為乳品科學及生物技術。E-mail:josephge@sina.com

