過渡金屬離子摻雜四氧化三錳納米催化劑*
王宏磊,許雪棠,王 凡
(廣西大學化學化工學院,廣西南寧530004)
過渡金屬離子摻雜四氧化三錳納米催化劑*
王宏磊,許雪棠,王 凡
(廣西大學化學化工學院,廣西南寧530004)
以高錳酸鉀和葡萄糖為原料,通過水熱反應制備了四氧化三錳納米晶顆粒,探討了過渡金屬離子摻雜的影響,并考察制備的產物作為催化劑在催化一氧化碳氧化反應中的性能。采用X射線衍射(XRD)、掃描電鏡(SEM)、透射電鏡(TEM)、X射線光電子能譜(XPS)、氫氣程序升溫還原(H2-TPR)等手段對產物進行結構表征。結果表明,過渡金屬離子摻雜可消除產物中的MnOOH雜相。制備的產物具有八面體形貌,尺寸隨摻雜離子的變化而變化。摻雜還可以提高四氧化三錳納米晶催化一氧化碳氧化反應的活性,呈現摻雜效應。
四氧化三錳;摻雜效應;水熱合成;催化性能;一氧化碳氧化
Mn3O4是Mn的穩定氧化物之一,廣泛應用于催化、電極材料、磁性材料等領域。Mn3O4離子結構一般認為是[Mn2+(Mn3+)2O4],Mn(Ⅱ)和Mn(Ⅲ)離子分別位于氧四面體和氧八面體空隙。Mn3O4可通過對低價錳鹽氧化或對高價錳鹽(KMnO4)還原來制備。KMnO4中Mn元素處于最高氧化態,具有高氧化能力,為控制錳的還原價態,需要合理選擇還原劑種類以及反應條件。湯林等[1]利用乙醇為還原劑,KMnO4為錳源,在水熱條件下制備出Mn3O4超細粉末。在180℃時,隨著反應的進行,產物結晶度提高,顆粒逐漸長大。此外,KMnO4濃度可影響產物尺寸和團聚程度,濃度越高產物顆粒尺寸越大,團聚程度也越大。Zhang等[2]研究了醇類還原劑結構對還原產物的影響。當KMnO4與CH3OH反應時,只需80℃、48 h的水熱條件就可制備出純相Mn3O4納米晶體;而KMnO4與CH3CH2OH反應時,要制備出純相Mn3O4納米晶體,需100℃、15 h。多元醇還原能力更強,對反應體系壓力變化影響更小,更有利于控制反應。筆者以葡萄糖為還原劑,在水熱條件下合成了Mn3O4八面體納米晶,研究了過渡金屬離子(Co2+、Ni2+)摻雜對納米晶晶相及催化性能的影響。結果表明,過渡金屬離子的引入可有效提高CO氧化催化性能。
1 實驗方法
1.1 制備方法
實驗試劑均為分析純。稱取0.36 g KMnO4溶于15 mL去離子水中,磁力攪拌溶解,再分批次加入0.10 g葡萄糖,繼續攪拌90 min直至溶液轉變為棕色懸濁液。將懸濁液轉移至20 mL含聚四氟乙烯內襯的不銹鋼高壓水熱釜中,180℃恒溫反應。為研究過渡金屬離子對Mn3O4納米晶的影響,在水熱處理前預先加入Co2+、Ni2+的硫酸鹽于溶液中。過渡金屬與Mn的物質的量比為0.05。水熱反應結束后,反應釜自然冷卻至室溫。將沉淀離心分離,用去離子水和無水乙醇洗滌2~3次,60℃干燥6 h。
1.2 樣品表征和性能測試
采用掃描電鏡(SEM,S-3400N)、透射電鏡(TEM,JEM-2100F)、X射線衍射(XRD,Rigaku D/max-RB)、X射線光電子能譜 (XPS,Axis Ultra,Kratos)、BET比表面分析(Quantachrome Autosorb-1)、H2程序升溫還原(H2-TPR)等手段對產物進行表征。Mn3O4納米晶催化劑對CO氧化反應的活性評價在常壓固定床反應器中進行。反應氣氛為CO和O2,采用N2為平衡氣,V(CO)∶V(O2)∶V(N2)=1∶10∶89,反應空速為24 000 mL/(g·h),氣體總流量為20 mL/min。反應后氣體用氣相色譜(GC7890Ⅱ)分析。
2 結果與討論
2.1 XRD分析
KMnO4與葡萄糖的反應為多步反應。圖1為KMnO4還原產物XRD譜圖。室溫下,KMnO4快速氧化葡萄糖,形成無定型錳氧化物沉淀(圖1a)。圖1b為180℃水熱產物XRD譜圖,通過分析衍射峰可以確認,產物中含有MnOOH(JCPDS 41-1379)、Mn3O4(JCPDS 80-0382)和MnCO3(JCPDS 44-1472)3種成分,其中Mn3O4為主要成分。在水熱條件下,體系中糖類物質還原能力增強,無定型錳氧化物沉淀被還原為Mn(Ⅲ)化合物。水溶劑誘導了MnOOH形成,并防止產物轉變為Mn2O3。隨后,部分MnOOH被進一步還原,生成Mn(Ⅱ)離子,從而形成具有混合價態的Mn3O4。隨著氧化還原反應進行,葡萄糖碳鏈被逐漸打斷,還原產物中碳酸根數量增多,使得MnCO3沉淀生成趨勢增大。Mn3O4與MnCO3沉淀都需要Mn(Ⅱ)離子參與,因此這兩種沉淀的生長存在著相互制約關系。當反應時間延長至12 h時,MnOOH衍射峰已消失,MnCO3衍射峰強度增大,此時產物轉變為兩相混合物(圖1c)。Mn(Ⅱ)與Mn(Ⅲ)離子共存是獲得Mn3O4的關鍵,但Mn(Ⅱ)離子濃度隨反應過程而變化,并傾向于與前期生成的碳酸根形成沉淀,因此在水熱條件下難以獲得Mn3O4純相。
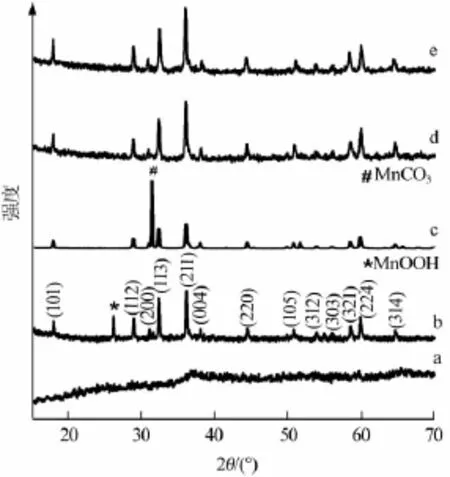
圖1 KMnO4還原產物XRD譜圖
在水熱還原KMnO4過程中,添加少量其他二價金屬離子,可以加快Mn3O4晶核形成,抑制MnCO3和MnOOH相生長。圖1d、e分別是在水熱體系中加入Co2+、Ni2+硫酸鹽后所得產物XRD譜圖。產物主要衍射峰歸屬Mn3O4衍射峰,沒有出現明顯MnOOH和MnCO3衍射峰,說明產物為Mn3O4純相。Mn2+(離子半徑為0.080 nm)和Co2+(離子半徑為0.074 nm)、Ni2+(離子半徑為0.069 nm)具有相同的價態,外來金屬離子可能以置換Mn2+方式進入晶格,生成摻雜Mn3O4晶體。經過Co2+和Ni2+摻雜,Mn3O4晶胞體積從0.31532nm3分別下降到0.31364nm3和0.31256nm3。摻雜樣品衍射峰相對強度沒有發生明顯變化,說明Mn3O4晶體生長方式不受外來離子影響。
2.2 XPS分析
圖2為Mn3O4納米晶摻雜Co2+、Ni2+前后XPS圖。Mn3O4的Mn 2p3/2和Mn 2p1/2結合能分別為641.3 eV和652.9 eV,結合能差值為自旋軌道分裂能,其數值為11.6 eV,與文獻報道相符[3]。Co2+和Ni2+摻雜使Mn平均價態略有升高,Mn 2p3/2峰向高結合能方向移動,其中Ni/Mn3O4的Mn 2p3/2峰移動了約0.5 eV。O 1s的XPS圖可以拆分為3個高斯函數峰,結合能在529~530 eV處的峰是由表面晶格氧產生,在531.0 eV處的峰是由表面化學吸附氧產生(如O22-、O-、—OH、CO32-等),在534 eV處還存在著表面吸附水的峰。從圖2b可知,3種物質均在529.8 eV處出現主峰,并且在531.0 eV處伴隨肩峰。隨著外來離子的引入,表面吸附氧數量增加。Ni/Mn3O4的表面化學吸附氧和表面晶格氧的峰面積相等,說明其表面結構已經發生了較大變化。
Co離子和Ni離子的氧化態也可以通過XPS來確定。在Co能譜區域,Co 2p3/2和Co 2p1/2峰分別位于780.6 eV和796.6 eV。2p1/2與2p3/2的峰間距為16 eV,說明Co離子主要以Co(Ⅱ)形式存在于化合物中[4]。在Ni能譜區域,Ni 2p3/2和Ni 2p1/2兩個主峰分別位于855.8 eV和873.4 eV,能量間隔為17.6 eV,每個主峰都有衛星峰,分別位于879.6eV和861.5eV,說明Ni離子也主要以Ni(Ⅱ)的形式存在于化合物中[5]。根據XPS結果計算,在Co/Mn3O4中n(Co)/ n(Mn)約為0.05,說明Co(Ⅱ)離子能完全進入尖晶石內的四面體空隙中,晶體體相和表面具有相同的組成。在Ni/Mn3O4中,n(Ni)/n(Mn)約為0.151,說明在產物顆粒表面有較高含量的Ni(Ⅱ)化合物存在。Mn2+和Ni2+的離子半徑相差較大,因此Ni2+的晶格取代效率較低。從XRD譜圖中未能觀察到Ni相關化合物衍射峰,說明未摻雜進入晶格的Ni化合物主要以小尺寸顆粒的形式附著在Mn3O4晶體表面。
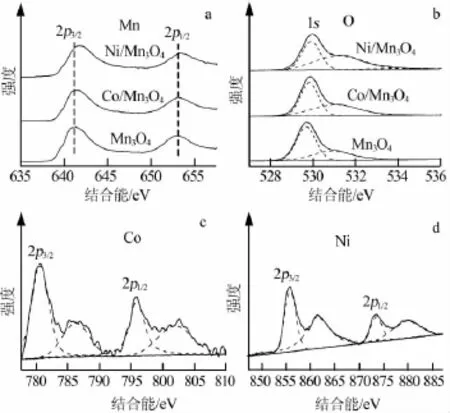
圖2 Mn3O4納米晶摻雜Co2+、Ni2+前后XPS圖
2.3 SEM和TEM分析
圖3a~c為摻雜Co2+、Ni2+前后Mn3O4產物SEM照片。3種產物均呈現近八面體微晶形貌,表明在水熱反應條件下八面體構型是Mn3O4熱力學穩定構型。未摻雜Mn3O4微晶尺寸分布較大,為50~100 nm(圖3a),產物中可發現納米棒結構。過渡金屬離子摻雜有效改善了納米晶尺寸分布,Co/Mn3O4和Ni/Mn3O4納米晶尺寸約為50 nm和80 nm(圖3b~c)。圖3d~f為摻雜Co2+、Ni2+前后Mn3O4產物TEM照片。3種樣品均為近八面體構型,但形貌有差異。未摻雜樣品末端為尖角構型,表面有少量絮狀物質(圖3d)。Co/Mn3O4具有較小微晶尺寸,末端多為截面結構(圖3e)。Ni/Mn3O4具有變形八面體形貌和較大尺寸,納米晶表面不光滑(圖3f),說明Mn3O4納米晶表面構造因Ni2+引入發生了改變,與XPS測試結果相符。Co/Mn3O4盡管具有較小尺寸,但其比表面積(21.7 m2/g)與未摻雜樣品比表面積(21.4 m2/g)差異很小,這可能是未摻雜樣品中絮狀物質所致。較大尺寸Ni/Mn3O4比表面積最小,為17.9 m2/g。因此,摻雜離子可用于調節Mn3O4納米晶組成、形貌及尺寸。

圖3 Mn3O4納米晶摻雜Co2+、Ni2+前后SEM照片和TEM照片
2.4 H2-TPR分析
Mn3O4在較低溫度下對CO氧化消除反應催化性能較差。采用沉淀法制備的Mn3O4納米立方體催化劑可在240℃使CO完全氧化為CO2[6]。貴金屬負載催化劑可以實現低溫下高催化活性,但其成本高。具有微孔結構的錳氧化物催化劑比表面積大,催化性能好,但制備成本也較高[7]。摻雜是增強催化劑性能的有效辦法。通過離子摻雜,催化劑晶格內的化學鍵能和鍵長發生變化,表面氧遷移能力增強,提高了其表面的催化活性[8]。筆者采用過渡金屬離子摻雜來提高Mn3O4納米晶催化活性。摻雜Co2+、Ni2+前后Mn3O4納米晶H2-TPR實驗結果見圖4。Mn3O4納米晶在250~300℃和350~490℃有兩個還原峰。第一個峰對應MnOOH還原為Mn3O4,第二個峰對應Mn3O4還原為MnO[9]。Co/Mn3O4和Ni/Mn3O4納米晶,第一個還原峰基本消失,說明樣品中MnOOH組分含量很低,與XRD結果相符;第二個還原峰位置向低溫區域移動,說明其還原能力增強。過渡金屬離子在晶格內形成M—O—Mn鍵是還原性增強的主要原因。Co和Ni元素具有較大電負性,可促進電子離域行為,弱化Mn—O鍵,造成錳氧化物還原溫度下降,催化活性提高。Co/Mn3O4納米晶在420℃附近還出現一個肩峰,這是Co2+還原為Co的標志。
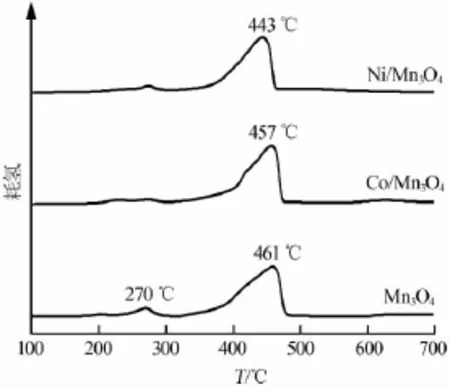
圖4 Mn3O4納米晶摻雜Co2+、Ni2+前后H2-TPR圖
2.5 活性評價
圖5為摻雜Co2+、Ni2+前后Mn3O4納米晶及商業Mn3O4粉末對CO氧化反應催化活性比較。商業Mn3O4粉末對CO氧化反應催化活性非常差,200℃以下CO轉化率僅為7%。Mn3O4納米晶催化活性明顯提高,200℃時CO轉化率為63%,完全轉化溫度為240℃,與文獻[9]一致,說明較小微晶尺寸可以提供較多活性表面,提高催化性能。Co/Mn3O4和Ni/ Mn3O4納米晶催化劑完全轉變溫度分別為170℃和140℃,說明過渡金屬離子摻雜可以進一步提高Mn3O4納米晶的催化性能,呈現出明顯的摻雜效應。
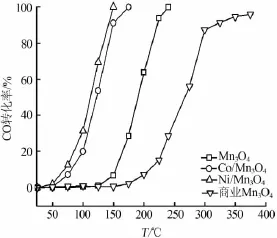
圖5 摻雜CO2+、Ni2+前后Mn3O4納米晶及商業Mn3O4粉末對CO氧化反應催化活性比較
CO在金屬氧化物或者混合氧化物上的反應一般遵從Mars-van Krevelen機理,也被叫做氧化-還原機理。該機理認為CO分子首先吸附到催化劑表面并被活化,然后與催化劑表面晶格氧發生反應。氣相中分子氧也可以吸附到催化劑表面成為表面晶格氧。在3種納米晶催化劑中,Ni/Mn3O4納米晶比表面積較小,但催化活性最優,說明比表面積不是催化活性決定因素。與Mn—O相比,Co—O鍵能較小,能在催化反應過程中提供更多表面活性氧數量,增強Co/Mn3O4納米晶催化活性[10]。對應Ni/Mn3O4納米晶,表面吸附氧數量較多,在催化過程中表面再氧化過程容易進行,使Ni/Mn3O4納米晶呈現出更優的催化性能[11]。
3 結論
以高錳酸鉀和葡萄糖為原料,在水熱條件下合成了Mn3O4納米晶。Co2+、Ni2+摻雜可有效抑制產物中MnOOH和MnCO3生成。納米晶呈八面體形貌,尺寸為50~100 nm。納米晶尺寸和形貌隨摻雜離子的差異而變化。摻雜金屬離子可以有效增強Mn3O4納米晶對CO氧化消除反應的催化性能。未摻雜Mn3O4納米晶在240℃可使CO完全轉化為CO2,Co/Mn3O4和Ni/Mn3O4納米晶催化劑完全轉變溫度為170℃和140℃,呈現明顯的摻雜效應。催化活性增強可歸結于表面氧活性的增強及表面吸附氧數量的增加。
[1] 湯林,陳權啟,黃可龍.水熱法四氧化三錳超細粉體的研制與表征[J].礦冶工程,2003,23(2):63-65.
[2]Zhang W,Yang Z,Liu Y,et al.Controlled synthesis of Mn3O4nanocrystallites and MnOOH nanorods by a solvothermal method[J].J. Cryst.Growth,2004,263(1):394-399.
[3]Davar F.Thermal decomposition route for synthesis of Mn3O4nanoparticles in presence of a novel precursor[J].Polyhedron,2010,29(7):1747-1753.
[4]Yang H,Ouyang J,Tang A.Single step synthesis of high-purity CoO nanocrystals[J].J.Phys.Chem.B,2007,111(28):8006-8013.
[5]Liu F.Segmented Pt/Ru,Pt/Ni,and Pt/RuNinanorods as model bifunctional catalysts for methanol oxidation[J].Small,2006,2(1): 121-128.
[6]Zhang J,Du J,Wang H,et al.A novel mild route to hausmannite Mn3O4nanocubes at room temperature and its catalytic performance[J].Mater.Lett.,2011,65(17):2565-2567.
[7]Poyraz A S.Crystalline mesoporous K2-xMn8O16and ε-MnO2by mild transformations of amorphous mesoporous manganese oxides and their enhanced redox properties[J].ACS Appl.Mater.Inter.,2014,6(14):10986-10991.
[8]McFarl E W,Metiu H.Catalysis by doped oxides[J].Chem.Rev.,2013,113(6):4391-4427.
[9]Kim S C.Catalytic combustion of VOCs over a series of manganese
oxide catalysts[J].Appl.Catal.B:Environ.,2010,98(3/4):180-185.
[10]Liu Y X,Dai H X,Deng J G,et al.Controlled generation of uniform spherical LaMnO3,LaCoO3,Mn2O3,and Co3O4nanoparticles and their high catalytic performance for carbon monoxide and toluene oxidation[J].Inorg.Chem.,2013,52(15):8665-8676.
[11]Laberty C.CO oxidation over nonstoichiometric nickel manganite
spinels[J].J.Catal.,2001,198(2):266-276.
Transition metal cation doped Mn3O4nanocatalysts
Wang Honglei,Xu Xuetang,Wang Fan
(School of Chemistry and Chemical Engineering,Guangxi University,Nanning 530004,China)
Pristine and transition metal doped Mn3O4nanocrystals were prepared by a hydrothermal method using KMnO4and glucose as raw materials.The obtained samples were characterized by X-ray diffraction(XRD),scanning electron microscopy(SEM),transmission electron microscopy(TEM),X-ray photoelectron spectroscopy(XPS),and H2-temperature-programmed reduction(H2-TPR),and their catalytic activities on CO oxidation were also studied.The results showed that Mn3O4nanocrystals were formed with the elimination of MnOOH impurity phase by doping with transition metal cations.The obtained particles were shaped in octahedron with various sizes according to the doping cations.The catalytic activities of doped Mn3O4nanocrystals on CO oxidation were greatly enhanced by comparing with pristine Mn3O4,demonstrating the doping effect on nanocatalysts.
Mn3O4;doping effect;hydrothermal synthesis;catalytic properties;CO oxidation
TQ137.12
A
1006-4990(2016)09-0079-04
2016-03-16
王宏磊(1989— ),男,在讀碩士研究生,從事金屬氧化物功能材料的研究。
王凡,教授。
國家自然科學基金項目(21163001)。
聯系方式:fanwang@gxu.edu.cn

