廣棗黃酮清除自由基能力及抗氧化性能的細胞模型法評價
楊云舒,姜子濤*,李 榮
(天津商業大學生物技術與食品科學學院,天津市食品生物技術重點實驗室,天津 300134)
廣棗黃酮清除自由基能力及抗氧化性能的細胞模型法評價
楊云舒,姜子濤*,李 榮
(天津商業大學生物技術與食品科學學院,天津市食品生物技術重點實驗室,天津 300134)
利用制備色譜將廣棗黃酮分離成F1和F2兩個組分。分別測定廣棗黃酮、F1和F2的總抗氧化能力、清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、羥自由基(·OH)以及超氧陰離子自由基(O2-·)的能力,并與常見的抗氧化劑VC進行對比。結果表明:廣棗黃酮具有良好的抗氧化效果,總黃酮的抗氧化能力介于F1和F2之間;F1對DPPH自由基的清除能力以及F1和F2對·OH的清除能力均高于VC,而在總抗氧化能力以及清除O2-·方面F1和F2的效果均弱于VC。另外,細胞模型法評價結果顯示,廣棗黃酮可清除小鼠巨噬細胞RAW264.7內的活性氧,表現出明顯的抗氧化活性。
廣棗黃酮;總抗氧化能力;自由基清除活性;細胞抗氧化活性;小鼠巨噬細胞RAW264.7
漆樹科植物南酸棗(Choerospondias axillaris (Roxb.)Burtt et Hill)在我國分布廣泛,其干燥果實稱為廣棗[1]。由于廣棗對抗心律失常、改善心肌缺血具有明顯的效果,因此在臨床上常被用于治療心血管疾病[2-6],含廣棗的制劑占蒙成藥總方劑的10%[7]。目前已有的研究表明,廣棗中含有黃酮類化合物、脂肪酸、甾醇、氨基酸以及多種無機鹽成分[8-14]。其中,黃酮類物質被認為是主要的抗氧化活性成分[15]。郭英等[16]發現廣棗提取物對于活性氧(reactive oxygen species,ROS)自由基有較強的體外清除能力。包保全等[17]通過觀察廣棗總黃酮對乳鼠心肌細胞中乳酸脫氫酶和脂質過氧化物的影響,證明了廣棗總黃酮可以通過清除自由基對氧合血紅蛋白產生保護作用。細胞模型法是一種新型的抗氧化活性評價方法,與化學法相比,細胞模型法具有更好的生物相關性,能夠更加準確地預測活性物質在人體內的抗氧化活性,但目前對于廣棗黃酮的研究還極少涉及細胞抗氧化活性的評價[18]。
本課題組在前期的實驗中,將提取得到的廣棗黃酮經制備色譜分離純化,得到了極性不同的兩個組分——F1和F2[19],本實驗擬對廣棗總黃酮及兩個分離組分分別進行抗氧化活性和清除自由基能力的研究,并與常用抗氧化劑VC進行對比。同時采用細胞模型法研究廣棗黃酮在小鼠巨噬細胞中的抗氧化能力,為今后廣棗黃酮的開發應用以及進一步的成分分析和構效關系的研究奠定基礎。
1 材料與方法
1.1 材料與試劑
廣棗,產地西藏昌都。按照文獻[19]方法提取廣棗黃酮,并通過制備色譜將黃酮分為F1和F2兩個組分,并分別溶解于30%的乙醇溶液中,配制成1.0 mg/mL的貯備液。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美國Sigma公司;小鼠巨噬細胞RAW264.7 江蘇齊氏生物科技有限公司;胎牛血清(fetal bovine serum,FBS) 美國Gibco公司;四甲基偶氮唑藍(methyl thiazolyl tetrazolium,MTT)中國醫學科學院血液學研究所科技公司;DMEM高糖培養基 美國HyClone公司;2',7'-二氫二氯熒光黃雙乙酸鈉(dichloro-dihydro-fluorescein diacetate,DCFH-DA)熒光探針 江蘇碧云天生物技術研究所;無水乙醇等其他試劑均為分析純。
1.2 儀器與設備
SpectraMax M5多功能讀板機 美國Molecular Devices公司;Agilent 1260系列高效液相色譜儀 美國安捷倫公司;U-3900紫外-可見分光光度計 日本日立公司;HERAcell 240i CO2培養箱 美國Thermo公司;Alpha-1500紫外-可見分光光度計 上海譜元儀器有限公司;DS-5MC倒置顯微鏡 日本Nikon公司。
1.3 方法
1.3.1 磷鉬絡合物法測定總抗氧化活性
依據文獻[20-21]的方法,用蒸餾水液稀釋得到質量濃度分別為0.10、0.15、0.20、0.25、0.30 mg/mL的F1、F2、廣棗總黃酮樣品液和VC溶液。在一系列具塞試管中分別加入4.0 mL磷鉬試劑(終濃度為0.6 mol/L硫酸、4.0 mmol/L鉬酸銨和28.0 mmol/L磷酸鈉)和0.4 mL樣品液,迅速搖勻,將試管在95 ℃條件下恒溫水浴90 min,在695 nm波長處測定吸光度(A695nm),平行測定3 次,取平均值。
1.3.2 清除DPPH自由基能力的測定
依據文獻[22]的方法,用蒸餾水稀釋得到質量濃度分別為0.01、0.05、0.10 mg/mL的F1、F2、總黃酮樣品液和VC溶液。在具塞試管中加入濃度為1.0×10-4mol/L的DPPH溶液3.5 mL和無水乙醇0.5 mL,避光靜置30 min,測定其在517 nm波長處的吸光度A1;在具塞試管中加入1.0×10-4mol/L的DPPH溶液3.5 mL和樣品液0.5 mL混合,避光靜置30 min,測定其在517 nm波長處的吸光度A;取3.5 mL無水乙醇與0.5 mL樣品液混合,測定其在517 nm波長處的吸光度A0,同時以3.5 mL無水乙醇和0.5 mL蒸餾水的混合液作為空白。平行測定3 次,取平均值。按照公式(1)計算DPPH自由基清除率。
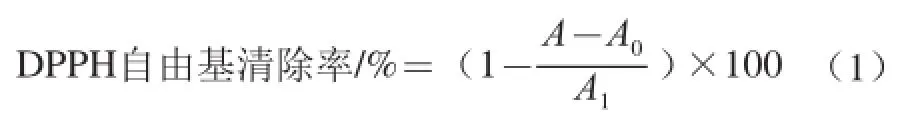
1.3.3 清除羥自由基(·OH)能力的測定
依據文獻[23-24]的方法,采用結晶紫法對樣品清除·OH的能力進行測定:將儲備液稀釋,配制成0.1 mg/mL的F1、F2、總黃酮樣品液和VC溶液。在一系列10 mL具塞試管中先后加入0.4 mmol/L結晶紫0.3 mL、pH 4.0磷酸氫二鉀-檸檬酸緩沖液(磷酸氫二鉀濃度為0.2 mol/L、檸檬酸濃度為0.1 mol/L)3.0 mL、15.0 mmol/L的FeSO4溶液2.5 mL和20.0 mmol/L的H2O2溶液2.0 mL,用緩沖液定容至10 mL并搖勻,放置30 min,測定其在580 nm波長處的吸光度A0;同時測定不加H2O2時的吸光度,記為Ab;在加入H2O2前分別加入0.2、0.6、1.0 mL的樣品液,測定其在580 nm波長處的吸光度,記為Ax,同時以30%乙醇溶液為空白。平行測定3 次,取平均值。按照公式(2)計算·OH清除率。
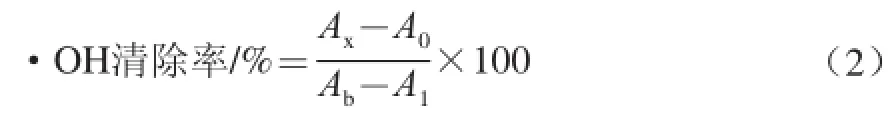
1.3.4 清除超氧陰離子自由基(O2-·)能力的測定[25-26]
1.3.4.1 最大吸收波長的確定
向試管中加入pH 8.2的Tris-HCl(濃度為0.05 mol/L)緩沖液4.5 mL和蒸餾水4.0 mL,在37 ℃條件下恒溫水浴20 min,立即加入3.0 mmol/L的鄰苯三酚(已在相同條件下預熱)0.5 mL,迅速搖勻,在2~16 min內每隔2 min于250~500 nm波長范圍內進行全波長掃描,確定其最大吸收波長。
1.3.4.2 鄰苯三酚自氧化速率的測定
將按照1.3.4.1節混合的溶液在320 nm波長處測定吸光度,以10.0 mmol/L HCl為參比,在2~6 min內每1 min記錄一次吸光度,將測定值進行線性回歸,得到其斜率k0。
1.3.4.3 樣品液對O2-·清除率的測定
用蒸餾水稀釋得到質量濃度分別為0.01、0.05、0.10 mg/mL的F1、F2、總黃酮樣品液和VC溶液。向具塞試管中加入pH 8.2的Tris-HCl(濃度為0.05 mol/L)緩沖溶液4.5 mL、樣品液1.5 mL和蒸餾水2.5 mL,在37 ℃條件下恒溫水浴20 min,立即加入3.0 mmol/L的鄰苯三酚(已在相同條件下預熱)0.5 mL,迅速搖勻,在320 nm波長處以10.0 mmol/L HCl溶液為參比,在2~6 min內每1 min記錄一次吸光度,進行線性回歸得到斜率ks。所有實驗均平行測定3 次,取平均值。根據公式(3)計算O2-·清除率。

1.3.5 細胞內抗氧化活性(cellular antioxidant activity,CAA)的測定
1.3.5.1 細胞毒性實驗
適當改進文獻[27]的方法,用于測定廣棗總黃酮、F1和F2對小鼠巨噬細胞RAW264.7的毒性作用。將處于對數生長期的RAW264.7細胞以每孔100 μL的接種量接種于96 孔板中,每孔細胞數約為1×105個,于37 ℃、5% CO2培養箱中孵育,使細胞貼壁生長。培養24 h后吸去培養液并用磷酸鹽緩沖液(phosphate buffered saline,PBS)清洗,實驗組每孔中加入100 μL不同質量濃度(1.0、100.0、500.0 μg/mL)的廣棗總黃酮、F1和F2溶液培養24 h,每個質量濃度設6 個復孔。小心吸棄培養液并用PBS清洗,加入20 μL 5 mg/mL的MTT溶液繼續培養4 h。吸去MTT溶液,加入150 μL二甲基亞砜(dimethyl sulfoxide,DMSO)溶液,低速振蕩至結晶物溶解,于570 nm波長處測定每孔吸光度。空白組不接種細胞,只用培養液處理;對照組接種細胞,以培養液代替樣品溶液。按照公式(4)計算細胞存活率。
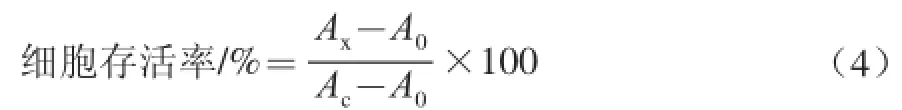
式中:Ax、Ac、A0分別為實驗組、對照組、空白組在570 nm波長處的吸光度。
1.3.5.2 細胞內熒光強度的測定
根據Qian Zhongji[28]和Yang Lichen[29]等的方法并進行適當改進,測定廣棗總黃酮、F1和F2在小鼠巨噬細胞RAW264.7內的抗氧化活性。按照1.3.5.1節條件接種細胞,培養24 h后小心吸棄培養液并用PBS清洗,每孔加入廣棗總黃酮、F1和F2溶液(100.0 μg/mL)和DCFH-DA探針溶液(10.0 μmol/L)各100 μL,每個質量濃度設6 個復孔。培養30 min后用PBS清洗兩次,加入100 μL的H2O2溶液(100.0 μmol/L)。在1 h內每5 min測定一次熒光強度,測定條件為:激發波長488 nm,發射波長525 nm。空白組只用DCFH-DA探針和培養液處理,不加入樣品溶液和H2O2。對照組用DCFH-DA和H2O2處理,以培養液代替樣品溶液。
1.3.5.3 CAA的計算
對1.3.5.2節得到的熒光強度-時間曲線進行積分,按照公式(5)計算CAA。

式中:∫SA為實驗組熒光強度-時間曲線積分面積;∫CA為對照組熒光強度-時間曲線積分面積。
2 結果與分析
2.1 廣棗總黃酮及F1、F2的總抗氧化活性

磷鉬絡合物法測定總抗氧化活性的原理是抗氧化物質可將Mo6+還原為綠色的Mo5+絡合物,因此吸光度大小與抗氧化物質的活性成正相關[30]。由圖1可知,廣棗總黃酮及F1、F2的抗氧化活性均隨質量濃度的增大而增強,F2組分的抗氧化活性整體高于F1組分和廣棗總黃酮,但隨著質量濃度的增大,三者之間的差距逐漸減小;在0.1 mg/mL時,F2的抗氧化活性與VC基本相當,即在低質量濃度時F2有較強的抗氧化活性。
2.2 廣棗總黃酮及F1、F2清除DPPH自由基的能力
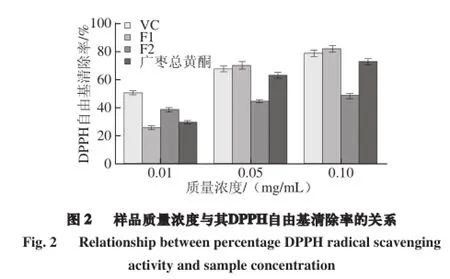
當DPPH自由基中的孤對電子與自由基清除劑配對時,自由基被還原為非自由基形式,表現為在517 nm波長處的吸收減弱,其褪色程度與自由基清除劑的活性相關[31]。由圖2可知,在0.01 mg/mL時,VC具有較好的清除DPPH自由基的能力,其DPPH自由基清除率高于3 種樣品,而F2的DPPH自由基清除率高于F1和廣棗總黃酮;在0.2、0.3 mg/mL時,廣棗總黃酮的DPPH自由基清除率與VC相當,而F1的DPPH自由基清除率略高于VC,表明F1在高質量濃度時有較強的清除DPPH自由基的能力。
2.3 廣棗總黃酮及F1、F2清除·OH的能力
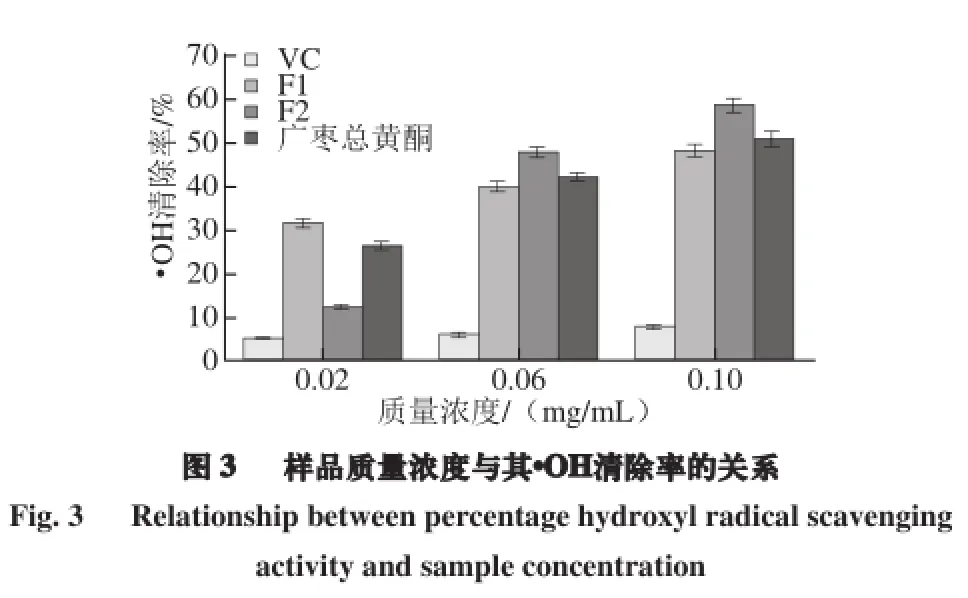
·OH是活性氧的一種,會加速機體老化,并且是許多疾病產生的誘因[32]。H2O2與Fe2+反應·OH,·OH進攻較高電子云密度的乙烯基基團使結晶紫發生褪色,而抗氧化劑的加入能夠清除·OH,從而使體系的吸光度升高[23]。由圖3可知,在0.02、0.06、0.1 mg/mL時,3 種樣品對·OH的清除能力均遠高于VC,且終質量濃度僅為0.1 mg/mL時,各樣品的·OH清除率均接近或達到50%,是同質量濃度下VC對·OH清除率的6~7 倍,顯著高于Wang Hua等[33]的研究結果;在0.02 mg/mL時,F1的清除效果要好于F2和廣棗總黃酮,隨著質量濃度的增大,F2的·OH清除率迅速增長,反而高于F1和廣棗總黃酮。
2.4 廣棗總黃酮及F1、F2清除O2-·的能力

由圖4可知,隨著時間的延長,鄰苯三酚自氧化體系的吸光度不斷升高,在2~6 min內持續增長,結合吸光度最大值,選擇320 nm為檢測波長。
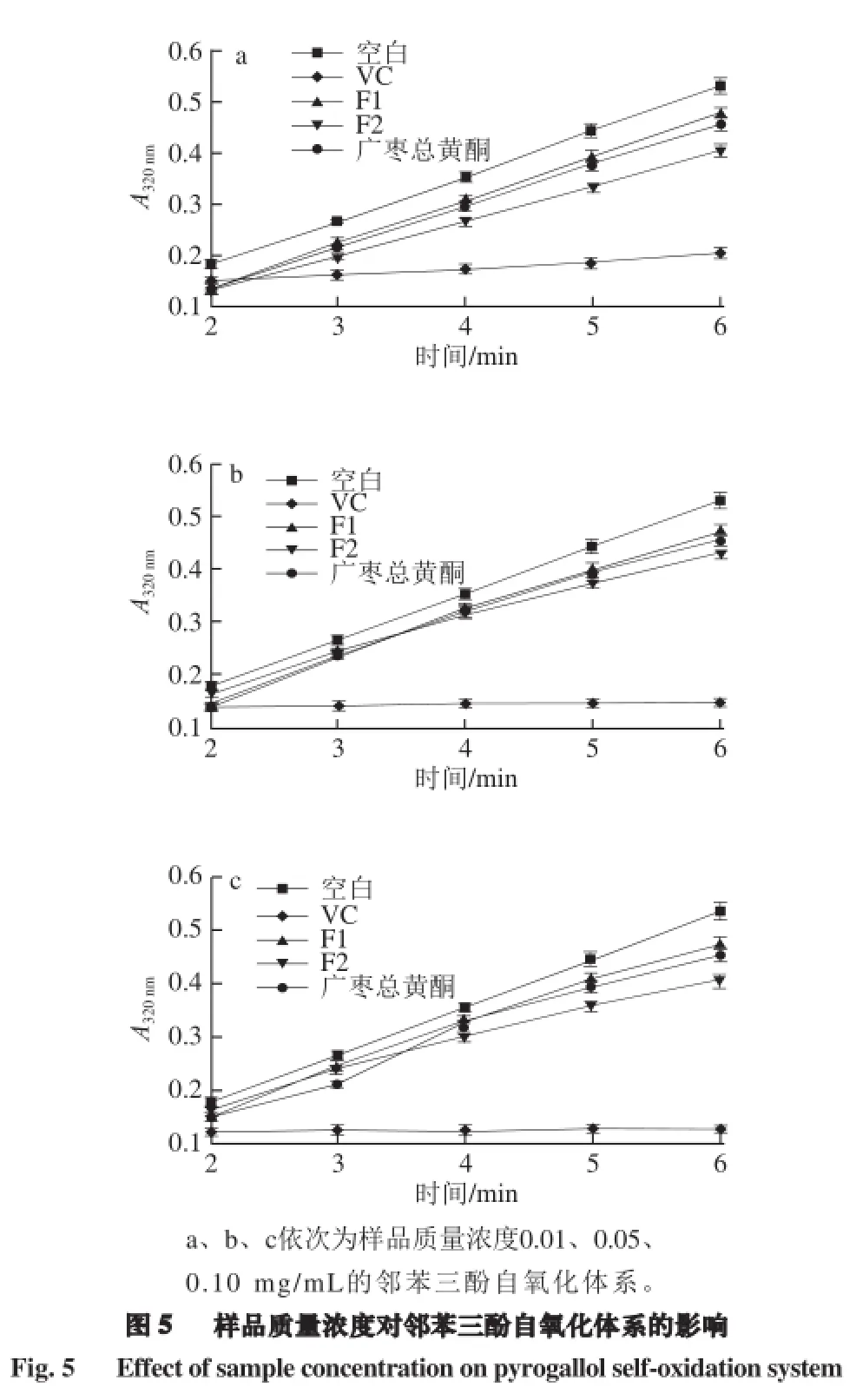
如圖5所示,對橫坐標時間和縱坐標吸光度進行回歸分析,得到k0和ks,從而計算出樣品對O2-·的清除率,結果如圖6所示。

由圖6可知,廣棗總黃酮對O2-·的清除率隨著質量濃度的升高而增大,但明顯弱于VC;F2的O2-·清除率高于F1和廣棗總黃酮。這一結論與狄建軍等[34]的研究結果一致,他闡述廣棗粗提物具有很強的清除O2-·的能力,而經過離子交換層析的提取物清除能力則減弱,這可能與不同的處理方法有關。
2.5 廣棗總黃酮及F1、F2的細胞內抗氧化能力

由圖7可知,各樣品僅在1.0 μg/mL時對RAW264.7細胞的存活率有輕微的抑制作用,而當各樣品的質量濃度升高到100.0、500.0 μg/mL時,對RAW264.7細胞的存活反而有輕微的促進作用,但RAW264.7細胞存活率總體變化不大,即在實驗設定的質量濃度范圍(1.0~500.0 μg/mL)內,廣棗總黃酮、F1和F2對RAW264.7細胞存活率的影響可以忽略不計。
使用DCFH-DA對RAW246.7細胞進行預處理,使DCFH-DA探針自由擴散進細胞,細胞內酯酶切開了DCFH-DA探針二醋酸鹽的一半,形成了極性更強的DCFH,使得DCFH被困在細胞里。DCFH可以與H2O2或過氧硝酸鹽發生反應從而被氧化[35]。H2O2在細胞中形成ROS,從而將DCFH氧化為有熒光性的DCF,因此,通過檢測熒光強度就可以監控細胞內的ROS水平[36]。抗氧化劑可以消除ROS從而阻止DCFH被氧化為DCF,即通過檢測熒光強度也可以間接檢測出物質的抗氧化能力。

由圖8可知,對照組的熒光強度明顯高于空白組,說明經過H2O2處理后的細胞產生了更多的ROS。而經過廣棗總黃酮及F1、F2處理后,RAW246.7細胞的熒光強度均明顯降低,即3 種樣品可清除細胞內產生的ROS,具有一定的抗氧化能力。進一步計算得到RAW246.7細胞經廣棗總黃酮、F1和F2處理后的CAA值分別為51.05%、57.71%和62.02%,這表明廣棗黃酮具有明顯的抗氧化活性。根據文獻[37-38]報道,黃酮的抗氧化性與—OH數目成正相關,特別是廣棗黃酮中含有的槲皮苷等在B環具有3',4'-O-二羥基結構的黃酮類物質具有較高的細胞內抗氧化能力。
3 結 論
由于不同物質抗氧化活性的機制有所不同,因此,物質的抗氧化性能需要通過多種方法來評判,使用任何一種單一的方法來評價都是不夠全面和客觀的。本研究不僅采用了總抗氧化活性、清除DPPH自由基、·OH和O2-·的能力這4 種化學方法,還使用了目前較為先進的細胞模型法,比較全面地考察了廣棗黃酮的抗氧化活性和清除自由基的能力。本研究的結果與Wang Hua等[33]的結論有較大差異,這可能是由于不同產地的廣棗生長環境不同導致的。本實驗結果證實,廣棗黃酮的兩個組分F1、F2之間的抗氧化性能存在著明顯差別。廣棗黃酮不僅在清除·OH的能力上遠勝于合成抗氧化劑VC,在清除DPPH自由基的能力上也并不遜色,在細胞模型法中廣棗黃酮也表現出了較強的抗氧化性。雖然在清除O2-·的能力上略遜于VC,但不能否認,廣棗黃酮作為一種安全、無毒的天然抗氧化劑,在食品工業中將具有廣闊的開發利用前景。
[1] 王曉琴, 王力偉, 趙巖, 等. 廣棗的化學成分和藥理活性研究進展[J].食品科學, 2014, 35(13): 281-285. DOI:10.7506/spkx1002-6630-201413056.
[2] LI C M, HE J, GAO Y L, et al. Preventive effect of total flavones of Choerospondias axillaries on ischemia/reperfusion-induced myocardial infarction-related MAPK signaling pathway[J]. Cardiovascular Toxicology, 2014, 14(2): 145-152. DOI:10.1007/s12012-013-9238-7.
[3] 王鳳華, 楊玉梅, 徐繼輝, 等. 蒙藥廣棗3種黃酮類成分對烏頭堿所致心律失常的作用比較[J]. 中國中藥雜志, 2005, 30(14): 1096-1098. DOI:10.3321/j.issn:1001-5302.2005.14.012.
[4] 張浩楠, 楊玉梅, 鄔國棟, 等. 蒙藥廣棗抗心律失常作用有效成分的分離[J]. 包頭醫學院學報, 2013, 29(3): 1-4. DOI:10.3969/j.issn.1006-740X.2013.03.001.
[5] 李增晞, 田風居, 吳秀英, 等. 復方廣棗注射液對動物耐缺氧和急性心肌缺血的保護作用[J]. 中藥通報, 1985, 10(3): 42-44.
[6] 國家藥典委員會. 中華人民共和國藥典2010版(一部)[M]. 北京: 中國醫藥科技出版社, 2010: 41.
[7] 內蒙古衛生廳. 內蒙古蒙成藥標準[M]. 呼和浩特: 內蒙古科學技術出版社, 1986: 399.
[8] 鄧麗嘉, 王月梅, 顧維彰, 等. 蒙藥廣棗的化學成分研究[J]. 中草藥,1989, 20(3): 8-9.
[9] 連珠, 張承忠, 李沖, 等. 蒙藥廣棗化學成分的研究[J]. 中藥材, 2003,26(1): 23-24. DOI:10.3321/j.issn:1001-4454.2003.01.013.
[10] 唐麗, 李國玉, 楊柄友, 等. 廣棗化學成分的研究[J]. 中草藥, 2009,40(4): 541-543. DOI:10.3321/j.issn:0253-2670.2009.04.013.
[11] 申旭霽, 格日力, 王金輝, 等. 廣棗的化學成分[J]. 河南大學學報(醫學版), 2009, 28(3): 196-199. DOI:10.3969/ j.issn.1672-7606.2009.03.011.
[12] 王乃利, 倪艷, 陳英杰, 等. 廣棗活血有效成分的研究[J]. 沈陽藥學院學報, 1987, 4(3): 203.
[13] ZHAO X F, ZHANG W J, KONG S S, et al. A valid assay for the pharmacokinetic study of gallic acid from Choerospondiatis fructus in rabbit plasma by LC-MS/MS[J]. Journal of Liqiud Chromatography and Related Technologies, 2007, 30(2): 235-244. DOI:10.1080/10826070601064383.
[14] PAUDEL K C, EDER R, PAAR E, et al. Chemical composition of Lapsi (Choerospondias axillaris) fruit from Nepal[J]. Mitteilungen Klosterneuburg Rebe und Wein, Obstbau und Früchteverwertung,2002, 52(1/2): 45-53.
[15] 先宏, 吳可, 孫存普, 等. 中藥抗氧化活性的主要成分及其自由基清除作用[J]. 國外醫學(中醫中藥分冊), 2003, 25(3): 150-153. DOI:10.3760/cma.j.issn.1673-4246.2003.03.007.
[16] 郭英, 貝玉祥, 王雪梅, 等. 廣棗提取物體外清除活性氧自由基及抗氧化作用研究[J]. 微量元素與健康研究, 2008, 25(5): 22-24. DOI:10.3969/j.issn.1005-5320.2008.05.009.
[17] 包保全, 張昕原, 烏日娜, 等. 廣棗總黃酮抗氧化作用的實驗研究[J].中藥藥理與臨床, 2001, 17(2): 8-10. DOI:10.3969/j.issn.1001-859X.2001.02.005.
[18] WOLFE K L, LIU R H. Cellular antioxidant activity (CAA) assay for assessing antioxidants, foods, and dietary supplements[J]. Journal of Agricultural and Food Chemistry, 2007, 55(22): 896-907. DOI:10.1021/jf0715166.
[19] 楊云舒, 李榮, 姜子濤. 響應面試驗優化廣棗黃酮的微波提取工藝及黃酮的提純[J]. 食品科學, 2015, 36(22): 18-24. DOI:10.7506/ spkx1002-6630-201522004.
[20] OZKAN G, SIMSEK B, KULEASAN H. Antioxidant activities of Sature jacilicica essential oil in butter and in vitro[J]. Journal of Food Engineering, 2007, 79: 1391-1396. DOI:10.1016/ j.jfoodeng.2006.04.020.
[21] KUMARAN A, KARUNAKARAN R. In vitro antioxidant activities of methanol extracts of five Phyllanthus species from India[J]. LWTFood Science and Technology, 2007, 40: 344-352. DOI:10.1016/ j.lwt.2005.09.011.
[22] 海平, 蘇雅樂其其格. 蒙藥小白蒿中總黃酮的提取及其抗氧化活性研究[J]. 中國實驗方劑學雜志, 2012, 18(3): 59-63. DOI:10.3969/ j.issn.1005-9903.2012.03.020.
[23] 翟麗萍, 孟杰, 裴力民, 等. 酸度對硫酸亞鐵/硫酸亞鐵銨溶液穩定性影響[J]. 精細與專用化學品, 2010, 18(12): 29-31. DOI:10.3969/ j.issn.1008-1100.2010.12.008.
[24] 劉駿. 結晶紫分光光度法測定Fenton反應產生的羥自由基[J].武漢工業學院學報, 2005, 24(2): 53-55. DOI:10.3969/ j.issn.1009-4881.2005.02.016.
[25] 赫春香, 盧麗男, 曹璨, 等. 熒光動力學分析新方法測定超氧自由基抑制劑的抗氧活性[J]. 遼寧師范大學學報(自然科學版), 2005,28(1): 73-75. DOI:10.3969/j.issn.1000-1735.2005.01.020.
[26] 焦士蓉, 王玲, 林玲. 蘆柑皮黃酮類物質的微波輔助提取及其抗氧化活性研究[J]. 西華大學學報(自然科學版), 2007, 26(4): 36-38. DOI:10.3969/j.issn.1673-159X.2007.04.014.
[27] HAMID R, ROTSHTEYN Y, RABADI L, et al. Comparison of alamar blue and MTT assays for high through-put screening[J]. Toxicology in Vitro, 2004, 18(5): 703-710. DOI:10.1016/j.tiv.2004.03.012.
[28] QIAN Z J, KANG K H, KIM S K. Isolation and antioxidant activity evaluation of two new phthalate derivatives from seahorse, Hippocampus kuda Bleeler[J]. Biotechnology & Bioprocess Engineering, 2012, 17(5):1031-1040. DOI:10.1007/s12257-012-0115-1.
[29] YANG L C, LI R, TAN J, et al. Polyphenolics composition of the leaves of Zanthoxylum bungeanum Maxim. grown in Hebei, China,and their radical scavenging activities[J]. Journal of Agricultural and Food Chemistry, 2013, 61(8): 1772-1778. DOI:10.1021/jf3042825.
[30] 黃海蘭, 趙祖亮, 王斌貴. 磷鉬絡合物法與β-胡蘿卜素-亞油酸法測定海藻脂類成分抗氧化活性的比較[J]. 中國油脂, 2005, 30(3): 32-35. DOI:10.3321/j.issn:1003-7969.2005.03.010.
[31] 韋獻雅, 殷麗琴, 鐘成, 等. DPPH法評價抗氧化活性研究進展[J].食品科學, 2014, 35(9): 317-322. DOI:10.7506/spkx1002-6630-201409062.
[32] 金鳴, 蔡亞欣, 李金榮, 等. 鄰二氮菲-Fe2+氧化法檢測H2O2/Fe2+產生的羥自由基[J]. 生物化學與生物物理進展, 1996(6): 553-555.
[33] WANG H, GAO X D, ZHOU G C, et al. In vitro and in vivo antioxidant activity of aqueous extract from Choerospondias axillaris fruit[J]. Food Chemistry, 2008, 106(3): 888-895. DOI:10.1016/ j.foodchem.2007.05.068.
[34] 狄建軍, 昝桂麗, 王穎, 等. 蒙藥廣棗提取物體外抗氧化活性研究[J]. 安徽農業科學, 2010, 38(34): 325-326. DOI:10.3969/ j.issn.0517-6611.2010.34.034.
[35] LABIENIEC M, GABRYELAK T. Antioxidative and oxidative changes in the digestive gland cells of freshwater mussels uniotumidus caused by selected phenolic compounds in the presence of H2O2or Cu2+ions[J]. Toxicology in Vitro, 2007, 21(1): 146-156. DOI:10.1016/ j.tiv.2006.09.017.
[36] XU B J, CHANG S K. Comparative study on antiproliferation properties and cellular antioxidant activities of commonly consumed food legumes against nine human cancer cell lines[J]. Food Chemistry,2012, 134(3): 1287-1296. DOI:10.1016/j.foodchem.2012.02.212.
[37] WOLFE K L, LIU R H. Structure-activity relationships of flavonoids in the cellular antioxidant activity assay[J]. Journal of Agricultural and Food Chemistry, 2008, 56(18): 8404-8411. DOI:10.1021/jf8013074.
[38] MENDES A P S, BORGES R S, NETO A M J C, et al. The basic antioxidant structure for flavonoid derivatives[J]. Journal of Molecular Modeling, 2012, 18(9): 4073-4080. DOI:10.1007/s00894-012-1397-0.
Evaluation of Free Radical Scavenging Ability and Antioxidant Activity of Flavonoids from Choerospondias axillaris Fruits Using Cell Model
YANG Yunshu, JIANG Zitao*, LI Rong
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science,Tianjin University of Commerce, Tianjin 300134, China)
Flavonoids from the dried fruits of Choerospondias axillaris were separated using preparative chromatography into two fractions (F1 and F2). The total antioxidant capacity, and DPPH radical, hydroxyl radical and superoxide anion radical scavenging activities of F1 and F2 were evaluated using ascorbic acid (VC) as the reference. The results demonstrated that total flavonoids from C. axillaris had obvious antioxidant capacity, which was between F1 and F2. The DPPH radical scavenging activity of F1 and the hydroxyl radical scavenging activities of F1 and F2 were higher than those of VC, but total antioxidant capacity and superoxide anion radical scavenging activity of F1 and F2 were lower than those of VC. In addition,as evaluated using cell model, the flavonoids from C. axillaris showed significant antioxidant activity in mouse macrophages(RAW264.7).
flavonoids from Choerospondias axillaris fruits; total antioxidant capacity; free radical scavenging activity;cellular antioxidant activity; mouse macrophages RAW264.7
10.7506/spkx1002-6630-201609018
TS202.3
A
1002-6630(2016)09-0092-06
楊云舒, 姜子濤, 李榮. 廣棗黃酮清除自由基能力及抗氧化性能的細胞模型法評價[J]. 食品科學, 2016, 37(9): 92-97. DOI:10.7506/spkx1002-6630-201609018. http://www.spkx.net.cn
YANG Yunshu, JIANG Zitao, LI Rong. Evaluation of free radical scavenging ability and antioxidant activity of flavonoids from Choerospondias axillaris fruits using cell model[J]. Food Science, 2016, 37(9): 92-97. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201609018. http://www.spkx.net.cn
2015-07-19
天津市自然科學基金重點項目(12JCZDJC34100);天津市高等學校創新團隊培養計劃項目(TD12-5049)
楊云舒(1991—),女,碩士研究生,研究方向為食品添加劑。E-mail:yangys019@hotmail.com
*通信作者:姜子濤(1956—),男,教授,博士,研究方向為食品添加劑。E-mail:ztjiang@tjcu.edu.cn

