乳酸菌對喹諾酮類耐藥性主動外排機制的研究
李 貞,李少英,*,宋曉敏,馬春艷,李淑芬,賀文英,曹英華
(1.內蒙古農業大學食品科學與工程學院,內蒙古 呼和浩特 010018;2.內蒙古農業大學生命科學學院,內蒙古 呼和浩特 010018;3.內蒙古農業大學理學院,內蒙古 呼和浩特 010018)
乳酸菌對喹諾酮類耐藥性主動外排機制的研究
李 貞1,李少英1,*,宋曉敏1,馬春艷1,李淑芬2,賀文英3,曹英華1
(1.內蒙古農業大學食品科學與工程學院,內蒙古 呼和浩特 010018;2.內蒙古農業大學生命科學學院,內蒙古 呼和浩特 010018;3.內蒙古農業大學理學院,內蒙古 呼和浩特 010018)
目的:為使分離自具有民族特色和特殊功效的內蒙古牧區馬奶及其制品中的乳酸菌更好地應用于發酵工業,對乳酸菌進行耐藥性實驗并研究其中是否存在由主動外排蛋白介導的喹諾酮類耐藥機制。方法:采用二倍稀釋法測定乳酸菌對臨床常用喹諾酮類藥物的最小抑菌濃度(minimum inhibitory concentration,MIC),利用質子泵抑制劑(利血平)結合熒光分光光度法檢測耐藥菌株和對照菌株對環丙沙星的攝取情況。結果:菌株HZ18、HZ28、NN3、NN4具有耐藥性并在加入利血平后菌體內環丙沙星累積量明顯增加。結論:乳酸菌中存在主動外排蛋白介導的喹諾酮類耐藥機制。
乳酸菌;喹諾酮類藥物;最小抑菌濃度;熒光分光光度法;主動外排
乳酸菌在人體內具有防治腸道功能紊亂、維持腸道菌群平衡,延緩衰老,抑菌、抗感染等益生功能[1-3]。通常人們認為乳酸菌是安全的、可以放心食用的,但是作為一種進入人體的外源性活菌,在應用過程中益生乳酸菌的安全性隱患被逐漸重視。2001年聯合國糧食及農業組織(Food and Agriculture Organization,FAO)與世界衛生組織(World Health Organization,WHO)聯合專家委員會在《食品益生菌評價指南》中把益生乳酸菌的耐藥性問題提到十分重要的位置[4]。乳酸菌出現耐藥性并不可怕,可使其更好地適應環境發揮功效;但如果耐藥基因可以在乳酸菌和致病菌之間進行傳遞,使致病菌獲得耐藥性,后果將不堪設想[5]。
近年來,喹諾酮類藥物因其良好的藥動力學和廣譜殺菌活性被廣泛用于尿路感染、呼吸道感染、腹腔感染等的治療[6-7]。但隨著臨床應用的增多,細菌對喹諾酮類藥物的耐藥性問題逐漸凸顯。研究發現,主動外排蛋白介導的細菌胞內藥物積聚減少在細菌對喹諾酮類藥物耐藥中發揮重要作用[8-9]。在多數細菌中已經發現各種各樣的具有主動外排功能的蛋白質,如大腸埃希氏菌中的AcrAB-TolC,銅綠假單胞菌中的 MexAB-OprM 和金黃色葡萄球菌中的NorA蛋白[10-12],而對乳酸菌中主動外排蛋白的研究報道較少。
本實驗利用能量抑制劑——利血平,結合熒光分光光度法研究乳酸菌中是否存在主動外排蛋白介導的喹諾酮類耐藥性。其理論依據為利血平可以阻斷菌株主動外排藥物過程中的能量供應,從而減少菌株對藥物的泵出量。同時,喹諾酮類藥物在一定的激發波長下可以發射熒光,其熒光強度與藥物濃度呈函數關系。通過對比加入利血平前后菌體對藥物攝取量的變化,從而確證乳酸菌主動外排系統的有無。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株
實驗菌株:分離自內蒙古牧區馬奶及其制品中的10 株乳酸菌,分別為HZ9、HZ18、HZ22、HZ23、HZ28、NN、NN1、NN3、NN4、M22,由內蒙古農業大學微生物實驗室提供。其中菌株HZ9、HZ28、M22屬于堅強腸球菌(Enterococcus durans);菌株NN、NN1屬于Enterococcus villorum;菌株NN3、NN4屬于異腸球菌(Enterococcus dispar);菌株HZ18、HZ22、HZ23分別歸屬于棉籽糖腸球菌(Enterococcus raffinosus)、雞腸球菌(Enterococcus gilvus)、假鳥腸球菌(Enterococcus pseudoavium)。
標準菌株:植物乳桿菌(Lactobacillus plantarum CICC6238)購于中國工業微生物菌種保藏管理中心。
質控菌株:糞腸球菌(Enterococcus faecalis CICC23658)購于中國工業微生物菌種保藏管理中心;大腸埃希氏菌(Escherichia coli ATCC 25922)購于美國模式菌種保藏中心。
1.1.2 試劑與藥品
MRS(man rogosa sharpe)肉湯培養基、雙料MRS肉湯培養基、MRS瓊脂培養基按照參考文獻[13]中的方法配制;CAMHB(cation adjusted mueller-hinton broth)肉湯培養基 青島高科園海博生物技術有限公司;脫脂乳培養基(100 mL蒸餾水,10 g脫脂乳粉,110 ℃,高壓滅菌10 min)、TPY(trypticase peptone yeast broth)液體培養基、磷酸緩沖鹽溶液(phosphate buffer saline,PBS;50 mmol/L) 賽默飛世爾科技公司;鹽酸甘氨酸緩沖液(0.1mol/L pH 3.0) 內蒙古農業大學微生物實驗室自制。
抗生素標準品:環丙沙星((ciprofloxacin),生產批號130451-201203)、諾氟沙星((norfloxacin),生產批號130450-201206) 中國食品藥品檢定研究院;利血平((reserpine),生產批號V900834) 美國Sigma公司。
1.1.3 儀器與設備
RF-5301PC熒光分光光度計 日本島津公司;分光光度計 北京普析通用儀器有限責任公司;SX-500全自動高壓蒸汽滅菌鍋 日本Tomy公司;OLYMPUS BX50型光學顯微鏡 日本Olympus公司;TGL-16G高速冷凍離心機 上海安亭科學儀器廠;FLC-3型超凈工作臺哈爾濱市東聯公司;SPX-1500型恒溫恒濕培養箱 上海博訊實業有限公司。
1.2 方法
1.2.1 藥敏實驗最適培養基的選擇
選取3 株實驗菌株HZ9、NN1、M22和1 株質控菌株Enterococcus faecalis,將其凍干菌粉接種于脫脂乳培養基,37 ℃培養24 h后,于4℃進行穿刺保存,同時將每株菌分別接種于MRS液體培養基和CAMHB肉湯培養基。37 ℃條件下活化24 h至第2、3代時,觀察菌株生長情況并在600 nm波長處測定光密度(optical density,OD)值,依照GB 4789.35—2010《食品安全國家標準 食品微生物學檢驗 乳酸菌檢驗》進行活菌計數,并記錄實驗結果。
1.2.2 供試菌液的制備
在無菌條件下將實驗菌株接種于MRS液體培養基中傳代培養3 代,并用空培養基稀釋菌液至活菌數為107CFU/mL。按體積分數為6%的接種量接種于雙料MRS液體培養基中混勻,待用[14]。
1.2.3 實驗菌株對喹諾酮類藥物耐藥性的測定
采用試管二倍稀釋法將環丙沙星和諾氟沙星溶液的質量濃度稀釋為1、2、4、8、16、32、64、128、256、512、1 024 μg/mL。將供試菌液和藥物等體積混合,同時設置藥物空白、菌株空白和培養基空白對照,并置于37 ℃恒溫恒濕培養箱中培養18 h后,釆用目視比濁法觀察,并以美國臨床實驗室標準化協會(Clinical and Laboratory Standards Institute,CLSI)(M100-S26)解釋標準(表1)為依據記錄結果。每實驗重復3 次。參照CLSI(M100-S26)藥敏解釋標準中腸球菌屬最小抑菌濃度(minimum inhibitory concentration,MIC)解釋標準對結果進行判讀。

1.2.4 實驗菌株主動外排系統的測定
以環丙沙星為代表,利用質子泵抑制劑——利血平,結合熒光分光光度法檢測耐藥菌株和對照菌株對環丙沙星的攝取情況。通過對比利血平存在與否的情況下,菌體對藥物攝取量的變化,從而確證實驗菌株主動外排系統是否存在。
標準曲線的繪制:利用熒光分光光度計在251 nm/583 nm波長處測定不同質量濃度環丙沙星的熒光強度并繪制標準曲線。
供試菌液的制備:將實驗菌株分別接種于TPY液體培養基中,37 ℃搖床培養至活菌數達107CFU/mL,5 000 r/min、4 ℃ 離心 20 min后,收集菌體,PBS緩沖液洗滌3 次。最后將菌體分為2 份重懸于PBS中,使菌體質量濃度達到40 mg/mL,37 ℃振蕩溫浴10 min[15]。
加抑制劑前環丙沙星熒光強度的測定:向其中一份供試菌液加環丙沙星,使其最終質量濃度達1 000 μg/mL。分別在加環丙沙星后的0.5、1、3、5、7、9、12、15、25 min取樣,每管取0.5 mL到預冷的3 mL PBS緩沖液中,4 ℃、4 000r/min離心8 min,棄去上清液。同樣條件下洗滌3 次并沉淀菌體。沉淀物加鹽酸-甘氨酸緩沖液4 mL,26 ℃水浴2 h,離心沉淀,取上清液于251 nm/583 nm波長處測定熒光強度。
加抑制劑后環丙沙星熒光強度的測定:另一份供試菌液在加環丙沙星前加利血平,使其最終質量濃度為50 μg/mL。同樣條件下測定熒光強度。
2 結果與分析
2.1 培養基的選擇
3 株實驗菌株在MRS培養基中均長勢旺盛,培養3 代后在試管底部有大量白色菌泥沉淀,振蕩后試管明顯混濁;而在CAMHB肉湯培養基中培養的實驗菌株均長勢微弱,試管底部無菌泥出現,混勻后與空白培養基對比無明顯差別。實驗菌株在MRS培養基和CAMHB培養基中的OD600nm值及對應活菌數見表2。
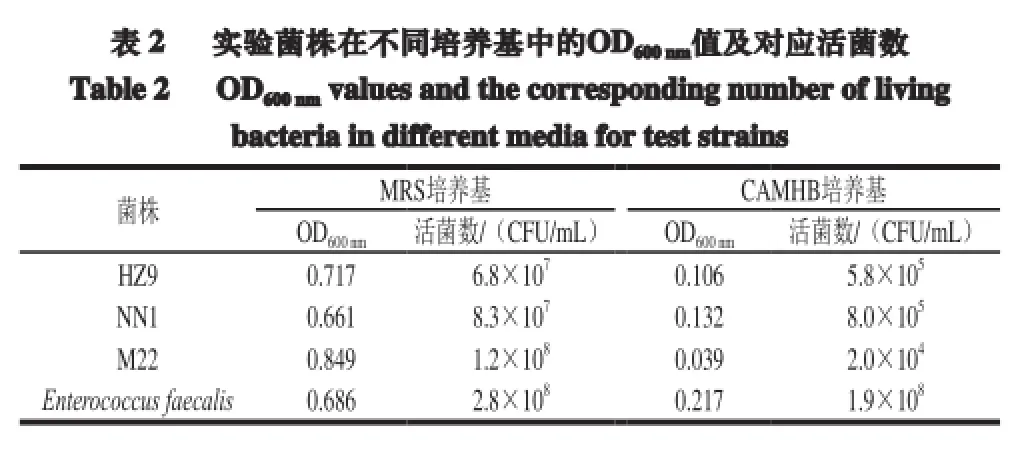
由表2可知,菌株Enterococcus faecalis在2 種培養基中生長情況差別不大,活菌數均大于108CFU/mL。實驗菌株在MRS培養基中培養后的活菌數均大于107CFU/mL,符合CLSI在藥敏實驗中對活菌數的要求(106~108CFU/mL)[16],而在CAMHB培養基中培養的菌株其活菌數均小于106CFU/mL,無法滿足CLSI對藥敏實驗的要求。
2.2 實驗菌株的最小抑菌質量濃度
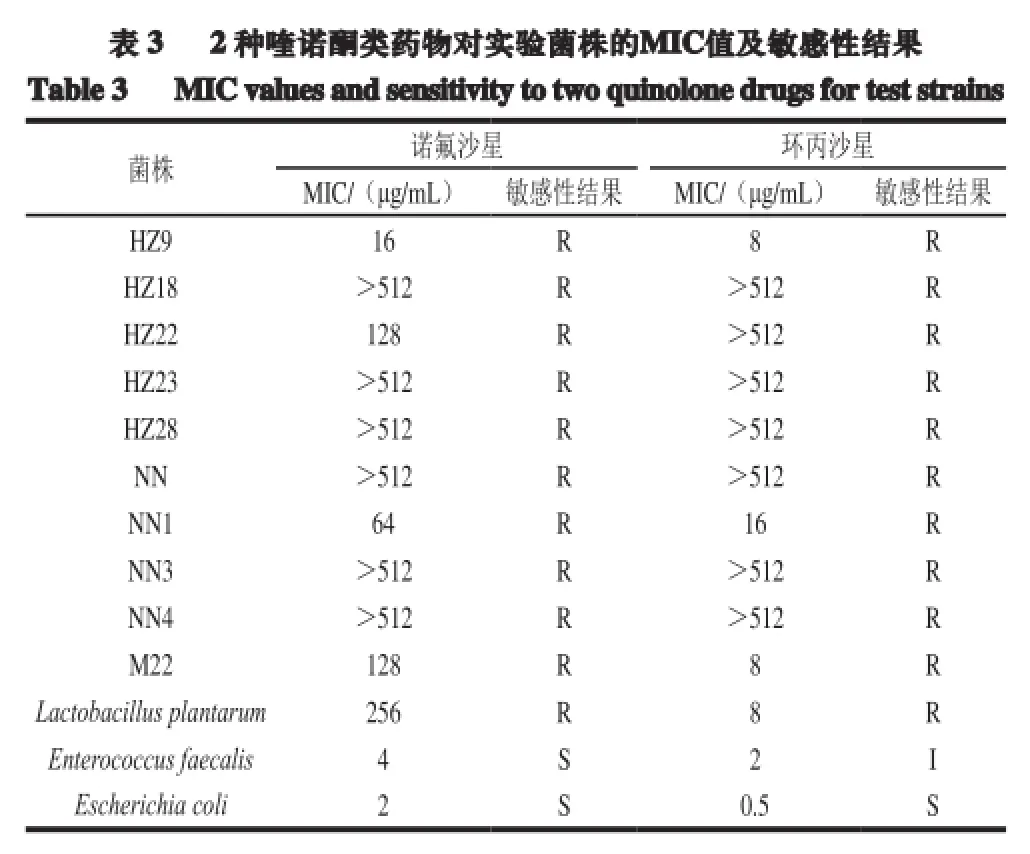
由表3可知,實驗菌株HZ18、HZ23、HZ28、NN、NN3、NN4對諾氟沙星和環丙沙星的MIC值均大于512 μg/mL,此值遠大于諾氟沙星和環丙沙星耐藥標準的界限質量濃度。菌株HZ9、NN1、M22、Lactobacillus plantarum對諾氟沙星和環丙沙星的MIC值也均高于CLSI耐藥標準,且對諾氟沙星的MIC值均大于對環丙沙星的MIC值,其原因可能是環丙沙星是合成的第3 代喹諾酮類藥物,其臨床應用時間較諾氟沙星短。實驗菌株如此高的MIC值可能是由于近年來喹諾酮類藥物應用的增多,導致許多乳酸菌對喹諾酮類藥物產生耐藥性。
2.3 實驗菌株對2 種喹諾酮類藥物的敏感性判定
由表3可知,質控菌株Escherichia coli對諾氟沙星和環丙沙星均表現為敏感,而菌株Enterococcus faecalis對諾氟沙星表現為敏感,對環丙沙星表現為中介。10 株實驗菌株經MIC法檢測對諾氟沙星和環丙沙星表現為不同程度的耐藥,耐藥率高達100%。其中6 株乳酸菌的MIC值均高于512 μg/mL,屬于高度耐藥。可見乳酸菌對喹諾酮類藥物的耐藥性較為普遍,這與細菌對喹諾酮類藥物耐藥性呈上升趨勢結論一致[17-18]。
2.4 主動外排系統證實實驗結果
環丙沙星質量濃度(x,μg/mL)與熒光強度(y)的回歸方程為:y=-0.001 7x3-0.069 1x2+5.400 7x+ 0.672 9(R2=0.998 7),根據回歸方程計算各菌株對環丙沙星的攝入量。
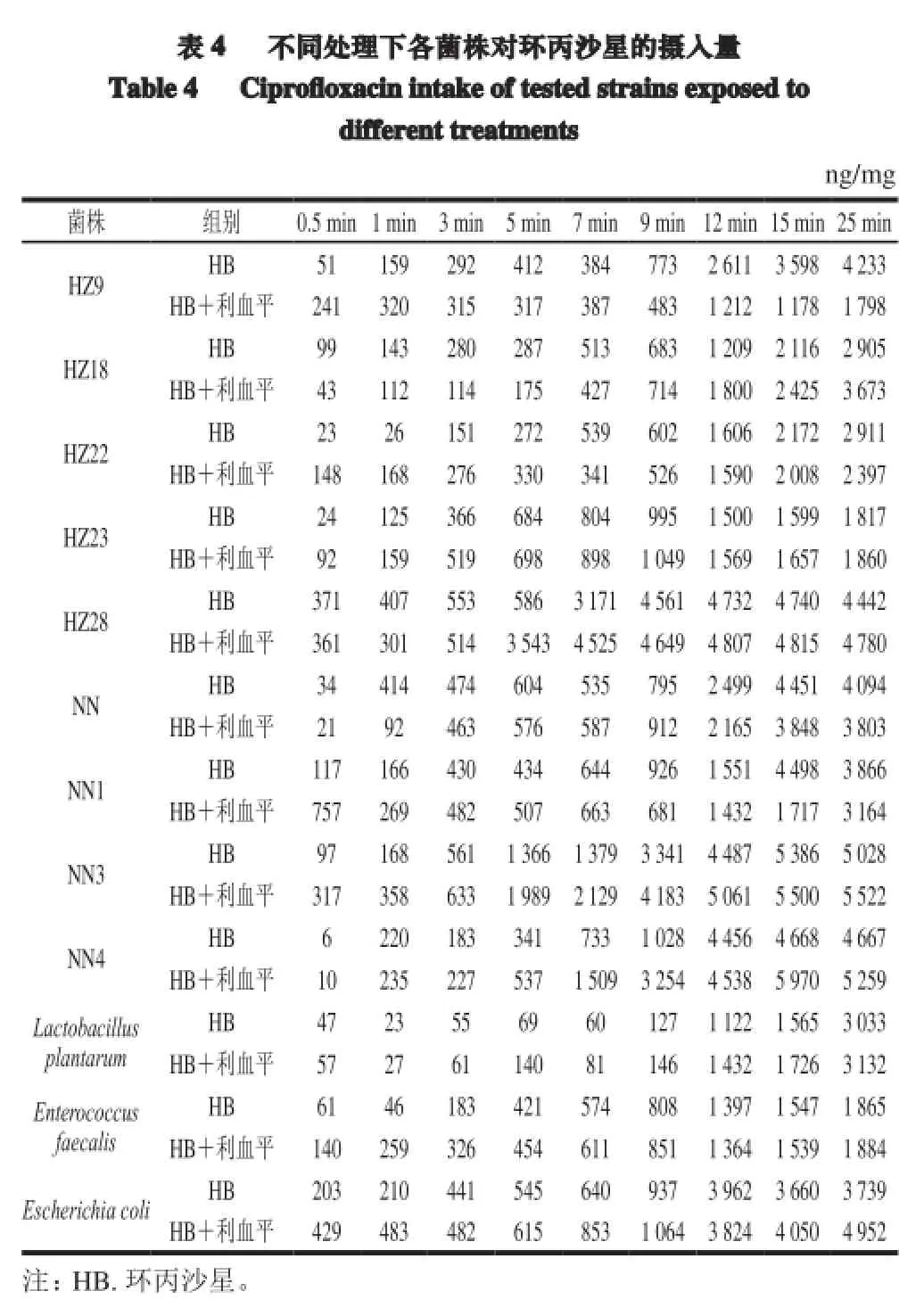
由表4可知,對照菌株Enterococcus faecalis及實驗菌株HZ9、HZ22、HZ23、NN、NN1在加入利血平前后菌體內環丙沙星累積量無明顯變化。而耐藥菌株HZ18、HZ28、NN3、NN4、標準菌株Lactobacillus plantarum及質控菌株Escherichia coli在加入利血平后菌體內藥物累積量明顯高于不加抑制劑組。以25 min為例,菌株HZ18、HZ28、NN3、NN4加入抑制劑后菌體內藥物累積量分別增加768、338、494、592 ng/mg,增加百分比分別為26.4%、7.6%、9.8%、12.7%。另外,由表4可知,各菌株菌體內藥物累積量存在一個隨時間延長,先緩慢增長,在9~12 min時快速增長,然后隨時間又略降低的過程。值得注意的是,經最小抑菌濃度實驗判定為高度耐藥的菌株HZ18、HZ28、NN3、NN4,在加入利血平后其菌體內環丙沙星的累積量明顯高于其他菌株。
3 結 論
CLSI的抗微生物藥物敏感性實驗操作方法和判斷標準是國內臨床細菌檢驗遵循的標準。CLSI是針對臨床致病菌設立的,它要求腸球菌和腸桿菌在進行藥物敏感性實驗時選用CAMHB培養基。但對于乳酸菌來說,CAMHB培養基營養成分過于簡單,乳酸菌在其中不能很好的生長,活菌數達不到進行藥敏實驗的要求(106~108CFU/mL)。另外,研究者Danielsen等[19]發現MRS培養基的成分對抗生素活性并無明顯影響,所以本實驗選擇MRS培養基進行喹諾酮類藥物敏感性實驗。這與2007年Hummel等[20]在研究作為發酵劑的乳酸菌的耐藥性時所選用的培養基一致。
利血平是一種吲哚生物堿,常用作細菌主動外排作用的能量抑制劑。已有文獻報道,利血平可增加某些耐藥菌株對喹諾酮類藥物的敏感性。Markham等[21-23]于1996年和1999年先后證實了利血平可抑制金黃色葡萄球菌對諾氟沙星的誘導耐藥以及肺炎鏈球菌對環丙沙星的耐藥性。Jonas等[24]于2001年證實了利血平可以抑制腸球菌對喹諾酮類藥物的外排作用。
本實驗中對照菌株Enterococcus faecalis及實驗菌株HZ9、HZ22、HZ23、NN、NN1在加入利血平前后菌體內環丙沙星累積量無明顯變化。而耐藥菌株HZ18、HZ28、NN3、NN4、標準菌株Lactobacillus plantarum及質控菌株Escherichia coli在加入利血平后菌體內藥物累積量明顯增加。這可能是由于主動外排作用在這些菌株的耐藥機制中發揮主要作用,導致對喹諾酮類藥物的外排增加。但并非所有的耐藥菌株藥物累積量都有所增加,有的還略有降低,推測在這些菌株中可能同時存在其他耐藥機制,如拓撲異構酶基因gyrA和parC發生突變。探討這些乳酸菌的耐藥機制及其轉移性將為這些特性優良的菌株在發酵工業中的應用提供安全方面的數據。
[1] LI S Y, LI Z, WEI W, et al. Association of mutation patterns in GyrA and ParC genes with quinolone resistance levels in lactic acid bacteria[J]. The Journal of Antibiotics, 2015, 68(2): 81-87. DOI:10.1038/ja.2014.113.
[2] 王夢姣, 李少英, 郝苗苗, 等. 分離自馬奶及其制品中7株乳酸菌的安全性初步評價[J]. 微生物學通報, 2014, 41(5): 871-880. DOI:10.13344/j.microbiol.china.130830.
[3] 李少英, 烏尼. 馬奶酒中乳酸菌的分離及其生物學特性的研究[J]. 內蒙古農業大學學報(自然科學版), 2002, 23(4): 59-66. DOI:10.3969/j.issn.1009-3575.2002.04.014.
[4] FAO/WHO Working Group. Guidelines for the evaluation of probiotics in food[R]. London Ontario: FAO/WHO, 2002.
[5] 王夢姣, 李少英, 李淑芬, 等. 馬奶及其制品中腸球菌屬乳酸菌的安全性評價[J]. 食品科學, 2014, 35(17): 204-208. DOI:10.7506/ spkx1002-6630-201417039.
[6] 王玉寶, 宋詩鐸. 腸球菌對氟喹諾酮類抗菌藥物耐藥機制研究進展[J]. 醫學綜述, 2006, 12(10): 621-624. DOI:10.3969/ j.issn.1006-2084.2006.10.020.
[7] 夏培元. 細菌體內藥物蓄積濃度減少與氟喹諾酮耐藥性的研究進展[J]. 國外醫藥(抗生素分冊), 2001, 22(1): 24-27. DOI:10.3969/ j.issn.1001-8751.2001.01.004.
[8] OYAMADA Y, ITO H, INOUE M, et al. Topoisomerase mutations and efflux are associated with fluoroquinolone resistance in Enterococcus faecalis[J]. Journal of Medical Microbiology, 2006,55(10): 1395-1401. DOI:10.1099/jmm.0.46636-0.
[9] 吳英. 腸球菌對氟喹諾酮類藥物外排機制及主動外排泵 EmeA 與耐藥關系的研究[D]. 衡陽: 南華大學, 2006: 30.
[10] 姚明曉, 苑廣盈, 聞新棉. 主動外排系統介導細菌多重耐藥的研究進展[J]. 現代預防醫學, 2014, 41(1): 118-121.
[11] 衣美英, 王鵬遠, 黃漢菊, 等. 外排泵高表達和外膜蛋白缺失在銅綠假單胞菌對碳青霉烯耐藥中的作用[J]. 中華醫學雜志, 2006, 86(7):457-462. DOI:10.3760/j:issn:0376-2491.2006.07.008.
[12] 王春梅, 何啟蓋, 操繼躍. 細菌多重耐藥泵的研究進展[J]. 畜牧獸醫學報, 2011, 42(4): 455-467.
[13] 張剛. 乳酸細菌基礎技術和應用[M]. 北京: 化學工業出版社, 2007: 421.
[14] 宋曉敏, 李少英, 馬春艷, 等. 內蒙古牧區乳酸球菌的分離鑒定及耐藥表型分析[J]. 中國釀造, 2014, 33(5): 44-48. DOI:10.11882/ j.issn.0254-5071.2014.05.011.
[15] 于錄, 鄧旭明, 李乾學, 等. 外輸泵介導的金黃色葡萄球菌對環丙沙星耐藥性的確證[J]. 吉林農業大學學報, 2005, 27(3): 335-338. DOI:10.3969/j.issn.1000-5684.2005.03.025.
[16] RICHARD B T, JOHN H R. Performance standards for antimicrobial susceptibility testing, 26th Edition[EB/OL]. Pennsylvania: Clinicale and Laboratory Standards Institute, 2016. http://em100.edaptivedocs. com/GetDoc.aspx?doc=CLSI%20M100%20S26:2016&scope=user.
[17] PULIDO R P, OMAR N B, LUCAS R, et al. Resistance to antimicrobial agents in lactobacilli isolated from caper fermentations[J]. Antonie van Leeuwenhoek, 2005, 88(3/4): 277-281. DOI:10.1007/s10482-005-6964-2.
[18] ZHOU J S, PILLIDGE C J, GOPAL P K, et al. Antibiotic susceptibility profiles of new probiotic Lactobacillus and Bifidobacterium strains[J]. International Journal of Food Microbiology, 2005, 98(2): 211-217. DOI:10.1016/j.ijfoodmicro.2004.05.011.
[19] DANIELSEN M, WIND A. Susceptibility of Lactobacillus spp. to antimicrobial agents[J]. International Journal of Food Microbiology,2003, 82(1): 1-11. DOI:10.1016/S0168-1605(02)00254-4.
[20] HUMMEL A S, HERTELC, HOLZAPFEL W H, et al. Antibiotic resistances of starter and probiotic strains of lactic acid bacteria[J]. Applied and Environmental Microbiology, 2007, 73(3): 730-739. DOI:10.1128/AEM.02105-06.
[21] MARKHAM P N, NEYFAKH A A. Inhibition of the multidrug transporter NorA prevents emergence of norfloxacin resistance in Staphylococcus aureus[J]. Antimicrobial Agents and Chemotherapy,1996, 40(11): 2673-2674.
[22] MARKHAM P N. Inhibition of the emergence of ciprofloxacin resistance in Streptococcus pneumoniae by the multidrug efflux inhibitor reserpine[J]. Antimicrobial Agents and Chemotherapy, 1999,43(4): 988-989.
[23] MARKHAM P N, WESTHAUS E, KLYACHKO K, et al. Multiple novel inhibitors of the NorA multidrug transporter of Staphylococcus aureus[J]. Antimicrobial Agents and Chemotherapy, 1999, 43(10):2404-2408.
[24] JONAS B M, MURRAY B E, WEINSTOCK G M. Characterization of emeA, a norA homolog and multidrug resistance efflux pump in Enterococcus faecalis[J]. Antimicrobial Agents and Chemotherapy,2001, 45(12): 3574-3579. DOI:10.1128/AAC.45.12.3574-3579.2001.
Corroboration of Quinolone Resistance Mediated by Active Efflux System in Lactic Acid Bacteria
LI Zhen1, LI Shaoying1,*, SONG Xiaomin1, MA Chunyan1, LI Shufen2, HE Wenying3, CAO Yinghua1
(1. College of Food Science and Engineering, Inner Mongolia Agricultural University, Hohhot 010018, China;2. College of Life Sciences, Inner Mongolia Agricultural University, Hohhot 010018, China;3. College of Science, Inner Mongolia Agricultural University, Hohhot 010018, China)
Purpose: In this study, lactic acid bacteria (LAB) were separated from horse milk and horse milk products with national characteristics and special functions in pastoral areas of Inner Mongolia. In order to ensure better application of the isolated strains in the fermentation industry, it is necessary to test their drug resistance and explore if LAB possess an active efflux system mediating quinolone resistance. Methods: Double dilution method was used to determine the minimum inhibitory concentration (MIC) of quinolone. The proton pump inhibitor reserpine was combined with fluorescence spectrophotometry to detect the ciprofloxacin intakes of drug-resistant strains and control strains. Results: The accumulation of ciprofloxacin increased significantly in drug-resistant strains HZ18, HZ28, NN3 and NN4 after adding reserpine. Conclusion: Lactic acid bacteria may possess an active efflux system mediating quinolone resistance.
lactic acid bacteria; quinolone; minimum inhibitory concentration (MIC); fluorescence spectrophotometry;active efflux system
10.7506/spkx1002-6630-201609028
R965
A
1002-6630(2016)09-0150-05
李貞, 李少英, 宋曉敏, 等. 乳酸菌對喹諾酮類耐藥性主動外排機制的研究[J]. 食品科學, 2016, 37(9): 150-154. DOI:10.7506/spkx1002-6630-201609028. http://www.spkx.net.cn
LI Zhen, LI Shaoying, SONG Xiaomin, et al. Corroboration of quinolone resistance mediated by active efflux system in lactic acid bacteria[J]. Food Science, 2016, 37(9): 150-154. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201609028. http://www.spkx.net.cn
2015-04-29
國家自然科學基金地區科學基金項目(31060014);內蒙古自治區高等學校科學研究項目(NJ09059)
李貞(1990—),女,碩士研究生,研究方向為食品微生物。E-mail:15248045663@163.com
*通信作者:李少英(1961—),女,教授,博士,研究方向為食品質量與安全。E-mail:nmglshy@126.com

