老黑谷米色素的提取工藝優(yōu)化及體外抗氧化活性分析
黃佳琦,楊士花,初雅潔,陶 亮,馮志祥,李華君,嚴 艷,李雪良,李永強,*
(1.云南農業(yè)大學食品科學技術學院,云南 昆明 650201;2.云南農業(yè)大學外語學院,云南 昆明 650201;3.云南農業(yè)大學植物保護學院,云南 昆明 650201)
老黑谷米色素的提取工藝優(yōu)化及體外抗氧化活性分析
黃佳琦1,楊士花2,初雅潔1,陶 亮3,馮志祥1,李華君1,嚴 艷1,李雪良1,李永強1,*
(1.云南農業(yè)大學食品科學技術學院,云南 昆明 650201;2.云南農業(yè)大學外語學院,云南 昆明 650201;3.云南農業(yè)大學植物保護學院,云南 昆明 650201)
以老黑谷米為對象,在單因素試驗的基礎上,利用二次通用旋轉試驗設計,對老黑谷米色素的提取工藝進行了優(yōu)化,并對色素的體外抗氧化活性進行了評價。結果表明:老黑谷米色素的最 佳提取溶劑為乙醇,在282 nm和342 nm處有最大吸收波長,初步定性為黃酮醇類物質;該色素的最佳提取條件為提取溫度30 ℃、液料比20∶1(mL/g)、提取時間40 min;該色素具有較好的抗氧化活性,DPPH自由基清除能力為(3 512.56±26.28)μg阿魏酸/g,鐵離子還原/抗氧化能力為(44.04±6.60)mmol Fe2+/L,還原能力為(203.47±23.75)μg抗壞血酸/g,H2O2清除活性為(3 676.60±114.32)μg阿魏酸/g,ABTS+·清除能力為(2 778.70±262.90)μg Trolox/g。
老黑谷米;色素;二次通用旋轉;提取;抗氧化活性
目前,色素作為食品添加劑或營養(yǎng)補充劑,廣泛應用于化妝品、藥品、飼料和其他領域。但是,由于大部分合成色素具有不同程度的毒性,對人類有一定的致癌作用,被越來越多的國家限制使用[1-5]。天然色素來自天然物質,主要是由植物組織中提取,也包括來自動物和微生物的一些色素。植物色素主要包括花色苷、類胡蘿卜素、甜菜素和葉綠素,可分為脂溶性色素和水溶性色素[1,3,6-8]。雖然天然色素穩(wěn)定性差,但是由于安全性高,具有一定的營養(yǎng)和藥理作用,并且在著色時色調更能接近天然物質的顏色,因此開發(fā)利用動植物天然食用色素資源,日益受到人們的普遍重視[1-8]。近年來,研究者對谷物、果蔬、微生物中色素的提取工藝、結構鑒定和生物學活性進行了大量研究[2-17]。以水、乙醇、甲醇及丙酮等作為提取溶劑,采用微波、超聲等輔助提取方法,利用二次通用旋轉、響應面等試驗設計對天然色素的提取工藝進行了優(yōu)化,并利用比色法對黃烷醇、花色苷等進行了含量測定[4,10-11,16-19];利用高效液相色譜-串聯(lián)質譜、傅里葉紅外光譜、核磁共振、液相色譜-質譜聯(lián)用等方法對天然色素進行了結構鑒定[2-3,8,17]。大量研究[1-2,6,11-13,20]表明,天然色素具有抗氧化、抑菌、抗癌、抑制肥胖、紫外線防護、抗炎等作用。
1 材料與方法
1.1 材料與試劑
老黑谷米采自云南迪慶州維西縣攀天閣鄉(xiāng)皆菊村,磨粉后過50 目篩,避光于-80 ℃儲存?zhèn)溆谩?/p>
1,1-二苯基-2-苦基肼基(1,1-d i p h e n y l-2-p i c r y l h y d r a z y l,D P P H)、三吡啶基三嗪(2,4,6-tris(2-pyridyl)-s-triazine,TPTZ)、六水三氯化鐵(FeCl3·6H2O)、H2O2、2,2’-聯(lián)氮-雙(3-乙基苯并噻唑啉-6-磺酸)二銨鹽(2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonate),ABTS)、七水硫酸亞鐵(FeSO4·7H2O)、抗壞血酸 上海晶純生化科技股份有限公司;Trolox 美國Sigma公司;阿魏酸、兒茶素 北京北納創(chuàng)聯(lián)生物技術研究院;其他試劑均為分析純。
1.2 儀器與設備
JFS-13A旋風式粉碎磨 杭州錢江儀器設備有限公司;UV-1800CP紫外分光光度計 上海美譜達儀器有限公司;RE-52AA旋轉蒸發(fā)儀 上海亞榮生化儀器廠。
1.3 方法
1.3.1 最佳提取溶劑的選擇和最大吸收波長的確定
準確稱取9 份老黑谷米面粉各1 g(干質量),置于三角瓶中,分別加入10 mL體積分數1%鹽酸-甲醇溶液、1%鹽酸-乙醇溶液、1%鹽酸溶液、60%甲醇溶液、甲醇、乙醇、丙酮、石油醚、蒸餾水,提取30 min后,分別用提取溶劑定容至50 mL,在200~1 000 nm波長范圍內進行掃描,確定最佳提取溶劑和最大吸收波長。
1.3.2 單因素試驗
以吸光度為指標,在不同條件下考察提取時間、提取溫度、液料比和提取次數對老黑谷米色素提取效果的影響。提取時間分別為10、20、30、40、50 min,提取溫度分別為30、40、50、60、70 ℃,液料比分別為5∶1、10∶1、15∶1、20∶1、25∶1(mL/g),提取次數分別為1、2、3、4 次。
1.3.3 二次通用旋轉試驗設計
在單因素試驗的基礎上,選擇提取溫度、液料比和提取時間3 個因素,采用二次通用旋轉試驗設計,進行三因素五水平試驗,試驗因素水平見表1。
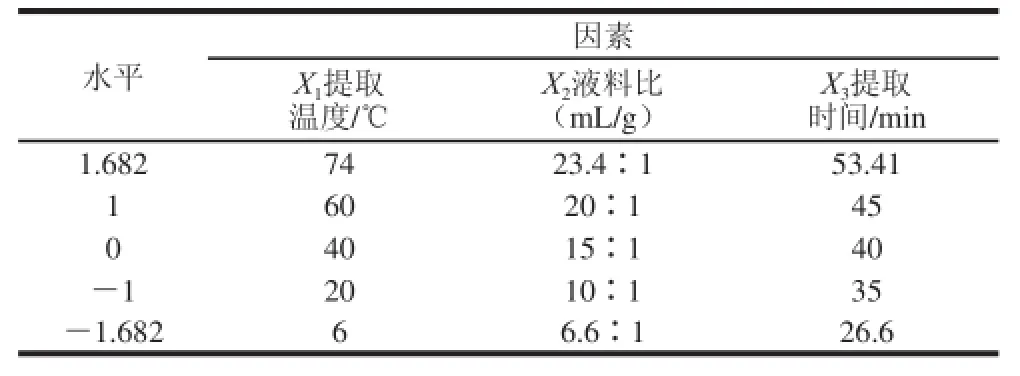
表1 二次通用旋轉試驗因素水平Table 1 Factors and levels used in quadratic general rotary design
1.3.4 抗氧化能力測定
1.3.4.1 老黑谷米色素對DPPH自由基清除能力的測定[6,20]
分別吸取0.5 mL色素粗提液,添加2 mL 0.19 mmol/L DPPH溶液,充分振搖后,室溫條件下暗處放置10 min,然后在517 nm波長處比色測定,用乙醇替代色素溶液作為空白。用阿魏酸繪制標準曲線,建立回歸方程為y=0.940 6x+28.698(線性范圍為23.2~139.2 μg/mL,R2=0.969),式中:y為DPPH自由基清除率;x為阿魏酸質量濃度/(μg/mL)。自由基清除能力表示為每克干燥樣品中阿魏酸當量(μg阿魏酸/g)。
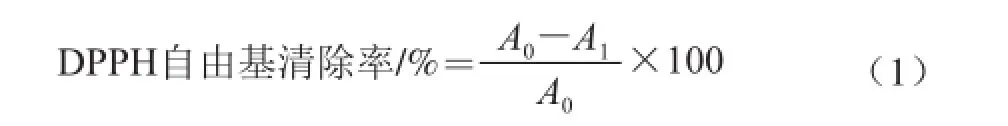
式中:A0為DPPH溶液本身的吸光度(空白對照);A1為樣品或者陽性對照的DPPH溶液的吸光度。
1.3.4.2 老黑谷米色素對鐵離子還原/抗氧化能力(ferric reducing antioxidant power,FRAP)的測定[20-21]
FRAP溶液的配制:乙酸緩沖溶液(300 mmol/L,pH 3.6)、六水三氯化鐵(20 mmol/L)和三吡啶基三嗪(10 mmol/L)以體積比10∶1∶1充分混勻。
吸取100 μL色素粗提液加入3 mL FRAP溶液充分混合,于37 ℃反應4 min,在593 nm波長處測定吸光度,用乙醇替代色素溶液作為空白。用硫酸亞鐵繪制標準曲線,建立回歸方程為y=6.24x+0.000 5(線性范圍為0.2~1.2 mmol/L,R2=0.998 4)。式中:y為吸光度;x為硫酸亞鐵濃度/(mmol/L)。FRAP表示為每毫升色素提取液中Fe2+濃度當量(mmol Fe2+/L)。
1.3.4.3 老黑谷米色素對ABTS+·清除能力的測定[20,22-24]
ABTS工作液的配制:將ABTS(7 mmol/L)和過硫酸鉀(2.45 mmol/L)兩種溶液等體積混合,于4 ℃條件下反應16 h,得到ABTS工作液。
吸取100 μL色素粗提液,加入3.8 mL ABTS工作液,室溫條件下反應6 min,于734 nm波長處測定吸光度,用乙醇替代色素溶液作為空白。用Trolox繪制標準曲線,建立回歸方程為y=5.382 7x+3.3472(線性范圍為7.488~37.44 μg/mL,R2=0.999 7),式中:y為ABTS+·清除率;x為Trolox質量濃度/(μg/mL)。自由基清除能力表示為每克干燥樣品中Trolox當量(μg Trolox/g)。
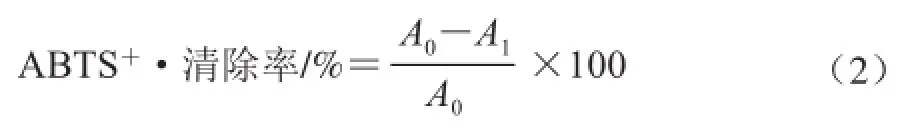
式中:A0為ABTS溶液本身的吸光度(空白對照);A1為樣品或者陽性對照的ABTS溶液的吸光度。
1.3.4.4 老黑谷米色素還原能力的測定[23]
吸取1 mL色素粗提液,加入2.5 mL磷酸鹽緩沖溶液(0.2 mol/L,pH 6.6),加入2.5 mL 1%鐵氰化鉀溶液,充分混勻后于50 ℃水浴反應20 min;再加入2.5 mL 10%三氯乙酸溶液,4 000×g離心10 min;吸取上清液1 mL,加入2.5 mL蒸餾水和0.5 mL 0.1% FeCl3溶液,于700 nm波長處測定吸光度,用乙醇替代色素溶液作為空白。用抗壞血酸繪制標準曲線,建立回歸方程為y=0.045 5x-0.115(線性范圍為80~180 μg/mL,R2=0.991 6),式中:y為吸光度;x為抗壞血酸質量濃度/(μg/mL)。還原能力表示為每克干燥樣品中抗壞血酸當量(μg抗壞血酸/g)。
1.3.4.5 H2O2清除活性測定[24]
吸取0.6 mL色素粗提液,加入0.9 mL H2O2(40 mmol/L),加入磷酸鈉緩沖溶液(45 mmol/L,pH 7.4),30 ℃反應40 min,于230 nm波長處測定吸光度,用乙醇替代色素溶液作為空白。用阿魏酸繪制標準曲線,建立回歸方程為:y=0.657 1x-11.119(線性范圍為55~275 μg/mL,R2=0.994 3),式中:y為H2O2清除率;x為阿魏酸質量濃度/(μg/mL)。自由基清除能力表示為每克干燥樣品中阿魏酸當量(μg阿魏酸/g)。
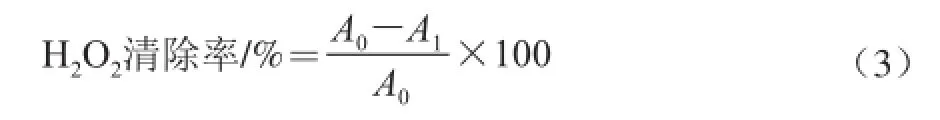
式中:A0為H2O2溶液本身的吸光度(空白對照);A1為加有樣品或者陽性對照的H2O2溶液的吸光度。
1.4 統(tǒng)計分析
利用DPS數據處理軟件進行統(tǒng)計分析。
2 結果與分析
2.1 最佳提取溶劑的選擇和最大吸收波長的確定
通過采用9 種不同溶劑對老黑谷米中的色素進行提取,并在200~1 000 nm范圍內進行全波長掃描,在最大吸收波長測定其吸光度,發(fā)現在各種溶劑中,乙醇吸光度較大,提取效果較好,說明該色素為醇溶性色素。

圖1 老黑谷米色素浸提液的吸收光譜Fig.1 Absorption spectrum of pigments extracted from “Laoheigu” rice
由圖1可看出,色素的乙醇提取液和石油醚提取液的吸收光譜在342 nm和282 nm處均有明顯吸收峰,其中乙醇提取液吸光度最大。由文獻[25]得知,黃酮醇在240~400 nm區(qū)域主要有兩個吸收峰,帶Ⅰ在300~380 nm有最大吸收峰,帶Ⅱ在240~280 nm有最大吸收峰,結合該色素為醇溶性色素,說明該色素可能為黃酮醇類物質。如A環(huán)有氧取代,而B環(huán)沒有氧取代的黃酮醇,其光譜具有一個強的帶Ⅱ和一個弱的帶Ⅰ。帶Ⅰ的位置能夠提供關于黃酮醇及其氧取代類型的信息。故選取乙醇作為最佳提取溶劑,342 nm作為測定該色素溶液的最大吸收波長。
2.2 單因素試驗結果
2.2.1 提取時間對色素提取效果的影響
準確稱取1 g(干質量)樣品,在室溫條件下分別用乙醇提取10、20、30、40、50 min,液料比10∶1、提取次數2 次,定容于50 mL容量瓶中,在342 nm波長處測定吸光度,結果見圖2。
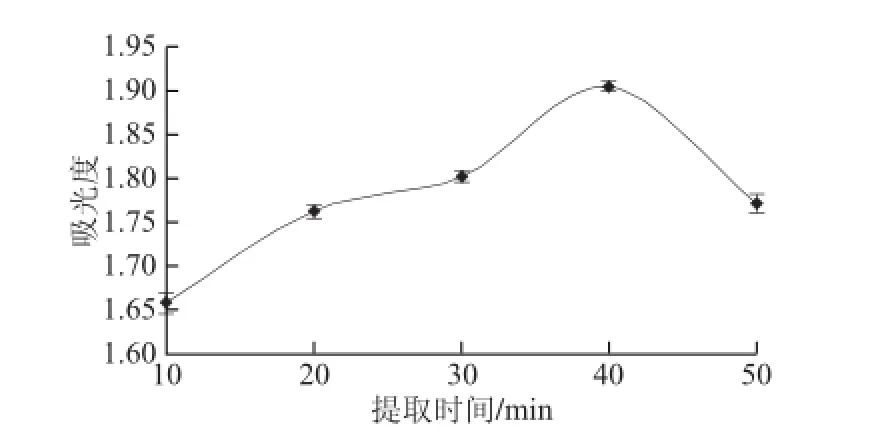
圖2 提取時間對色素提取效果影響Fig.2 Effect of extraction time on the extraction efficiency
由圖2可見,隨著提取時間的延長,色素溶液吸光度呈先上升后下降的趨勢。可能提取時間過長,色素會發(fā)生降解,含量降低,從而導致色素溶液吸光度降低。所以選擇提取時間為40 min。
2.2.2 提取溫度對色素提取效果的影響
準確稱取1 g(干質量)樣品,分別用乙醇在30、40、50、60、70℃條件下進行提取,提取時間40 min、液料比10∶1、提取次數2 次,定容于50 mL容量瓶中,在342 nm波長處測定吸光度,結果見圖3。
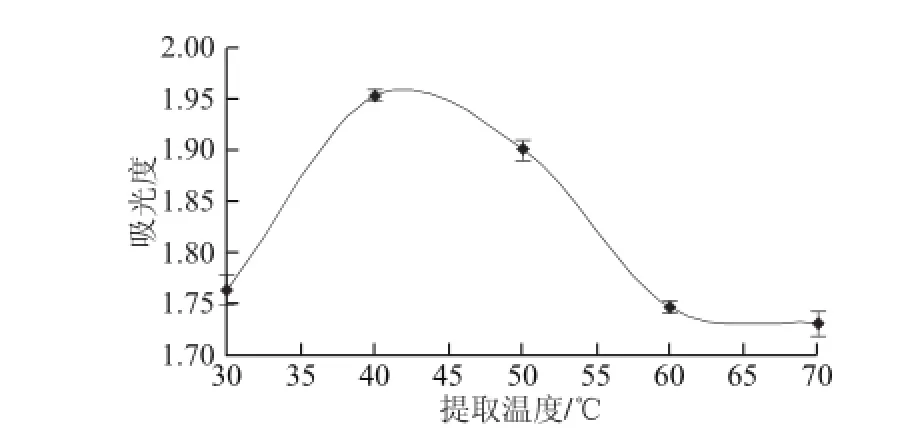
圖3 提取溫度對色素提取效果的影響Fig.3 Effect of extraction temperature on the extraction efficiency
由圖3可知,提取溫度對老黑谷米色素提取效果具有一定的影響,隨著溫度的上升,吸光度呈現先上升后下降的趨勢,在溫度為40 ℃時吸光度最大,顏色也有明顯變化,所以選擇提取溫度為40 ℃。
2.2.3 液料比對色素提取效果的影響
準確稱取1 g(干質量)樣品,分別加入5、10、15、20、25 mL乙醇進行提取,提取時間40 min、提取溫度40 ℃、提取次數2次,定容至50 mL容量瓶中,在342 nm波長處測定吸光度,結果見圖4。
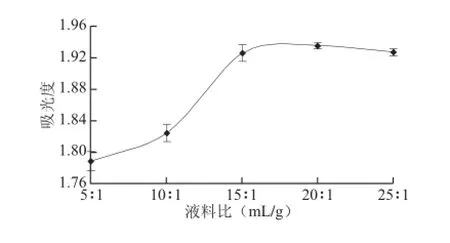
圖4 液料比對色素提取效果的影響Fig.4 Effect of ratio of liquid to material on the extraction efficiency
由圖4可知,隨著液料比的上升,吸光度逐漸增大,當液料比大于15∶1(mL/g)時,吸光度變化不明顯。料液比過小會造成提取不完全,料液比過大會降低溶劑利用率,造成溶劑和能源的浪費,提高生產成本并給后序的濃縮工序帶來困難,所以選擇液料比為15∶1(mL/g)。
2.2.4 提取次數對色素提取效果的影響
準確稱取1 g(干質量)樣品,用乙醇分別提取1、2、3、4 次,提取時間40 min、提取溫度40 ℃、液料比15∶1(mL/g),定容至100 mL容量瓶,在342 nm波長處測定吸光度,結果見圖5。
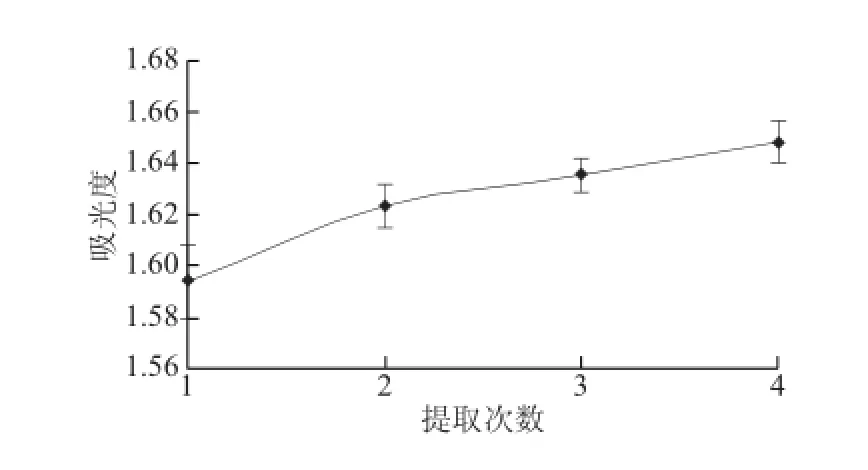
圖5 提取次數對色素提取效果的影響Fig.5 Effect of extraction number on the extraction efficiency
由圖5可見,隨著提取次數的增加,色素溶液吸光度呈增加趨勢,當提取次數3 次后,吸光度增加不再明顯。考慮到提取次數過多會浪費溶劑且延長提取周期,故選擇提取次數3 次為宜。
2.3 二次通用旋轉試驗結果
2.3.1 二次通用旋轉試驗設計與結果
二次通用旋轉試驗方案及結果見表2。
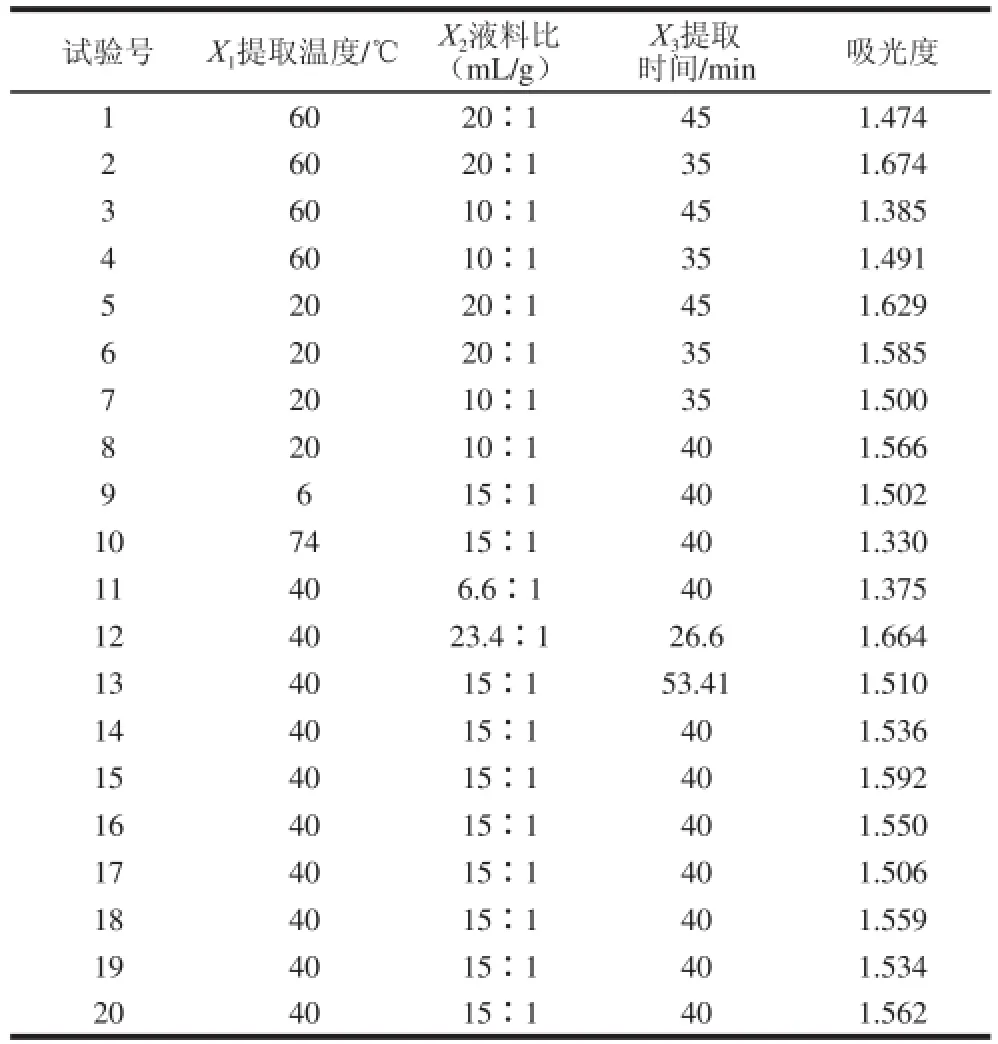
表2 二次通用旋轉試驗方案及結果Table 2 Experimental design and results of quadratic general rotary design
2.3.2 數學模型的建立與檢驗
利用DPS軟件對試驗結果進行分析,得到二次回歸模型為:Y=1.548 70-0.039 93X1+0.066 34X2-0.020 82X3-0.035 79X12+0.000 80X2
2+0.002 04X3
2+ 0.015 50X1X2-0.035 50X1X3+0.002 00X2X3。
根據試驗結果進行方差分析,由表3可知,該回歸模型達到顯著水平(P<0.05),說明方程與實際情況擬合良好,能夠反映色素提取效果與提取溫度、液料比和提取時間的關系。
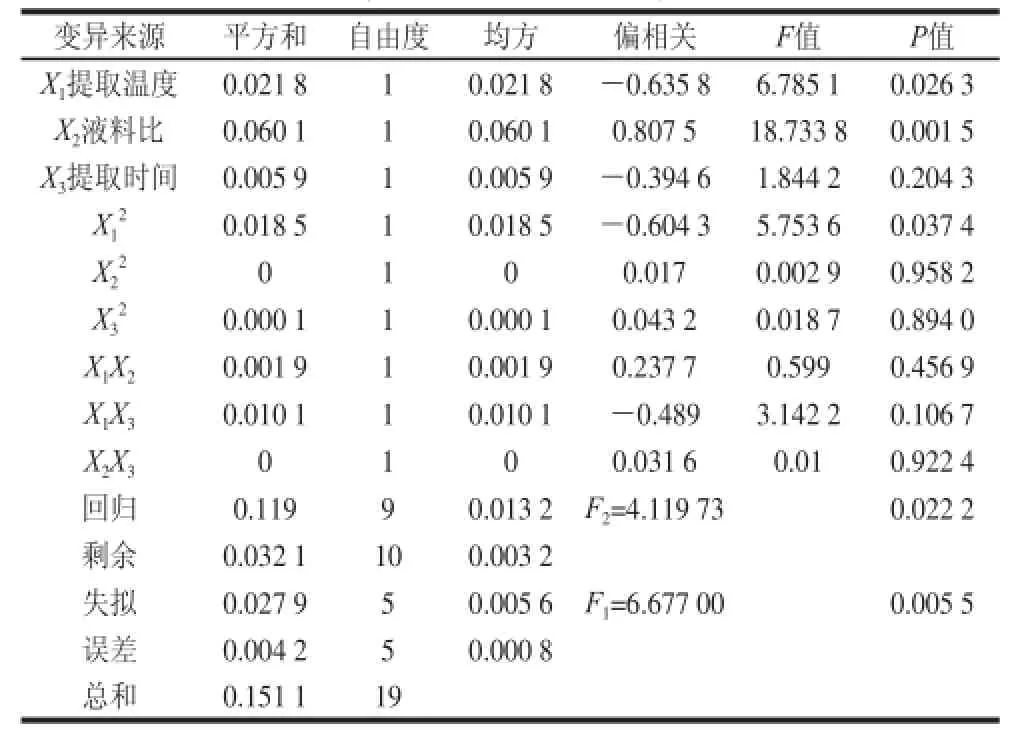
表3 回歸方程方差分析表Table 3 Analysis of variance of regression model
2.3.3 變量輪換直接尋優(yōu)
根據已建立的數學模型,在-1.682≤Xi≤1.682(i= 1、2、3)范圍內,每個因素取5 個水平(±1.682、±1、0),對53=125個方案進行統(tǒng)計尋優(yōu),在試驗范圍內可得吸光度的最高值為1.66,此時各因素取值為:X1= -1,X2=+1.682,X3=-1.682,對應提取溫度20 ℃、液料比23.4∶1(mL/g)、提取時間26.6 min。
2.3.4 頻率分析及統(tǒng)計尋優(yōu)
對不同設計水平條件下的組合進行模擬試驗,以均值1.53為臨界值,獲得大于臨界值的方案50個,各變量取值的頻率分布見表4。
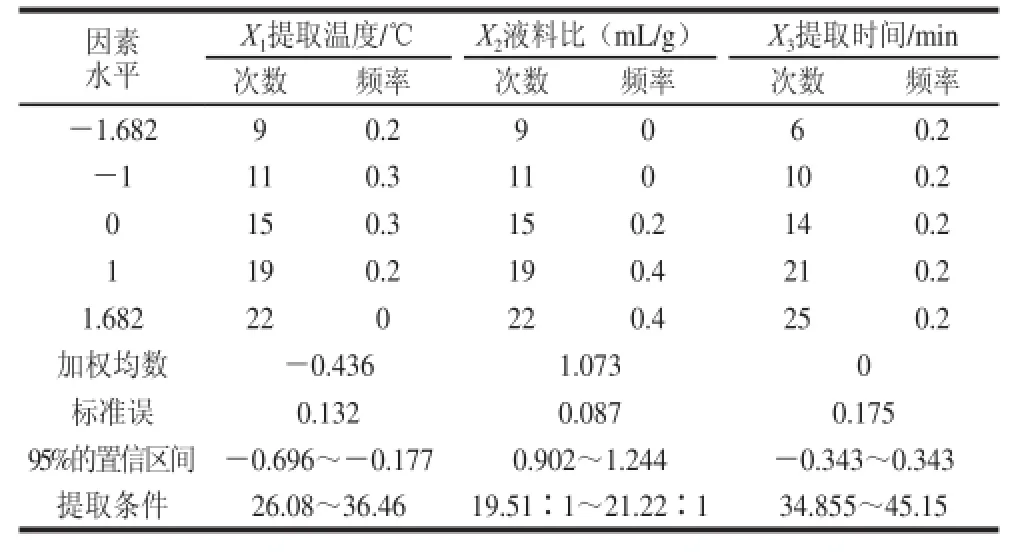
表4 優(yōu)化提取方案中Xi取值頻率分布表Table 4 Frequency distribution of Xiin the extraction optimization scheme
由表4可以看出,在95%的置信區(qū)間吸光度大于1.53的優(yōu)化方案為:提取溫度26.08~36.46 ℃、液料比19.51∶1~21.22∶1、提取時間38.285~45.15 min。為了貼近實際的工業(yè)化生產,可將優(yōu)化方案定為:提取溫度30 ℃、液料比20∶1(mL/g)、提取時間40 min。對此方案進行驗證實驗,色素溶液的吸光度為1.54,與優(yōu)化方案的理論值1.53比較接近,進一步證實了方案的可靠性。
2.4 老黑谷米色素的抗氧化活性
由表5可見,老黑谷米色素具有較強的抗氧化能力。其中DPPH自由基清除能力為(3 512.56±26.28)μg阿魏酸/g,FRAP為(44.04±6.60)mmol Fe2+/L,還原能力為(203.47±23.75)μg抗壞血酸/g,H2O2清除活性為(3 676.60±114.32)μg阿魏酸/g,ABTS+·清除能力為(2 778.70±262.90)μg Trolox/g。

表5 老黑谷米色素的抗氧化能力測定(以每克面粉計,干質量)Table 5 Antioxidant capacity of pigments from“Laoheigu”eigu rice ice (per g dry weight of flour)
3 結 論
老黑谷米色素是一種醇溶性色素,乙醇提取效果最佳,在282 nm和342 nm處有最大吸收波長,初步定性為黃酮醇類物質。最佳提取工藝為:提取溫度30 ℃、液料比20∶1(mL/g)、提取時間40 min。該色素具有較好的抗氧化活性,可作為功能性的天然色素進一步開發(fā)利用,也為老黑谷米的開發(fā)利用提供新思路。
[1] BOO H O, HWANG S J, BAE C S, et al. Extraction and characterization of some natural plant pigments[J]. Industrial Crops and Products, 2012, 40: 129-135. DOI:10.1016/j.indcrop.2012.02.042.
[2] JOAQUIN-CRUZ E, DUENAS M, GARCIA-CRUZ L, et al. Anthocyanin and phenolic characterization, chemical composition and antioxidant activity of chagalapoli (Ardisia compressa K.) fruit: a tropical source of natural pigments[J]. Food Research International, 2015, 70: 151-157. DOI:10.1016/j.foodres.2015.01.033.
[3] TAN M X, GAN D H, WEIL X, et al. Isolation and characterization of pigment from Cinnamomum burmannii’ peel[J]. Food Research International, 2011, 44: 2289-2294. DOI:10.1016/ j.foodres.2010.05.022.
[4] MARANA J P, PRIYA B, NIVETHA C V. Optimization of ultrasound-assisted extraction of natural pigments from Bougainvillea glabra flowers[J]. Industrial Crops and Products, 2015, 63: 182-189. DOI:10.1016/j.indcrop.2014.09.059.
[5] 李永強, 楊士花, 高斌, 等. 黃酮對楊梅花色苷的輔色作用[J]. 食品科學, 2011, 32(13): 37-39.
[6] ZHANG J F, HOU X, AHMAD H. Assessment of free radicals scavenging activity of seven natural pigments and protective effects in AAPH-challenged chicken erythrocytes[J]. Food Chemistry, 2014, 145: 57-65. DOI:10.1016/j.foodchem.2013.08.025.
[7] VENIL C K, ZAKARIA Z A, AHMAD W A. Bacterial pigments and their applications[J]. Process Biochemistry, 2013, 48: 1065-1079. DOI:10.1016/j.procbio.2013.06.006.
[8] KULANDAISAMY V C, AKMAR Z Z, USHA R, et al. Isolation and characterization of flexirubin type pigment from Chryseobacterium sp. UTM-3T[J]. Biocatalysis and Agricultural Biotechnology, 2014, 3: 103-107. DOI:10.1016/j.bcab.2014.02.006.
[9] 楊曉娜, 徐玲, 趙昶靈, 等. 龍陵紫皮石斛色素的提取及其穩(wěn)定性[J]. 食品科學, 2015, 36(9): 49-54. DOI:10.7506/spkx1002-6630-201509010.
[10] 李亞輝, 馬艷弘, 黃開紅, 等. 超聲波輔助酶法提取黑莓酒渣中花色苷工藝優(yōu)化及其生物活性[J]. 食品科學, 2015, 36(6): 63-68. DOI:10.7506/spkx1002-6630-201506012.
[11] 呂曼曼, 劉航, 苗修港, 等. 超聲波輔助提取高粱全粉色素工藝及其體外抗氧化性分析[J]. 食品科學, 2014, 35(16): 39-45. DOI:10.7506/ spkx1002-6630-201516012.
[12] 陳鋼, 黃立山, 徐靜, 等. 黑莓花色苷的超聲波提取與抗氧化性活性研究[J]. 食品科學, 2012, 33(24): 117-121. DOI:10.7506/spkx1002-6630-201224024.
[13] PANGESTUTI R, KIM S K. Biological activities and health benefit effects of natural pigments derived from marine algae[J]. Journal of Functional Foods, 2011, 3: 255-266. DOI:10.1016/j.jff.2011.07.001.
[14] BORGES G D S C, VIEIRA F G K, COPETTI C, et al. Optimization of the extraction of flavanols and anthocyanins from the fruit pulp of euterpe edulis using the response surface methodology[J]. Food Research International, 2011, 44: 708-715. DOI:10.1016/ j.foodres.2010.12.025.
[15] MARAN J P, PRIYA B, NIVETHA C V. Optimization of ultrasoundassisted extraction of natural pigments from Bougainvillea glabra flowers[J]. Industrial Crops and Products, 2015, 63: 182-189. DOI:10.1016/j.indcrop.2014.09.059.
[16] 李月嘉, 楊士花, 李永強, 等. 響應面法優(yōu)化玉米花粉黃酮提取工藝的研究[J]. 食品與發(fā)酵科技, 2010, 48(3): 30-33. DOI:10.3969/ j.issn.1674-506X.2012.03-008.
[17] TAKAHAMA U, YAMAUCHI R, HIROTA S. Isolation and characterization of a cyanidin-catechin pigment from adzuki bean (Vigna angularis)[J]. Food Chemistry, 2013, 141: 282-288. DOI:10.1016/j.foodchem.2013.02.113.
[18] 李永強, 楊士花, 付曉萍, 等. 多酚對楊梅花色苷的輔色作用及穩(wěn)定性的影響[J]. 食品與發(fā)酵科技, 2011, 37(4): 64-67.
[19] 李永強, 楊士花, 岳曉川, 等. 野生滇橄欖多酚提取工藝的優(yōu)化[J]. 中國食物與營養(yǎng), 2015, 21(1): 46-50. DOI:10.3969/ j.issn.1006-9577.2015.01.012.
[20] AK T, GULCIN I. Antioxidant and radical scavenging properties of curcumin[J]. Chemico-Biological Interactions, 2008, 174: 27-37. DOI:10.1016/j.cbi.2008.05.003.
[21] BENZIE I F F, STRAIN J J. The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”: the FRAP assay[J]. Analytical Biochemistry, 1996, 239: 70-76. DOI:10.1016/ abio.1996.0292.
[22] RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine, 1999, 26(9/10): 1231-1237. DOI:10.1016/S0891-5849(98)00315-3.
[23] CHANDRASEKARA A, SHAHIDI F. Content of insoluble bound phenolics in millets and their contribution to antioxidant capacity[J]. Journal of Agricultural and Food Chemistry, 2010, 58: 6706-6714. DOI:10.1021/jf100868b.
[24] CHANDRASEKARA A, NACZK M, SHAHIDI F. Effect of processing on the antioxidant activity of millet grains[J]. Food Chemistry, 2012, 133: 1-9. DOI:10.1016/j.foodchem.2011.09.043.
[25] 徐任生, 周炳南. 黃酮體化合物鑒定手冊[M]. 北京: 科學出版社, 1981.
Optimization of Extraction and Antioxidant Activities in Vitro of Pigments from the Grains of “Laoheigu” Rice
HUANG Jiaqi1, YANG Shihua2, CHU Yajie1, TAO Liang3, FENG Zhixiang1, LI Huajun1, YAN Yan1, LI Xueliang1, LI Yongqiang1,*
(1. College of Food Science and Technology, Yunnan Agricultural University, Kunming 650201, China; 2. College of Foreign Languages, Yunnan Agricultural University, Kunming 650201, China; 3. College of Plant Protection, Yunnan Agricultural University, Kunming 650201, China)
The extraction process for pigments from the grains of “Laoheigu” rice, a red-grained rice variety grown in Pantiange town, Diqing prefecture, Yunnan province was optimized by quadratic general rotary design based on single factor experiments and the antioxidant activities in vitro of the extracted pigments were investigated. The results showed that the best extraction solvent for the pigments was determined as alcohol and the maximum absorption peaks appeared at 282 and 342 nm, suggesting that they were flavonol compounds. The optimum extraction conditions were as follows: extraction temperature, 30 ℃; liquid to material ratio, 20:1 (mL/g); and extraction time, 40 min. The pigments had potent antioxidant activities; DPPH radical scavenging activity was (3 512.56 ± 26.28) μg ferulic acid equivalents/g; ferric reducing antioxidant power (FRAP) was (44.04 ± 6.60) mmol Fe2+equivalents/L; reducing power (RP) was (203.47 ± 23.75) μg ascorbic acid equivalents/g; hydrogen peroxide scavenging activity was (3 676.60 ± 114.32) μg ferulic acid equivalents/g, and 2,2’-azinobis (3-ethylbenzothiazoline-6-sulfonate) (ABTS) radical scavenging activity was (2 778.70 ± 262.90) μg Trolox equivalents/g.
“Laoheigu” rice; pigments; quadratic general rotary design; extraction; antioxidant activity
10.7506/spkx1002-6630-201602004
TS201.4
A
1002-6630(2016)02-0019-06
黃佳琦, 楊士花, 初雅潔, 等. 老黑谷米色素的提取工藝優(yōu)化及體外抗氧化活性分析[J]. 食品科學, 2016, 37(2): 19-24. DOI:10.7506/spkx1002-6630-201602004. http://w ww.spkx.net.cn
HUANG Jiaqi, YANG Shihua, CHU Yajie, et al. Optimization of extraction and antioxidant activities in vitro of pigments from the grains of “Laoheigu” rice[J]. Food Science, 2016, 37(2): 19-24. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201602004. http://www.spkx.net.cn
2015-06-02
國家自然科學基金面上項目(31360378;31560428);云南省自然科學基金項目(2013FB042);云南省高校食品加工與安全控制重點實驗室項目(201401);國家大學生創(chuàng)新創(chuàng)業(yè)訓練計劃項目(201510676001)
黃佳琦(1993—),女,碩士研究生,研究方向為天然產物化學。E-mail:601017577@qq.com
*通信作者:李永強(1975—),男,副教授,博士,研究方向為食品科學。E-mail:Liyongqiang7512@163.com

