SphK1在膀胱尿路上皮癌中的表達及對其增殖和轉移的影響
孟曉東,邱建宏*,周占松,趙新鴻
(1.中國人民解放軍白求恩國際和平醫院泌尿外科,河北 石家莊 050082;2.中國人民解放軍第三軍醫大學第一附屬醫院泌尿外科,重慶 400038)
?
·泌外專欄論著·
SphK1在膀胱尿路上皮癌中的表達及對其增殖和轉移的影響
孟曉東1,邱建宏1*,周占松2,趙新鴻1
(1.中國人民解放軍白求恩國際和平醫院泌尿外科,河北 石家莊 050082;2.中國人民解放軍第三軍醫大學第一附屬醫院泌尿外科,重慶 400038)
目的探討鞘氨醇激酶1(sphingosine kinases-1, SphK1)在膀胱尿路上皮癌中的表達及其對尿路上皮癌細胞增殖和轉移的影響。方法逆轉錄定量聚合酶聯反應(quantitative real time polymerase chain reaction,qRT-PCR)方法檢測膀胱癌患者膀胱癌組織和鄰近的正常組織SphK1 mRNA的表達。以佛波醇12-豆蔻酸酯13-乙酸酯(phorbol 12-myristate 13-acetate,PMA)為SphK1激活劑、二甲基鞘氨醇(N-dimethyl D-erythrosphingsine,DMS)為SphK1抑制劑、0.9%NaCl為空白試劑將膀胱癌BIU-87細胞株分別處理為激活組、抑制組和空白對照組。采用CCK-8法檢測各組細胞的增殖情況。Matrigel三維培養法觀察各組細胞血管生成擬態(vasculogenic mimicry, VM)形成能力。結果對比膀胱尿路上皮癌組織及鄰近正常組織,發現癌組織中SphK1 mRNA的表達顯著高于癌旁正常組織;SphK1激活劑可促進BIU-87細胞增殖,促進Matrigel構建的三維培養系統中VM的形成。SphK1抑制劑則能抑制BIU-87細胞增殖,三維培養中不能形成管狀VM。結論SphK1在膀胱尿路上皮癌發生發展中發揮著重要的作用,其機制可能與促進癌細胞增殖及促進VM形成有關。
膀胱腫瘤;鞘氨醇激酶1;細胞增殖doi:10.3969/j.issn.1007-3205.2016.10.007
膀胱癌是泌尿系統中易發的首位腫瘤[1],具有較高的發病率和病死率。其中尿路上皮癌是其最常見的病理類型[2]。目前治療措施主要有手術、適形放療和局部灌注或全身化療等,但是經上述措施單獨或合并治療后還經常出現腫瘤再發甚至轉移,預后不良[3]。脂類組學的研究發現鞘脂參與細胞的信號調控進程,進而影響細胞周期并具有調控細胞凋亡的作用[4]。其中鞘氨醇激酶1(sphingosine kinase 1,SphK1)通過調控鞘脂代謝的平衡,在細胞的增殖、轉化、遷移等眾多生物學行為中發揮了重要作用[5]。研究發現SphK1在多數細胞中普遍表達,但其在多種腫瘤中表達異常,包括乳腺癌、結腸癌、肺癌、宮頸癌等[6]。本研究旨在探討SphK1在膀胱尿路上皮癌中的表達及其功能,報告如下。
1 資料與方法
1.1患者情況及組織來源收集2005年7月—2011年1月在中國人民解放軍白求恩國際和平醫院泌尿外科住院行手術治療的膀胱癌患者的冰凍腫瘤病理組織及癌旁組織。患者情況:男性41例,女性11例,年齡33~82歲,平均(57.0±19.7)歲。術前未行任何形式(腔內或開放)手術處理并且未行任何形式的放射性治療、化學藥物治療及中成藥物治療。術后病理診斷符合:尿路上皮癌1級(G1);尿路上皮癌2級(G2);尿路上皮癌3級(G3)。手術或活組織檢查切下腫瘤組織后,30 min內無菌條件下將腫瘤組織用滅菌生理鹽水沖洗兩遍后切除3/4用于病理檢查,1/4用于凍存。選取的標本包括同一患者的腫瘤組織及瘤旁組織(距離病變部位2 cm以外),2~5 mm,共52對。
本研究經中國人民解放軍白求恩國際和平醫院倫理委員會批準,患者和家屬均知情并簽署知情同意書。
1.2細胞來源購自中國科學院典型培養物保藏中心昆明細胞庫。細胞株名稱:人膀胱移行細胞癌細胞株(BIU-87)。組織來源:膀胱。形態特征:上皮樣細胞。培養條件:完全培養基,90%RPMI-1640培養液(內含2 mmol/L谷氨酰胺)+10%胎牛血清(fetal bovine serum,FBS),將其置于37 ℃,5% CO2培養箱內常規條件下培養擴增,0.25%胰酶消化,傳代。
1.3主要試劑90% RPMI-1640培養液、10%FBS、青鏈霉素雙抗溶液、磷酸鹽緩沖液、二甲基亞砜、胰蛋白酶均購于美國Gibco公司。Sphk1激動劑佛波醇12-豆蔻酸酯13-乙酸酯(Phorbol 12-myristate 13-acetate,PMA)購自美國Sigma-Aldrich公司。SphK1抑制劑二甲基鞘氨醇(N-dimethylsphingisine,DMS)購自上海惠誠生物科技有限公司。Martrigel膠購自美國BD,Bioscience公司。無血清培養基購自美國Gibco公司。Hank′s液購自德國Merck公司。CCK-8試劑盒購自廣州奕源科技公司。Trizol購自Invitrogen15596-026。cDNA合成試劑盒、Premix Ex TaqTM購自日本TaKaRa公司。引物、探針委托太原科瑞斯克公司合成。
1.4逆轉錄定量聚合酶聯反應(quantitative real time polymerase chain reaction,qRT-PCR)檢測將新鮮凍存的膀胱腫瘤組織及配對癌旁組織液氮研磨,Trizol法提取總RNA,紫外分光光度法測定所提RNA純度和濃度;變性瓊脂糖凝膠電泳法測定所提取RNA質量,檢測28s、18s條帶的完整性。按照反轉錄試劑盒上的步驟反轉錄成cDNA,以cDNA為模板行PCR擴增。引物合成及探針標記委托太原科瑞斯克公司完成。SphK1:上游為5′-CTTGCAGCTCTTCCGGAGTC-3′;下游為5′-GCTCAGTGAGCATCAGCGTG-3′。SphK1 Probe為5′-(FAM)CCCTTTTGGCTGAGGCTGAAAT-CTCC(TAMRA)-3′。擴增長度77bp。內參選GAPDH:上游為5′-GACTCATGACCACAGTCC-ATGC-3′;下游為5′-AGAGGCAGGGATGATG-TTCTG-3′。GAPDH Probe為5′-(FAM)CATCA-CTGCCACCCAGAAGACTGTG(TAMRA)-3′。擴增長度123bp。用2-△△Ct法評估SphK1 mRNA的水平。
1.5BIU-87細胞分組培養處于對數生長期的BIU-87細胞,吸凈舊培養液,消化液消化,加入完全培養基停止消化過程。移液器將細胞懸浮液移入離心管中,1 000 r/min離心3 min,棄上清,加入細胞培養液,調整濃度為10 000個/100 μL,移液器將細胞懸浮液加入96孔板中,每5孔為1個重復,依次加入PMA(100 mmol/L),DMS(80 μmol/L)及等量0.9%NaCl[7]。37 ℃、5%CO2、飽和濕度培養箱中培養。
1.6觀察BIU-87細胞增殖能力的方法將BIU-87細胞行胰酶消化并進行細胞計數,調整細胞濃度為10 000個/100 μL。用移液器將細胞懸液混勻后加入到96孔板中,每孔加入100 μL細胞懸液,并設置完全培養基調零孔,每孔設置5個重復,分為PMA組、DMS組和空白對照組(0.9%NaCl),加入相應藥物并于37 ℃、5%CO2、飽和濕度培養箱中分別培養4、6、12、24、48 h。每孔加入10 μL CCK-8溶液,注意不要加入氣泡以免影響OD值。繼續培養3 h。在紫外分光光度計中檢測各組450 nm吸光度值。
1.7觀察各組血管生成擬態(vasculogenic mimicry,VM)形成能力的方法將Matrigel在-4 ℃下放置12 h融化為液態。Eppendoff移液器槍頭和24孔細胞培養板置于冰上預冷。在24孔細胞培養板上每孔內加入300 μL Matrigel原液,搖動以使之均勻分布于孔的各個位置,避免氣泡產生。37 ℃培養箱內孵育此板30 min使其凝固,完成膠的包被。0.25%胰酶消化各處理組細胞為單細胞懸液狀態,移液槍在每孔內接種1 mL濃度為5×105/mL的各實驗組及對照組BIU-87細胞懸液,分別置于37 ℃、CO2培養箱下繼續培養。12 h后終止培養,觀察各組BIU-87細胞在膠中形成交叉的網狀結構,說明BIU-87細胞形成血管的雛形,稱其為VM。照相記錄各組細胞管狀結構排列情況和完整程度:倒置顯微鏡下(×200)視野內隨機取上、下、左、右、中5個視野,照相記錄并計數類似管狀結構數量,取每個視野的均值。
1.8統計學方法應用SSPS 19.0統計軟件進行數據分析,計量資料比較分別采用成對樣本的t檢驗、單因素方差分析和SNK-q檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1膀胱癌組織及癌旁組織中SphK1 mRNA的含量通過qRT-PCR方法檢測52對冰凍膀胱癌組織及其鄰近正常組織,發現SphK1 mRNA含量不同,腫瘤組織的相對表達量(3.51±1.19)高于正常膀胱黏膜組織的相對表達量(1.07±0.56),差異有統計學意義(t=13.379,P<0.01)。
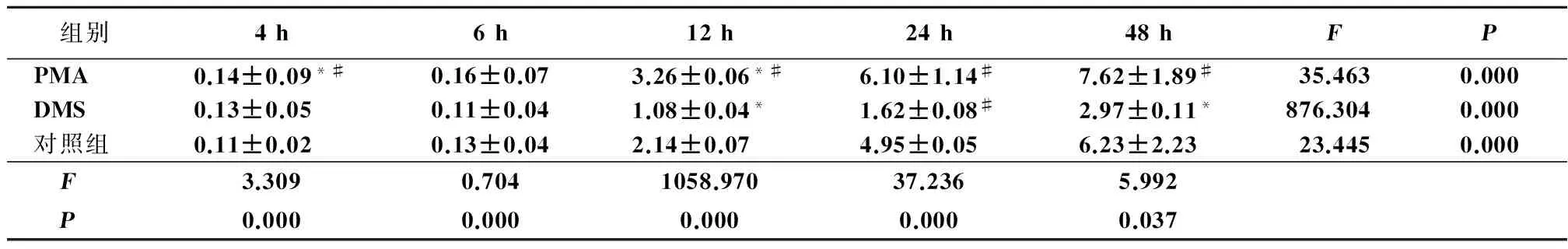
2.2各BIU-87細胞株增殖能力的變化不同組細胞在不同作用時間后,在紫外分光光度計中檢測450 nm吸光度值,各組BIU-87細胞通過不同處理,增殖能力表現不同,3組在培養6 h之內趨于穩定,都有隨著培養時間延長增殖逐漸增強趨勢(P<0.01);對照組從12~48 h呈現出緩慢增殖狀態(P<0.05),而PMA組較對照組的增殖能力明顯增強(P<0.05),DMS組的細胞增殖能力受到了明顯抑制(P<0.05)。見表1,圖1。
表1各組不同時點吸光值的單因素方差分析
組別4h6h12h24h48hFPPMA0.14±0.09*#0.16±0.073.26±0.06*#6.10±1.14#7.62±1.89#35.4630.000DMS0.13±0.050.11±0.041.08±0.04*1.62±0.08#2.97±0.11*876.3040.000對照組0.11±0.020.13±0.042.14±0.074.95±0.056.23±2.2323.4450.000F3.3090.7041058.97037.2365.992P0.0000.0000.0000.0000.037
*P<0.01與對照組比較#P<0.05,與DMS組比較(SNK-q檢驗)
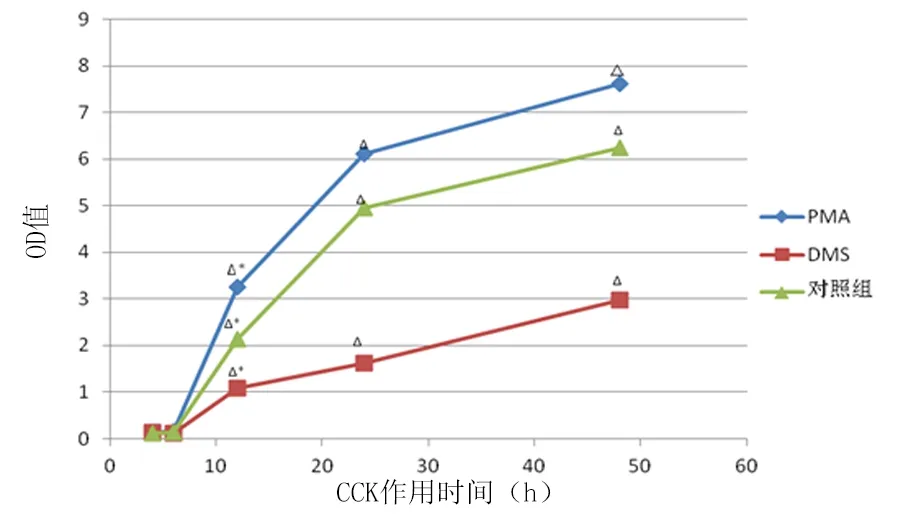
圖1不同處理組不同時間OD值變化
Figure 1The OD changes of different groups in different time
2.3各組VM形成能力比較按照上述方法將各組細胞加入膠12、16、24 h后,照相記錄各組細胞管狀結構排列情況和完整程度。觀察24 h,對照組和DMS組均無明顯VM形成;PMA組培養12 h無明顯變化,16 h有些纖維狀物質出現,到24 h已有明顯的血管狀結構出現(圖2)。
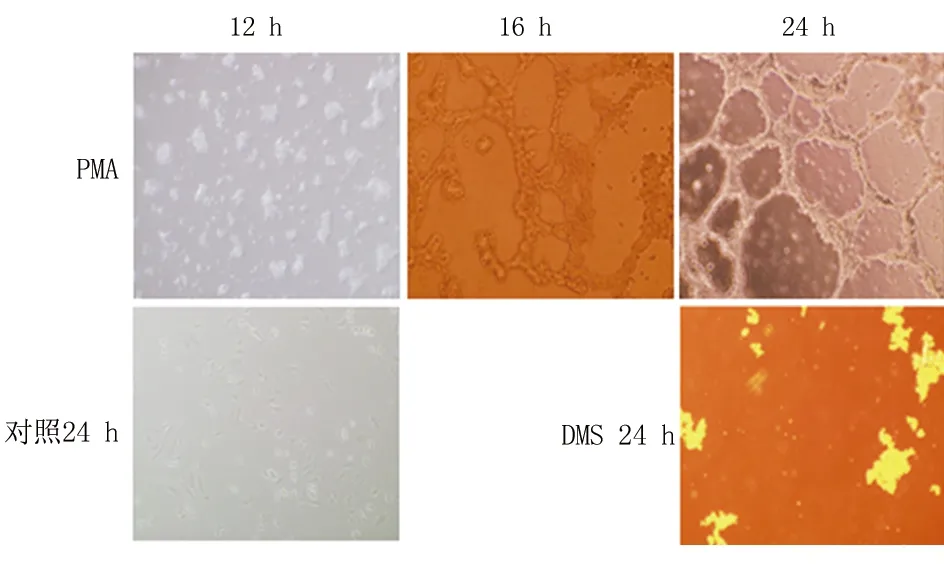
圖2Matrigel三維培養法觀察各組VM能力
Figure 2Matrigel three-dimensional culture method to observe vasculogenic mimicry ability
3 討 論
現代腫瘤學研究發現,膀胱癌的發生發展、侵襲轉移是一個復雜的病理生理過程,受許多因素影響。多項研究證實了在膀胱癌的病程中,諸如趨化因子受體CXCR4及其配體基質細胞衍生因子1[8-9]、基質金屬蛋白酶中MMP-2、MMP-9[10-11]、VEGF[12]、整合素(Integrin)[13]、E-黏附素、γ連接素(γ-catenins)[14]、膀胱癌腫相關抗原(bladder tumor associated antigen,BTA)、核基質蛋白22(nuclear martrix protein 22,NMP22)等,在膀胱腫瘤組織中的表達較正常膀胱黏膜組織出現異常[15],而且其表達與膀胱癌的惡性程度、浸潤、轉移等生物學行為有關。其中有些甚至可以作為影響膀胱癌進展預后情況的獨立因素。還有研究發現腫瘤轉移相關基因如LOH[16]、KAI-1[17]及腫瘤抑制基因PTEN[18]等在膀胱癌組織中表達異常,且與膀胱腫瘤的發生發展、侵襲轉移有關。這些腫瘤相關細胞因子及基因均有可能作為膀胱腫瘤診斷以及防治的新靶點,針對這些分子在腫瘤發展中的作用實施特意的調控措施將會影響腫瘤的生長和發展。這些基礎研究對尋找診治膀胱癌的分子治療靶點具有十分重要的意義。
脂類代謝在腫瘤的發生發展中也起到了重要的作用:脂類中鞘磷脂的生物學行為不僅包括細胞膜的代謝與調節,也參與了腫瘤的發生發展及浸潤擴散。鞘磷脂的活性代謝產物中鞘氨醇1-磷酸(sphingosine1-phosphate,S1P),神經酰胺(ceramide,Cer)和鞘氨醇(sphingosine,Sph)均是重要的信號分子。S1P具有促進細胞的生長、增殖和生存,刺激新生血管生成,抑制細胞凋亡的功能,而Cer與Sph則起著相反的作用,它們的功能與啟動細胞凋亡進程及細胞周期變化有關。Cer/Sph:S1P維持一個動態平衡,這個動態的相對平衡決定了這個細胞的命運,決定了它能否繼續生存。當平衡傾向于Cer/Sph時,細胞就準備進入程序性死亡途徑;而當S1P水平增加時細胞會繼續生存并出現增殖。這就是所謂的“鞘脂類可調變阻器(sphingolipid-rheostat)”[4-5]。通過此機制的調節,可以實現對細胞生物學活動的影響,該理論為癌癥治療研究提供了新的思路。
多項研究發現SphK1在腫瘤組織中較正常組織表達明顯升高,已經證實在包括乳腺癌、黑色素癌、肺癌、結腸癌、宮頸癌、胃癌、子宮癌、腎癌、直腸癌等腫瘤患者中,共241對癌組織與癌旁正常組織通過癌癥分析陣列(clontech)相比,癌組織中的SphK1 mRNA表達較癌旁正常組織高出約2倍[19]。在http://www.oncomine.org/,http://www.ncbi.nlm.nih.gov/geo/的網站上都可以查到經N-甲基-N-亞硝脲(N-methyl-N-nitrosourea,NMU)誘導的小鼠乳腺癌模型、經他莫西芬治療后復發的乳腺癌患者的癌組織中、黑色素瘤皮膚癌、晚期的宮頸癌、浸潤性膀胱癌、樹突狀膠質瘤、頭頸部癌、白血病(包括B、T細胞急性淋巴細胞白血病和急性髓系白血病)、成年男性生殖細胞瘤等腫瘤組織的芯片分析顯示SphK1的表達有統計學意義上的顯著增加。本研究結果顯示SphK1在膀胱尿路上皮癌中像其他腫瘤一樣同樣存在表達異常,膀胱癌組織SphK1的表達明顯高于癌旁正常組織,差異有統計學意義。
腫瘤細胞的增殖與轉移是影響腫瘤疾病患者預后好壞的重要原因。增殖、轉移是一個復雜的病理生理過程,其進程受許多因素影響,最核心的原因源自于腫瘤細胞的增殖與轉移能力。如前所述在可調脂質變阻器的動態平衡中SphK1起到了關鍵酶的作用。細胞內Cer、Sph水平上升可由調控SphK1的活性下降實現,S1P水平下降,進而促進細胞進入凋亡。SphK1表達的變化不僅改變脂類分子的平衡,還能影響細胞周期,周期內不同階段轉化的速率、腫瘤組織中S期細胞數量可受其上調而增加和提高,而腫瘤細胞的倍增時間會減少,進而促進腫瘤細胞的生長。另外,其底物外源性S1P也會抑制腫瘤細胞的凋亡。外源性S1P分泌出胞,可作為第二信使與細胞膜上的S1P受體結合,S1P受體屬于GPCR蛋白家族,不同受體在不同時間的表達激活會起到不同的生物學功能,GPCR蛋白家族的激活引發一些列下游信號,如Ras/Raf/ERK、PI3K/AKT/mTOR、Rac/Rho等。這些信號通路與細胞遷移、侵襲、增殖及血管新生都密切相關[20]。腫瘤的生物學特征之一即表現為迅速、不受控制的生長,為了保證其快速的增長速度,腫瘤組織都伴有豐富的血液供應。血供如果欠佳會導致缺氧,缺氧產生的刺激信號會促進新的血管的生成。研究發現腫瘤血管新生過程是一系列互相關聯的事件構成,諸如內皮細胞游離,細胞外基質崩解,血管內皮細胞增殖和遷移,雛形血管構建、延伸,與瘤內部相溝通,內皮祖細胞的募集,血管擬態和淋巴管擬態形成等。S1P可通過其受體來維持內皮細胞聚集構成完整的屏障,促進其向血管擬態結構方向的轉變,從而完成新生血管的形成[21]。Schwalm等[22]通過研究發現人腦膠質瘤U87MG細胞在缺氧條件下的SphK1 mRNA和蛋白質表達均呈上調態勢,而通過siRNA抑制SphK,減少細胞內的S1P生產和釋放,進而能阻止低氧誘導因子HIF-2α的表達。Ader等[23]的研究發現,在低氧環境下培養人類腫瘤細胞系腫瘤細胞,如前列腺癌、腦膠質瘤、乳腺癌、腎癌、肺癌,抑制SphK1活性能抑制HIF-1α的積累和轉錄活性。這些研究都表明在處于缺氧狀態的腫瘤細胞中,SphK1為新生血管的建立以改變腫瘤的缺氧狀態起到了重要作用。Kolmakova等[24]的研究直接表明,SphK1可能在新生血管生成的調節中起作用,抑制其表達能夠抑制新生血管的形成。此外,Limaye等[25]的研究表明,SphK1的高表達能夠通過PECAM-1依賴的PI-3K/AKt激活以及調節Bcl-2家族活性來增強在缺氧條件下內皮細胞的存活,這說明在缺氧條件下高表達SphK1可能促進新生血管形成。Mizugishi等[26]在雙敲除SphK1和SphK2基因的小鼠中發現,小鼠的神經系統和脈管系統都存在發育紊亂,失去正常結構。對多種腫瘤細胞的研究均提示SphK1/S1P參與了VEGF以及血管新生的調節。
目前關于SphK1其是否參與尿路上皮癌細胞的增殖及侵襲轉移過程,通過什么具體通路,是調控信號蛋白還是直接作用,都尚不清楚。本研究從該分子著手,在腫瘤細胞水平,選用我國自行培養的人類膀胱癌細胞系BIU-87細胞株,通過用SphK1激動劑PMA、SphK1抑制劑DMS處理BIU-87細胞,并設空白對照組,研究干預措施直接作用此分子后,觀察腫瘤細胞增殖、轉移功能是否出現變化。通過采取 CCK-8 法檢測經處理后的不同組BIU-87細胞之間增殖能力變化,結果顯示經PMA處理后的BIU-87細胞(PMA組)較對照組增殖能力增強,特別是在培養12 h以后,細胞的增殖能力明顯升高,而經DMS處理的BIU細胞(DMS組)增殖能力較對照組受到了明顯抑制。本研究采取Matrigel三維培養法觀察腫瘤細胞的VM形成能力,觀察24 h,對照組和DMS組均無明顯VM形成,PMA組培養12 h無明顯變化,16 h有些纖維狀物質出現,到24 h已有明顯的血管狀結構出現,表明SphK1激活劑作用于BIU-87細胞后才出現了VM趨勢。而膀胱癌細胞具有激活SphK1的作用,本研究顯示SphK1在細胞水平即可檢測到,也說明癌細胞具備了血管生成能力,能促進膀胱腫瘤的增殖、侵襲,為其進一步轉移擴散提供了基礎。
總之,SphK1在膀胱尿路上皮癌中高表達,其表達程度與腫瘤的發生發展有關,其機制與SphK1提高腫瘤細胞的增殖能力、促進腫瘤細胞VM形成等機制有關。本研究對以SphK1為靶點的分子腫瘤治療提供了一定理論依據。
[1]Parkin DM. The global burden of urinary bladder cancer[J]. Scand J Urol Nephrol Suppl,2008,(218):12-20.
[2]Gray M,Sims TW. NMP-22 for bladder cancer screening and surveillance[J]. Urol Nurs,2004,24(3):171-172,177-179,186.
[3]黃健,林天歆,李鍇文,等. 膀胱癌精準治療現狀與展望[J].中華泌尿外科雜志,2014,36(7):484-485.
[4]Ogretmen B,Hannun YA. Biologically active sphingolipids in cancer pathogenesis and treatmen[J]. Nature Rev Cancer,2004,4(8):604-616.
[5]Spiegel S,Milstien S. Sphingosine-1-phosphate:an enigmatic signalling lipid[J]. Nat Rev Mol Cell Biol,2003,4(5):397-407.
[6]French KJ,Schrecengost RS,Lee BD,et al. Discovery and evaluation of inhibitors of human sphingosine kinase[J]. Cancer Res,2003,63(18):5962-5969.
[7]Sauer L,Nunes J,Salunkhe V,et al. Sphingosine kinase 1 inhibition sensitizes hormone-resistant prostate cancer to docetaxel[J]. J Cancer,2009,125(11):2728-2736.
[8]Juarez J,Bendall L,Bradstock K. Chemokines and their receptors as therapeutic targets:the role of the SDF-1 /CXCR4 axis[J]. Curr Pharm Des,2004,10(11):1245-1259.
[9]Wang H,Yang D,Wang K,et al. Expression and potential role of chemokine receptor CXCR4 in human bladder carcinoma cell lines with different metastatic ability[J]. Mol Med Report,2011,4(3):525-528.
[10]Sier CF,Casetta G,Verheijen JH,et al. Enhanced urinary gelatinase activities(matrix metalloproteinases 2 and 9) are associated with early-stage bladder carcinoma:a comparison with clinically used tumor marker[J]. Clin Cancer Res,2000,6(6):2333-2340.[11]Zeng ZS,Cohen AM,Guillem JG. Loss of basement membrane type Ⅳ collagen is associated with increased expression of metalloproteinases 2 and 9(MMP-2 and MMP-9) during human colorectal tumorigenesis[J]. Carcinogenesis,1999,20(5):749-755.
[12]Chow NH,Liu HS,Chan SH,et al. Expression of vascular endothelial growth factor in primary superficial bladder cancer[J]. Anticancer Res,1999,19(5C):4593-4597.
[13]Kausch I,B?hle A.Molecular aspects of bladder cancer Ⅲ.Prognostic markers of bladder cancer[J]. Eur Urol,2002,41(1):15-29.
[14]Clairotte A,Lascombe I,Fauconnet S,et al.Expression of E-cadherin and alpha-,beta-,gamma-catenins in patients with bladder cancer:identification of gamma-catenin as a new prognostic marker of neoplastic progression in T1 superficial urothelial tumors[J]. Am J Clin Pathol,2006,125(1):119-126.
[15]Emerson RE,Cheng L. Immunohistochemical markers in the evaluation of tumors of the urinary bladder[J]. Anal Quant Cytol Histol,2005,27(6):301-316.
[16]Hartmann A,Schlake G,Zaak D,et al. Occurrence of chromosome 9 and p53 alterations in multifocal dysplasia and carcinoma in situ of human urinary bladder[J]. Cancer Res,2002,62(3):809-818.
[17]Ow K,Delprado W,Fisher R,et al. Relationship between expression of the KAI1 metastasis suppressor and other markers of advanced bladder cancer[J]. J Pathol,2000,191 (1):39-47.
[18]Tanaka M,Grossman HB. In vivo gene therapy of human bladder cancer with PTEN suppresses tumor growth,downregulates phosphorylated Akt,and increases sensitivity to doxorubicin[J]. Gene Ther,2003,10(19):1636-1642.
[19]French KJ,Schrecengost RS,Lee BD,et al. Discovery and evaluation of inhibitors of human sphingosine kinase[J]. Cancer Res,2003,63(18):5962-5969.
[20]Yester J,Tizazu E,Harikumar K,et al. Extracellular and intracellular sphingosine-1-phosphate in cancer[J]. Cancer Metastasis Rev,2011,30(3/4):577-597.
[22]Schwalm S,D?ll F,R?mer I,et al. Sphingosine kinase-1 is a hypoxia-regulated gene that stimulates migration of human endothelial cells[J]. Biochem Biophys Res Commun,2008,368(4):1020-1025.
[23]Ader I,Brizuela L,Bouquerel P,et al.Sphingosine kinase1:a new modulator of hypoxia inducible factor 1 alpha during hypoxia in human cancer cells[J]. Cancer Res,2008,68(20):8635-8642.
[24]Kolmakova A,Rajesh M,Zang D,et al. VEGF recruits lactosylceramide to induce endothelial cell adhesion molecule expression and angiogenesis in vitro and in vivo[J]. Glycoconj J,2009,26(5):547-558.
[25]Limaye V,Li X,Hahn C,et al. Sphingosine kinase-1 enhances endothelial cell survival through a PECAM-1-dependent activation of PI-3K/Akt and regulation of Bcl-2 family members[J]. Blood,2005,105(8):3169-3177.
[26]Mizugishi K,Yamashita T,Olivera A,et al. Essential role for sphingosine kinases in neural and vascular development[J].Mol Cell Biol,2005,25(24):11113-11121.
(本文編輯:許卓文)
Expression of SphK1 and its effect on the proliferation and metastasis of bladder transitional cell carcinoma
MENG Xiao-dong1, QIU Jian-hong1*, ZHOU Zhan-song2, ZHAO Xin-hong1
(1.Department of Urology, the Bethune International Peace Hospital, Shijiazhuang 050082,China;2.Department of Urology, Southwest Hospital, the Third Military Medical University, Chongqing 400038, China)
ObjectiveTo investigate the sphingosine kinase 1(SphK1) expression in bladder urothelial carcinoma and effects on the proliferation and metastasis of urothelial cancer cells. MethodsThe expression of mRNA in bladder urothelial cancer tissue and adjacent normal tissue SphK1 was detected by qRT-PCR method. Phorbol 12-myristate 13-acetate(PMA) was used as SphK1 activator. N-dimethyl D-erythrosphingsine (DMS)was used as SphK1 inhibitor. 0.9% NaCl reagent was used as blank control. Bladder cancer cell line BIU-87 was treated as active group, control group and blank control group. The cell proliferations in each group were measured by CCK-8 method. Matrigel method was used to observe the vascular cells vasculogenic mimicry(VM) forming ability in three-dimensional culture method. ResultsThe expression of SphK1 mRNA in bladder urothelial cancer tissue was significantly higher than that in adjacent normal tissue. SphK1 activator can promote the proliferation of BIU-87 cells and to promote the formation of VM in the three dimensional culture system constructed by Matrigel. SphK1 inhibitors can inhibit the proliferation of BIU-87 cells, and can not form a tubular VM in three dimensional culture. ConclusionSphK1 plays an important role in the occurrence and development of bladder cancer, and its mechanism may be related to promoting the proliferation of cancer cells and promoting the formation of VM.
bladder cancer ;sphingosine kinase 1; cell proliferation
2016-10-20;
2016-10-24
孟曉東(1977-),男,河北石家莊人,中國人民解放軍
。E-mail:hpyyqiujh@163.com
R737.14
A
1007-3205(2016)10-1139-06
白求恩國際和平醫院主治醫師,醫學博士,從事泌尿外科疾病診治研究。

