鎖陽提取物對肝纖維化模型大鼠的改善作用及其機制研究Δ
李榮華,王航宇,林友勝,劉漪淪,李卉園,黃小梅,唐琳梅,何海林,崔 浪,鄧峰美#(.成都醫學院基礎醫學院,成都 60500;.石河子大學藥學院,新疆石河子 8000;.成都醫學院第一附屬醫院,成都60500)
·實驗研究·
鎖陽提取物對肝纖維化模型大鼠的改善作用及其機制研究Δ
李榮華1*,王航宇2,林友勝1,劉漪淪3,李卉園1,黃小梅1,唐琳梅1,何海林1,崔浪1,鄧峰美1#(1.成都醫學院基礎醫學院,成都610500;2.石河子大學藥學院,新疆石河子832000;3.成都醫學院第一附屬醫院,成都610500)
目的:考察鎖陽提取物對肝纖維化模型大鼠的改善作用及其機制。方法:將90只SD大鼠隨機分為正常組、模型組、秋水仙堿組(陽性藥物,0.2 mg/kg)和鎖陽提取物低、中、高劑量組(50、100、200 mg/kg),每組15只。除正常組外,其余各組大鼠均采用四氯化碳法復制肝纖維化模型。成模后,各給藥組大鼠ig相應藥物,正常組和模型組大鼠ig生理鹽水,每天1次,連續6周。給藥結束后,檢測大鼠血清肝功能指標[天冬氨酸轉氨酶(AST)、丙氨酸轉氨酶(ALT)、堿性磷酸酶(ALP)、肌酸激酶(CK)]水平;采用蘇木精-伊紅和Masson法染色后觀察大鼠肝臟病理變化;檢測血清和肝組織中轉化生長因子β1(TGF-β1)水平并計算大鼠肝臟指數。結果:與正常組比較,模型組大鼠肝臟指數,血清中AST、ALT、CK、ALP水平以及血清和肝組織中TGF-β1水平升高(P<0.05);病理觀察結果顯示,模型組大鼠肝組織發生明顯纖維化病變。與模型組比較,除鎖陽提取物中劑量組大鼠血清中ALP、CK外,秋水仙堿組和鎖陽提取物中、高劑量組其余各指標均顯著改善,鎖陽提取物低劑量組僅ALT得到明顯改善(P<0.05);各給藥組大鼠肝纖維化程度減輕。結論:鎖陽提取物對大鼠肝纖維化有一定的改善作用,其機制可能與抑制TGF-β1的表達有關。
肝纖維化;鎖陽提取物;轉化生長因子β1;肝功能指標;大鼠
肝纖維化(Liver fibrosis,LF)為一種慢性肝臟疾病,是由多種原因引起的肝損害病理改變,其特征是正常的肝組織被再生結節、瘢痕組織所替代,從而使肝臟功能發生障礙,最終發展為肝硬化[1]。LF的發病機制尚不明確,有研究認為與氧化應激[2]、自由基[3]以及轉化生長因子β1(Transforming growth factor beta 1,TGF-β1)等多種因素有關,其中TGF-β1在LF形成的過程中起重要的作用[4]。LF的發病率在全球都很高,并無良好的治療方案。中藥在改善癥狀及減輕肝臟病理改變方面明顯優于化學藥,且毒副作用較小,已為國內外所共識。
鎖陽作為傳統中藥,對多種疾病均有治療效果[5]。本課題組前期已從鎖陽中分離出了15種單體[6-7],并發現單體Songarin A對肝損傷細胞模型有保護作用[8],為進一步證實鎖陽對肝損傷的保護作用,本課題組擬復制LF大鼠模型,以血清中天冬氨酸轉氨酶(AST)、丙氨酸轉氨酶(ALT)、堿性磷酸酶(ALP)、肌酸激酶(CK)為指標,并結合蘇木精-伊紅(HE)、Masson法染色后大鼠肝臟病理變化,考察鎖陽提取物對模型大鼠LF的改善作用;并以TGF-β1為指標,初步探討其作用機制,為今后鎖陽用于臨床治療LF提供實驗依據。
1 材料
1.1儀器
Multiskan FC酶標儀(美國Thermo Fisher公司);Roche Modular D2400全自動生化分析儀(瑞士Roche公司);HC-2518離心機(安徽中科中佳科學儀器有限公司)。
1.2藥品與試劑
鎖陽提取物[新疆石河子大學藥學院提供,批號:20140906,規格:100 mg(提取物)/kg(藥材)];秋水仙堿片(云南玉藥生物制藥有限公司,批號:H53021904,規格:0.5 mg/片);四氯化碳(CCl4,成都科龍化工試劑廠);ALT、AST、ALP、CK測定試劑盒(南京建成試劑公司,批號:20140806、20140601、20140506、20140606);大鼠TGF-β1酶聯免疫吸附(ELISA)測定試劑盒(批號:20140901)、兔抗鼠TGF-β1抗體、生物素標記的山羊抗兔免疫球蛋白G(IgG)抗體均購自武漢博士德生物公司;其余試劑均為分析純。
1.3動物
SD大鼠90只,SPF級,♂,體質量140~160 g,購于成都達碩公司,實驗動物生產許可證為SCXK(川)2013-024。將大鼠于溫度為(20±2)℃、相對濕度為35%~40%、明暗各12 h(明7:00-19:00,暗19:00-7:00)的環境中適應性飼養1周后用于實驗。飼養期間大鼠常規飼料喂養、自由飲水。
2 方法
2.1分組、造模與給藥
將大鼠隨機分為正常組、模型組、秋水仙堿組(陽性藥物,0.2 mg/kg)[9]和鎖陽提取物低、中、高劑量組(50、100、200 mg/kg,劑量根據前期預實驗結果確定),每組15只。除正常組外,其余各組大鼠于每周三、周日ih CCl4-花生油(4∶6)混合液3 ml/kg(實驗首次ih劑量為5 ml/kg),連續6周,復制LF大鼠模型。6周后,各給藥組大鼠ig相應藥物,正常組和模型組大鼠ig等體積生理鹽水,每天1次,持續6周。實驗期間各組大鼠正常飲食。
2.2一般情況觀察
在喂食大鼠飼料、造模和給藥的時候對大鼠的毛色、精神、行為、飲食量、攝水量等一般情況進行觀察,記錄。
2.3取材及肝臟指數測定
給藥結束后,將大鼠固定,ip水合氯醛麻醉,開腹,以5 ml注射器腹主動脈取血,將血液分裝到1.5 ml EP管中,靜置至血液凝固后離心,取上清,置于-20℃冰箱中保存。取出肝臟,去除系膜,冷生理鹽水沖盡殘血,用濾紙吸干,觀察大鼠肝臟光滑度、顏色、硬度等,稱定肝臟質量,計算肝臟指數[肝臟指數=肝臟質量(g)/體質量(100g)]。
2.4肝功能指標檢測
取血清,采用全自動生化分析儀檢測血清中ALT、AST、 CK、ALP水平,具體操作按試劑盒說明書進行。
2.5肝組織病理變化觀察
取肝右葉的相同位置,大小約為5 mm×5 mm×5 mm的肝組織,脫水,透明,石蠟包埋,制備冠狀位切片(厚度為4 μm)。參照文獻[10]中方法分別進行HE和Masson染色,光鏡下觀察肝臟組織病理變化。
2.6肝組織中TGF-β1水平檢測
參照文獻[9],將“2.5”項下制備的切片脫蠟、水化,用3%過氧化氫阻斷內源性氧化酶,0.01 mol/L檸檬酸修復液(pH 6.0)微波修復抗原,血清封閉,加入兔抗鼠TGF-β1抗體(1∶100),4℃過夜,滴加生物素標記的羊抗兔IgG抗體,37℃孵育30 min,二氨基聯苯胺(DAB)顯色,蘇木精染色,脫水,透明,封片。組織染色陽性表達主要表現為細胞膜、細胞漿呈黃色或者褐色顆粒。參照文獻[10]中方法,以高倍視野觀察染色細胞數量、染色顏色深淺等:0分表示不著色,1分表示淡著色(呈淺黃色),2分表示中等著色(呈棕黃色),3分表示重度著色(呈棕褐色)。將所有大鼠肝組織切片的著色程度、范圍進行綜合分析以評估TGF-β1水平。對免疫組化結果進行半定量分析。
2.7血清中TGF-β1水平測定結果
采用ELISA法測定血清中TGF-β1水平,具體操作按試劑盒說明書進行。
2.8統計學方法
用SPSS 19.0統計軟件進行分析。實驗數據用x ±s表示,多組間比較采用單因素方差分析,組間兩兩比較行LSD-t檢驗。P<0.05表示差異有統計學意義。
3 結果
3.1一般情況及各組大鼠存活情況
正常組大鼠進食正常,體質量自然增長,鼠毛有光澤。模型組大鼠食欲與精神狀態差,毛發黃、雜亂,活動量減少;給藥后上述癥狀較模型組有所好轉。最終各組大鼠存活情況如下:正常組14只(因打架死亡1只),模型組8只,秋水仙堿組14只,鎖陽提取物低劑量組12只,鎖陽提取物中劑量組14只,鎖陽提取物高劑量組12只。
3.2肝臟觀察結果
正常組大鼠肝臟顏色鮮艷,表面光滑、亮如鏡、無斑點,質地柔軟。模型組大鼠肝臟顏色明顯發黃,表面粗糙、呈顆粒狀,邊緣鈍,包膜緊張且極其僵硬。給藥各組大鼠肝臟顏色、質感都有不同程度的改善。與鎖陽提取物低劑量組比較,秋水仙堿組和鎖陽提取物中、高劑量組大鼠肝臟變化更為明顯,質地更加松軟、表面結節變得極小。與秋水仙堿組比較,鎖陽提取物高劑量組大鼠肝臟光澤度較高。各組大鼠肝臟觀察結果見圖1。
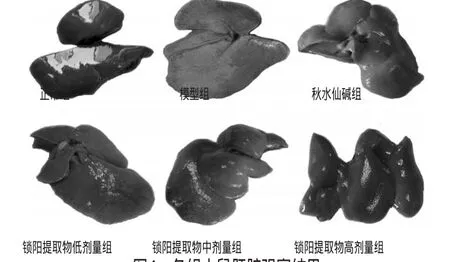
圖1 各組大鼠肝臟觀察結果Fig 1 Observed results of liverof rats in each group
3.3肝功能指標和肝臟指數測定結果
與正常組比較,模型組大鼠血清中AST、ALT、ALP、CK水平以及肝臟指數顯著升高(P<0.05);與模型組比較,各給藥組大鼠血清中上述指標水平均有不同程度降低,除鎖陽提取物低劑量組大鼠血清中AST、ALP、CK水平以及肝臟指數和鎖陽提取物中劑量組大鼠血清中ALP、CK水平降低不顯著外(P>0.05),其余各指標水平均顯著降低(P<0.05)。各組大鼠肝功能指標和肝臟指數測定結果見表1。
表1 各組大鼠肝功能指標及肝臟指數測定結果(±s)Tab 1 Results of liver function index and liver index of rats in each group(±s)
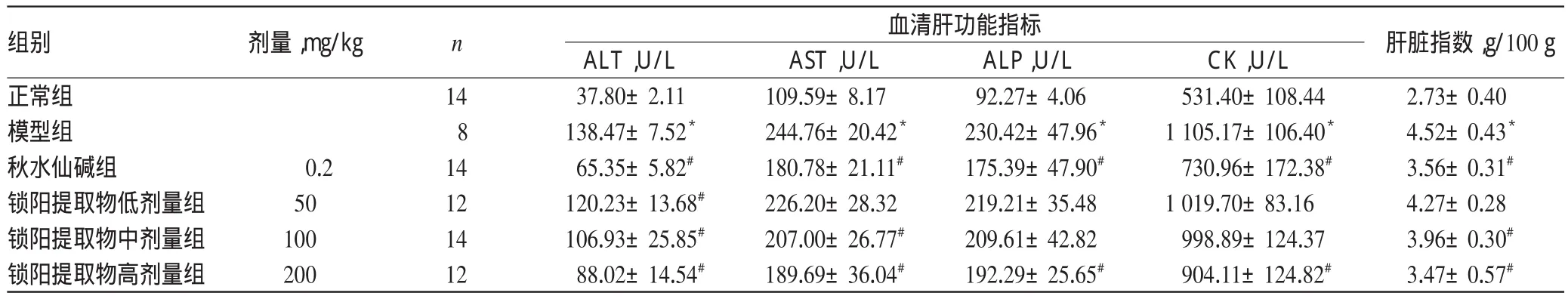
表1 各組大鼠肝功能指標及肝臟指數測定結果(±s)Tab 1 Results of liver function index and liver index of rats in each group(±s)
注:與正常組比較,*P<0.05;與模型組比較,#P<0.05Note:vs.normal group,*P<0.05;vs.model group,#P<0.05
組別正常組模型組秋水仙堿組鎖陽提取物低劑量組鎖陽提取物中劑量組鎖陽提取物高劑量組肝臟指數,g/100 g 2.73±0.40 4.52±0.43*3.56±0.31#4.27±0.28 3.96±0.30#3.47±0.57#劑量,mg/kg n 血清肝功能指標0.2 50 100 200 14 8 14 12 14 12 ALT,U/L 37.80±2.11 138.47±7.52*65.35±5.82#120.23±13.68#106.93±25.85#88.02±14.54#AST,U/L 109.59±8.17 244.76±20.42*180.78±21.11#226.20±28.32 207.00±26.77#189.69±36.04#ALP,U/L 92.27±4.06 230.42±47.96*175.39±47.90#219.21±35.48 209.61±42.82 192.29±25.65#CK,U/L 531.40±108.44 1 105.17±106.40*730.96±172.38#1 019.70±83.16 998.89±124.37 904.11±124.82#
3.4肝組織病理觀察結果
3.4.1HE染色正常組大鼠肝小葉結構清晰、肝細胞正常。模型組大鼠肝小葉結構有破壞,肝細胞脂肪沉積,胞質內呈現空泡狀、點狀壞死,纖維化明顯。給藥后大鼠肝組織病變減輕,僅有部分細胞脂肪沉淀,且隨著鎖陽提取物給藥劑量增大,改善越明顯。各組大鼠肝組織HE染色結果見圖2。

圖2 各組大鼠肝組織HE染色結果(×10)Fig 2 HE staining of liver tissue of rats in each group(×10)
3.4.2Masson染色正常組大鼠肝組織只是在匯管區有極少膠原纖維的表達,細胞索排列整齊。模型組大鼠肝組織有假小葉生成,細胞索雜亂,有大量的脂肪空泡,纖維化明顯。給藥后大鼠肝組織變性細胞和膠原沉積減少,纖維化程度減輕。各組大鼠肝組織Masson染色結果見圖3。
3.5血清及肝組織中TGF-β1水平
與正常組比較,模型組大鼠血清及肝組織中TGF-β1水平顯著升高(P<0.05)。與模型組比較,各給藥組大鼠血清及肝組織中TGF-β1水平均有所降低,且與鎖陽提取物呈劑量-效應關系;除鎖陽提取物低劑量組大鼠降低不顯著外,其余各組差異均有統計學意義(P<0.05)。各組大鼠血清及肝組織中TGF-β1水平測定結果見表2。
表2 各組大鼠血清及肝組織中TGF-β1水平測定結果(±s)Tab 2 Results of the levels of TGF-β1in serum and liver tissue of rats in each group(±s)
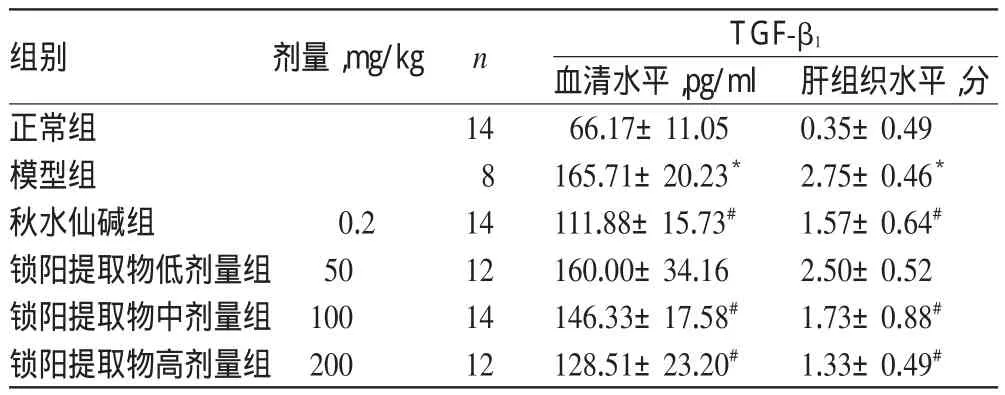
表2 各組大鼠血清及肝組織中TGF-β1水平測定結果(±s)Tab 2 Results of the levels of TGF-β1in serum and liver tissue of rats in each group(±s)
注:與正常組比較,*P<0.05;與模型組比較,#P<0.05Note:vs.normal group,*P<0.05;vs.model group,#P<0.05
組別正常組模型組秋水仙堿組鎖陽提取物低劑量組鎖陽提取物中劑量組鎖陽提取物高劑量組肝組織水平,分0.35±0.49 2.75±0.46*1.57±0.64#2.50±0.52 1.73±0.88#1.33±0.49#劑量,mg/kg n 0.2 50 100 200 14 8 14 12 14 12 TGF-β1血清水平,pg/ml 66.17±11.05 165.71±20.23*111.88±15.73#160.00±34.16 146.33±17.58#128.51±23.20#
4 討論
LF的產生是由于細胞外基質(Extracellular matrix,ECM)的合成與降解平衡失調,導致肝內纖維結締組織異常沉積的病理過程。而ECM的來源主要是激活了的肝星狀細胞(HSCs)。正常情況下HSCs處于靜止狀態,當致病因子造成肝細胞損傷時,就會激活血小板、Kupffer細胞以及損傷的肝細胞等分泌多種細胞因子和某些化學介質共同作用于HSCs,使HSCs被激活并轉化為肌成纖維細胞(Myofibroblast,MF);激活了的HSCs通過自分泌和旁分泌,促進HSCs增殖,合成大量細胞外基質并在肝內沉積,導致LF的發生[11]。
鎖陽最早在1964年被發現對神經系統有一定的影響。近年來被發現有抗腫瘤的功效[12],以及通過增加老年鼠血液和腦組織中端粒的長度來達到抗衰老的作用[13]。而對肝臟疾病方面的影響尚未見報道,直到近期研究發現,在鎖陽中被提取出來的一個新的黃烷醇Songarin A可以減輕體外HepG2細胞的損傷[8]。基于這一發現,本研究表明鎖陽提取物對大鼠LF也有一定的影響。但是也有研究證明從鎖陽中提取的沒食子酸和矢車菊3-O-葡萄糖苷具有抗氧化應激的作用[14],且提取物蕓香苷、兒茶素和異槲皮苷不僅可以減少自由基的形成,還能清除自由基[15]。結合上述LF的發病原因,鎖陽提取物亦可能是通過這幾種提取物對LF大鼠發揮作用。
TGF-β1是多效細胞因子,通過自分泌或旁分泌的方式調節細胞的增殖、分化、凋亡,另外還對創傷的修復、細胞外基質的合成、免疫功能等有重要的作用。TGF-β1的過量表達能促進HSCs合成彈性蛋白、黏著蛋白、膠原及蛋白聚糖等細胞外基質,減少降解蛋白酶的合成,從而降低ECM的分解,打破了合成與降解的平衡,使ECM的沉積增多,加速LF的發展[16]。本研究發現,鎖陽提取物干預以后,LF大鼠血清中TGF-β1的量和肝組織中TGF-β1的表達均有所降低。鎖陽可能是通過作用于此靶點來減少HSCs合成ECM。TGF-β1信號通路主要是通過下游分子受體活化型蛋白Smad2、Smad3,以及抑制型蛋白Smad7來調控表達的[17-18]。另外有文獻報道,在與LF有關的Hedgehog通路中,TGF-β1可以刺激其下游轉錄因子Gli使其累積[19],而Gli可以誘導抗凋亡基因和激活HSCs活化基因的表達,從而使活化的HSCs累積造成LF的發生[20]。因此TGF-β1也可能通過這兩條通路來減輕纖維化程度。
綜上所述,本研究在用鎖陽提取物治療LF模型大鼠時,在采用秋水仙堿[21]作為陽性對照的基礎上,通過計算肝臟指數、觀察肝臟外觀和病理切片、檢測肝功能,發現LF程度明顯減輕,提示鎖陽提取物對LF確實有一定的改善作用,但具體是否為Songarin A這一成分發揮的效應,需要進一步的驗證。而且筆者發現TGF-β1表達有所降低,說明鎖陽提取物作用于LF的機制可能與TGF-β1這一靶點有關。
[1]Suk KT,Kim DJ.Staging of liver fibrosis or cirrhosis:the role of hepatic venous pressure gradient measurement [J].World J Hepatol,2015,7(3):607.
[2]Sánchez-Valle V,Chávez-Tapia NC,Uribe M,et al.Role of oxidative stress and molecular changes in liver fibrosis:a review[J].Curr Med Chem,2012,19(28):4850.
[3]Abdel-Moneim AM,Al-Kahtani MA,El-Kersh MA,et al. Free radical-scavenging,anti-inflammatory/anti-fibrotic and hepatoprotective actions of taurine and silymarin against CCl4induced rat liver damage[J].PLoS One,2015,10(12):e0144509.
[4]Hong L,Eric R,Donna H,et al.Transforming growth factor b neutralization ameliorates pre-existing hepatic fibrosis and reduces cholangiocarcinoma in thioacetamidetreated rats[J].PLoS One,2013,8(1):e54499.
[5]Cui Z,Guo Z,Miao J,et al.The genus Cynomorium in China:an ethnopharmacological and phytochemical review[J].J Ethnopharmacol,2013,147(1):1.
[6]謝石安,李國玉,王航宇,等.鎖陽化學成分的研究[J].中國藥師,2012,15(7):911.
[7]謝石安,李國玉,張珂,等.鎖陽化學成分的分離與鑒定[J].沈陽藥科大學學報,2012,29(7):525.
[8]Xie SA,Li GY,Huang J,et al.A new flavanol from Cynomorium songaricum[J].J Asian Nat Prod Res,2013,15(4):413.
[9]陳小亮,李俊,鄧子煜,等.苦參素對肝纖維化大鼠肝臟TGF-β1的調節作用[J].中國藥理學通報,2009,25(6):761.
[10]周學東,劉慶濤.荔枝核總黃酮對肝纖維化模型大鼠肝細胞損傷的改善作用[J].中國藥房,2015,26(22):3099.
[11]許珂玉,肖建英.五味子粗多糖提取物對大鼠肝纖維化的防治作用研究[J].中國藥房,2011,22(19):1743.
[12]Shi G,Jiang W,Cai L,et al.Molecular characteristics and antitumor capacity of Glycan extracted from Cynomorium songaricum[J].Int J Biol Macromol,2011,48(5):788.
[13]Ma L,Chen G,Nie L,et al.Effect of Cynomorium songaricum polysaccharide on telomere length in blood and brain of D-galactose-induced senescence mice[J].Zhongguo Zhong Yao Za Zhi,2009,34(10):1257.
[14]Zucca P,Rosa A,Tuberoso CI,et al.Evaluation of antioxidant potential of“maltese mushroom”(Cynomorium coccineum)by means of multiple chemical and biological assays[J].Nutrients,2013,5(1):149.
[15]Yu FR,Liu Y,Cui YZ,et al.Effects of a flavonoid extract from Cynomorium songaricum on the swimming endurance of rats[J].Am J Chin Med,2010,38(1):65.
[16]Gressner AM,Weiskirchen R.Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-b as major players and therapeutic targets[J].J Cellular and Molecular Medicine,2006,10(1):76.
[17]Uemura M,Swenson ES,Ga?a MDA,et al.Smad2 and Smad3 play different roles in rat hepatic stellate cell function and α-smooth muscle actin organization[J].Mol Biol Cell,2005,16(9):4214.
[18]Dooley S,Hamzavi J,Breitkopf K,et al.Smad7 prevents activation of hepatic stellate cells and liver fibrosis in rats[J].Gastroenterology,2003,125(1):178.
[19]Omenetti A,Choi S,Michelotti G,et al.Hedgehog signaling in the liver[J].J Hepatol,2011,54(2):366.
[20]林春蕾,郭傳勇.Hedgehog通路與肝纖維化關系的研究進展[J].胃腸病學和肝病學雜志,2012,21(10):909.
[21]孫嘉臨,王先化.秋水仙堿對實驗性大鼠肝纖維化的影響[J].中國現代醫生,2012,50(14):1.
(編輯:林靜)
Effects of Cynomorium songaricum Extract on Liver Fibrosis Model Rats and Its Mechanism Study
LI Ronghua1,WANG Hangyu2,LIN Yousheng1,LIU Yilun3,LI Huiyuan1,HUANG Xiaomei1,TANG Linmei1,HE Hailin1,CUI Lang1,DENG Fengmei1(1.School of Basic Medical Sciences,Chengdu Medical College,Chengdu 610500,China;2.School of Pharmacy,Shihezi University,Xinjiang Shihezi 832000,China;3.The First Affiliated Hospital of Chengdu Medical College,Chengdu 610500,China)
OBJECTIVE:To investigate the effects of Cynomorium songaricum extract on liver fibrosis model rats and its mechanism.METHODS:90 SD rats were randomly divided into normal group,model group,colchicine group(positive drug,0.2 mg/kg),C.songaricum extract low-dose,medium-dose and high-dose groups(50,100,200 mg/kg),with 15 rats in each group.Except for normal group,those groups were given carbon tetrachloride to induce liver fibrosis model.After modeling,treatment groups were given relevant medicine intragastrically,and normal group and model group were given normal saline intragastrically,once a day,for consecutive 6 weeks.After treatment,serum liver function index[AST,ALT,ALP,CK]of rats were detected.The pathological changes in the livers of rats were observed by HE and Masson staining;the expression of TGF-β1in the livers and serum of rats were detected and liver index was calculated.RESULTS:Compared with normal group,liver index,AST,ALT,CK,ALP,the level of TGF-β1in serum and liver were increased in model group,with statistical significance(P<0.05).Pathological results showed that fibrosis lesion was found in liver tissue of rats in model group.Compared with model group,those index of colchicine group,C.songaricum extract medium-dose and high-dose groups were improved significantly and ALT of C.songaricum extract low-dose group was improved obviously,except for serum levels of ALP and CK in C.songaricum extract medium-dose groups. The degree of fibrosis was relieved in treatment groups.CONCLUSIONS:C.songaricum extract can improve liver fibrosis to certain extent,which may be related with inhibiting the expression of TGF-β1.
Liver fibrosis;Cynomorium songaricum extract;TGF-β1;Liver function index;Rats
R285
A
1001-0408(2016)28-3903-04
10.6039/j.issn.1001-0408.2016.28.05
國家自然科學基金資助項目(No.81560566);四川省大學生創新訓練計劃項目(No.201313705011);成都醫學院大學生創新訓練計劃項目(No.CXXS201303)
*碩士研究生。研究方向:肝纖維化的發病機制。E-mail:lrh_ 1990@126.com
教授,碩士生導師,博士。研究方向:肝纖維化的發病機制。電話:028-62739109。E-mail:dengfm2004@163.com
(2016-01-04
2016-04-16)

