32546例疏血通注射液醫院集中監測研究
姜俊杰+謝雁鳴+張寅+楊志欣+易丹輝

[摘要]為了解疏血通注射液的不良反應特征、發生率等安全性信息,該研究采用多中心、大樣本醫院集中監測的設計方法,在全國54家醫療機構中,以使用疏血通的住院患者為監測對象,進行用藥周期的全程監測。監測內容為患者的一般信息、診斷信息、用藥信息、不良反應/事件信息等。共納入32 546例病例,發生不良反應64例,不良反應發生率為0.197%,發生特征主要是皮膚瘙癢、皮疹、感冒狀、呼吸困難、心悸、頭痛、胸悶等過敏反應;發生不良反應患者以中老年人為主,用藥特征基本符合說明書。以上結果說明,疏血通注射液在臨床應用中安全性良好。
[關鍵詞]疏血通注射液; 醫院集中監測; 不良反應; 安全性
[Abstract]This study adopted multi-center and large sample design to understand the incidence, characteristics and other information about adverse reaction of Shuxuetong injection. In 54 medical institutions, use of Shuxuetong injection of entire treatment period was monitored, including patients′ general information, diagnostic information, medication, adverse reaction/event information, etc. Sixty four cases of adverse reactions in 32 546 patients was monitored, adverse rate was 0.197%, mainly characterized by skin itching, rash, flu-like, dyspnea, palpitations, headache, chest tightness and other allergic reactions. Adverse reaction occurred mainly in elderly patients and medication was consistent with the instruction. Based on these results, safety of Shuxuetong injection in clinical application is excellent.
[Key words]Shuxuetong injection; intensive hospital monitoring; adverse reactions; safety
doi:10.4268/cjcmm20162023
疏血通注射液(以下簡稱“疏血通”)是我國第一個動物類中藥注射劑,成分是水蛭、地龍提取物,功效活血化瘀、通經活絡,用于瘀血阻絡所致的中風病中經絡急性期,癥見半身不遂、口眼歪斜、言語蹇澀,急性腦梗死見上述證候者。疏血通在臨床上有較廣泛的應用,不僅限于說明書中的適應癥急性腦梗死,還涉及其他腦血管疾病、心血管疾病、腎臟疾病以及糖尿病周圍神經病變、突發性耳聾、視網膜中央靜脈阻塞、類風濕性關節炎等疾病的治療[1]。關于其安全性,既往研究中,李百強等于黑龍江省內進行疏血通的醫院集中監測,結果共納入9 897例患者,發生9例不良反應(adverse reactions,ADR),ADR發生率是0.09%,以過敏反應為主[2]。但該研究的監測范圍僅局限于黑龍江省內,監測結果僅代表局部區域。基于此,本研究以全國范圍內的醫療機構為監測對象,開展疏血通的多中心、大樣本、醫院集中監測研究,以了解真實世界疏血通的安全性情況。
1 方法
1.1 監測設計 本研究為多中心、大樣本、醫院集中監測的設計方法。
1.2 監測機構 本研究在全國共設有54家監測機構,其中,河南中醫藥大學第一附屬醫院、廣東省中醫院、長春中醫藥大學附屬醫院、石家莊市中醫院為負責單位,其余50家為監測參加單位,包括哈爾濱醫科大學附屬第一醫院、齊齊哈爾醫學院第一附屬醫院、佳木斯大學附屬第一醫院、河南大學第一附屬醫院、重慶市中醫院等。
1.3 監測對象 2012年3月—2015年3月,在監測機構使用疏血通的住院患者。各監測醫院所使用的疏血通是由牡丹江友搏藥業有限責任公司獨家生產的不同批次產品。
1.4 樣本量 根據國際通用“三例原則”,確定樣本量是3萬例。
1.5 監測周期 用藥期間全程觀察。
1.6 監測形式及內容 本監測的形式分為2種,一是由臨床醫師觀察,并由臨床醫師填寫監測表;二是由臨床醫師觀察,繼而將觀察結果上報藥師,由藥師填寫監測表。監測表分為A,B 2個表。A表包括一般信息、診斷信息、用藥信息、聯合用藥信息,每個病例均需填寫;B表是不良事件相關信息,發生不良事件的患者需要填寫。A,B表具體內容是①一般信息:包括性別、年齡、生命體征、個人過敏史、家族過敏史等;②診斷信息:包括西醫診斷、中醫診斷、合并疾病;③用藥信息:包括疏血通的使用方式、用藥天數、藥物劑量、溶媒、溶媒用量、注射室溫、配液放置時間、注射持續時間、滴速;④聯合用藥信息:合并用藥名稱、注射前使用的注射劑名稱、注射期間使用的注射劑名稱、注射后使用的注射劑名稱、注射前后是否沖管、注射前后是否更換輸液器、注射期間;⑤不良反應/事件信息:不良反應/事件名稱、發生時間、癥狀、體征、臨床檢驗,不良反應/事件結果、轉歸、預后,懷疑藥品、溶媒、輸液器、并用藥品的名稱、批準文號、通用名、生產廠家、批號、用法用量、室溫等,關聯性評價結果等。
1.7 質量控制 質量控制主要從以下7個方面實施:監測中心、監測人員、監測進度、原始文件、電子數據、檔案管理、質量管理。其中,原始文件和電子數據是質量控制的重要內容。原始文件方面,主要是防止漏報病例以及監測表的填寫質量檢查。通過調取醫院信息系統數據中研究時間范圍內使用疏血通的病例數,與實際登記例數相對照的方法,檢查是否有漏報情況。原始文件質量方面,通過與原始病歷對照溯源進行檢查,要求具備規范性、及時性、準確性、真實性。電子數據要求與紙質監測表內容一致。
1.8 數據管理 本研究的數據采集工具是監測表,并建立了專有網絡平臺數據庫,網址為www.crpcm.com。采用獨立雙人雙份數據錄入的形式,并由計算機執行差異校驗功能,解決錄入間的不一致。數據的現場核查主要指核對源數據(住院病歷)與監測表或電子數據的一致性。在收集數據結束之后,對所有數據進行整體核查與清理,包括清除重復數據、修改錯誤數據和疾病名稱、藥物名稱不標準的數據,繼而,鎖定數據庫,用于統計分析。
1.9 不良反應因果判斷方法 按照國家藥品不良反應監測中心2011年公布的《藥品不良反應報告和監測管理辦法》(衛生部第81號令),對不良反應、不良事件、嚴重不良反應進行判斷,并采用6級不良事件關聯性評價對不良事件與疏血通的關聯性做出評價,包括肯定、很可能、可能、可能無關、待評價、無法評價。
1.10 倫理審查與國際注冊 本監測已通過倫理審查,審查機構是中國中醫科學院中醫臨床基礎醫學研究所倫理委員會,倫理批件號碼是2012-9-3。并于美國臨床試驗注冊網www.clinicaltrials.gov通過注冊,注冊號是NCT01508403。
1.11 數據標準化 由于監測數據來源于多家醫院,為便于分析,需要對數據庫的相關信息進行標準化。參照西醫ICD-10 疾病分類[3]對西醫診斷進行規范化;參照《中華人民共和國國家標準——中醫病證分類與代碼》(GB/T15657-1995)[4]對中醫診斷標準化;參照2015年版《中國藥典》[5]對藥品名稱進行標準化;參照《WHO不良反應術語集》對不良反應/事件名稱及所屬系統進行標準化。
1.12 數據統計 對于計數資料,采用描述方法分析頻數及百分比;對于計量資料,采用分段描述頻數和百分比的方式,Excel輔助作圖。采用SAS 9.3進行統計分析。
2 結果
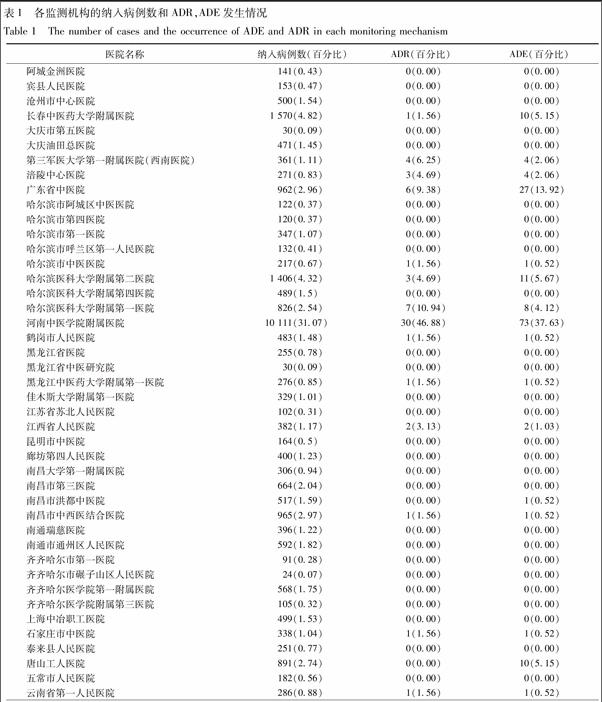
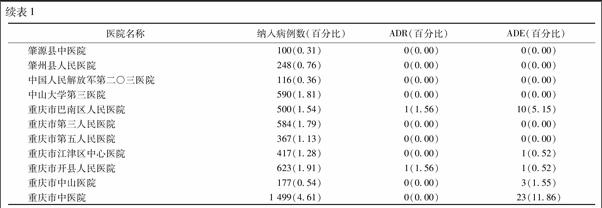
2.1 監測完成情況及ADR發生率 全國54家監測機構共納入32 546例使用疏血通的患者資料,發生ADR 64例,不良事件(adverse event,ADE)194例,ADR發生率是0.197%。所有監測機構納入病例數及ADR,ADE發生例數、百分比見表1。
2.2 ADR表現 每個病例可能有多個ADR表現,因此,64例ADR病例中,發生183頻次。其中,皮膚瘙癢、皮疹分別占19.13%,13.11%,ADR表現的頻次及百分比見表2。ADR類型中,一般ADR 54例,嚴重ADR 1例,是上消化道出血,新發ADR 9例,見表2。
ADR表現所涉及的系統見表3,其中,皮膚及其附件損害最多,占64.06%。
2.3 年齡及性別 64例ADR患者中,中老年人占多數,年齡分布見表4。性別分布為男性27例,女性37例。
2.4 西醫診斷及合并疾病 64例ADR患者的前10位西醫診斷分布見表5。急性腦梗死、糖尿病、短暫性腦缺血是主要的西醫診斷。
64例ADR患者的前10位合并疾病分布見表6。高血壓、糖尿病、高脂血癥、冠心病是主要合并疾病。
2.5 中醫診斷 64例ADR患者的中醫病名見表7,中醫辨證見表8。由于西醫院未收集中醫診斷相關信息,因此,64例患者的中醫診斷信息缺失,共收集中醫病名12例次,中醫辨證22例次。
2.6 過敏史 64例ADR患者中,15例有過敏史,過敏原均為藥物,過敏表現是皮疹、胃腸道痛性痙攣等。
2.7 疏血通用藥特征 64例患者使用的疏血通均為靜脈滴注的方式;溶媒方面,使用5%葡萄糖注射液的42例,0.9%氯化鈉注射液的22例;溶媒用量≤250 mL的62例,250~500 mL的2例;單次使用劑量≤6 mL的49例,6~8 mL的4例,8~10 mL的11例;注射室溫是17~26 ℃的60例,26 ℃的3例,0~16 ℃的1例;配液放置時間在0~30 min的44例,30 min~4 h的20例;0~60滴/min的57例,61~80滴/min的7例;注射前沖管的14例,注射后沖管的10例,注射前更換輸液器的2例,注射后更換輸液器的2例。
2.8 合并用藥 64例ADR患者的前10位合并用藥見表9。
2.9 出現ADR距用藥時間 64例ADR患者中,出現ADR距用藥時間分布見表10。大部分ADR在24 h內發生。
2.10 ADR轉歸 64例ADR中,痊愈38例,好轉25例,未好轉1例。停藥/減量后癥狀消失的51例,未消失的1例,未停藥/減量的12例。再次使用可疑藥品出現類似癥狀的5例,未出現類似癥狀的8例,不明的5例,未再使用的46例。
3 討論
3.1 疏血通的安全性良好,不良反應以過敏反應為主 本監測結果表明,32 546例監測病例中,共發生ADR 64例,不良反應發生率為0.197%,屬于偶見不良反應,說明其在臨床中應用的安全性良好。64例不良反應中,一般ADR 54例,嚴重ADR 1例,新發ADR 9例。一般不良反應表現以過敏反應為主,包括皮膚瘙癢、皮疹、感冒狀、呼吸困難、心悸、頭痛、胸悶、皮膚腫脹、頭暈等。嚴重不良反應是上消化道出血。新發不良反應表現是頭暈、胃部不適、腰痛、靜脈炎等。郭新峰等對2012年2月以前的所有關于疏血通不良反應的文獻進行全面梳理分析,得到的疏血通ADR主要臨床表現是血壓下降、呼吸困難等的過敏性休克,胸悶、憋氣、心悸等全身過敏反應,結膜充血等過敏性眼部反應,皮疹,消化道出血、惡心等消化系統反應,頭暈、頭痛、低熱、輕度嗜睡、靜脈炎等其他反應[6]。該研究結果得到的主要ADR表現,本研究均已監測到,說明本監測結果較為全面,可信度較高。
3.2 發生ADR的患者疏血通用藥特征基本符合說明書 本監測結果顯示,發生ADR的64例患者的疏血通用藥特征中,用藥原因是急性腦梗死的22例,占33.33%;使用方式均為靜脈滴注;單次用藥劑量為6 mL以下的49例;溶媒種類是5%葡萄糖注射液的42例,0.9%氯化鈉注射液的22例;溶媒用量≤250 mL的62例,250~500 mL的2例。疏血通說明書中表明:“靜脈滴注,每日6 mL,加于5%葡萄糖注射液(或0.9%氯化鈉注射液)250~500 mL中,緩慢滴入。”說明發生ADR患者的用藥特征基本符合說明書,因此,疏血通發生ADR的影響因素尚需進一步的統計分析或前瞻性試驗加以探索。
3.3 本研究的局限及優勢 在不良事件和不良反應的觀察方面,本研究可能存在一定的低估問題:①本監測為醫生或藥師主導的研究,因無法在用藥期間時時刻刻觀察患者,可能會出現漏報輕度不良反應的情況;②研究涉及的實驗室指標相對較少,有可能會低估實驗室檢查異常值方面的不良事件/反應;③由于觀察僅限于用藥期間,并不涉及隨訪,因此,對于遠期產生的不良反應無法觀測到。
在偏倚控制中,本研究在抽樣時為非隨機抽樣,選取的研究醫院為疏血通用量較大的醫院,可能存在一定的選擇偏倚。但選擇時,使監測醫院盡量分布于我國的東、西、南、北、中,以使監測醫院更具全國代表性,從而減小偏倚。監測醫院分布于北部的黑龍江、吉林,南部的廣東、江西,西部的四川、重慶,東部的江蘇,中部的河北、河南。另外,由于門診患者較難得到相應的安全性數據,所以納入的門診患者較少,可能會造成一定的偏倚。各監測醫院對ADR因果關系的判斷及輕重程度的判斷方面,因監測者知識結構的不同存在測量偏倚。
藥物上市后的安全性研究中,包括大樣本的醫院集中監測研究,基于國家藥品不良反應監測中心數據(SRS)的ADR信號發現,基于醫院信息系統數據的安全性研究、文獻分析、個案分析等。其中,大樣本、前瞻性的醫院集中監測的數據來源于真實世界,不僅能觀察到不良事件的發生情況,而且已知使用藥物的基礎人群情況,因此能計算不良反應發生率,得出的結論是藥物安全性研究中證據級別最高的[7],也是目前較好的藥物安全性研究方法。
[參考文獻]
[1]郭倫,崔瑛,楊亞蕾,等. 疏血通注射液的臨床應用研究進展[J].中國現代藥物應用,2015,9(1):240.
[2]李百強,魯仲平,方洪壯,等.疏血通注射液大樣本臨床使用安全性分析[J].中國藥物警戒,2011,8(10):592.
[3]董景五.疾病和有關健康問題的國際統計分類[M].北京:人民衛生出版社,2008.
[4]陳佑邦,潘筱秦,金棣生,等.中醫病證分類與代碼[M].北京:中國標準出版社,1995.
[5]中國藥典.一部[S]. 2015:143.
[6]郭新峰,溫澤淮,謝雁鳴,等.疏血通注射液臨床安全性的系統分析[J].中國中藥雜志,2012,37(18):2782.
[7]廖星,謝雁鳴,王永炎,等.藥品安全性證據分級分類探索研究——構建中藥上市后安全性證據體[J].中國中藥雜志,2015,40(24):4723.
[責任編輯 曹陽陽]

