石榴枯萎病菌拮抗放線菌對南方根結(jié)線蟲的毒力
周銀麗, 楊艷麗, 袁紹杰, 林麗飛, 胡先奇*
(1. 云南農(nóng)業(yè)大學(xué)農(nóng)業(yè)生物多樣性與病害控制教育部重點實驗室, 昆明 650201;2. 紅河學(xué)院云南省高校農(nóng)作物優(yōu)質(zhì)高效栽培與安全控制重點實驗室, 蒙自 661100)
?
石榴枯萎病菌拮抗放線菌對南方根結(jié)線蟲的毒力
周銀麗1,2, 楊艷麗1, 袁紹杰1, 林麗飛1, 胡先奇1*
(1. 云南農(nóng)業(yè)大學(xué)農(nóng)業(yè)生物多樣性與病害控制教育部重點實驗室, 昆明 650201;2. 紅河學(xué)院云南省高校農(nóng)作物優(yōu)質(zhì)高效栽培與安全控制重點實驗室, 蒙自 661100)
從云南蒙自萬畝石榴園、建水石榴園采集的土樣中分離篩選得到對石榴枯萎病菌有較強拮抗活性的放線菌,其中菌株JS1對石榴枯萎病菌的室內(nèi)抑菌半徑為11 mm。測定了菌株JS1發(fā)酵液對南方根結(jié)線蟲的抑殺活性,結(jié)果表明,50% JS1菌株發(fā)酵液處理南方根結(jié)線蟲卵6 d,卵孵化率與對照相比降低了51.67%;50% JS1菌株發(fā)酵液處理南方根結(jié)線蟲2齡幼蟲72 h,2齡幼蟲的校正死亡率增加了88.10%;菌株JS1兼有拮抗石榴枯萎病菌及抑殺南方根結(jié)線蟲的活性。結(jié)合菌株JS1在鑒定培養(yǎng)基上的培養(yǎng)特征、形態(tài)學(xué)觀察及16S rDNA序列分析,將JS1初步鑒定為壯觀鏈霉菌(Streptomycesspectabilis)。
石榴枯萎病菌; 根結(jié)線蟲; 生物防治; 壯觀鏈霉菌
石榴(PunicagranatumL.),隸屬于石榴科(Punicaceae),又名珍珠石榴、安石榴,若榴、山力葉、丹若、海石榴、謝榴、沃丹、天漿、金罌,是我國重要的果樹之一。石榴既可觀花又可食果,享有“天堂之果”的美譽[1]。云南省蒙自縣被譽為“中國石榴之鄉(xiāng)”,隨著石榴栽培的集約化和樹齡的增長,各種病害的發(fā)生也日益嚴重,尤其是石榴枯萎病的發(fā)生。石榴枯萎病是由甘薯長喙殼(CeratocystisfimbriataEllisetHalsted)引起的土傳真菌病害,而該病原菌主要從甘薯、芋頭、木薯及咖啡等多種木本、草本植物的根部傷口侵入,可引起甘薯黑斑病、石榴枯萎病、芋頭黑腐病[2-3]等。石榴枯萎病在我國先后發(fā)生于云南省蒙自縣[4]、四川省攀西地區(qū)(主要包括涼山州的會理縣、西昌市和攀枝花市仁和區(qū))[5]。 2004年,蒙自的石榴枯萎病的病株率達15.0%[6],近年來該病害呈逐年擴散加重的趨勢,被當?shù)毓r(nóng)稱為石榴的“癌癥”。已有研究表明根結(jié)線蟲在石榴枯萎病發(fā)生過程中起著“打開通道”的作用[7],兩者的復(fù)合侵染加重了石榴的產(chǎn)量損失。在蒙自十字路、紅塘子、三路地、瞭望臺附近、板凳橋、蔣臺等地的根結(jié)線蟲發(fā)生率已達30%~45%[8]。隨著石榴根結(jié)線蟲的發(fā)生日益加劇,石榴枯萎病的危害也日益嚴重。然而,石榴根結(jié)線蟲的發(fā)生與危害具有隱蔽性,在生產(chǎn)上常被忽略。因此,尋找到防治石榴枯萎病同時能兼治根結(jié)線蟲的生防菌,將對蒙自石榴產(chǎn)業(yè)的可持續(xù)綠色防控具有重要意義。
石榴枯萎病的防治目前主要依賴化學(xué)藥劑的施用,而長期施用單一的化學(xué)藥劑易使石榴枯萎病菌產(chǎn)生抗藥性,加重果實和環(huán)境污染。利用生防微生物或其次生代謝產(chǎn)物進行石榴枯萎病的防治,已成為控制其進一步蔓延的有效措施,已有研究表明枯草芽胞桿菌(Bacillussubtilis)和熒光假單胞桿菌(Pseudomonasfluorescens)等土著微生物在石榴枯萎病防治中具有良好的應(yīng)用前景[9]。本研究篩選了對石榴枯萎病菌及南方根結(jié)線蟲(Meloidogyneincognita)卵孵化有較強抑制作用的生防放線菌,旨在為石榴枯萎病的綜合防控提供參考。
1 材料與方法
1.1 材料
1.1.1 試驗材料
健康石榴樹根際土壤樣本及枯萎病石榴樹根際土壤樣本,采自蒙自萬畝石榴園和建水石榴園,共采集了45份樣本;石榴枯萎病菌標準樣品由云南農(nóng)業(yè)大學(xué)植物病理實驗室黃瓊教授提供;南方根結(jié)線蟲采自紅河州蒙自市草壩鎮(zhèn)大落就村大棚絲瓜地。
1.1.2 供試培養(yǎng)基
放線菌分離培養(yǎng)基為改良高氏1號培養(yǎng)基,平板對峙培養(yǎng)試驗采用 PDA 培養(yǎng)基。放線菌鑒定培養(yǎng)基包括:蔡氏培養(yǎng)基,麥芽膏-酵母膏培養(yǎng)基,甘油-天門冬酰胺培養(yǎng)基,無機鹽淀粉培養(yǎng)基,PDA培養(yǎng)基,葡萄糖-天門冬酰胺培養(yǎng)基,營養(yǎng)瓊脂培養(yǎng)基,燕麥片瓊脂培養(yǎng)基[10-11]。
1.2 試驗方法
1.2.1 土壤中放線菌的分離與培養(yǎng)
在蒙自萬畝石榴園的三角地、十字路、紅塘子、三路地、瞭望臺附近、板凳橋、蔣臺、水井凹、馬山?jīng)_和建水石榴園的周伍、小營、李伍山分別采集石榴枯萎病樹根際土樣(采后應(yīng)將工具用75%乙醇消毒)、健康石榴樹根際土樣。在每點選取樣株3株,從每樣株周圍選3處不同的位置,用鋤頭挖至距地表面10~20 cm處將石榴根系暴露出來,輕輕抖掉外圍大塊土壤,收集根系周圍1 cm左右的土壤500 g,將采集的每點3株3個樣本混合均勻,取500 g裝入無菌自封袋,編號,將土樣及時帶回實驗室后,進行去雜和過0.1 cm篩處理。
放線菌的分離與培養(yǎng)均采用改良高氏一號培養(yǎng)基,土壤中放線菌的分離采用平板稀釋法。首先制備土壤樣品稀釋液,在無菌環(huán)境條件下取5 g根際土溶解于45 mL無菌水中,在28℃恒溫下振蕩30 min使微生物充分分散,靜置10 min,即得10-1稀釋液,再依次稀釋為10-2、10-3、10-4、10-5系列濃度稀釋液[12]。用無菌移液器吸取100 μL 濃度為10-3、10-4、10-5土壤稀釋液于平板上,用涂布器將其涂均勻。置于28℃恒溫下培養(yǎng)5 d,每個土壤稀釋液濃度重復(fù)3次,將分離到的形態(tài)、顏色不同的放線菌進行畫線純化,得到單菌落,將純化的放線菌菌株保存在改良高氏一號培養(yǎng)基中,置于4℃冰箱保存。
1.2.2 石榴枯萎病菌拮抗菌的篩選
拮抗菌初篩:將培養(yǎng)7 d的石榴枯萎病菌用滅菌水配制成濃度為103個/mL的孢子懸浮液,取100 μL涂布于PDA平板上,靜置5 h。將分離得到的放線菌活化,接種到涂有石榴枯萎病病原菌的平板上,每個平板進行十字畫線,在十字線距離中心3 cm位置分別接種4種放線菌,置于28℃恒溫培養(yǎng)箱培養(yǎng)5 d后,觀察并測定其拮抗圈的半徑(r)。拮抗性強弱的分級及判定標準為:強拮抗性放線菌,r≥10 mm;中等拮抗性放線菌,7.5 mm ≤r<10 mm;弱拮抗性放線菌,r<7.5 mm;無拮抗性放線菌,r=0 mm[13]。
拮抗菌復(fù)篩:根據(jù)初篩結(jié)果,選擇有明顯抑菌效果的放線菌,用平板對峙法對拮抗菌進行復(fù)篩,抑菌效果的判斷標準同上。
拮抗放線菌發(fā)酵液及菌絲浸出液對石榴枯萎病菌的抑菌作用:將篩選得到的放線菌在高氏一號培養(yǎng)基上活化后,接種于放線菌發(fā)酵培養(yǎng)液中,置于28℃恒溫搖床150 r/min發(fā)酵培養(yǎng)7 d,將發(fā)酵液在10 000 r/min、4℃條件下離心20 min后得菌絲和發(fā)酵液兩部分,收集所有上清發(fā)酵液,在超凈工作臺上用0.22 μm微孔濾膜過濾,備用[14]。菌絲溶于3倍體積的滅菌水于560 W和4 s/5 s(工作時間/間隔時間)條件下,在超聲波破碎儀中冰浴破碎60 min,再以10 000 r/min離心20 min,收集上清液,在超凈工作臺上用0.22 μm微孔濾膜過濾,即可得菌絲提取液[15]。用孔洞法測定抑菌作用:將石榴枯萎病菌(d=5 mm)置于PDA培養(yǎng)基平板中心,在距中心30 mm處(d=5mm)的直徑上打兩個孔,每孔加入100 μL菌絲浸出物或發(fā)酵液,每種3個重復(fù),以只接病原菌為對照,于28℃恒溫箱培養(yǎng),待對照長滿平板,觀察并測量抑菌圈半徑[16]。
1.2.3 拮抗菌對南方根結(jié)線蟲的影響
放線菌菌株發(fā)酵液的制備:將篩選出的放線菌在高氏一號培養(yǎng)基上活化后,接種于放線菌發(fā)酵培養(yǎng)液中,置于28℃恒溫搖床150 r/min發(fā)酵培養(yǎng)7 d,5 000 r/min離心發(fā)酵液10 min獲取上清液,取上清液用0.22 μm微孔濾膜過濾,備用。
放線菌發(fā)酵液對南方根結(jié)線蟲卵孵化的影響:南方根結(jié)線蟲卵懸液的制備采用改良的振蕩法分離[17]。將感染南方根結(jié)線蟲的絲瓜根剪成1~2 cm小段,放入200 mL 1%次氯酸鈉溶液中,在豆?jié){機中攪拌1 min后,將懸浮液快速經(jīng)過100、300和500目的套篩,上下振蕩網(wǎng)篩,500目網(wǎng)篩可收集到游離的卵,快速用無菌水沖洗500目篩網(wǎng)上的卵以除去殘留的次氯酸鈉。多次沖洗振蕩根段以獲取更多的卵,過篩收集到離心管中,加入40%蔗糖溶液20 mL,3 500 r/min離心5min,吸取上層溶液過500目篩,用無菌水沖洗去除蔗糖液,將卵收集到三角瓶中加無菌水制成卵懸液,濃度為1 200個/mL,置于4℃冰箱備用。在24孔細胞培養(yǎng)板中加入50 μL濃度為1 200個/mL南方根結(jié)線蟲卵懸液、放線菌菌株發(fā)酵液及滅菌水,總體積均為500 μL,調(diào)整放線菌菌株發(fā)酵液及滅菌水的加入體積,使24孔細胞培養(yǎng)板中放線菌菌株發(fā)酵液的濃度分別為0%、10%、20%、30%、40%、50%[18]。首先測定50%放線菌發(fā)酵液抑卵孵化作用,選擇抑卵孵化率超過40%的菌株進行重復(fù)測定。每個處理3次重復(fù),放入28℃培養(yǎng)箱中,分別在第2、4、6天記錄2齡幼蟲的孵化數(shù),計算孵化率。孵化率(%)=2齡幼蟲孵化數(shù)/總卵數(shù)×100。所得數(shù)據(jù)經(jīng)軟件SPSS17.0進行數(shù)據(jù)處理和方差分析。
放線菌發(fā)酵液對南方根結(jié)線蟲2齡幼蟲的抑殺作用測定:在解剖鏡下挑取感染南方根結(jié)線蟲絲瓜根組織上的卵塊,經(jīng)1%次氯酸鈉溶液消毒后,置于無菌水中孵化2齡幼蟲,定容至濃度為1 000條/mL 2齡幼蟲懸液,置于4℃?zhèn)溆谩>甑臐舛仍O(shè)置同上,分別向處理和對照中加入50 μL濃度為1 000條/mL南方根結(jié)線蟲2齡幼蟲懸液,每個濃度3次重復(fù),放入28℃培養(yǎng)箱中, 分別于24、48、72 h后記錄2齡幼蟲死亡數(shù),用尖細針刺激蟲體,如果蟲體不動就記錄為死亡,計算死亡率及校正死亡率。
線蟲死亡率(%)=(死亡線蟲數(shù)/供試線蟲數(shù))×100;
校正死亡率(%)=(處理線蟲死亡率-對照線蟲死亡率)/(1-對照線蟲死亡率)×100;
所得數(shù)據(jù)經(jīng)軟件SPSS17.0進行數(shù)據(jù)處理和方差分析。
1.2.4 生防放線菌JS1的鑒定
采用插片法培養(yǎng)放線菌菌株,在高氏一號培養(yǎng)基平板上28℃培養(yǎng)6~10 d,在光學(xué)顯微鏡下觀察菌絲形態(tài),記錄菌落形態(tài),基內(nèi)菌絲、氣生菌絲和孢子絲的形態(tài)及顏色,是否產(chǎn)生可溶性色素等。同時配制用于放線菌鑒定的培養(yǎng)基:蔡氏培養(yǎng)基、麥芽膏-酵母膏培養(yǎng)基、甘油-天門冬酰胺培養(yǎng)基、無機鹽淀粉培養(yǎng)基、馬鈴薯培養(yǎng)基、葡萄糖-天門冬酰胺培養(yǎng)基、燕麥片瓊脂粉培養(yǎng)基、營養(yǎng)瓊脂培養(yǎng)基,觀察菌株在其上的生長狀況。
采用Promega細菌基因組提取試劑盒提取放線菌菌株JS1的DNA,用16S rDNA通用引物(27F:5′-AGA GTT TGA TCC TGG CTC AG-3′; 1492R: 5′-GGT TAC CTT GTT ACG ACT T-3′)進行PCR擴增,擴增產(chǎn)物切膠回收后送至華大生物技術(shù)有限公司測序,獲得的序列提交GenBank數(shù)據(jù)庫,用BLAST進行同源性比較,選取相似度高的不同種菌株,用MEGA5.0軟件中的Neighbor-joining法構(gòu)建系統(tǒng)發(fā)育樹并進行分析。
2 結(jié)果與分析
2.1 石榴枯萎病菌拮抗放線菌的篩選
從建水石榴園和蒙自石榴園采集了45個土壤樣本,分離得到菌落特征各不相同的放線菌168株,初步篩選得到38株拮抗石榴枯萎病的放線菌,進一步用平板對峙法復(fù)篩得到6株石榴枯萎病菌拮抗放線菌,6株放線菌對石榴枯萎病菌的抑菌半徑在3.5~11 mm之間,其中JS1菌株對石榴枯萎病菌有較好的拮抗活性,抑菌半徑為11 mm,6個菌株對石榴枯萎病菌的拮抗效果見圖1,根據(jù)復(fù)篩的結(jié)果,我們選擇JS1菌株進一步試驗。

圖1 生防菌JS1、JS2、MZ11、MZ12、MZ93、MZ1對石榴枯萎病菌的拮抗效果Fig.1 Antifungal plate of JS1, JS2,MZ11, MZ12, MZ93 and MZ1 against Ceratocystis fimbriata
采用孔洞法測定了拮抗放線菌JS1發(fā)酵液及菌絲浸出液對石榴枯萎病菌的抑菌作用,其中拮抗放線菌JS1發(fā)酵液對石榴枯萎病菌的抑菌半徑為10 mm,說明放線菌JS1發(fā)酵液中含有某些抑菌物質(zhì),抑制了石榴枯萎病菌的生長;拮抗放線菌菌絲浸出液對石榴枯萎病菌沒有明顯的抑菌作用,說明拮抗放線菌細胞內(nèi)沒有抑制石榴枯萎病菌的活性物質(zhì)存在。綜合以上結(jié)果,拮抗放線菌JS1的抑菌成分主要存在于其發(fā)酵產(chǎn)物而非菌體本身。
2.2 放線菌JS1發(fā)酵液對南方根結(jié)線蟲卵孵化的抑制活性
石榴枯萎病菌拮抗放線菌JS1發(fā)酵液對南方根結(jié)線蟲卵孵化的抑制活性見表1。不同濃度的JS1發(fā)酵液處理南方根結(jié)線蟲卵2 d,孵化率與對照相比差異不顯著;不同濃度的JS1發(fā)酵液處理南方根結(jié)線蟲卵4 d,濃度為30%、40%、50%的處理與對照卵孵化率相比差異顯著;不同濃度的JS1發(fā)酵液處理南方根結(jié)線蟲卵6 d,孵化率與對照相比都差異顯著,且JS1發(fā)酵液濃度為20%、30%、40%、50%的處理與對照卵孵化率相比差異極顯著。南方根結(jié)線蟲卵孵化率隨著JS1發(fā)酵液濃度升高而降低,50% JS1發(fā)酵液處理6 d,南方根結(jié)線蟲卵孵化率與對照相比降低了51.67%,說明JS1菌株發(fā)酵液對南方根結(jié)線蟲卵孵化有較好的抑制作用。

表1 JS1菌株發(fā)酵液對南方根結(jié)線蟲卵孵化的抑制作用1)Table 1 Inhibition effect of JS1 fermented liquid on egg hatching of Meloidogyne incognita
1) 同列數(shù)據(jù)后不同小寫字母表示數(shù)據(jù)間差異顯著 (P<0.05),同列數(shù)據(jù)后不同大寫字母表示數(shù)據(jù)間差異極顯著 (P<0.01)。下同。
Different lowercase letters in the same column indicate significant difference at 0.05 level; different capital letters in the same column indicate significant difference at 0.01 level. The same below.
2.3 放線菌JS1發(fā)酵液對南方根結(jié)線蟲2齡幼蟲的抑殺活性
放線菌JS1發(fā)酵液對南方根結(jié)線蟲2齡幼蟲的抑殺活性見表2,不同濃度的JS1發(fā)酵液處理2齡幼蟲24、48 h,發(fā)酵液濃度為30%、40%、50%的處理2齡幼蟲死亡率與對照相比差異顯著;不同濃度的JS1發(fā)酵液處理2齡幼蟲72 h,所有處理中2齡幼蟲的死亡率與對照相比差異極顯著。南方根結(jié)線蟲2齡幼蟲的校正死亡率隨著JS1發(fā)酵液濃度增大而增加,濃度50%的JS1發(fā)酵液處理72 h,南方根結(jié)線蟲2齡幼蟲校正死亡率與對照相比增加了88.10%,說明JS1發(fā)酵液對南方根結(jié)線蟲2齡幼蟲有較好的抑殺活性。

表2 JS1菌株發(fā)酵液對南方根結(jié)線蟲2齡幼蟲的抑殺活性Table 2 Toxicity effect of JS1 fermented liquid on Meloidogyne incognita second-stage juveniles
2.4 石榴枯萎病拮抗放線菌JS1的鑒定
石榴枯萎病拮抗放線菌JS1在高氏一號培養(yǎng)基上,菌絲生長好,基內(nèi)菌絲秋海棠紅,無隔不斷裂;氣生菌絲舌紅,菌苔表面絨狀;孢子絲直形或波曲,孢子橢圓形或長柱形,兩端整齊,不產(chǎn)生水溶性色素。石榴枯萎病拮抗放線菌JS1在鑒定培養(yǎng)基上的培養(yǎng)特性見表3。
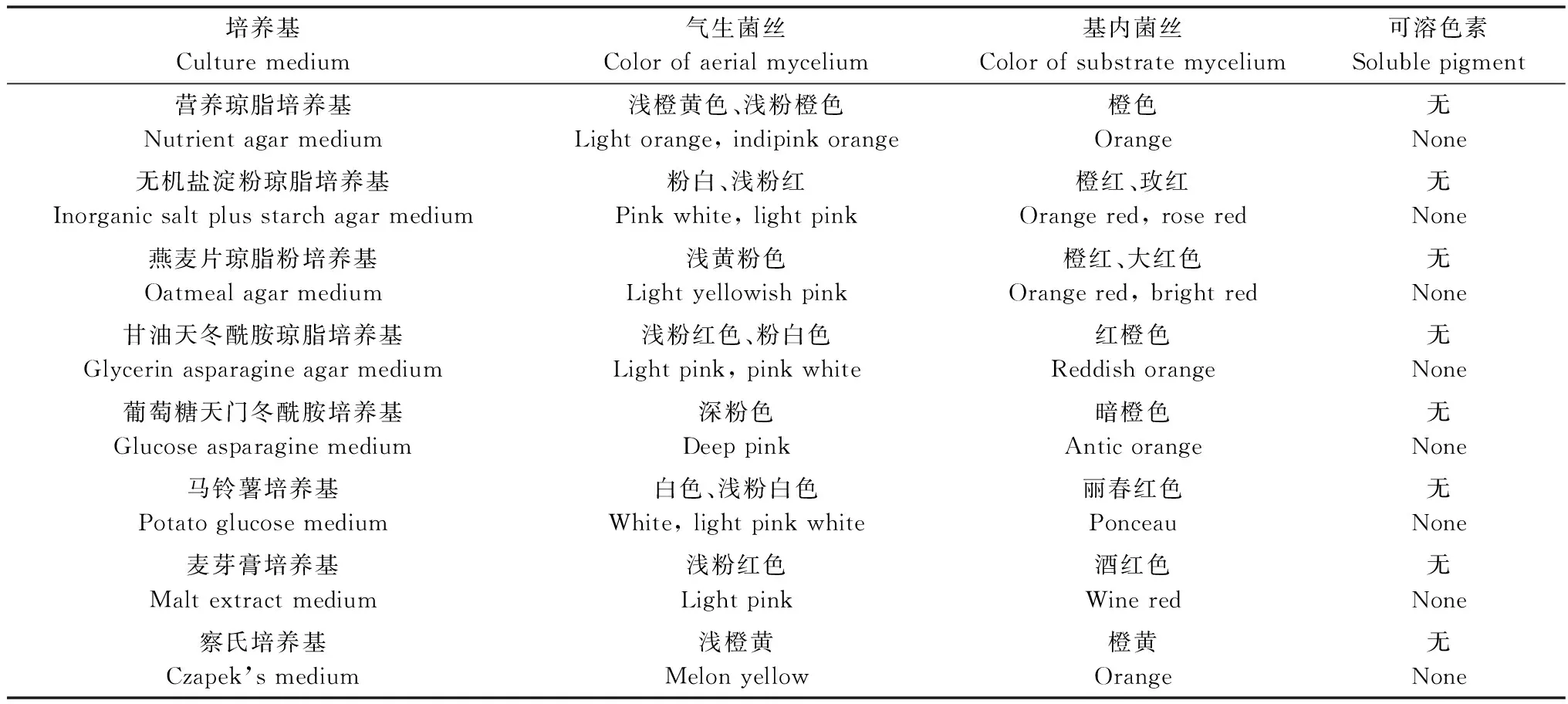
表3 放線菌JS1在各種鑒定培養(yǎng)基上的培養(yǎng)特性Table 3 Cultural characteristics of actinomycetes strain JS1 in different media
利用16S rDNA通用引物對菌株JS1進行PCR擴增,片段經(jīng)測序后得到16SrDNA近全長序列,GenBank序列號為KT069562。Blast相似性分析表明,放線菌JS116S rDNA序列與壯觀鏈霉菌(Streptomycesspectabilis)的同源性為100%,構(gòu)建的系統(tǒng)發(fā)育樹(圖2)揭示放線菌JS1與壯觀鏈霉菌處于同一分支。
結(jié)合形態(tài)學(xué)特征和分子特征分析,初步鑒定菌株JS1為壯觀鏈霉菌。
3 討論
放線菌因種類多樣、分布廣泛,且可產(chǎn)生豐富的農(nóng)用抗生素和抗菌活性物質(zhì),使其在植物病害的防治及微生物農(nóng)藥的篩選上得到廣泛應(yīng)用[19]。據(jù)報道壯觀鏈霉菌能產(chǎn)生大觀霉素、曲張鏈菌素及間環(huán)丙菌素等多種抗生素[20];Chaudhary等[21]研究表明壯觀鏈霉菌在氨基糖甙類抗生素的生產(chǎn)中有特殊作用,氨基糖甙類抗生素通過抑制微生物的蛋白質(zhì)合成而產(chǎn)生快速的殺菌作用。Benallaoua等[22]從土壤中分離得到壯觀鏈霉菌BT352,從該菌的上清液分離純化得到一種非多烯的大環(huán)內(nèi)酯結(jié)構(gòu)代謝產(chǎn)物有抗真菌活性,研究發(fā)現(xiàn)這種代謝物與沙漠霉素有關(guān)。趙淑莉等[23]報道壯觀鏈霉菌對玉米大斑病菌具有較強的拮抗作用,室內(nèi)抑菌半徑為15.5 mm;本研究從云南蒙自、建水石榴園采集的土樣中分離篩選得到對石榴枯萎病菌有較強拮抗活性的放線菌菌株JS1,鑒定為壯觀鏈霉菌菌株,對石榴枯萎病菌的室內(nèi)抑菌半徑為11 mm,與趙淑莉等的研究結(jié)果相比略低,可能是因為拮抗的病原菌不同。另Khamna等[24]的研究表明分離自七葉蘭根際土壤的壯觀鏈霉菌CMU-PA101能高效地產(chǎn)生生物活性代謝物質(zhì),對多種病原真菌有較好的拮抗作用;壯觀鏈霉菌CMU-PA101對尖孢鐮刀菌、齊整小核菌的拮抗作用尤其顯著[25]。綜合以上結(jié)果,壯觀鏈霉菌對多種植物病原真菌有較好的拮抗作用,本研究首次發(fā)現(xiàn)壯觀鏈霉菌對石榴枯萎病菌有較強的拮抗活性,其有效成分主要存在于發(fā)酵產(chǎn)物中,其對石榴枯萎病的田間防效有待進一步研究。

圖2 以16S rDNA為基礎(chǔ)構(gòu)建的JS1系統(tǒng)進化樹Fig.2 Phylogenetic tree of JS1 based on 16S rDNA sequences
放線菌對病原生物有很高的寄生性和拮抗作用,是控制植物病原生物的重要微生物資源,在根結(jié)線蟲的生防菌株開發(fā)方面具有巨大的潛能。放線菌中的一些種類能夠產(chǎn)生具有殺線蟲特性的化合物,已報道的主要有鏈霉菌和諾卡氏菌[26],鏈霉菌產(chǎn)生的阿維菌素已成功應(yīng)用于南方根結(jié)線蟲的預(yù)防與治療[27]。本研究中分離獲得的放線菌JS1,其50%發(fā)酵液處理南方根結(jié)線蟲6 d的卵孵化率與對照相比降低了51.67%,JS1菌株發(fā)酵液抑制卵孵化效果優(yōu)于田陽等[28]報道的海洋放線菌M1D14發(fā)酵液,略低于陳立杰等[29]報道的放線菌C49、C25-3、C58對孢囊線蟲的孵化相對抑制率。本研究中50% JS1發(fā)酵液處理南方根結(jié)線蟲2齡幼蟲72 h,南方根結(jié)線蟲2齡幼蟲校正死亡率增加了88.10%,略低于田陽等[28]報道的海洋放線菌M1D14發(fā)酵液的效果。放線菌對根結(jié)線蟲的抑殺活性有較多的報道,曾慶飛等[30]分離自海泥樣品中的鏈霉菌HA10002發(fā)酵原液對2齡幼蟲的校正死亡率達100%;黃惠琴等[31]分離的放線菌菌株 HA11097發(fā)酵液稀釋40倍,抗根結(jié)線蟲2齡幼蟲的校正死亡率為46.7%;魏華等[32]報道從紅樹林底泥中分離篩選的放線菌HA11090,其發(fā)酵液稀釋40倍抗根結(jié)線蟲校正死亡率為65.0%。
本研究分離得到的壯觀鏈霉菌對石榴枯萎病菌有較好的室內(nèi)拮抗作用,對南方根結(jié)線蟲卵孵化及2齡幼蟲有較強的抑殺活性。蒙自萬畝石榴園中石榴根結(jié)線蟲病的廣泛發(fā)生加重了石榴枯萎病發(fā)生程度及病害的防控難度,尋找對石榴枯萎病及根結(jié)線蟲都有防效的菌株是環(huán)保有效地控制該病害的努力方向,該菌株在石榴枯萎病及根結(jié)線蟲病復(fù)合侵染的防治上有較好的開發(fā)利用潛力。
[1] Stover E D, Mercure E W.The pomegranate: a new look at the fruit of paradise [J]. HortScience, 2007, 42(5), 1088-1092.
[2] 李倩, 鄧吉, 李健強. 甘薯長喙殼菌產(chǎn)生芳香性氣體物質(zhì)研究進展[J]. 植物保護, 2009, 35(4): 8-14.
[3] 劉云龍, 何永宏, 王新志. 國內(nèi)一種果樹新病害—石榴枯萎病[J]. 植物檢疫, 2003, 17(4): 206-208.
[4] Huang Q, Zhu Y Y, Chen H R, et al. First report of pomegranate wilt caused byCeratocystisfimbriatain Yunnan, China [J]. Plant Disease, 2003, 87(9): 1150.
[5] Xu B, Zheng X H, Guo W X, et al. First report of pomegranate wilt caused byCeratocystisfimbriatain Sichuan Province[J]. Plant Disease, 2011, 95(6): 776-777.
[6] 鄧吉, 陸進, 李健強, 等. 石榴枯萎病發(fā)生危害與防治初步研究[J]. 植物保護, 2006, 32(6): 97-101.
[7] 周銀麗, 胡先奇, 王衛(wèi)疆, 等. 根結(jié)線蟲在云南石榴枯萎病發(fā)生過程中的作用初探[J]. 江蘇農(nóng)業(yè)科學(xué), 2010, (1): 149-150.
[8] 周銀麗, 楊偉, 余光海, 等. 中國云南省石榴根結(jié)線蟲的種類初報[J]. 華中農(nóng)業(yè)大學(xué)學(xué)報, 2005, 24(4): 351-354.
[9] 潘俊, 毛忠順, 李霞, 等. 利用枯草芽孢桿菌和熒光假單胞桿菌防治石榴枯萎病的初步研究[J]. 云南農(nóng)業(yè)大學(xué)學(xué)報(自然科學(xué)), 2013, 28(1): 27-32.
[10]Shirling E B, Gottlieb D.Methods for characterization ofStreptomycesspecies [J]. International Journal of Systematic and Evolutionary Microbiology, 1966, 16(3): 313-340.
[11]Williams S T, Goodfellow M, Alderson G, et al. Numerical classification ofStreptomycesand related genera [J]. Journal of General Microbiology, 1983, 129: 1743-1813.
[12]劉國生.微生物學(xué)實驗技術(shù)[M]. 北京:科學(xué)技術(shù)出版社,2007:125-128.
[13]張鴻雁,薛泉宏,唐明, 等. 不同種植年限人參地土壤放線菌生態(tài)研究[J]. 西北農(nóng)林科技大學(xué)學(xué)報(自然科學(xué)版),2010,38(8):151-159.
[14]楊敬輝,文平蘭,陳宏州, 等. 放線菌NF0919的鑒定及生防活性[J]. 西北農(nóng)業(yè)學(xué)報,2013,22(4):201-206.
[15]張武崗,馮俊濤,張錦恬, 等. 放線菌19G-317菌株發(fā)酵產(chǎn)物抑菌活性初步研究[J]. 西北農(nóng)林科技大學(xué)學(xué)報(自然科學(xué)版),2009,37(4):158-162.
[16]李姝江,朱天輝,余琴, 等. 桑氏鏈霉菌突變株的抑菌活性及對楊樹紫紋羽病的盆栽防效[J]. 植物保護,2015,41(5):61-68.
[17]田陽,李平,張莉,等.海洋放線菌M1D14代謝產(chǎn)物對幾種重要植物寄生線蟲的抑制作用[J].植物保護,2012,38(4):96-100.
[18]Lee Y S, Nguyen X H, Moon J H.Ovicidal activity of lactic acid produced byLysobactercapsiciYS1215 on eggs of root-knot nematode,Meloidogyneincognita[J]. Journal of Microbiology and Biotechnology, 2014, 24(11): 1510-1515.
[19]劉冰, 宋水林, 劉曉麗, 等. 生防放線菌ML27的鑒定及其抗真菌活性代謝產(chǎn)物的性質(zhì)研究[J]. 江西農(nóng)業(yè)大學(xué)學(xué)報, 2014, 36(3): 656-660.
[20]金燕華, 裘娟萍, 何景昌. 壯觀鏈霉菌產(chǎn)生抗生素的多樣性[J]. 中國醫(yī)藥工業(yè)雜志, 2006, 37(12): 849-855.
[21]Chaudhary H S, Soni B, Shrivastava A R, et al. Diversity and versatility of actinomycetes and its role in antibiotic production[J]. Journal of Applied Pharmaceutical Science, 2013, 3(8 S 1): S83-S94.
[22]Benallaoua S, Nguyen Van P, De Meo M P, et al. Recherches sur le mode d’action d’un antifongique non polyénique (désertomycine) produit par une souche deStreptomycesspectabilis[J]. Canadian Journal of Microbiology, 1990, 36(9): 609-616.
[23]趙淑莉,任飛娥,劉金亮,等.玉米大斑病生防放線菌的篩選鑒定及發(fā)酵條件優(yōu)化[J].微生物學(xué)報,2012,52(10):1228-1236.
[24]Khamna S, Yokota A, Peberdy J F, et al. Antifungal activity ofStreptomycesspp. isolated from rhizosphere of Thai medicinal plants[J]. International Journal of Integrative Biology, 2009, 6(3): 143-147.
[25]Khamna S, Yokota A, Lumyong S.Actinomycetes isolated from medicinal plant rhizosphere soils: diversity and screening of antifungal compounds, indole-3-acetic acid and siderophore production [J]. World Journal of Microbiology and Biotechnology, 2009, 25(4): 649-655.
[26]羅紅麗, 孫漫紅, 謝建平, 等. 根結(jié)線蟲放線菌及其生物防治活性研究[J]. 微生物學(xué)報,2006,46(4):598-601.
[27]朱衛(wèi)剛, 胡偉群, 陳定花.阿維菌素對南方根結(jié)線蟲的生物活性[J]. 現(xiàn)代農(nóng)藥,2008,7(4):38-39.
[28]田陽,李平,張莉,等.海洋放線菌M1D14代謝產(chǎn)物對幾種重要植物寄生線蟲的抑制作用[J].植物保護,2012,38(4):96-100.
[29]陳立杰,陳井生,段玉璽, 等. 防治大豆孢囊線蟲的生防放線菌初步篩選[J]. 植物保護,2008,34(3):116-119.
[30]曾慶飛, 黃惠琴, 朱軍, 等. 根結(jié)線蟲拮抗放線菌的篩選及菌株HA10002的鑒定與活性物質(zhì)分析[J]. 植物保護,2011,37(6):159-163.
[31]黃惠琴, 袁維道, 魏華, 等. 一株抗根結(jié)線蟲放線菌的篩選與鑒定[J]. 生物技術(shù)通報,2013(11):175-179.
[32]魏華,劉敏,鮑時翔,等.1株抗根結(jié)線蟲紅樹林放線菌的篩選與鑒定[J].微生物學(xué)雜志,2012,32(4):13-16.
(責任編輯:田 喆)
Nematicidal activity of actinomycete antagonistic to pomegranate wilt pathogen
Zhou Yinli1,2, Yang Yanli1, Yuan Shaojie1, Lin Lifei1, Hu Xianqi1
(1. Key Laboratory for Agro-biodiversity and Pest Management of Education Ministry of China,Yunnan Agricultural University, Kunming 650201, China; 2. Yunnan Key Laboratory for High-Quality Crops and Efficient Cultivation and Security Control, Honghe University, Mengzi 661100, China)
This study was conducted to separate actinomycetes with a strong antagonistic activity to pomegranate wilt pathogen from the soil collected from Mengzi megranate garden, Mengzi County and Jianshui Megranate Garden, Jianshui County in Yunnan Province. The indoor bacteriostatic radius of actinomycetes strains JS1 against pomegranate wilt pathogen was 11mm. Nematicidal activity of JS1 supernatant of fermented liquid toMeloidogyneincognitawas measured. The results showed that, compared with the control,M.incognitaegg hatching rate was lowered by 51.67% when treated for 6 d with 50% JS1 supernatant of the fermented liquid, and the corrected mortality rate ofM.incognitasecond-stage juveniles was increased by 88.10% if treated for 72 h with 50% JS1 supernatant of the fermented liquid. The finding suggested that strain JS1 could inhibit pomegranate wilt pathogen and was toxic toM.incognita. Strain JS1 was identified asStreptomycesspectabilisbased on its growth characteristics, morphological characteristics and analysis of 16S rDNA sequence.
pomegranate wilt pathogen; root knot nematode; biological control;Streptomycesspectabilis
2015-10-28
2015-12-10
公益性行業(yè)(農(nóng)業(yè))科研專項 (201103018-7);云南省應(yīng)用基礎(chǔ)研究項目(2013FZ125);云南省教育廳科研基金(2012Y453);紅河學(xué)院碩士點植物保護一級學(xué)科建設(shè)項目
S 476
A
10.3969/j.issn.0529-1542.2016.05.009
* 通信作者 E-mail: xqhoo@126.com

