經皮電刺激聯合減重跑臺訓練對完全性脊髓損傷大鼠膠質源性神經營養因子及RhoA表達的影響
蔡洪梅,王維,馬頔,王文娟,易添,周曉紅
經皮電刺激聯合減重跑臺訓練對完全性脊髓損傷大鼠膠質源性神經營養因子及RhoA表達的影響
蔡洪梅1,王維2,馬頔1,王文娟2,易添1,周曉紅2
(錦州醫科大學 1.研究生院;2.附屬第一醫院康復科,遼寧 錦州 121000)
目的研究經皮電刺激聯合減重跑臺訓練對完全性脊髓損傷大鼠膠質源性神經營養因子(GDNF)及RhoA表達的影響,探討其存在的可能機制。方法將108只成年雌性SD大鼠隨機均分為6組:正常組(A組)、假損傷組(B組)、損傷組(C組)、電刺激組(D組)、訓練組(E組)、電刺激+訓練組(F組)。術后第5天對D、E、F組進行相應的干預治療,在治療前后對所有大鼠進行BBB評分,并檢測治療1、3、7、14、21、28 d后損傷脊髓處的GDNF與RhoA的表達。結果從治療第7天開始,與C組比較,D、E、F組的BBB評分、GDNF表達都增高(P<0.05),RhoA的表達降低(P<0.05),且F組BBB評分、GDNF、RhoA表達差異更為顯著(P<0.01);正常組與假損傷組比較,BBB評分、GDNF、RhoA表達無統計學差異(P>0.05)。結論經皮電刺激與減重跑臺訓練能有效改善損傷脊髓的功能重建,其作用機制與GDNF、RhoA的表達變化有關;經皮電刺激與減重跑臺訓練聯合應用對大鼠運動功能恢復的治療作用更明顯,并適合長時間使用。
經皮電刺激;減重跑臺訓練;完全性脊髓損傷;膠質源性神經營養因子;RhoA
網絡出版地址
脊髓損傷(spinal cord injury,SCI)作為一種高致殘性疾病,造成患者肢體感覺、運動功能障礙等生理損傷的同時還給心理帶來嚴重壓力,對其回歸社會有很大的影響。大量研究[1]表明SCI危害巨大主要源于繼發性損傷,即神經元繼發性凋亡和脊髓損傷局部微環境的形成。經皮電刺激與減重跑臺訓練作為干預治療措施已被證實對改善SCI后遺癥、促進患者回歸社會家庭有效[2]。但對兩者的聯合應用目前未見相關報道。
近年來,研究[3]發現膠質源性神經營養因子(glial cell line?derived neurotrophic factor,GDNF)可維持脊髓運動神經元存活,抗神經元凋亡,實現運動功能重建,RhoA在軸突再生抑制性因子誘導脊髓神經元細胞骨架塌陷的過程中起到關鍵作用[4],針對GDNF和RhoA相關藥物與基因重組治療脊髓損傷的研究成為了熱點,但其給藥途徑和安全性問題也相繼出現[5],因此,本實驗將經皮電刺激與減重跑臺訓練聯合應用于脊髓損傷大鼠模型,檢測脊髓損傷大鼠GDNF、RhoA在脊髓中的表達,探討經皮電刺激與減重跑臺訓練對脊髓損傷存在的可能機制,為臨床研究開辟新思路提供相關的實驗數據。
1 材料與方法
1.1材料
經皮電刺激儀,自制減重跑臺訓練器,Bio?rad蛋白電泳裝置,Bio?rad半干轉印儀,搖床,Anti?RhoA(北京博奧森生物技術有限公司),Anti?GDNF(生工生物工程有限公司),SABC?POD(兔lgG)試劑盒、DAB顯色試劑盒、ECL試劑盒(博士德生物工程有限公司)。4.0%水合氯醛(0.4 g、10 mL生理鹽水配制,過濾,現用現配),青霉素鈉(80萬U,10 mL生理鹽水配制),PBS,肝素鈉等。
1.2動物及分組
SPF級成年雌性SD大鼠108只,體質量200~220 g,購自遼寧省實驗動物資源中心,由錦州醫科大學動物實驗中心喂養管理,室溫保持在20~25℃。
將108只成年雌性SD大鼠按隨機數字表法分為6組:正常組(A組)、假損傷組(B組)、損傷組(C組)、電刺激組(D組)、訓練組(E組)、電刺激+訓練組(F組),每組18只,干預治療1、3、7、14、21、28 d 6個時間點各3只。
1.3大鼠模型的制作
將C、D、E、及F組大鼠用自配的4.0%水合氯醛(3 mL/kg)腹腔注射麻醉。麻醉成功后放于大鼠手術臺上俯臥固定,以T10為中心,背部剃毛,常規消毒。縱行依次切開皮膚及皮下組織,剝離椎旁肌肉并暴露棘突與椎板,咬除T9~11椎板,暴露T10段脊髓,用尖銳刀片自背側至腹側快速橫斷脊髓,這時大鼠出現雙后肢快速收縮痙攣,尾巴痙攣性左右擺動,造模成功,再檢查脊髓兩斷端確認是否橫斷完全。壓迫止血后,逐層縫合切口,手術全程嚴格按無菌操作。術后立即給予青霉素鈉8萬U、生理鹽水2 mL 1次,皮下注射,稍按摩注射部位以助吸收。獨籠飼養,每日早晚各1次按摩擠壓膀胱助大鼠排尿,至排尿反射恢復;皮下注射青霉素鈉8萬U,1次/d,維持1周。注意觀察手術切口愈合情況,下肢、尾巴有無潰爛、自噬。假損傷組大鼠不做脊髓橫斷,其余同上述操作,A組大鼠不做任何特殊處理。除A組外,所有大鼠在手術前后各禁食水12 h,預防手術并發癥的產生。如有死亡或不適合繼續實驗的大鼠及時同條件補充。
1.4干預方法
1.4.1經皮電刺激:術后第5天對D組和F組大鼠進行電刺激,將大鼠放于固定器內,正極接T10位置的皮膚,負極接右下肢小腿位置的皮膚。刺激頻率10 Hz,疏密波脈沖電流3~8 mA,強度以引起肌肉收縮為宜,電刺激1次/d,每次30 min[6]。C組與相同的電刺激儀相連,但不給予刺激。
1.4.2減重跑臺訓練:術后第5天對E組和F組大鼠進行減重跑臺訓練。訓練設備是在大鼠跑步機的基礎上自制減重裝置,在跑步機上方置兩根帶有夾子的魚線,一根夾于大鼠項背部,控制前肢負重,另一根(長度可調)夾于尾部,控制后肢負重并根據后肢恢復情況調節減重量[7]。跑步機平板的速度為8~12 m/min,減重為大鼠體質量的30%~70%,速度與減重根據各組大鼠具體運動情況做適當調整。訓練時間為30 min/d,分3次進行,每次10 min,間隔5 min。在實驗前所有大鼠做跑臺適應性訓練,以熟悉跑臺環境,實驗過程中用細木棍給予大鼠適當刺激以保證訓練量。
1.5大鼠后肢運動功能評定量表(Bosso?Beattie?Bresnahan locomotor rating scale,BBB)
該評定法有21項,0~21分,分數越高表明下肢運動功能越好。本實驗中各組大鼠于造模前后進行BBB評分,造模前各組大鼠均達到21分。0分作為橫斷脊髓造模成功的標準,>0分視為造模失敗并同條件增補。取材前對各時間點大鼠進行BBB評分,以對比脊髓損傷后的運動功能恢復情況。所有評分都是由熟悉評定方法但不了解實驗分組的3名成員進行,取平均值作為最終評定得分。
1.6蛋白檢測
各組大鼠均于末次干預治療24 h后(即術后6、8、12、19、26、33 d)進行取材,每組每個時間點3只大鼠,其中1只用于免疫組化檢測,另外2只用于
Western blot檢測。
1.6.1免疫組化檢測GDNF蛋白表達:用過量的4.0%水合氯醛腹腔麻醉大鼠,依次剪開胸部的皮膚、肌肉、胸骨,暴露心臟,自心尖部插管直至主動脈后固定,剪開右心耳,灌注加入1 mL肝素鈉的生理鹽水(約200 mL)直到有澄清液從右心耳流出,肝臟、腸系膜變白,再改用經過濾的4℃4%多聚甲醛(約300 mL)灌注,直到肝臟、四肢變硬。拆除灌注裝置,剪下T10上下各2 cm的胸段脊髓,用彎眼科剪小心剔除椎板取出脊髓,放入4%多聚甲醛4℃恒溫固定,更換多聚甲醛液1次/d,連續3 d,于錦州醫科大學附屬第一醫院病理科包埋成蠟塊。按照試劑盒說明書行免疫組織化學染色:切片、烤片、脫蠟、3%H2O2滅活、抗原修復、封閉血清、一抗4℃孵育過夜、滴加二抗、DAB顯色、蘇木精染色、脫水封片。400倍放大,隨機選4個視野,觀察胞質內棕黃色纖維狀的GDNF陽性表達,應用Image?Pro Plus 6.0彩色病理圖文分析系統(Olympus公司),測定GDNF的陽性細胞數。
1.6.2Western blot檢測RhoA蛋白表達:用過量的4.0%水合氯醛進行腹腔麻醉大鼠,剪下T10上下各1 cm的胸段脊髓,小心剔除椎板取出脊髓,經1次PBS清洗掉血液等后放入標記好的2 mL EP管內,置于-80℃保存備用,整個過程在冰上作業并在5 min內完成。然后蛋白定量制樣、灌膠、加樣、電泳、轉膜、封閉、加一抗置于4℃過夜、加適當濃度的二抗、ECL顯色曝光,經定影處理后掃描分析。
1.7統計學分析
2 結果
因麻醉意外死亡3只,膀胱破裂造成4只死亡,腸梗阻死亡6只,均于造模后5 d內死亡。以上大鼠均同條件及時補充。
2.1各組大鼠各時間點BBB評分及分析
與C組比較,D、E、及F組從治療3 d開始(即術后第8天)BBB評分升高有統計學意義(P<0.05)。與D組和E組比較,治療7 d開始(即術后第12天)F組的BBB評分升高(P<0.05)。說明電刺激與減重跑臺訓練均能改善脊髓損傷大鼠下肢的運動功能,并且聯合運用對大鼠下肢功能重建的恢復更為顯著;治療7 d開始(即術后第12天),D組與E組BBB評分比較差異具有統計學意義(P<0.05),說明電刺激療法比減重跑臺訓練對脊髓損傷大鼠運動功能的恢復作用更明顯;而A組與B組比較,BBB評分無統計學差異(P>0.05),說明假損傷造模方法對該實驗研究未造成影響。見表1。
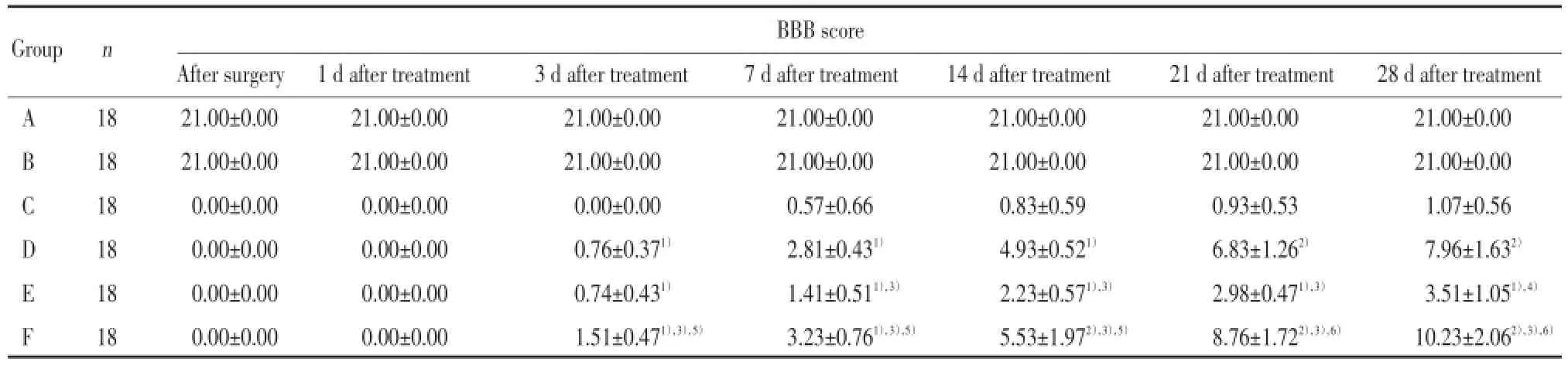
表1 各組大鼠各時間點BBB評分比較Tab.1 Comparison of BBB score in each rat group at each time point
2.2各組大鼠在各個時間點GDNF、RhoA蛋白表達
與B組比較,C組GDNF的陽性細胞數呈先升高后降低的趨勢,在術后第19天達到高峰,術后第33天降低到正常水平,說明GDNF在脊髓損傷后短期內有反應性升高,但維持時間不長,并由此推測隨著時間的延長,損傷組GDNF的陽性細胞數有可能會低于正常水平。與C組比較,D、E、F組GDNF的陽性細胞數升高有統計學意義(P<0.05);與D組和E組比較,F組升高差異有統計學意義(P<0.05),說明電刺激與減重跑臺訓練都能增加脊髓損傷大鼠脊髓處GDNF的分泌,聯合運用更為顯著。D組與E組比較陽性細胞數差異具有統計學意義(P<0.05),說明電刺激療法比減重跑臺訓練對GDNF的表達影響更明顯。見表2。
與C組比較,F組從治療3 d開始(即術后第8天)RhoA的表達降低(P<0.05),并且隨著治療時間延長差異更顯著(P<0.01);與D組和E組比較,F組RhoA的表達降低(P<0.01)。與C組比較,D、E組在治療7 d(即術后第12天)開始RhoA表達差異有統計學意義(P<0.05),說明電刺激與減重跑臺訓練的聯合運用,比兩者中任何一種單一療法對RhoA的表達影響都顯著,并適合長時間堅持使用。從治療7 d(即術后第12天)開始,D組與E組比較RhoA表達差異具有統計學意義(P<0.05),說明電刺激療法對RhoA的表達影響更顯著。D、E、F組RhoA的表達在治療3~7 d迅速降低并達高峰,隨后雖然其表達量在繼續降低,但降低速度變緩,說明早期治療對RhoA表達的影響較為明顯。見表3。
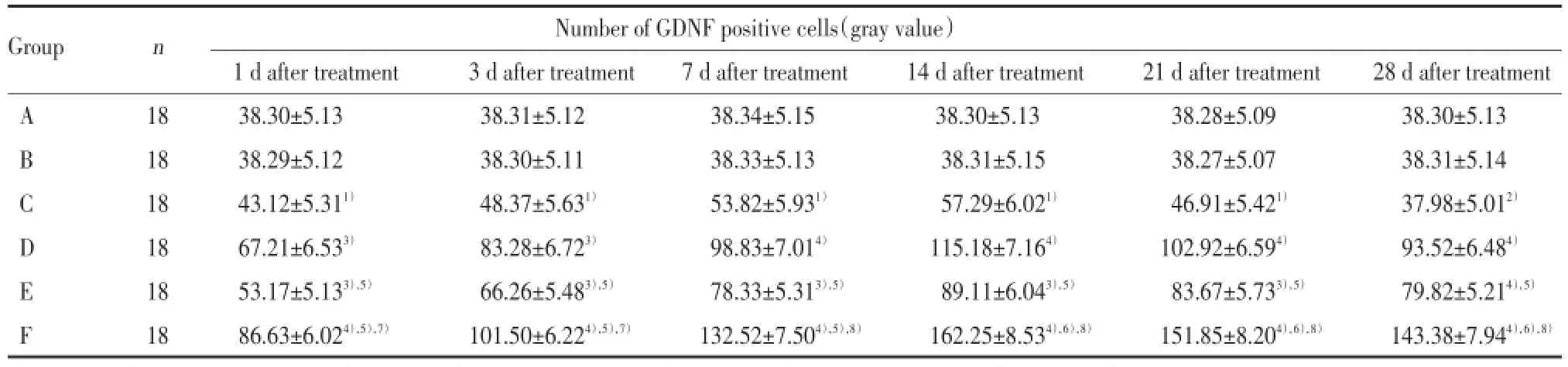
表2 各組大鼠免疫組化法檢測GDNF的表達比較Tab.2 Comparison of GDNF expression in each group by immunohistochemistry
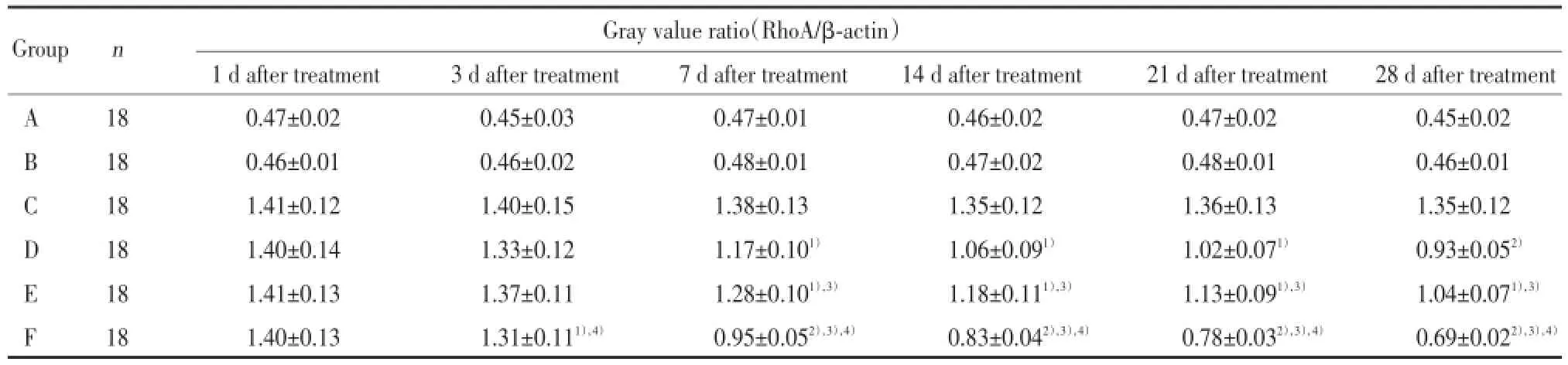
表3 各組大鼠Western blot檢測RhoA表達比較Tab.3 Comparison of RhoA expression in each group by Western blot
3 討論
隨著醫療技術的不斷發展,單一的治療方法已不再適應臨床需求。本實驗將經皮電刺激與減重跑臺訓練聯合作用于脊髓損傷大鼠,從而探討聯合療法的作用效果。經皮電刺激可通過抑制炎性因子及瘢痕形成、促進營養因子分泌改善脊髓的繼發性損傷;減重跑臺訓練是利用特殊的減重裝置,將上肢懸吊以減輕雙下肢負重,達到脊髓損傷后下肢的行走、肌力、感覺等功能逐漸恢復的一種康復訓練方法[8]。目前,減重跑臺訓練多用于不完全脊髓損傷及腦卒中患者的康復,而用于完全性脊髓損傷的研究較少。其作用機制可能與通過感覺信息的傳入,刺激損傷部位神經元軸突再生,從而促進神經環路的形成有關[9]。
本實驗結果顯示,D、E組大鼠BBB得分均高于C組,說明電刺激和減重跑臺訓練都可促進完全性SCI大鼠下肢運動功能的恢復;D、E組GDNF與RhoA的表達變化也表明電刺激和減重跑臺訓練對損傷脊髓的作用與GDNF和RhoA有關;F組的BBB得分、GDNF分泌和RhoA表達與C組比較都有明顯的差異,而且優于D、E 2組,另外還發現F組BBB得分、GDNF分泌和RhoA表達早期的變化速度較快,之后趨于平穩但仍與C組差異顯著。由此說明電刺激與減重跑臺訓練的聯合療法治療效果更明顯,且早期治療作用顯著并適合長期使用。
GDNF來源于神經膠質細胞,由134個氨基酸組成,分子量為(33~35)×103,是TGF?β超家族的亞家族,在脊髓中分布廣泛,其在正常大鼠脊髓后角中的含量較高。GDNF是一個較新的神經營養因子,近些年引起研究者的廣泛關注,大量在體和體外實驗都已表明,GDNF可維持損傷脊髓神經元的存活,促進軸突再生,減輕神經元繼發性凋亡,對脊髓損傷后運動功能的恢復發揮著至關重要的作用[10]。RhoA是小G蛋白超家族中Rho家族的Rho亞族中的成員,激活后的RhoA主要與下游的ROCK(即Rho激酶)結合影響肌動-球蛋白系統,最終導致生長錐的塌陷,抑制神經軸突再生[11?12]。而有研究[13]發現脊髓繼發性損傷的重要抑制因子(MAG、Nogo?A、Omgp等)都會通過影響RhoA信號通路發揮抑制作用,因此抑制RhoA的表達成為了阻斷脊髓繼發性損傷的關鍵。
經皮電刺激與減重跑臺訓練作為物理治療方法安全性較高,也已應用于臨床,但未見其對GDNF、RhoA影響的報道。因此,本實驗探討了經皮電刺激和減重跑臺訓練對脊髓損傷后運動功能恢復的作用機制是否與促進損傷脊髓中GDNF的分泌和抑制RhoA的表達有關。實驗研究結果顯示,D、E組與C組的比較,差異具有統計學意義(P<0.05),說明經皮電刺激和減重跑臺訓練一方面可通過促進GDNF的分泌抵抗運動神經元的凋亡,刺激軸突再生,另一方面,通過抑制RhoA的表達,切斷繼發性SCI抑制因子發揮抑制作用的信號通路,最終達到改善運動功能恢復的目的。
本次實驗通過對橫斷脊髓損傷大鼠模型進行經皮電刺激與減重跑臺訓練的不同干預設計,評定大鼠干預前后的BBB評分來反映脊髓損傷大鼠運動功能的恢復情況,同時檢測干預后損傷脊髓組織中GDNF和RhoA的表達變化,結果說明經皮電刺激與減重跑臺訓練都能有效改善損傷脊髓的功能重建,其作用機制與GDNF、RhoA的表達有關;且兩種方法的聯合應用對大鼠運動功能恢復的治療作用更明顯,并適合長時間使用。但由于實驗經費等原因,本實驗未能監測更長時間的使用結果及停止干預治療后的隨訪,故經皮電刺激及減重跑臺訓練對完全性脊髓損傷大鼠的長期效應還需要進一步研究。
[1]WHITE?SCHENK D,SHI RY,LEARY JF.Nanomedicine strategies for treatment of secondary spinal cord injury[J].Int J Nanomed,2015,10(1):923-938.DOI:https://dx.doi.org/10.2147/IJN.S7568 6.
[2]李華,李小萍,王玉龍,等.減重步行訓練對不完全脊髓損傷患者步行能力的影響[J].臨床和實驗醫學雜志,2008,7(7):69-73. DOI:10.3969/j.issn.1671?4695.2008.07.039.
[3]DENG LX,DENG P,RUAN YW,et al.A novel growth?promoting pathway formed by GDNF overexpressing schwann cells promotes propriospinal axonal regeneration,synapse formation,and partial re?covery of function after spinal cord injury[J].J Neurosci,2013,33(13):5655-5667.DOI:10.1523/JNEUROSCI.2973?12.2013.
[4]SCHOLLENBERGER L,GRONEMEYER T,HUBER CM,et al. RhoA regulates peroxisome association to microtubules and the ac?tin cytoskeleton[J].PLoS One,2010,5(11):e13886.DOI:10.1371/ journal.pone.0013886.
[5]PARGRIDGE WM,BOADO RJ.Pharmacokinetics and safety in rhe?sus monkeys of a monoclonal antibody?GDNF fusion protein for tar?geted blood?brain barrier delivery[J].Pharm Res,2009,26(10):2227-2236.DOI:10.1007/s11095?009?9939?6.
[6]DELEY G,DENUZILLER J,BABAULT N,et al.Effects of electri?cal stimulation pattern on quadriceps isometric force and fatigue in individuals with spinal cord injury[J].Muscle Nerve,2015,52(2):260-264.DOI:10.1002/mus.24530.
[7]馬睿杰,孫連珠,張柳娟,等.電針結合減重步行訓練對急性脊髓損傷大鼠巢蛋白和神經生長因子表達的影響[J].中國康復醫學雜志,2015,30(6):532-537.DOI:10.3969/j.issn.1001?1242.2015. 06.003.
[8]趙俊,鄒任玲,胡秀枋,等.大鼠跑臺訓練模型方法研究進展[J].動物醫學進展,2014,35(9):101-105.DOI:10.3969/j.issn.1007?5038.2014.09.025.
[9]MEHRHOLZ J,POHL M,ELSNER B.Treadmill training and body weight support for walking after stroke[J].Cochrane Database Syst Rev,2014,1:CD002840.DOI:10.1002/14651858.CD002840.pub3.
[10]LEDDA F,PARATCHA G,SANDOVAL?GUZMAN T,et al.GDNF and GFRa1 promote formation of neuronal synapses by ligand?in?duced cell adhesion[J].Nature Neurosci,2007,10(3):293-300. DOI:10.1038/nn1855.
[11]CONRAD S,GENTH H,HPFMANN F,et al.Neogenin?RGMa sig?naling at the growth cone is bone morphogenetic protein?indepen?dent and involves RhoA,ROCK,and PKC[J].J Biolog Chem,2007,282(22):16423-16433.DOI:10.1074/jbcM610901200.
[12]COSTA P,SCALES TME,IVASKA J,et al.Integrin?specific con?trol of focal adhesion kinase and RhoA regulates membrane protru?sion and invasion[J].PLoS One,2014,8(9):e74659.DOI:10.1371/journal.pone.0074659.
[13]CAFFERTY WBJ,DUFFY P,HUEBNER E,et al.MAG and OMgp synergize with Nogo?A to restrict axonal growth and neuro?logical recovery after spinal cord trauma[J].J Neurosci,2010,30(20):6825-6837.DOI:10.1523/JNEUROSCI.6329?09.2010.
(編輯武玉欣)
Effects of Transcutaneous Electrical Stimulation and Combination Body Weight Supported Treadmill Training on Glial Cell Line?derived Neurotrophic Factor and RhoA in Transection Spinal Cord Rats
CAI Hongmei1,WANG Wei2,MA Di1,WANG Wenjuan2,YI Tian1,ZHOU Xiaohong2
(1.Graduate School,Jinzhou Medical University,Jinzhou 121000,China;2.Department of Rehabilitation,The First Affiliated Hospital,Jinzhou Medical University,Jinzhou 121000,China)
ObjectiveTo study the effects of transcutaneous electrical stimulation and combination body weight supported treadmill training on glial cell line?derived neurotrophic factor(GDNF)and RhoA in rats with spinal cord transection,and explore their possible mechanism.Methods A total of 108 adult female SD rats were randomly divided into 6 groups:normal group(A group),sham injured group(B group),injured group(C group),electrical stimulation group(D group),training group(E group)and electrical stimulation+training group(F group).After 5 days of sur?gery corresponding intervention treatment for the D,E,F groups,Bosso?Beattie?Bresnahan locomotor rating scale for open field(BBB scale)was assessed.The expression of GDNF and RhoA in spinal cord tissue were measured 1,3,7,14,21 and 28 d after treatment.ResultsCompare with C group,the scores of BBB and levels of GDNF were increased(P<0.05),and the levels of RhoA were reduced(P<0.05)in D,E,F groups since 7 d after treatment,and the BBB scales,levels of GDNF,RhoA in F group was more obviously(P<0.01).There were no statistical differenc?es of the BBB scales,levels of GDNF,and RhoA between normal group with sham injured group(P>0.05).ConclusionTranscutaneous electri?cal stimulation and body weight supported treadmill training can effectively improve the injured spinal cord function reconstruction,and their mech?anism may be associated with the expression of GDNF and RhoA in injured spinal cord.The combination therapy of electrical stimulation and body weight supported treadmill training is more apparent for motor function recovery of rats,which is suitable for long time use.
transcutaneous electrical stimulation;body weight support treadmill training;complete spinal cord injury;glial cell line?derived neurotrophic factor;RhoA
R493
A
0258-4646(2016)09-0838-05
10.12007/j.issn.0258?4646.2016.09.016
蔡洪梅(1987-),女,碩士研究生.
王維,E-mail:dubutianxia315@163.com
2015-11-28
網絡出版時間:

