超聲波處理蛋白質-磷脂復合物結構與功能性構效關系解析
畢爽,李楊,毛惠婷,隋曉楠,王中江,齊寶坤,江連洲
(東北農業大學 食品學院,黑龍江 哈爾濱,150030)
?
超聲波處理蛋白質-磷脂復合物結構與功能性構效關系解析
畢爽,李楊,毛惠婷,隋曉楠,王中江,齊寶坤,江連洲*
(東北農業大學 食品學院,黑龍江 哈爾濱,150030)
大豆分離蛋白(SPI)和大豆卵磷脂(LEC)在中性條件下(pH 7.0)復合后,可自發組成蛋白質-磷脂復合物,但仍有部分未自組裝的蛋白質和磷脂存在于溶液中。目前研究中仍實現不了蛋白質-磷脂最大復合程度以及最多結合位點的目標。同時,超聲波對復合物性質的影響規律也尚不清晰。因此,該研究采用“超聲改性-結構變化-功能表達”的研究理念,以大豆蛋白-磷脂為研究對象,采用熒光光譜法研究了不同超聲波處理對蛋白質-磷脂復合程度的影響,采用起泡性及泡沫穩定性測定、表面疏水性分析、動態光散射粒度分析、濁度測定等重點解析了超聲波對蛋白質-磷脂結構變化與功能性質表達的構效關系。結果表明:當超聲時間較短時(12 min),中功率(300 W)超聲波對大豆蛋白-磷脂復合的影響最大,此時復合物的內源熒光性降低,表面疏水性升高。當超聲時間較長時(24 min),低功率(150 W)超聲波會明顯增加聚合物的起泡性及泡沫穩定性,同時粒徑由未超聲時的16.80 μm減小至6.39 μm、濁度明顯降低且溶液分散均勻、性質穩定。但隨著超聲功率的進一步增大,蛋白質發生不溶性聚集,導致其與磷脂間的相互作用變弱。
大豆蛋白-磷脂;超聲波處理;表面疏水性;粒度分析;熒光光譜
大豆蛋白作為一種營養價值較高的植物蛋白被廣泛地應用在食品加工與制造中[1]。但天然大豆蛋白的功能性質在加工中會受到一定程度的破壞,尤其是當溶液的pH接近蛋白質的等電點時,蛋白質的各種性質都會大幅度下降,因此常對蛋白進行適當的改性[2]。在過去幾年中,蛋白質的改性技術研究主要集中在物理改性和化學改性[3-4]。近年來,大豆蛋白天然改性成為研究熱點。如引入生物小分子使其與蛋白質發生相互作用,復合體系的產生對大豆蛋白的功能性質具有重要的影響。
大豆卵磷脂是食品中重要的營養成分,具有改善食品風味和質地的作用。作為一種兩性離子表面活性劑,它可以通過結合的方式使蛋白質的表面活性發生改變,且他們之間的交互作用會影響大豆蛋白的功能性質。現今文獻已對大豆蛋白-磷脂交互作用方式進行了部分研究,但未能清晰地解釋超聲波處理等物理加工方式對蛋白質-磷脂交互作用的影響,更缺少復合物結構及功能性質隨超聲波強度和超聲波時間變化規律的研究。BECKWITH等[5-6]通過研究預測大豆蛋白與卵磷脂之間存在交互作用,且蛋白質和磷脂間的交互作用可以使蛋白質包裹到磷脂的囊泡或膠束中。磷脂與蛋白會通過靜電作用和疏水作用結合形成復合物[7]。環境因素可以改變復合體系的性質,如:pH可以修改蛋白質和磷脂復合物的表面活性,同時改變液滴之間的流體動力學作用;NaCl濃度的增加導致乳清蛋白-磷脂乳液粒徑增大,易造成油滴聚集降低乳液穩定性[8-9]。但是物理改性技術如:超聲波處理對蛋白質-磷脂復合程度及復合物性質的影響研究目前仍缺少規律性,并未清晰闡明超聲波處理對蛋白質-磷脂交互作用的影響。
因此,本文中重點研究超聲功率和超聲時間對大豆蛋白-磷脂復合程度及復合物功能性質的影響。采用低、中、高3種超聲功率(150、300、450 W)和短時、長時2種超聲時間(12、24 min)對大豆蛋白-磷脂復合物進行超聲處理,并對復合物的結構性質、理化特性及功能特性進行了分析。綜合實驗結果,總結出不同超聲處理條件對大豆蛋白-磷脂復合物形成的影響,為超聲技術運用于大豆蛋白-磷脂復合產品、其他蛋白與磷脂復合的食品加工過程提供了理論依據。
1 材料與方法
1.1 材料與試劑
大豆,北大荒綠野食品有限公司;大豆分離蛋白,實驗室自制;大豆卵磷脂,Sigma公司;1-苯胺基-8-萘磺酸(ANS),Sigma公司;HCl、NaOH,北京新光化工試劑廠;NaH2PO4、Na2HPO4,天津市東麗區天大化學試劑廠;正己烷,天津北科化學品有限責任公司;國產分析純試劑。
1.2 儀器與設備
超聲波細胞破碎儀,寧波新芝生物科技股份有限公司;AL204型分析天平,梅勒特-托利多儀器(上海)有限公司;pHSJ-4A型實驗室pH計,中國上海雷磁公司;GL-20G-II高速冷凍離心機,上海安亭科學儀器廠;722型可見分光光度計,上海光譜儀器有限公司;F-4500熒光分光光度計,日本HITACHI公司;Mastersizer 2000 激光粒度儀,英國馬爾文儀器有限公司;ULTRA-TURRAX UTL2000 乳化機,德國IKA儀器設備公司。
1.3 實驗方法
1.3.1 大豆分離蛋白制備
大豆分離蛋白的制備參考WOLF[10]等人的方法,并適當修改。稱取無蟲害、新鮮大豆磨粉并過60目篩,所得豆粉與正己烷以1∶3的比例混合,在40 ℃下攪拌2 h脫脂3次。將脫脂豆粉按1∶10的比例與水混合,然后用2 mol/L的NaOH調節溶液的pH至8.5,45 ℃攪拌2 h后,將其懸浮液在4 ℃條件下10 000×g離心20 min,取上清液再用2 mol/L HCl調節pH值至4.5。靜置后在4℃條件下6 000×g離心20 min,得蛋白沉淀水洗2次,最后用2 mol/L NaOH調節蛋白質pH值至7.0。將此蛋白溶液冷凍干燥后研磨即得粉末狀大豆分離蛋白。
1.3.2 大豆蛋白-磷脂復合物的超聲制備
將大豆卵磷脂與大豆蛋白以1∶10的比例混合于50 mL錐形瓶中,大豆蛋白濃度為10 mg/mL,室溫下不斷攪拌2 h。然后將錐形瓶置于冰水浴中1 h使混合液溫度低于2 ℃,超聲處理的方法及條件設定參考HU等人[11]并進行一定的修改。將超聲波處理器的鈦探頭(直徑0.636 cm)插入液面下,距離錐形瓶底部1 cm處,在20 kHz下分別在輸出功率為150 W, 300 W, 450 W下處理12 min和24 min,超聲時間4 s,間隔時間2 s,并每5 min向冰水浴中加入冰塊保持低溫,將未超聲處理與不同超聲處理下的大豆蛋白-磷脂復合物按照表1所示編號為樣品0~6號。
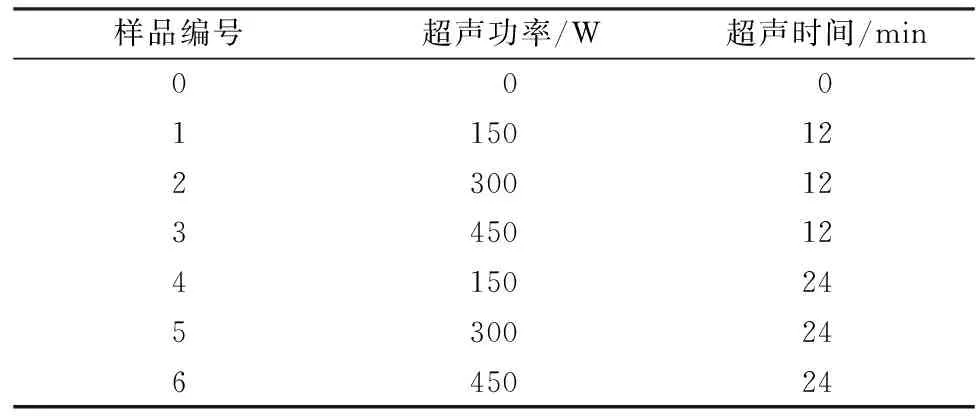
表1 超聲處理制備大豆蛋白-磷脂復合物
1.3.3 起泡性及泡沫穩定性
復合物水溶液起泡性及泡沫穩定性的測定方法參考SATHE等人[12]的方法。不同超聲處理的大豆蛋白-磷脂水溶液各100 mL,用高速均質機均質40 s,連續均質3次共2 min,轉速17 500 r/min。起泡性(FC)與泡沫穩定性(FS)計算公式如下:
(1)
(2)
其中:V0為均質后液面的高度,V30為靜置30min后再次記錄的液面高度。
1.3.4 表面疏水性測定
蛋白質-磷脂復合物的表面疏水性測定參考KATO和NAKAI[13]的測定方法,將不同超聲處理的大豆分離蛋白與大豆磷脂溶液以10 000×g離心30min,取上清液測定蛋白濃度,用0.01mol/L的磷酸鹽緩沖液依次將蛋白樣品稀釋,保證濃度在0.05~0.4mg/mL。實驗中激發波長λex=390nm,發射波長λem=468nm,夾縫為5nm,掃描速度10nm/s。取溶液4mL,分別加入40μL用0.01mol/L的磷酸鹽緩沖液(pH7.0)配制的最終濃度為8mmol/L的ANS溶液, 經振蕩快速混合后靜置3min后測定樣品熒光強度(FI)。以熒光強度與蛋白質濃度作圖,表面疏水值為蛋白質分子的初始段斜率。
1.3.5 粒徑的測定
利用Mastersizer2000 激光粒度儀進行粒徑分布測定。采用不同超聲條件形成的大豆蛋白-磷脂復合物溶液樣品進行測定,泵速1 800r/min,顆粒折射率1.46,分散劑折射率1.33, 吸收參數0.001[14]。
1.3.6 濁度的測定
蛋白質-磷脂復合物溶液濁度的測定參考MARTINI等人[15]的方法,樣品經超聲處理后用722型可見分光光度計在600nm下測定各蛋白溶液的吸光度。
1.3.7 熒光光譜的測定
蛋白質-磷脂復合物的內源性熒光光譜采用F-4500熒光分光光度計測定(色氨酸熒光光譜)。將超聲制備好的蛋白質-磷脂復合物樣品適度稀釋后配置蛋白質濃度為0.15mg/mL。大豆分離蛋白內部的色氨酸基團為熒光探針分析熒光發散光譜,激發波長設定為290nm,發散波長掃描范圍為300~500nm,激發狹縫為5nm,同樣發射狹縫寬也為5nm。重復掃描3次[16]。
1.3.8 數據統計及分析
2 結果與討論
2.1 起泡及泡沫穩定性的分析
不同超聲條件對大豆蛋白-磷脂復合物起泡性及泡沫穩定性的影響如圖1所示。蛋白質-磷脂溶液受到高速攪拌時,大量氣體進入溶液中形成一定量的水-空氣界面,溶液表面張力降低后形成泡沫的能力即為復合體系的起泡性[17]。起泡性改變與蛋白結構和物理化學性質的變化有關。
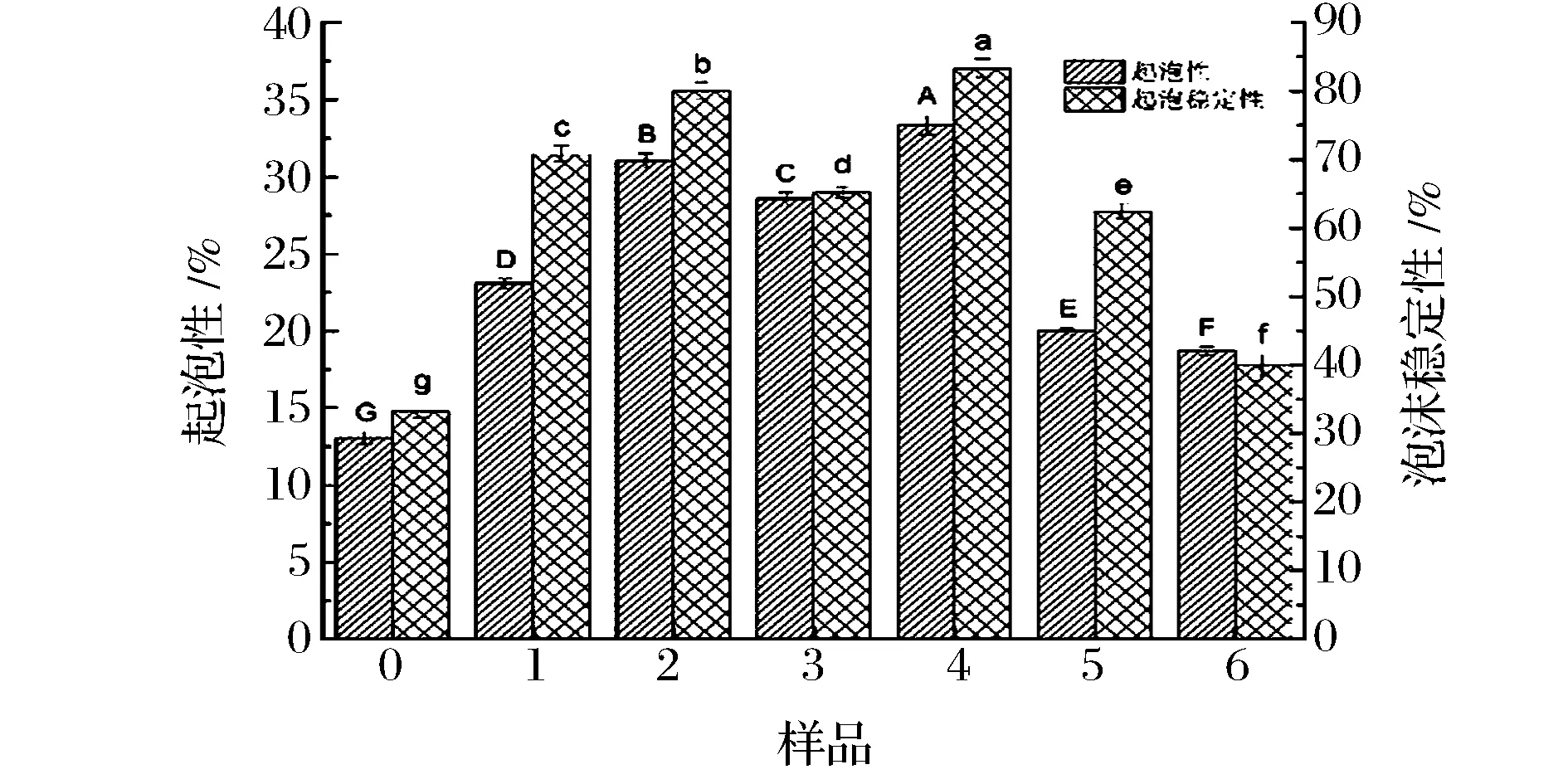
圖1 不同超聲處理條件下大豆蛋白-磷脂復合物的起泡性及泡沫穩定性Fig.1 Foaming capacity and forming stability of untreated and ultrasonication-treated soybean protein-lecithin complex
如圖1 所示,未經處理的蛋白質-磷脂樣品起泡性和泡沫穩定性都較差,經過超聲處理后各樣品的起泡性和泡沫穩定性均表現出一定程度的升高。在低功率超聲處理時,長時間超聲后起泡性及泡沫穩定性比短時間超聲的好。然而,在中功率和高功率超聲處理時,長時間超聲處理后樣品的起泡性和泡沫穩定性都較差。超聲作用有助于將蛋白質解聚成小分子亞基,同時暴露蛋白質的疏水基團,增加了氣水界面蛋白分子數目和與磷脂疏水結合的程度,從而不同程度提高了起泡能力[18]。但隨著超聲時間的延長以及超聲功率的增大,大豆蛋白分子結構進一步打開,分子間重新形成更大的聚集體,表現界面膜的穩定性下降,起泡能力下降[19]。蛋白質-磷脂復合體系起泡性的變化與其結構變化密切相關。
2.2 蛋白濃度分析
樣品表面疏水性測定之前,采用試劑盒測定離心后樣品的蛋白質濃度。不同超聲處理條件下樣品的蛋白質濃度見圖2。實驗結果顯示,不同超聲處理后樣品中蛋白質濃度分別有不同程度的提升。JAMBRAK等[11]研究指出超聲作用會提升大豆分離蛋白的溶解度。當超聲時間為12 min時,300 W超聲功率條件下復合物中蛋白質的溶解度最高,低、高功率超聲條件下蛋白質的溶解度接近于未超聲的樣品。當超聲時間延長至24 min后,低功率超聲波產生的空化作用足以使蛋白質結構完全展開,埋藏在內部的疏水基團和巰基暴露到分子表面,與磷脂通過疏水相互作用結合后復合物具有更多的親水基團,因而溶解度提升。另一種可能是因為適宜強度的超聲處理后,蛋白質分子質量降低,更多的蛋白質區域暴露到水分子周圍,增加了溶解度。
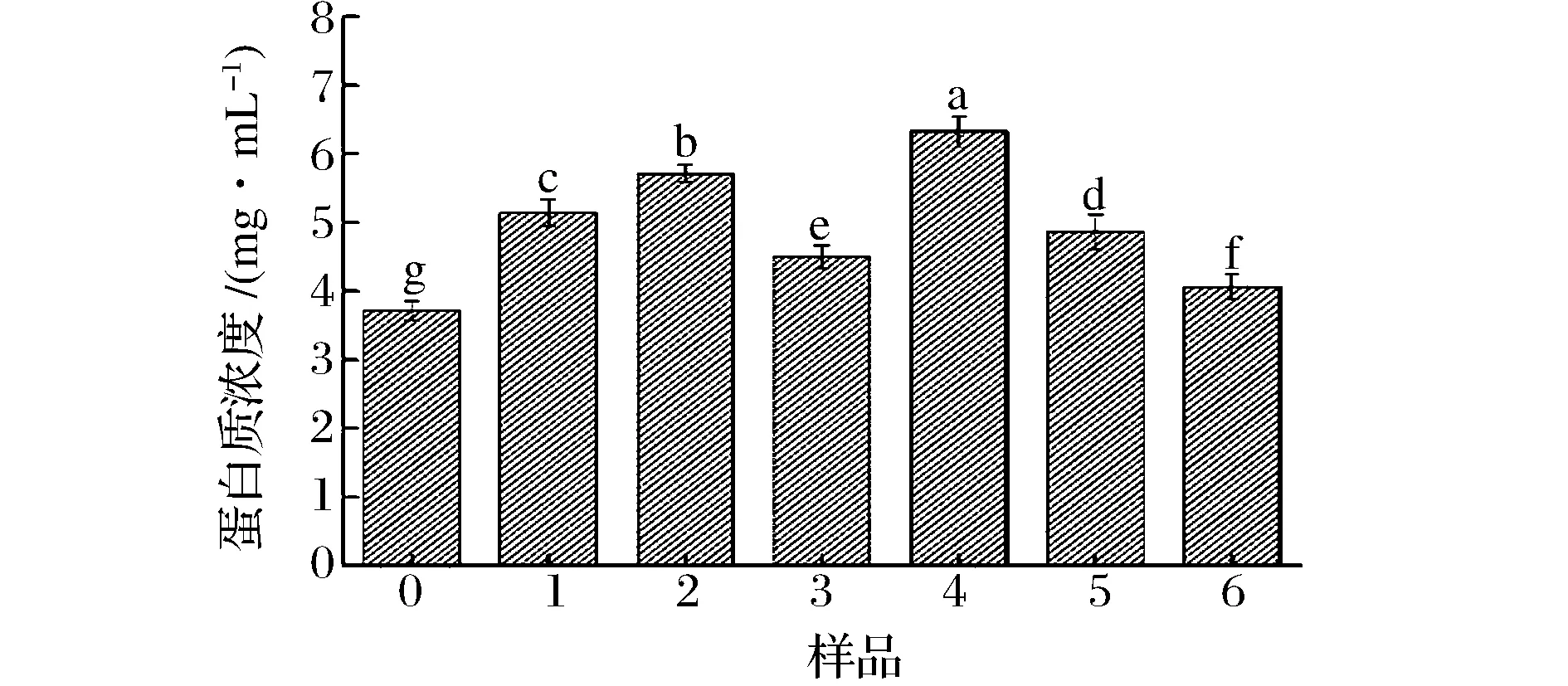
圖2 不同超聲處理條件下復合物中大豆蛋白的濃度Fig.2 Water solubility of untreated and ultrasonication-treated soybean protein-lecithin complex
2.3 表面疏水性分析
不同超聲條件處理后復合物中大豆分離蛋白的表面疏水性如圖3。表面疏水性(H0)是衡量分子表面疏水基團數目的指標[20]。磷脂與蛋白在超聲作用下形成復合物會影響蛋白質的表面結構,增加非極性基團間的疏水作用。經過離心后,不可溶部分被離出,上清液中吸附于磷脂的蛋白均屬于可溶性蛋白,因而可采用熒光探針法評價蛋白質-磷脂復合體系的表面疏水性,同時反應蛋白質的三級結構。
如圖3所示,未處理的樣品表面疏水性最低,這與HAYAKAWA等人[21]的研究結果一致,未經超聲處理的大豆蛋白中大多數疏水基團被緊密包埋在球狀區域內,蛋白質的疏水基團和熒光探針之間的接觸受到抑制,疏水性較低。經過超聲處理后,所有樣品中蛋白質的表面疏水性都有所升高,且在低超聲功率條件下(150 W),長時間的超聲處理使表面疏水性增強。這可能是由于大豆分離蛋白與磷脂相互作用后,改變了自身的空間結構,同時也以疏水相互作用的形式影響了磷脂分子的排列形式[22],超聲波作用使二者的結合更為緊密,蛋白質以疏水作用固定在磷脂膜上,所以復合物的表面疏水性進一步提高。但中(300 W)、高超聲功率(450 W)條件下,長時間的超聲處理反而會使表面疏水性減弱。這可能是由于大豆分離蛋白發生一定程度的聚集,這種蛋白質聚集阻止了疏水基團的暴露[23]。
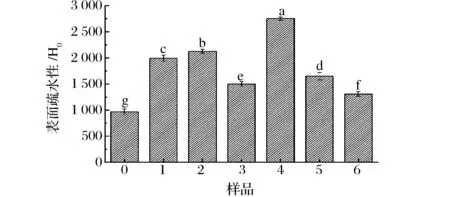
圖3 不同超聲處理條件下復合物中大豆分離蛋白的表面疏水性Fig.3 Surface hydrophobicity of untreated and ultrasonication-treated soybean protein-lecithin complex
2.3 粒徑分析
不同超聲處理對大豆蛋白-磷脂復合物粒度的影響見圖4、圖5。當超聲波作用于復合物溶液時,液滴破碎與重新聚合現象同時發生,因此,溶液中粒徑的變化情況可以通過體積平均徑D[4,3]和粒徑分布表示,同時表征蛋白質聚集、解聚等行為。如圖4、圖5所示,未超聲時共聚物的體積平均徑為16.872 μm,呈雙峰分布,且主要分布在10~100 μm之間。經過超聲處理后粒度降低,但當超聲功率增加超過300 W后,粒徑又增大,這說明高功率(450 W)超聲作用下,可溶性蛋白質聚集體重新聚集成更大的不溶性聚集體,減弱了與磷脂間的相互作用[24]。也可能是由于超聲作用會降低蛋白質-磷脂溶液的黏度,導致粒徑增大。該結果與他人的研究結果類似,超聲可以降低大豆分離蛋白的粒徑,但高強度超聲波對粒徑的降低效果不明顯[25-26]。在低功率(150 W)超聲處理時,湍流和微流效應增加分子間的碰撞和聚集,在空化作用下形成微小液滴。尤其是延長超聲時間至24 min后,變化更加明顯。由圖4中4號曲線可明顯發現體系中小粒徑含量升高,大粒徑含量降低,雙峰分布更窄,說明此時溶液更加穩定[27]。
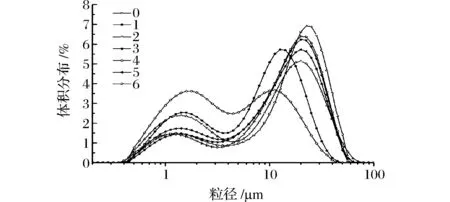
圖4 不同超聲處理條件下大豆蛋白-磷脂復合物的粒度分布Fig.4 Particle size distribution of untreated and ultrasonication-treated soybean protein-lecithin complex
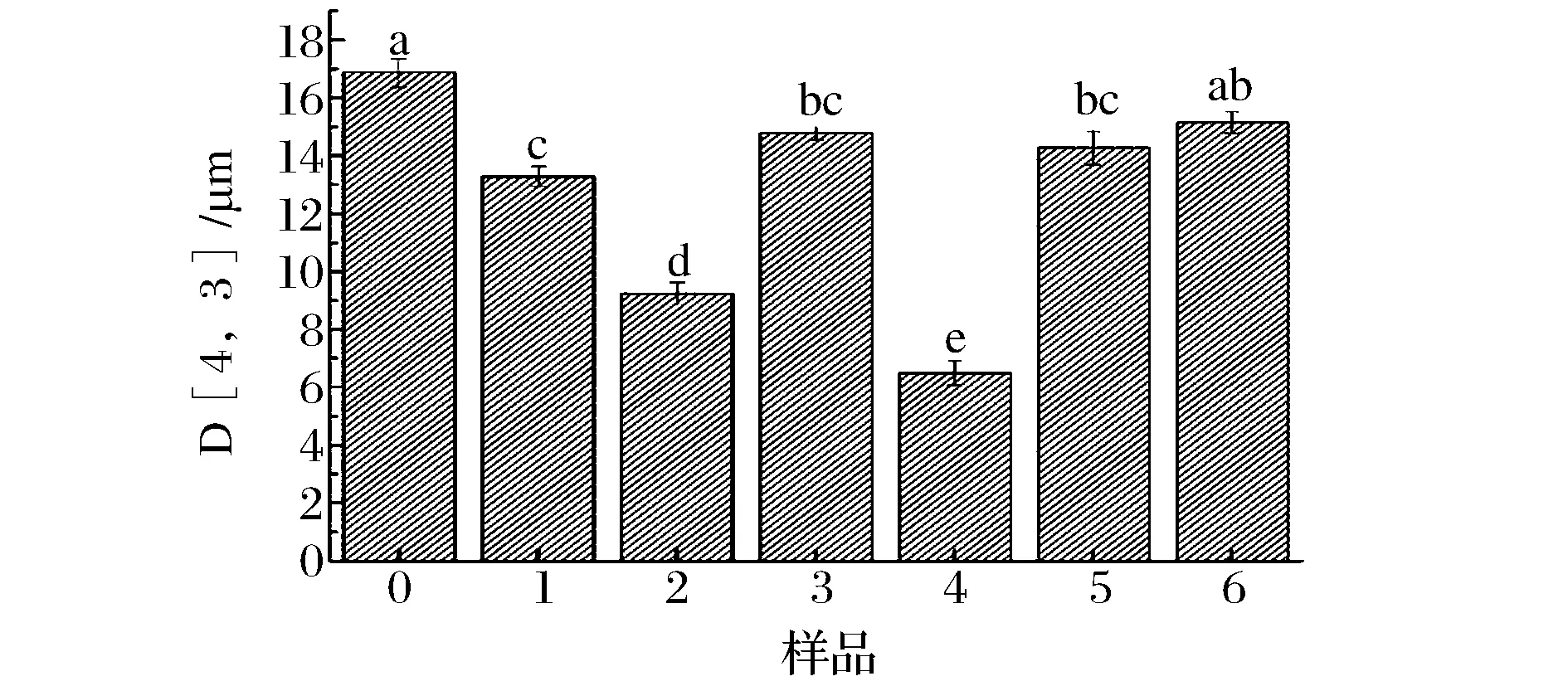
圖5 不同超聲處理條件下大豆蛋白-磷脂復合物的粒徑D [4,3]Fig.5 Particle size D [4,3] of untreated and ultrasonication-treated soybean protein-lecithin complex
2.4 濁度的分析
不同超聲處理對大豆蛋白-磷脂復合物濁度的影響見圖6。蛋白-磷脂復合物的濁度可以直觀反映溶液中蛋白質-磷脂顆粒的分散狀態,也可以間接反映溶液中蛋白質-磷脂的聚集狀態以及粒徑大小[28]。未經過超聲處理的蛋白質-磷脂樣品分散在緩沖液中形成的溶液較渾濁,這是因為溶液中聚集體的粒徑較大,在光線的作用下,發生漫反射,使溶液濁度增大[29]。經過不同條件超聲波處理后樣品的濁度發生不同程度的降低,可能是因為超聲波的空化作用產生巨大的壓強,減小了蛋白質分子的粒徑,所以濁度降低。超聲波對蛋白質-磷脂復合物濁度的影響具有一定規律性,超聲時間較短時,樣品濁度先減小后增大,說明中等強度超聲波可以將樣品粒徑降低到合適大小,漫散射降低后濁度減小;超聲時間較長時,蛋白-磷脂復合物的濁度隨著超聲功率的增加而增大,說明增大超聲功率會導致蛋白質分子發生再聚集,濁度隨聚集體的增多而增大。
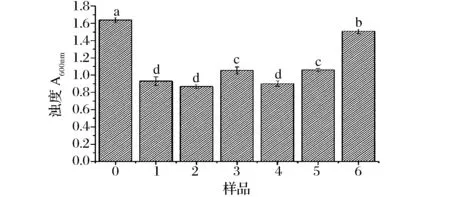
圖6 不同超聲處理條件下大豆蛋白-磷脂復合物的濁度Fig.6 Turbidity of untreated and ultrasonication-treated soybean protein-lecithin complex
2.5 熒光光譜分析
不同超聲處理后復合物中蛋白質的熒光光譜見圖7。熒光光譜是一種能反應蛋白質三級結構構象變化靈敏且有效的方法[30]。圖7表示不同超聲條件處理后大豆蛋白-磷脂復合物的熒光發射光譜圖。
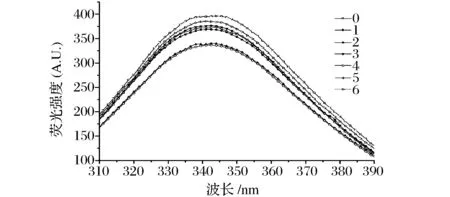
圖7 不同超聲處理條件下復合物中大豆分離蛋白熒光光譜譜圖 Fig.7 Emission fluorescence spectra for 0.15 mg/mL soybean protein of untreated and ultrasonication-treated soybean protein-lecithin complex
在本研究中,λmax均大于330 nm,說明Trp殘基位于蛋白質分子外部的極性環境中[31]。0表示未經超聲處理的樣品熒光發射光譜的變化。當激發波長為280 nm,掃描為300~400 nm發射譜時,經過超聲波處理后的樣品熒光光譜形狀無顯著變化,但最大吸收峰的熒光強度值均低于未經超聲處理的樣品,且樣品的λmax均發生紅移,說明蛋白質在磷脂和超聲波的共同作用下構象發生改變,Trp側鏈轉移到蛋白分子表面造成蛋白微環境極性的增加[32]。在所有超聲條件中,低強度和中強度超聲使熒光強度降低,這是由于該條件下蛋白質結構打開與磷脂發生相互作用后,使發色基團暴露到溶劑中,造成熒光強度的降低[33]。但是高強度超聲波處理后蛋白質發生一定的聚集,形成不溶性的蛋白質,與磷脂間的相互作用減弱,發色基團包埋在蛋白質的聚集體中使熒光性又有一定程度的升高。
3 結論
本文采用超聲處理探究超聲功率和超聲時間對大豆蛋白、磷脂相互作用及復合物功能性質的影響。本研究得出以下結論: (1) 適宜的超聲波處理可以顯著提高大豆蛋白與磷脂的復合程度,同時提升功能性質如:表面疏水性、起泡性及泡沫穩定性。(2)經過低、中功率超聲波處理后蛋白質的熒光性和濁度降低,但高超聲功率處理現象相反。可見超聲時間較短時,中功率超聲對大豆蛋白與磷脂的復合產生有利作用。(3) 延長超聲時間后,復和物的粒徑大小隨著功率的增加而增大,表面疏水性下降。因此當超聲時間較長時,較低的超聲功率可將液滴分散均勻、維持穩定,并使起泡性及泡沫穩定性等功能性質達到最大,過高的功率不僅影響效果且會造成能量浪費。該結果為超聲技術運用于大豆蛋白-磷脂復合產品、其他蛋白與磷脂復合的食品加工過程提供了一定的理論依據。
[1] MA L, LI B, HAN F, et al. Evaluation of the chemical quality traits of soybean seeds, as related to sensory attributes of soymilk[J]. Food Chemistry, 2015, 173(5): 694-701.
[2] KATO A, OSAKA Y, MATSUDOMI N, et al. Changes in the emulsifying and foaming properties of proteins during heat denaturation [J]. Agricultural and Biological Chemistry, 1983, 47(1): 33-37.
[3] WANG X S, TANG C H, Li B S, et al. Effects of high-pressure treatment on some physicochemical and functional properties of soy protein isolates [J]. Food Hydrocolloids, 2008, 22(4): 560-567.
[4] ZHANG Jinbo, WU Nannan, YANG Xiaoquan, et al. Improvement of emulsifying properties of Maillard reaction products fromβ-conglycinin and dextran using controlled enzymatic hydrolysis [J]. Food Hydrocolloids, 2012, 28(2): 301-312.
[5] BECKWITH A C. Interaction of phosphatidylcholine vesicles with soybean 7S and 11S globulin proteins[J]. Journal of Agricultural and Food Chemistry, 1984, 32(6): 1 397-1 402.
[6] NIEUWENHUYZEN W, SZUHAJ B F. Effects of lecithins and proteins on the stability of emulsions[J]. Lipid/Fett, 1998, 100(7): 282-291.
[7] SCURIATTI M, TOMAS M, & WANGNER J. Influence of soybean protein isolates-phosphatidycholine interaction on the stability on oil-in-water emulsions[J]. Journal of the American Oil Chemists' Society, 2003, 80(11): 1 093-1 100.
[8] MCCLEMENTS D J. Food Emulsions: Principles, Practices, and Techniques[M]. CRC press,2004.
[9] SUNDER A, SCHERZE I, MUSCHIOLIK G. Physico-chemical characteristics of oil-in-water emulsions based on whey protein-phospholipid mixtures[J]. Colloids and Surfaces B: Biointerfaces, 2001, 21(1): 75-85.
[10] WOLF W J. Soybean proteins. Their functional, chemical, and physical propertie[J]. Journal of Agricultural and Food Chemistry, 1970,18(6):969-976.
[11] HU H, WU J, LI-CHAN E C, et al. Effects of ultrasound on structural and physical properties of soy protein isolate (SPI) dispersions[J]. Food Hydrocolloids, 2013, 30(2): 647-655.
[12] SATHE S, DESHPANDE S, SALUNKHE D. Functional properties of lupin seed (Lupinus mutabilis) proteins and protein concentrates[J]. Journal of Food Science, 1982, 47(2): 491-497.
[13] NAKAI S. Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins[J]. Biochimica et Biophysica Acta (BBA)-Protein Structure, 1980, 624(1): 13-20.
[14] TANG C H, CHOI S M, MA C Y. Study of thermal properties and heat-induced denaturation and aggregation of soy proteins by modulated differential scanning calorimetry[J]. International Journal of Biological Macromolecules, 2007, 40(2): 96-104.
[15] MARTINI S, POTTER R, WALSH M. Optimizing the use of power ultrasound to decrease turbidity in whey protein suspensions[J]. Food Research International, 2010, 43(10): 2 444-2 451
[16] BONOMI F, MORA G, PAGANI M A, et al.Probing structural features of water-insoluble proteins by front-face fluorescence[J]. Analytical Biochemistry, 2004, 329(1): 104-111
[17] 王辰, 江連洲, 魏冬旭,等. 不同品種大豆分離蛋白結構與表面疏水性的關系[J]. 食品科學, 2012, 33(9):54-57.
[18] 張濤. 鷹嘴豆分離蛋白的制備及其功能性質研究[D]. 無錫:江南大學, 2005.
[19] 李迎秋. 脈沖電場對大豆蛋白理化性質和脂肪氧化酶的影響[D]. 無錫:江南大學, 2007.
[20] KATO A, NAKAI S. Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins[J]. Biochimica et Biophysica Acta (BBA)-Protein Structure, 1980, 624(1): 13-20.
[21] HAYAKAWA S, NAKAI S. Relationships of hydrophobicity and net charge to the solubility of milk and soy proteins, J. Food Sci,1985,50(2) 486-491.
[22] 吳富根. 兩親性分子自組裝聚集體的相變及其區域協同性. 北京:清華大學, 2011.
[23] CHANDRAPALA J, ZISU B, PALMER M, et al.Effects of ultrasound on the thermal and structural characteristics of proteins in reconstituted whey protein concentrate[J]. Ultrasonics Sonochemistry, 2011, 18(5): 951-957.
[24] TANG C H, WANG X Y, YANG X Q, et al. Formation of soluble aggregates from insoluble commercial soy protein isolate by means of ultrasonic treatment and their gelling properties[J]. Journal of Food Engineering, 2009, 92(4): 432-437.
[25] KENTISH S, WOOSTER T, ASHOKKUMAR M, et al. The use of ultrasonics for nanoemulsion preparation[J]. Innovative Food Science & Emerging Technologies, 2008, 9(2), 170-175.
[26] RAMISETTY K A, PANDIT A B, & GOGATE P R. Ultrasound assisted preparation of emulsion of coconut oil in water: Understanding the effect of operating parameters and comparison of reactor designs[J]. Chemical Engineering and Processing, 2015, 88(5): 70-77.
[27] ARZENI C, MARTINEZ K, ZEMA P, et al.Comparative study of high intensity ultrasound effects on food proteins functionality[J]. Journal of Food Engineering, 2012, 108(3): 463-472.
[28] 李云, 華欲飛. 大豆蛋白聚集及共混凝膠性質研究[D]. 無錫:江南大學, 2007.
[29] YANJUN S, JIANHANG C, SHUWEN Z, et al.Effect of power ultrasound pre-treatment on the physical and functional properties of reconstituted milk protein concentrate[J]. Journal of Food Engineering, 2014(4), 124:11-18.
[30] LIU W, ZHANG Z-Q, LIU C-M, et al.The effect of dynamic high-pressure microfluidization on the activity, stability and conformation of trypsin[J]. Food Chemistry, 2010, 123(3): 616-621.
[31] VIVIAN J T, CALLIS P R.Mechanisms of tryptophan fluorescence shifts in proteins[J]. Biophysical Journal, 2001, 80(5): 2 093-2 109.
[32] MIRIANI M, KEERATI-U-RAI M, CORREDIG M, et al.Denaturation of soy proteins in solution and at the oil-water interface: A fluorescence study[J]. Food Hydrocolloids, 2011, 25(4): 620-626.
[33] PALLAR S I, VENDRELL J, AVIL S F X, et al.Amyloid fibril formation by a partially structured intermediate state of α-chymotrypsin[J]. Journal of Molecular Biology, 2004, 342(1): 321-331.
Effect of ultrasound on soybean protein-phospholipid structure and function
BI Shuang, LI Yang, MAO Hui-ting, SUI Xiao-nan, WANG Zhong-jiang, QI Bao-kun, JIANG Lian-zhou*
(Northeast Agricultural University College of Food Science and technology, Harbin 150030, China)
Soy protein isolate and lecithin can make protein-lecithin complex spontaneously under neutral environmental condition (pH 7.0), but there are still protein and lecithin out of self-assembly in the solution. The large amount of lecithin and protein binding are still under study. At the same time, the effect of ultrasound on?the complex was unclear. Therefore, this study is based on the theory of “ultrasound modification-structure change-functional expression”, and using fluorescence spectrum to study different conditions of ultrasonic treatment on protein-lecithin compound, and discovered the relationship between protein-lecithin structure change and the functional properties of the complex through surface hydrophobicity analysis, dynamic light scattering particle size analysis, determination of turbidity, foaming ability and foam stability of the complex. The results showed that short ultrasonic time combined with medium ultrasonic power had the greatest influence on complex and the value of endogenous fluorescent was reduced. However, surface hydrophobicity was increased. When the ultrasonic time increased to 24 min, it could significantly increase functional properties of the complex, decrease particle size from 16.87 μm to 6.49 μm, and turbidity was also decreased which was beneficial to homogeneous distribution and stability of the solution. However, with continually increased the ultrasonic power, the insoluble protein aggregate occurred.
soybean protein-phospholipid; ultrasonic processing; surface hydrophobicity; particle size distribution; fluorescence spectrum
10.13995/j.cnki.11-1802/ts.201610011
碩士研究生(江連洲教授為通訊作者,E-mail:jlzname@163.com)。
國家科技支撐計劃課題(2014BAD22B00);國家"863"計劃(2013AA102104);黑龍江省自然科學基金項目重點項目(ZD201302);高等學校博士生學科點專項科研基金博導類資助課題(20132325110013)
2016-01-06,改回日期:2016-03-22

