響應面試驗優化末水壇紫菜多糖除蛋白工藝及其抗氧化活性
謝 飛,曹純潔,陳美珍*,葉天文
(汕頭大學理學院,廣東 汕頭 515063)
響應面試驗優化末水壇紫菜多糖除蛋白工藝及其抗氧化活性
謝 飛,曹純潔,陳美珍*,葉天文
(汕頭大學理學院,廣東 汕頭 515063)
目的:研究末水壇紫菜多糖的除蛋白方法及所制備多糖在細胞內的抗氧化作用。方法:響應面法優化末水壇紫菜多糖酶法除蛋白工藝條件;建立H2O2誘導HeLa細胞氧化損傷模型,MTT法測定細胞存活率,2′,7′-二氯熒光素二乙酸酯檢測細胞內活性氧水平。結果:樣品液中末水壇紫菜多糖酶法除蛋白最佳工藝條件為木瓜蛋白酶用量0.7 mg/mL、酶解溫度50 ℃、酶解時間55 min,此時蛋白清除率為61.28%;在此基礎上,用4%三氯乙酸繼續除蛋白,蛋白清除率可達80.73%,多糖保留率為79.7%。與模型組相比,經末水壇紫菜多糖處理的損傷細胞存活率顯著提高(P<0.01),且細胞內活性氧含量顯著下降(P<0.01)。結論:木瓜蛋白酶-三氯乙酸聯用可有效除去末水壇紫菜多糖中的蛋白。末水壇紫菜多糖有較強的抗氧化能力,能清除細胞內過剩的活性氧,修復H2O2對HeLa細胞的氧化損傷。
末水壇紫菜多糖;除蛋白;抗氧化;HeLa細胞;活性氧
壇紫菜(Porphyra haitanensis)是我國南方大規模養殖的重要經濟海藻之一。紫菜可分多次采收,第一次采割收獲的俗稱為頭水紫菜,以后依次采收的分二水、三水、四水紫菜等,四水以下的越往后口感越差因而較少食用[1]。由于末水壇紫菜(一般是六水)色澤差、口感粗糙、售價低、獲利少,菜農常放棄對其采收,使之腐爛在海里,造成資源的浪費和環境的污染。因此開展對末水壇紫菜的利用研究其意義重要。
紫菜多糖作為一種天然活性物質,其抗氧化及抗腫瘤等活性已有大量報道[2-4],但針對末水壇紫菜多糖的研究鮮見報道。陳美珍等[1]的研究發現,壇紫菜藻體多糖和蛋白質含量隨生長期而變化,即多糖減少,蛋白質增多,如三水壇紫菜含多糖30.56%、蛋白質30.49%,而末水壇紫菜多糖和蛋白質含量分別為20.67%和35.30%。末水壇紫菜蛋白質多于多糖,使提取的多糖采用常規方法難于清除蛋白,且多糖損失量大。因此,有必要研究末水壇紫菜多糖除蛋白工藝。此外,目前關于多糖抗氧化活性的研究,大多數以體外化學法進行,這些方法測定結果不能客觀地評價活性物質在機體內的作用,其生物相關性較差。因此,以細胞為模型的抗氧化活性測試方法在生物活性物質抗氧化活性評價中受到國內外的廣泛關注。
本研究以末水壇紫菜為材料提取多糖,對多糖的除蛋白工藝進行優化,并在細胞水平上探討除蛋白后的多糖抗氧化活性,以期為末水壇紫菜多糖的深入研究提供技術支持。
1 材料與方法
1.1 材料與試劑
末水壇紫菜 廣東省南澳縣金山農業發展有限公司;透析袋MD16 美國Spectrum公司。
人宮頸癌HeLa細胞株 汕頭大學多學科中心;正常狗腎細胞MDCK 汕頭大學醫學院。
三氯乙酸(trichloroacetic acid,TCA)、苯酚、無水乙醇、濃硫酸(均為分析純) 西隴化工股份有限公司;考馬斯亮藍G-250、牛血清白蛋白(均為分析純)美國Sigma公司;半乳糖標準品 中國食品藥品檢定研究院;DMEM高糖培養基 美國Hyclone公司;胎牛血清 杭州四季青科技有限公司;四甲基偶氮唑藍(methyl thiazolyl tetrazolium,MTT)、二甲基亞砜(dimethyl sulfoxide,DMSO) 美國Amresco公司;陽性藥物5-氟尿嘧啶(5-Fu) 上海源葉生物科技有限公司;胰酶細胞消化液、青霉素-鏈霉素溶液、活性氧檢測試劑盒 碧云天生物技術研究所。
1.2 儀器與設備
高速萬能粉碎機 天津市泰斯特儀器有限公司;UV-2100C型紫外-可見分光光度計 美國Unico公司;DK-S22型電熱恒溫水浴鍋 上海精宏實驗設備有限公司;3111二氧化碳細胞培養箱 美國Thermo公司;CK30倒置顯微鏡 美國Olympus公司;倒置熒光顯微鏡日本Nikon公司;全波段掃描酶標儀 瑞士Tecan公司。
1.3 方法
1.3.1 末水壇紫菜精多糖的制備
末水壇紫菜用水洗凈后于60 ℃條件下烘干,粉碎過40 目篩,于105 ℃條件下干燥至恒質量,置于試劑瓶中密閉保存備用。稱取紫菜粉,液料比為50∶1,用80%乙醇溶液回流2 h,離心棄上清液,加入等量蒸餾水,80 ℃提取5 h,離心,取上清液,使用旋轉蒸發儀濃縮至原體積1/3,得樣品液,4 ℃冷藏備用。取樣品液按優化后的工藝除蛋白,自來水透析2 d,蒸餾水透析1 d,濃縮透析液,冷凍干燥后得精多糖。
1.3.2 多糖含量的測定
1.3.2.1 多糖標準曲線制作
采用苯酚-硫酸法[5],以半乳糖為標準品作標準曲線。經測定得標準曲線回歸方程為:y=0.007 05x+ 0.003 67,R2=0.999 17(y表示吸光度,x表示多糖質量)。
1.3.2.2 樣品多糖含量測定
樣品液適當稀釋后,測其吸光度,代入標準曲線回歸方程計算多糖含量。多糖保留率按式(1)計算:

1.3.3 蛋白質含量的測定
1.3.3.1 蛋白質標準曲線制作
采用改良考馬斯亮藍法:精密稱取牛血清蛋白標準品10 mg于50 mL容量瓶中,加蒸餾水溶解并定容,配成
200 μg/mL的標準蛋白溶液。分別取標準蛋白溶液100、200、300、400、500、600 μL,并用蒸餾水補至1 mL,以同體積蒸餾水為空白,加入考馬斯亮藍溶液5.0 mL,充分振蕩、混勻,然后迅速于595 nm波長處測吸光度。橫坐標為蛋白質量(μg),縱坐標為吸光度,標準曲線回歸方程為:y=0.004 6x-0.003 9,R2=0.999 4。
1.3.3.2 多糖液中蛋白含量的測定
取多糖液1 mL,按上述操作測吸光度,代入標準曲線回歸方程計算蛋白質量。蛋白清除率按式(2)計算:

1.3.4 末水壇紫菜多糖除蛋白方法
1.3.4.1 TCA法
取適量樣品液,加入4% TCA溶液,80 ℃條件下反應30 min。離心,取上清液,測其多糖及蛋白質含量[6]。
1.3.4.2 木瓜蛋白酶法
取適量樣品液,加入活化的木瓜蛋白酶至終質量分數為0.05%,于80 ℃條件下反應3 h,離心,取上清液,測其多糖及蛋白質含量[7]。
1.3.4.3 木瓜蛋白酶結合TCA法
先用木瓜蛋白酶法除蛋白,然后用TCA法進一步除蛋白。
1.3.5 木瓜蛋白酶法除蛋白工藝優化
1.3.5.1 單因素試驗
選擇對蛋白質脫除率有顯著影響的3個因素作為考察對象,實驗方法如下:1)酶用量對脫蛋白效果的影響:取樣品液5 mL,分別加入0.5、2.5、5、10、15 mg木瓜蛋白酶,65 ℃反應3 h,離心,取上清液測其蛋白質含量,并計算各組別蛋白清除率。2)酶解溫度對脫蛋白效果的影響:取5 mL樣品液,加入2.5 mg木瓜蛋白酶,分別于40、50、60、65、70、80 ℃條件下反應1 h,離心,取上清液測其蛋白質含量。3)酶解時間對脫蛋白效果的影響:取5 mL樣品液,加入2.5 mg木瓜蛋白酶,溶液于60 ℃條件下,分別反應0.5、1、2、3、4、5 h,離心,取上清液測其蛋白質含量。
1.3.5.2 響應面優化試驗
根據Box-Behnken試驗設計原理,采用三因素三水平安排試驗。因素與水平設計見表1。

表1 Box-Behnken試驗因素與水平Table1 Coded levels for independent variables used in Box-Behnken design
1.3.6 HeLa細胞氧化損傷模型的建立
取對數生長期的HeLa細胞制成1×105個/mL細胞懸液,接種于96 孔板,于37 ℃、5% CO2、飽和濕度培養箱中培養18 h,吸出上清液,加入新鮮培養基繼續培養24 h。吸出上清液,加入用培養基稀釋的不同濃度(100、200、300、400、600、800、1 000 μmol/L)的H2O2處理細胞。陰性對照組加入相同體積的不含H2O2的培養基,培養24 h后,移除上清液加入MTT孵育4 h,吸出上清液,加入DMSO,振蕩混勻。酶標儀作雙波長檢測,檢測波長490 nm,參考波長570 nm,測其吸光度,按式(3)計算各組別的細胞抑制率。同時,倒置顯微鏡下觀察HeLa細胞的形態變化,并拍照[8-12]。
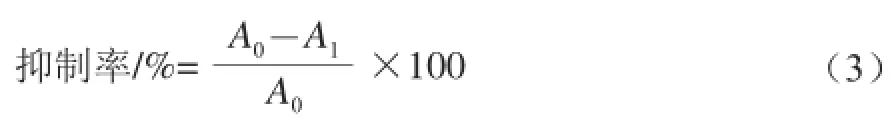
式中:A0為對陰性對照組吸光度;A1為給藥組吸光度。
1.3.7 末水壇紫菜多糖給藥劑量篩選
取對數生長期的HeLa細胞制成1×105個/mL細胞懸液,接種于96 孔板,于37 ℃、5% CO2、飽和濕度培養箱中培養18 h。隨機分組:空白對照組(只加相同體積的完全培養基),陽性對照組(25 μg/mL 5-Fu),實驗組(分別加入用完全培養基稀釋的100、200、400、600、800、1 000、1 200、2 000 μg/mL的多糖作用液),按分組情況分別給予處理,培養48 h后移除上清液,MTT法測其吸光度,計算各組別的細胞抑制率。選擇末水壇紫菜多糖對細胞無毒劑量范圍,觀察其對氧化損傷HeLa細胞是否有保護作用。
1.3.8 末水壇紫菜多糖對氧化損傷HeLa細胞的保護作用
細胞懸液貼壁18 h后,用篩選出的質量濃度范圍內的末水壇紫菜多糖作用24 h,吸出上清液,加入H2O2損傷處理24 h后,MTT法測其吸光度,計算各組別的細胞抑制率。
1.3.9 細胞內活性氧的測定
本身沒有熒光的2′,7′-二氯熒光素二乙酸酯(2’,7’-dic hlorodihydrofluorescin diacetate,DCFH-DA)可自由穿過細胞膜,進入細胞后被細胞內的酯酶水解生成 DCFH,而DCFH不能透過細胞膜,從而使探針很容易被裝載到細胞內,在活性氧存在的條件下,DCFH被氧化生成綠色熒光物質DCF,綠色熒光的強度與細胞內的活性氧水平成正比,因此通過檢測DCF熒光強度,可反映細胞內活性氧水平。
采用細胞活性氧檢測試劑盒檢測細胞內活性氧,具體操作按照試劑盒說明書進行,酶標儀測定其熒光值,并于倒置熒光顯微鏡下觀察、拍照。
1.4 數據統計
實驗結果采用SPSS 17.0統計軟件分析。用單因素方
差分析組間差異的顯著性,結果采用x±s表示,P<0.05為差異具有統計學意義。
2 結果與分析
2.1 末水壇紫菜多糖除蛋白方法優選

表2 不同方法除蛋白效果Table2 Efficiencies of different deproteinization methods
由表2可知,木瓜蛋白酶法除蛋白效果顯著優于TCA法;木瓜蛋白酶-TCA法聯用其脫蛋白效果有明顯提高,但多糖保留率有所下降。綜合考慮,選用木瓜蛋白酶-TCA法作為多糖除蛋白質方法。同時,以蛋白清除率作為考察指標[13-16],對木瓜蛋白酶除蛋白工藝進行優化。
2.2 木瓜蛋白酶法工藝優化
2.2.1 單因素試驗結果
2.2.1.1 酶用量對脫蛋白效果的影響
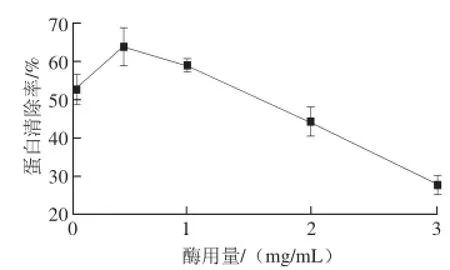
圖1 酶用量對蛋白清除率的影響Fig.1 Effect of enzyme concentration on deproteinization efficiency
由圖1可見,隨著酶用量的增加,其蛋白清除率呈現出先增加后下降的趨勢,當酶用量為0.5 mg/mL時,蛋白清除率達到最大值。這是因為,酶用量太低,反應進行的不夠充分;酶用量太高時導致體系中蛋白質總體含量升高,表現出蛋白清除率下降。因此,確定酶用量以0.5 mg/mL為宜。
2.2.1.2 酶解溫度對脫蛋白效果的影響
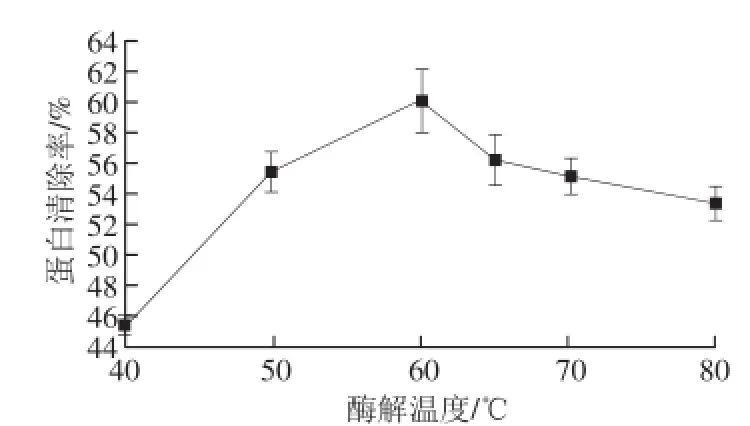
圖2 酶解溫度對蛋白清除率的影響Fig.2 Effect of hydrolysis temperature on deproteinization efficiency
由圖2可知,隨著酶解溫度的升高,蛋白清除率先上升后下降,60 ℃時蛋白脫除率最高。表明60 ℃可能是木瓜蛋白酶作用的最適溫度。

圖3 酶解時間對蛋白清除率的影響Fig.3 Effect of hydrolysis time on deproteinization efficiency
2.2.1.3 酶解時間對脫蛋白效果的影響由圖3可知,隨著酶解時間的延長,蛋白清除率先增加后下降,最后趨于穩定。原因可能是,酶解時間太短反應進行不徹底導致蛋白清除率不高,時間過長使木瓜蛋白酶變性失活,導致蛋白清除率下降。因此酶解時間以1 h為宜。
2.2.2 響應面試驗結果
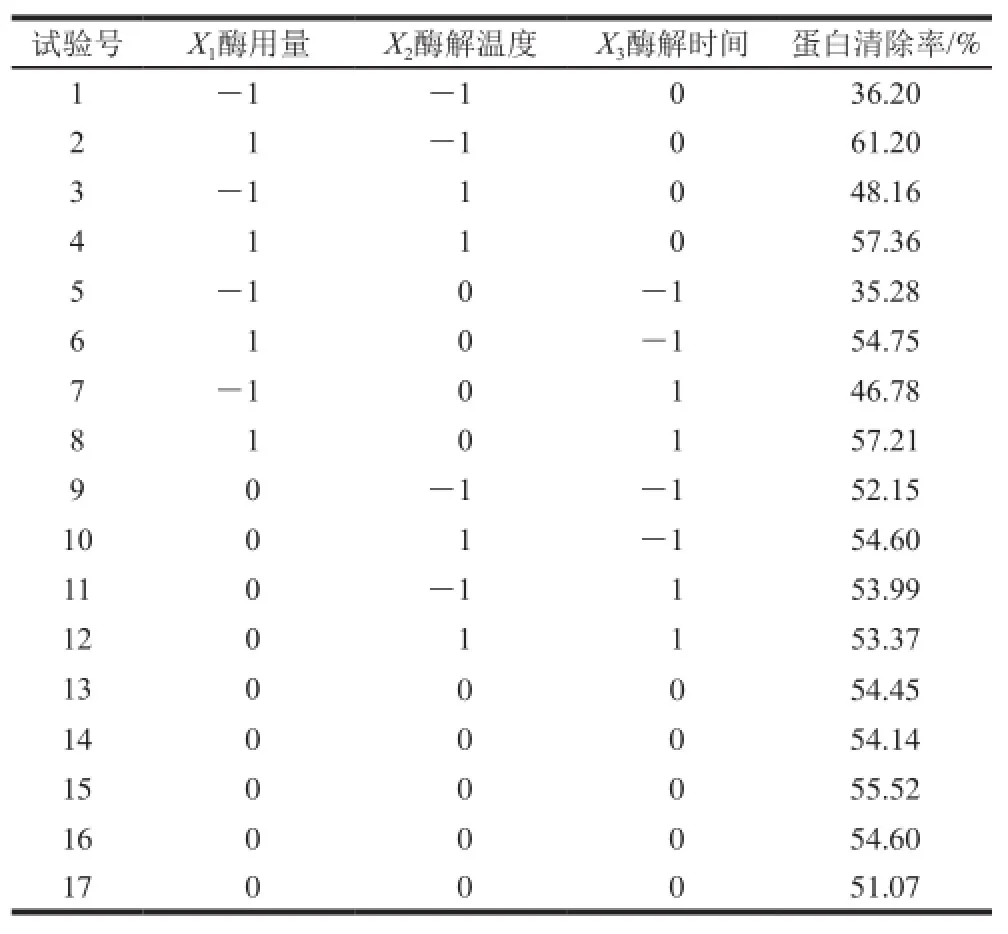
表3 Box-Behnken設計方案及結果Table3 The Box-Behnken experimental design and results for response surface analysis
響應面試驗方案及結果見表3。利用Design-Exepert 8.0.5b統計軟件,對試驗結果進行數據分析(表4)。以蛋白清除率為響應值進行多元回歸擬合,得相應回歸方程。建立的數學模型為:
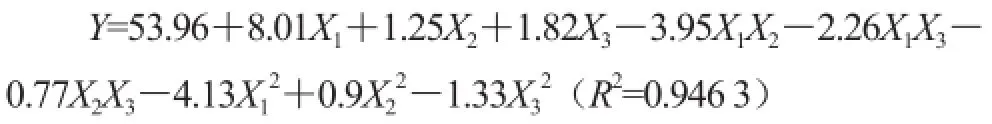

表4 回歸方程方差分析Table4 Analysis of variance for the fitted regression equation
表4方差分析表明,該模型回歸極顯著(P=0.001 2<0.01),失擬項(P=0.132 1>0.05)不顯著,表明二次多項式回歸模型正確;R2=94.63%,表明響應值蛋白清除率的實際值與預測值之間具有較好的擬合度,因此該模型可用于預測響應值的實際情況。F值可以反映出各因素對試驗指標影響的重要性,由表4可知,各因素的貢獻率為:X1>X3>X2,即酶用量>酶解時間>酶解溫度。
對模型進行回歸方程系數顯著性檢驗,得到模型一次項X1、二次項X12及交互作用項X1X2差異顯著(P<0.01),表明酶用量以及酶用量與酶解溫度的交互作用對蛋白清除率有顯著影響,且各具體試驗因素對響應值的影響不是簡單的線性關系。
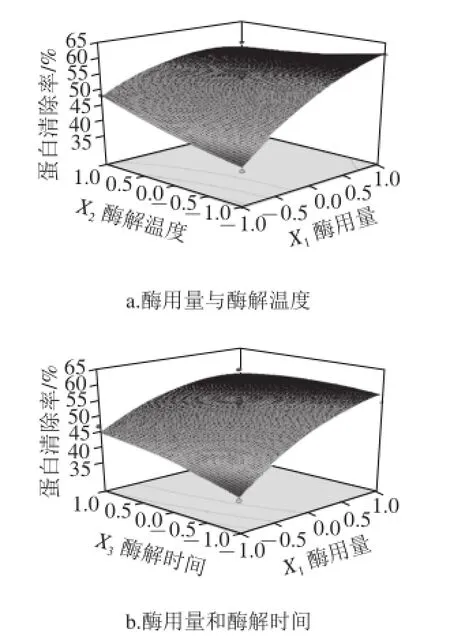
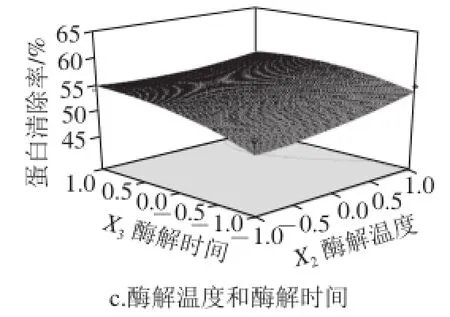
圖4 各因素交互作用對蛋白清除率影響的響應面圖Fig.4 Three-dimensional response surface diagram showing interactive effects of different factors on deproteinization efficiency
由圖4可知,酶用量對蛋白清除率的影響極顯著,可看出其繪制的曲線最為陡峭;酶解時間對蛋白清除率的影響次之,而影響最小的則是酶解溫度,與酶解時間相比,其曲線較為平滑一些。通過響應面法預測得到的回歸模型分析[17-18],可預測得到紫菜多糖的最佳除蛋白工藝條件為:酶用量0.71 mg/mL、酶解溫度50.76℃、酶解時間55.8 min,預測蛋白清除率為62.01%。
根據實際情況,結合預測結果設定驗證實驗工藝條件為:酶用量0.7 mg/mL、酶解溫度50 ℃、酶解時間55 min。在該工藝條件下,做3 組平行實驗,平均蛋白清除率為(61.28±1.58)%,與預測值62.01%接近,多糖保留率為(84.4±0.78)%。實驗結果表明,用響應面法優化紫菜多糖除蛋白回歸模型較可靠。
2.2.3 木瓜蛋白酶結合TCA法除蛋白效果
利用相應面優化的酶法除蛋白最佳工藝條件對樣品液除蛋白處理后,離心、收集上清液,再以TCA法進一步除蛋白,其蛋白清除率顯著提高,達(80.73±1.82)%,多糖保留率為(79.7±0.73)%。較單純木瓜蛋白酶法效果更佳,由此得最終蛋白清除工藝為:木瓜蛋白酶(酶用量0.7 mg/mL、酶解溫度50 ℃、酶解時間55 min)與TCA(4% TCA、80 ℃、30 min)聯用法。
2.3 HeLa細胞氧化損傷模型的建立
2.3.1 不同濃度H2O2對HeLa細胞的影響
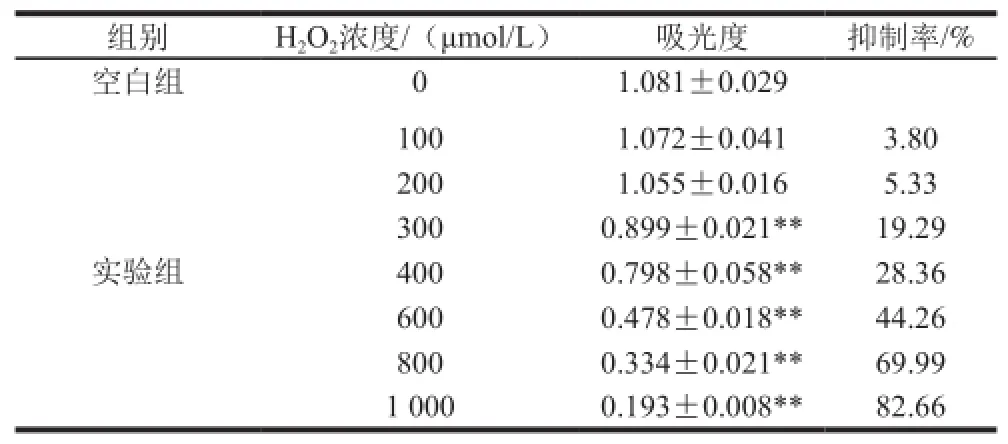
表5 不同濃度H2O2對HeLa細胞抑制率的影響Table5 Inhibitory effect of different H2O2concentrations on HeLa cells
由表5可知,細胞抑制率隨著H2O2濃度的增大而升高,具有明顯的濃度依賴性。根據細胞半數抑制率為
633.06 μmol/L,認為誘導HeLa細胞損傷及凋亡模型的條件為:H2O2濃度633.06 μmol/L、作用時間24 h。為方便操作,選擇630 μmol/L作為后續實驗的損傷濃度。
2.3.2 不同濃度H2O2對HeLa細胞形態學的影響
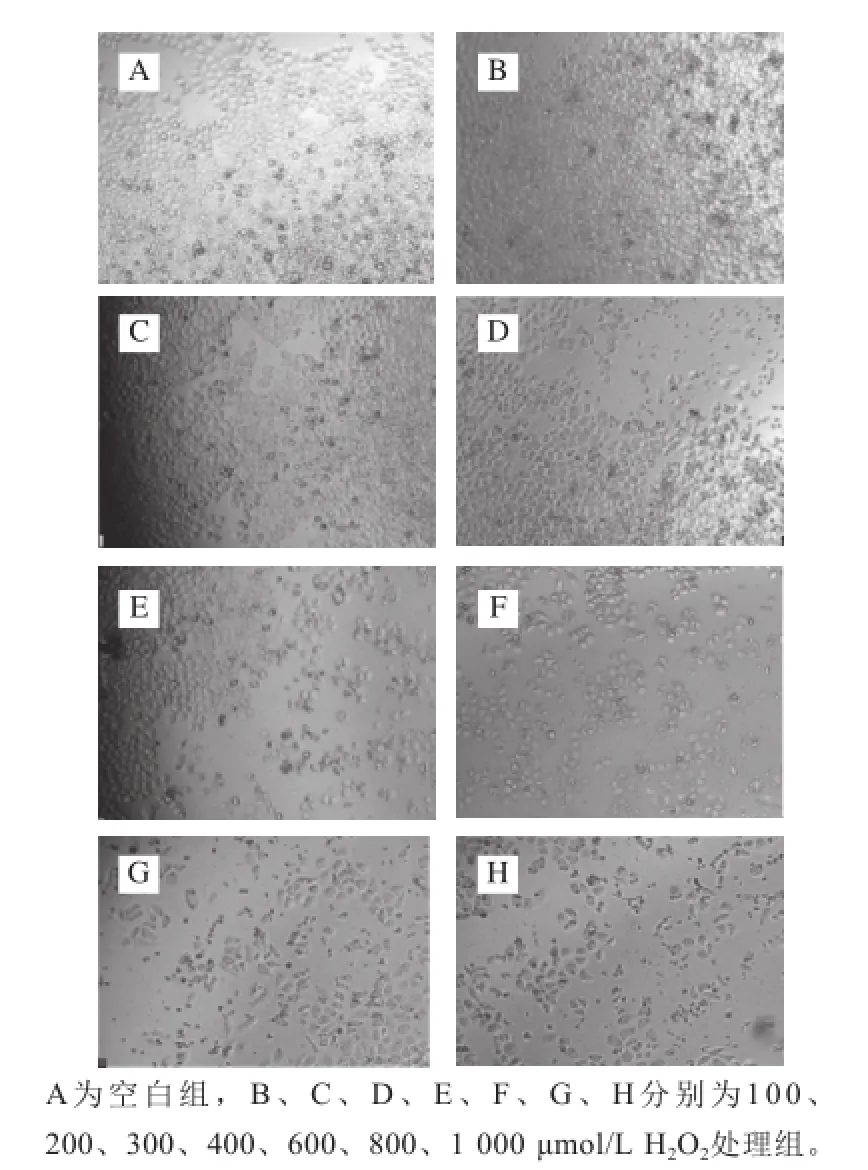
圖5 H2O2處理24 h對HeLa細胞的形態學觀察(10×20)Fig.5 Morphological observation of HeLa cells treated with H2O2for 24 h (10 × 20)
倒置顯微鏡下觀察HeLa細胞形態變化,由圖5可見,空白組細胞生長良好,細胞排列較緊密,胞體邊緣清晰;給藥組隨著H2O2濃度的增大,貼壁細胞逐漸減少,當H2O2濃度超過300 μmol/L時,細胞數量急劇減少,細胞碎片大量增加。結果顯示,H2O2能誘導HeLa細胞凋亡,抑制細胞生長。
2.4 末水壇紫菜多糖無毒質量濃度范圍的篩選

表6 末水壇紫菜多糖對HeLa及MDCK細胞的影響Table6 Effect of PHP on HeLa and MDCK cells
由表6可知,整體來看,末水壇紫菜多糖能抑制HeLa細胞的增殖,而對正常細胞MDCK的生長具有促進作用。對兩種細胞的抑制(促進)作用,均隨著末水壇紫菜多糖質量濃度增加而呈現出先增加后降低的趨勢,并且均在末水壇紫菜多糖質量濃度為800 μg/mL時,其作用效果最強。
當末水壇紫菜多糖質量濃度為100 μg/mL,其對HeLa的抑制率為5.70%,此時細胞生長狀況良好,末水壇紫菜多糖對細胞有作用但尚未對細胞產生較大毒性。當末水壇紫菜多糖質量濃度增加至200 μg/mL,末水壇紫菜多糖對細胞有較大損傷,抑制率達14.24%。因此,選擇40~200 μg/mL質量濃度范圍,作為探究末水壇紫菜多糖對HeLa細胞從基本無毒變為開始有較為明顯毒性時,其對由H2O2損傷的HeLa細胞修復作用的影響。
2.5 末水壇紫菜多糖對H2O2損傷的HeLa細胞的修復作用

表7 末水壇紫菜多糖對H2O2損傷的HeLa細胞的修復作用Table7 Protective effects of PHP on HeLa cells against H2O2-induced injury
由表7可知,在40~100 μg/mL范圍內,末水壇紫菜多糖對HeLa細胞基本無毒,其對損傷細胞的修復作用隨質量濃度的增加而增強。末水壇紫菜多糖質量濃度為100 μg/mL時,HeLa細胞的存活率為92.96%,與模型組相比,其保護作用極為突出。當末水壇紫菜多糖質量濃度進一步增加時,末水壇紫菜多糖的細胞毒性開始凸顯,其對損傷細胞的保護作用開始下降。
2.6 末水壇紫菜多糖對細胞內活性氧水平的影響

圖6 末水壇紫菜多糖對H2O2損傷的HeLa細胞內活性氧水平的影響Fig.6 Effects of PHP on ROS level in HeLa cells with injury induced by H2O2
酶標儀檢測DCFH-DA處理細胞內活性氧含量,與空白組相比,模型組熒光強度明顯增強,說明模型組細胞內
活性氧含量增加;與模型組相比,末水壇紫菜多糖各處理組熒光強度均降低,說明末水壇紫菜多糖能降低H2O2損傷細胞內活性氧含量。末水壇紫菜多糖低劑量組熒光強度遠低于高劑量組,說明低質量濃度的末水壇紫菜多糖能高效的清除細胞內過量的活性氧,隨著質量濃度的增加其清除能力會降低;結合表7實驗結果,表明在一定范圍內較高的活性氧水平有利于HeLa細胞的生長。

圖7 DCFH-DA染色觀察末水壇紫菜多糖處理后H2O2損傷HeLa細胞內活性氧水平(10×40)Fig.7 Effects of PHP treatment on ROS level of HeLa cells with H2O2-induced injury observed by DCFH-DA staining (10 × 40)
由圖7可知,倒置熒光顯微鏡觀察不同處理組的熒光強度,模型組的熒光強度明顯高于其他組,進一步證明末水壇紫菜多糖能清除HeLa細胞內過剩的活性氧。
3 討 論
與傳統Sevag法除蛋白相比,本研究得到的除蛋白工藝更易于操作,結合超濾技術,可進行多糖大量制備。為了簡化末水壇紫菜多糖的制備工藝,本研究省略了常規多糖制備方法中的醇沉步驟,直接對多糖濃縮液進行除蛋白處理,這可能是導致蛋白清除率(80.73%)偏低的原因。本實驗室前期研究發現,中等分子質量的紫菜多糖其相關生物活性最強,雖然TCA除蛋白會使部分多糖降解,但并不影響后面對多糖活性的研究。
在正常的生理狀態下,細胞內的活性氧水平是不斷產生和清除的,維持細胞內適合的活性氧水平對細胞生長繁殖極為重要[19]。活性氧對細胞的生長具有雙重角色:一方面,活性氧能促進細胞有絲分裂,誘導細胞增殖,活性氧含量過低,不利于細胞增殖;另一方面,活性氧含量過多,則會誘發細胞凋亡或壞死[20-22]。研究顯示,活性氧幾乎和人類大部分常見的疾病都有關系;很多致癌物必須在體內經過代謝活化形成自由基(主要是活性氧),并攻擊DNA才能致癌,而許多抗癌劑也是通過活性氧形式去殺死癌細胞,可以說活性氧介入了致癌、促癌和抗癌諸過程。
H2O2是一種重要的非自由基活性物,它可以穿透大部分細胞膜,這增加了H2O2的細胞毒性,當它穿透細胞膜后就可以與細胞內的鐵反應產生·OH(Fenton反應),從而導致細胞損傷[23]。H2O2極易獲得、性質穩定且容易操作,因此被廣泛用于誘導不同類型的細胞凋亡和氧化損傷,是體外氧化應激模型理想的誘導劑。本研究通過H2O2刺激HeLa細胞,建立體外氧化應激模型,探究末水壇紫菜多糖對損傷HeLa細胞的影響。結果顯示,對H2O2損傷的HeLa細胞,末水壇紫菜多糖能提高細胞存活率,有顯著的保護作用(P<0.01);活性氧測定發現,經末水壇紫菜多糖處理后,細胞內活性氧含量顯著下降(P<0.01),證明末水壇紫菜多糖能清除細胞內過剩活性氧。然而,低質量濃度(40 μg/mL)末水壇紫菜多糖對活性氧清除能力較高質量濃度(100 μg/mL)末水壇紫菜多糖更強,其原因尚待進一步探討分析。
游如旭等[24]研究發現,香菇多糖能誘導鼠肝癌細胞H22內活性氧含量升高,從而誘導細胞凋亡。越來越多的證據表明,對比正常細胞,其對應腫瘤細胞內的活性氧水平更高[25]。結合研究發現,一個合理的推測是:末水壇紫菜多糖對活性氧的作用除了能直接清除一部分活性氧外,還能通過激活或抑制相關抗氧化機制(如提高或抑制相關抗氧化酶活力等),間接降低或提高活性氧含量。當細胞處于氧化應激狀態時,末水壇紫菜多糖能激活相關抗氧化機制,表現為較強的活性氧清除能力(清除能力與末水壇紫菜多糖濃度相關);當末水壇紫菜多糖作用于非應激狀態的細胞時,較高質量濃度的末水壇紫菜多糖則會抑制相關抗氧化機制,最終表現為提高活性氧含量。所以末水壇紫菜多糖作用于HeLa和MDCK細胞時,表現出明顯的差異性。由于HeLa細胞內活性氧含量處于較高水平,當活性氧水平進一步提高超過其耐受能力時,會導致細胞凋亡;而正常MDCK細胞活性氧含量較低,適當提高細胞內活性氧水平有利于細胞生長繁殖。
[1] 陳美珍, 徐景燕, 潘群文, 等. 末水殘次壇紫菜的營養成分及多糖組成分析[J]. 食品科學, 2011, 32(20): 230-234.
[2] 顧佳雯, 張陸曦, 徐紅麗, 等. 條斑紫菜多糖的分離純化與抗腫瘤活性[J]. 中國生物工程雜志, 2007, 27(7): 50-54. DOI:10.3969/ j.issn.1671-8135.2007.07.011.
[3] 吳瓊英, 戴偉. 微波輔助提取條斑紫菜多糖及其抗氧化性研究[J]. 食品科技, 2007, 32(3): 96-99. DOI:10.3969/ j.issn.1005-9989.2007.03.026.
[4] 周小偉, 鐘瑞敏. 紫菜多糖提取工藝技術及抗氧化活性研究[J]. 食品研究與開發, 2014, 35(19): 43-47. DOI:10.3969/ j.issn.1005-6521.2014.19.012.
[5] 王文平, 郭祀遠, 李琳, 等. 苯酚-硫酸法測定野木瓜中多糖含量的研究[J]. 食品科學, 2007, 28(4): 276-279. DOI:10.3321/ j.issn:1002-6630.2007.04.065.
[6] 劉鳳, 陶慧卿, 何培民. 條斑紫菜多糖脫蛋白方法與條件優化[J].上海水產大學學報, 2007, 16(2): 141-143. DOI:10.3969/ j.issn.1004-7271.2007.02.009.
[7] 穆凱峰. 壇紫菜多糖的提取純化及其理化性質研究[D]. 廈門: 集美大學, 2010.
[8] 劉琴, 宋坤, 郭杰, 等. 籽瓜多糖對H2O2致PC12細胞氧化損傷的保護作用[J]. 天然產物研究與開發, 2015, 27(2): 338-343. DOI:10.16333/ j.1001-6880.2015.02.028.
[9] 羅春麗, 王林, 李杏, 等. 紫薯花青素體外抗氧化及對H2O2誘導HepG2細胞氧化損傷的保護作用[J]. 食品科學, 2015, 36(17): 225-230. DOI:10.7506/spkx1002-6630-201517042.
[10] 韓苗苗, 王文飛, 劉銘瑤, 等. FGF-21對H2O2誘導的大鼠心肌細胞H9c2氧化應激損傷的保護作用[J]. 藥學學報, 2014, 49(4): 470-475.
[11] 劉紅亮, 胡磊, 王靖凱, 等. 槲皮素對H2O2損傷PC12細胞的保護效果與機制[J]. 中國藥理學通報, 2014, 30(3): 373-377. DOI:10.3969/ j.issn.1001-1978.2014.03.017.
[12] 張培麗, 張帥, 陳雪香, 等. 桑葚多糖對H2O2誘導PC-12細胞氧化損傷的保護作用[J]. 現代食品科技, 2015, 31(11): 20-24. DOI:10.13982/ j.mfst.1673-9078.2015.11.004.
[13] 熊莉, 王承明. 花生粕多糖去蛋白方法的研究[J]. 食品科技, 2010, 35(9): 219-222. DOI:10.13684/j.cnki.spkj.2010.09.057.
[14] 楊斌, 楊英, 王雪飛, 等. 響應面法優化藍刺頭多糖除蛋白工藝的研究[J]. 食品工業科技, 2014, 35(10): 287-291. DOI:10.13386/ j.issn1002-0306.2014.10.055.
[15] 王海茹, 王雪飛, 姚晶. 黃柏花粉多糖除蛋白方法比較及其對抗氧化功能的影響[J]. 食品科技, 2015, 40(5): 224-228. DOI:10.13684/ j.cnki.spkj.2015.05.044.
[16] 張曜武, 王薇薇, 王超, 等. 淫羊藿多糖的酶法除蛋白工藝研究[J]. 青島科技大學學報, 2014, 35(2): 167-173. DOI:10.3969/ j.issn.1672-6987.2014.02.013.
[17] 劉玉芬, 夏海濤, 徐芹喜. 海英菜多糖提取工藝的響應面法優化及其體外抗氧化作用[J]. 食品科學, 2012, 33(20): 138-143.
[18] CAPEK P, MACHOBA E, TURIAN J. Scavenging and antioxidant actibities of immunomodulating polysaccharids isolated form Salvia officinalis[J]. International of Biologica Macromolecules, 2009, 44(1): 75-80. DOI:10.1016/j.ijbiomac.2008.10.007.
[19] PREETA R, NAIR R. Stimulation of cardiac fibroblast proliferation by cerium: a superoxide anion-mediated response[J]. Journal of Molecular and Cellular Cardiology, 1999, 31(8): 1573-1580. DOI:10.1006/ jmcc.1999.0994.
[20] PELICANO H, CARNEY D, HUANG P. ROS stress in cancer cells and therapeutic implications[J]. Drug Resistance Updates, 2004, 7(2): 97-110. DOI:10.1016/j.drup.2004.01.004.
[21] KOHEN R, NYSKA A. Oxidation of biological systems: oxidative stress phenomena, antioxidants, redox reactions, and methods for their quantification[J]. Journal of Toxicologic Pathology, 2002, 30(6): 620-50. DOI:10.1080/01926230290166724.
[22] RHEE S, BAE Y, LEE S, et al. Hydrogen peroxide: a key messenger that modulates protein phosphorylation through cysteine oxidation[J]. Science’s Stke, 2000, 53: 1-5. DOI:10.1126/stke.2000.53.pe1.
[23] SCHNABEL R, BLANKENBERG S. Oxidative stress in cardiovascular disease[J]. International Journal of Molecular Sciences, 2014, 15(4): 6002-6008.
[24] 游如旭, 張玉, 汪柳, 等. 香菇多糖誘導鼠肝癌H22細胞凋亡機制的初步探討[J]. 中國醫院藥學雜志, 2015, 35(9): 776-781. DOI:10.13286/j.cnki.chinhosppharmacyj.2015.09.04.
[25] HILEMAN E, LIU J, ALBITAR M, et al. Intrinsic oxidative stress in cancer cells: a biochemical basis for therapeutic selectivity[J]. Cancer Chemother Pharmacol, 2004, 53(3): 209-219. DOI:10.1007/s00280-003-0726-5.
Optimization of Deproteinization Process of Polysaccharides Extracted from Abandoned Porphyra haitanensis and Their Antioxidant Activity
XIE Fei, CAO Chunjie, CHEN Meizhen*, YE Tianwen
(College of Science, Shantou University, Shantou 515063, China)
Objective: This study aimed to investigate the deproteinization process of polysaccharides extracted from abandoned Porphyra haitanensis and to evaluate their cellular antioxidant activity. Methods: Response surface methodology was used to optimize the process conditions for the enzymatic deproteinization of P. haitanensis polysaccharides with papain. An oxidative stress model was built by stimulating HeLa cells with H2O2and the methyl thiazolyl tetrazolium (MTT) method was used to determine the cell survival rate. The level of cellular reactive oxygen species (ROS) was also measured by 2’,7’-dichlorodihydrofluorescin diacetate (DCFH-DA). Results: The optimized deproteinization conditions were determined as follows: hydrolysis time, 55 min; temperature, 50 ℃; and papain concentration, 0.7 mg/mL; giving a percentage of deproteinization of 61.28%. After further deproteinization with 4% trichloroacetic acid (TCA), the deproteinization rate increased up to 80.73%, and the retention rate of polysaccharide was 79.7%. Compared with the model group, the survival rate of cells treated with the purified polysaccharides from P. haitanensis was significantly increased (P < 0.01), and the level of ROS was significantly decreased (P < 0.01). Conclusions: The combination of papain hydrolysis and TCA treatment was an effective method for the removal of protein from Porphyra haitanensis polysaccharides. Porphyra haitanensis polysaccharides had significant antioxidant activity and could relieve the H2O2-induced injury in HeLa cells by eliminating redundant ROS.
polysaccharides extracted from abandoned Porphyra haitanensis; deproteinization; antioxidant activity; HeLa; reactive oxygen species
10.7506/spkx1002-6630-201622011
R931
A
1002-6630(2016)22-0077-08
謝飛, 曹純潔, 陳美珍, 等. 響應面試驗優化末水壇紫菜多糖除蛋白工藝及其抗氧化活性[J]. 食品科學, 2016, 37(22): 77-84. DOI:10.7506/spkx1002-6630-201622011. http://www.spkx.net.cn
XIE Fei, CAO Chunjie, CHEN Meizhen, et al. Optimization of deproteinization process of polysaccharides extracted from abandoned Porphyra haitanensis and their antioxidant activity[J]. Food Science, 2016, 37(22): 77-84. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201622011. http://www.spkx.net.cn
2016-04-13
廣東省高水平大學重點學科建設項目
謝飛(1990—),男,碩士研究生,研究方向為活性物質研究與開發。E-mail:14fxie@stu.edu.cn
*通信作者:陳美珍(1956—),女,教授,本科,研究方向為活性物質研究與開發。E-mail:chenmz@stu.edu.cn

