高效液相色譜法測(cè)定巴旦木青皮提取物中齊墩果酸和熊果酸
李維霞,魏 佳,蘇玉紅,吳 斌,張 平,*
(1.新疆大學(xué)化學(xué)化工學(xué)院,新疆 烏魯木齊 830046;2.新疆農(nóng)業(yè)科學(xué)院農(nóng)產(chǎn)品貯藏加工研究所,新疆 烏魯 木齊 830091)
高效液相色譜法測(cè)定巴旦木青皮提取物中齊墩果酸和熊果酸
李維霞1,魏 佳2,蘇玉紅1,吳 斌2,張 平2,*
(1.新疆大學(xué)化學(xué)化工學(xué)院,新疆 烏魯木齊 830046;2.新疆農(nóng)業(yè)科學(xué)院農(nóng)產(chǎn)品貯藏加工研究所,新疆 烏魯 木齊 830091)
采用質(zhì)譜儀對(duì)巴旦木青皮提取物中齊墩果酸(oleanolic acid,OA)和熊果酸(ursolic acid,UA)進(jìn)行鑒定,進(jìn)一步用高效液相色譜法測(cè)定OA和UA含量,優(yōu)化提取條件。高效液相色譜條件:利用Platisil ODS C18色譜柱(250 mm×4.6 mm,5 μm),以甲醇-0.2%磷酸(85∶15,V/V)溶液為流動(dòng)相,流速0.8 mL/min;柱溫20 ℃;檢測(cè)波長(zhǎng)210 nm。結(jié)果表明:OA在0.005~0.5 mg/mL范圍內(nèi)線性關(guān)系良好(R2=0.999 9),回收率在89.67%~94.85%之間,相對(duì)標(biāo)準(zhǔn)偏差在1.28%~3.16%之間(n=3);UA在0.005~0.5 mg/mL范圍內(nèi)線性關(guān)系良好(R2=0.999 9),回收 率在88.67%~94.77%之間,相對(duì)標(biāo)準(zhǔn)偏差在1.07%~1.92%(n=3)之間。在不同提取 條件下,提取劑為體積分?jǐn)?shù)95%乙醇、料液比1∶40(g/mL)、提取時(shí)間40 min及提取3 次為最佳條件。
巴旦木青皮;齊墩果酸;熊果酸;高效液相色譜法
巴旦木,又名扁桃(Amygdalus Communis L.),是薔薇科(Rosaceae)李亞科(Prunoideae)桃屬喬木,為世界著名干果及木本油料樹(shù)種[1]。因其果仁營(yíng)養(yǎng)豐富,含有人體所必需的多種微量元素[2-4]而廣受歡迎。巴旦木作為新疆地區(qū)的特色果品,在南疆喀什與和田地區(qū)被大量種植,每年為當(dāng)?shù)毓r(nóng)帶來(lái)巨大經(jīng)濟(jì)利益,同時(shí)也產(chǎn)生了大量的巴旦木青皮。
巴旦木青皮為巴旦木的干燥外果皮,其含有的三萜酸是自然界藥用植物的主要活性成分之一。齊墩果酸(土當(dāng)歸酸,oleanolic acid,OA)和熊果酸(烏索酸,ursolic acid,UA)是巴旦木青皮提取物中三萜酸的主要有效成分,二者屬于同分異構(gòu)體,是廣泛存在于自然界中的五環(huán)三萜類化合物。現(xiàn)代藥理學(xué)研究表明,OA和UA具有較強(qiáng)的生理活性,其中OA具有保肝、降血糖、抗心律失常、消炎、增強(qiáng)免疫、抑制血小板聚集和抗氧化等多種藥理作用[5-8];UA具有鎮(zhèn)靜、抗糖尿病、抗炎、抗菌、降血脂、穩(wěn)定肝功能、抗氧化 和抗腫瘤等作用[9-10]。三萜類物質(zhì)結(jié)構(gòu)復(fù)雜,目前人工合成技術(shù)不成熟,其主要來(lái)源是從植物中提取[11],因此,從植物提取物中分離檢測(cè)UA和OA是當(dāng)今研究的熱點(diǎn)之一。
目前,常用的OA和UA的分析方法主要有薄層色譜法[12-14]、分光光度法[15]、氣相色譜法[16]、高效液相色譜(high performance liquid chromatography,HPLC)法[17-18]及毛細(xì)管電泳法[19]等。其中HPLC法具有分析時(shí)間短、分離度好、靈敏度高、操作簡(jiǎn)便的特點(diǎn),近幾年來(lái)得到迅速發(fā)展并被廣泛應(yīng)用[20]。采用HPLC法測(cè)定OA和UA的含量已有大量文獻(xiàn)報(bào)道,但對(duì)巴旦木青皮提取物中OA和UA提取方法的優(yōu)化及含量的檢測(cè)報(bào)道較少。本實(shí)驗(yàn)通過(guò)單因素和正交試驗(yàn)優(yōu)化了巴旦木青皮提取物中OA和UA的提取條件,采用質(zhì)譜儀對(duì)提取物中OA和UA做了定性分析,并通過(guò)HPLC法測(cè)定了巴旦木青皮提取物中OA和UA的含量,為巴旦木青皮及其中藥制劑的質(zhì)量標(biāo)準(zhǔn)提供參考,也為巴旦木青皮資源的深加工提供理論依據(jù)和實(shí)驗(yàn)數(shù)據(jù)。
1 材料與方法
1.1 材料與試劑
巴旦木青皮采自新疆喀什市莎車縣國(guó)營(yíng)二農(nóng)場(chǎng)。將采集的青皮材料從-20 ℃冰箱中取出,立即放入用液氮冷凍過(guò)的植物粉碎機(jī)中粉碎,在-50 ℃條件下真空冷凍干燥除去水分,研磨并過(guò)40 目篩,置于干燥器中備用。
OA、UA標(biāo)準(zhǔn)品(純度≥98%) 上海源葉生物科技有限公司;甲醇(色譜純) 霍尼韋爾貿(mào)易(上海)有限公司;磷酸、乙醇(均為分析純) 天津市福晨化學(xué)試劑廠;實(shí)驗(yàn)室用水均為高純水(≥18 MΩ/cm)。
1.2 儀器與設(shè)備
Q EXACTIVE PLUS型質(zhì)譜儀 美國(guó)Thermo公司;1260型高效液相色譜儀(配有可變波長(zhǎng)紫外檢測(cè)器、示差折光檢測(cè)器和EZChrom Elite工作 站) 美國(guó)安捷倫公司;DZG-303A艾柯實(shí)驗(yàn)室專用超純水儀 成都唐氏康寧科技發(fā)展有限公司;A11基本型研磨機(jī) 德國(guó)IKA公司;LGJ-10冷凍干燥機(jī) 北京松源華興科技發(fā)展有限公司;SK 7200H超聲波清洗器 上海科導(dǎo)超聲儀器有限公司;RE100-Pro旋轉(zhuǎn)蒸發(fā)儀 美國(guó)Scilogex公司。
1.3 方法
1.3.1 樣品溶液的制備
參照黃浩[21]、鄒盛勤[22]等的方法,并略加改動(dòng)。準(zhǔn)確稱取巴旦木青皮干粉1.0 g,加入30 mL體積分?jǐn)?shù)95%乙醇溶液,超聲提取40 min,抽濾,殘?jiān)韵嗤姆椒ㄌ崛?0 min,合并2 次濾液,將濾液在45 ℃、20 r/min旋轉(zhuǎn)濃縮蒸干乙醇,殘?jiān)盟芙猓兔演腿? 次,水層旋轉(zhuǎn)蒸發(fā)近干,用甲醇溶解并定容至10 mL容量瓶后,取上清液過(guò)0.22 μm濾膜后直接注入進(jìn)樣瓶以供HPLC分析。
1.3.2 標(biāo)準(zhǔn)溶液的配制
分別準(zhǔn)確稱取OA和UA標(biāo)準(zhǔn)品各5.0 mg,用甲醇溶解并定容于10 mL棕色容量瓶中,其質(zhì)量濃度為0.5 mg/mL,將其作為標(biāo)準(zhǔn)儲(chǔ)備液放置冰箱備用。采用逐步稀釋法得到0.005、0.01、0.05、0.1、0.2、0.5 mg/mL一系列不同質(zhì)量濃度的標(biāo)準(zhǔn)工作溶液,過(guò)0.22 μm濾膜后進(jìn)樣。
1.3.3 質(zhì)譜條件
電噴霧離子源;檢測(cè)方式:正離子模式;鞘氣流速5 psi;輔助氣流速1 psi;噴霧電壓3.5 kV;毛細(xì)管溫度320 ℃;輔助氣加熱器溫度300 ℃。
1.3.4 HPLC條件
參照文獻(xiàn)[23-24]等并稍作調(diào)整,確定色譜條件為:Platisil ODS C18色譜柱(250 mm×4.6 mm,5 μm);流動(dòng)相:甲醇-0.2%磷酸(85∶15,V/V)溶液;流速0.8 mL/min;柱溫20 ℃;檢測(cè)波長(zhǎng)210 nm;進(jìn)樣量20 μL。
1.3.5 提取條件的優(yōu)化
提取條件單因素水平:提取劑為甲醇、乙醇、乙酸乙酯、丙酮和三氯甲烷;提取劑體積分?jǐn)?shù)為65%、75%、85%、95%、100%;料液比為1∶10、1∶20、1∶30、1∶40、1∶50(g/mL);提取時(shí)間為10、20、30、40、50 min;提取次數(shù)為1、2、3、4 次,在單因素試驗(yàn)基礎(chǔ)上設(shè)計(jì)了L9(34)正交試驗(yàn)對(duì)提取條件進(jìn)行全面考察。
2 結(jié)果與分析
2.1 巴旦木青皮提取物中OA和UA的鑒定
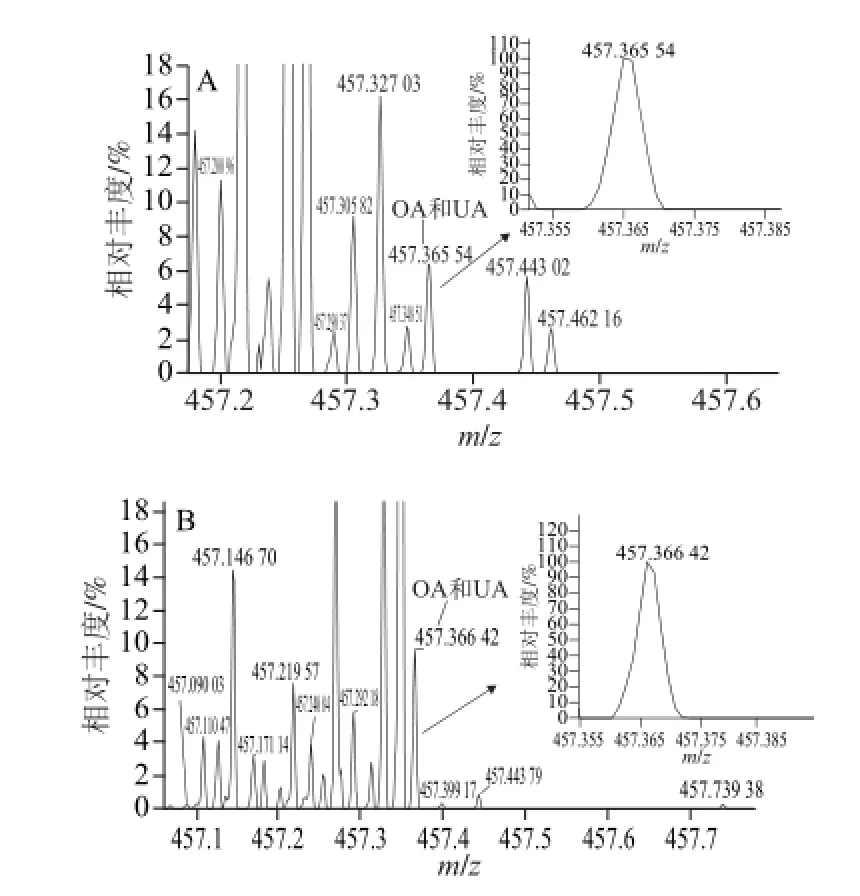
圖1 OA、UA標(biāo)準(zhǔn)品(A)和巴旦木青皮提取物(B)電噴霧-質(zhì)譜圖Fig. 1 ESI-MS spectra of mixed OA and UA standards (A) and almond green husk extracts (B)
對(duì)巴旦木青皮提取物和OA、UA混合標(biāo)準(zhǔn)品進(jìn)行電噴霧-質(zhì)譜正離子模式掃描,通過(guò)樣品和混合標(biāo)準(zhǔn)品的精確質(zhì)荷比判斷巴旦木青皮提取物是否含有OA及其同分異構(gòu)體UA。由圖1可以看出,巴旦木青皮提取物中目標(biāo)物的質(zhì)荷比與混合標(biāo)準(zhǔn)品的質(zhì)荷比相吻合,故推測(cè)巴旦木青皮提取物中可能含有OA或其同分異構(gòu)體UA[25],采用HPLC法進(jìn)一步對(duì)樣品進(jìn)行分析。
2.2 提取條件的優(yōu)化
以巴旦木青皮提取物中OA和UA的提取量為指標(biāo),采用單因素試驗(yàn)和正交試驗(yàn)對(duì)提取條件進(jìn)行了優(yōu)化。
2.2.1 提取劑的選擇
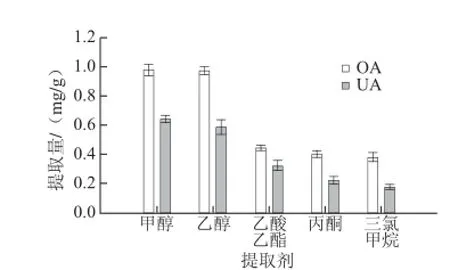
圖2 提取劑對(duì)OA和UA提取量的影響Fig. 2 Effect of organic solvents on the extraction effi ciency of OA and UA
OA和UA可溶于多種有機(jī)溶劑,本實(shí)驗(yàn)采用5 種試劑進(jìn)行溶劑優(yōu)化,由圖2可知,5 種溶劑的提取能力為甲醇>乙醇>乙酸乙酯>丙酮>三氯甲烷,由于甲醇有毒,且提取后溶液顏色較深,脂溶性成分較多,故選用乙醇為提取劑。
2.2.2 提取劑體積分?jǐn)?shù)的優(yōu)化
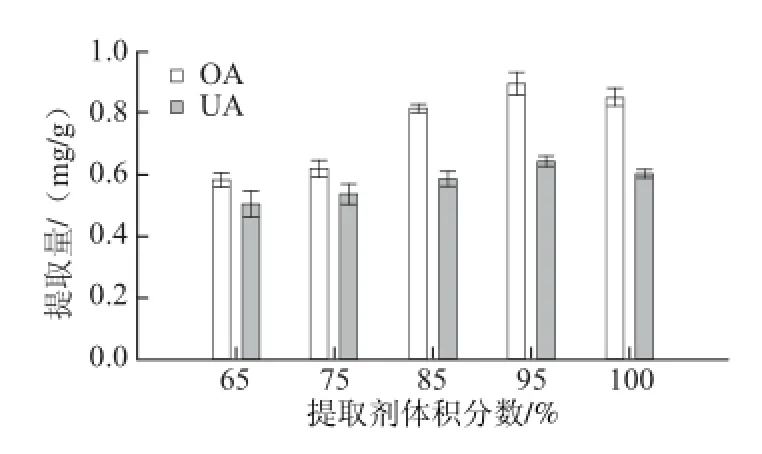
圖3 提取劑體積分?jǐn)?shù)對(duì)OA和UA提取量的影響Fig. 3 Effect of different ethanol concentrations on the extraction yields of OA and UA
由圖3可知,隨著乙醇體積分?jǐn)?shù)的增加,OA和UA的提取量逐漸增加,當(dāng)乙醇體積分?jǐn)?shù)為95%時(shí)提取效果最佳,當(dāng)乙醇體積分?jǐn)?shù)為100%時(shí),其提取效果有所下降,可能是由于溶劑中少量水的存在增加了溶劑的相對(duì)極性,從而增加了其傳質(zhì)過(guò)程,提高了對(duì)OA和UA的溶解能力[25]。
2.2.3 料液比的優(yōu)化

圖4 料液比對(duì)OA和UA提取量的影響Fig. 4 Effect of solid/solvent ratio on the extraction yields of OA and UA
由圖4可看出,隨著提取劑用量的增加,OA和UA提取量也逐漸增加,當(dāng)料液比為1∶30時(shí),巴旦木青皮提取物中OA和UA提取量基本保持不變,由于溶劑用量增大,增加了提取成本,同時(shí)對(duì)后續(xù)濃縮操作過(guò)程不利,因此選擇料液比為1∶30。
2.2.4 提取時(shí)間的優(yōu)化
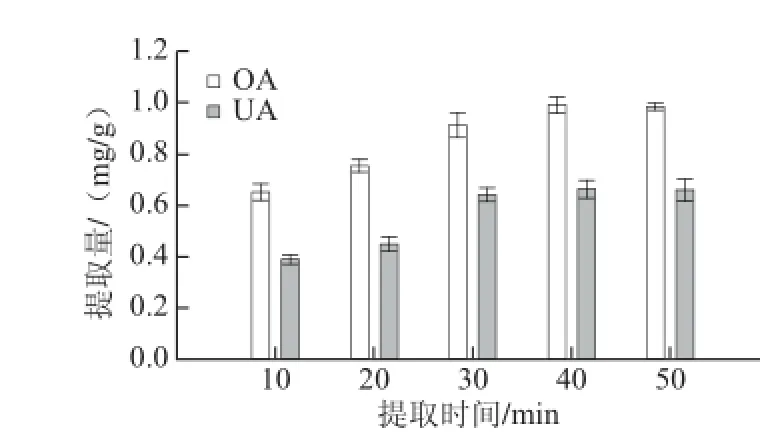
圖5 提取時(shí)間對(duì)OA和UA提取量的影響Fig. 5 Effect of extraction time on the extraction yields of OA and UA
由圖5所示,OA和UA在提取時(shí)間低于40 min時(shí),隨著提取時(shí)間的延長(zhǎng),OA和UA的提取量隨之增加,當(dāng)
再延長(zhǎng)提取時(shí)間其提取量有下降趨勢(shì),可能原因是在提取時(shí)間到達(dá)40 min時(shí),巴旦木青皮充分溶脹,進(jìn)而增加了溶劑的溶解能力。隨著時(shí)間的延長(zhǎng)至50 min時(shí),雜質(zhì)溶出量會(huì)相應(yīng)增加,同時(shí)OA和UA的提取量并無(wú)明顯增大,因此,選用40 min為最佳提取時(shí)間。
2.2.5 提取次數(shù)的優(yōu)化
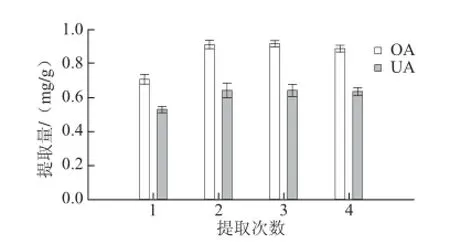
圖6 提取次數(shù)對(duì)OA和UA提取量的影響Fig. 6 Effect of number of extraction cycles on the extraction yields of OA and UA
由圖6可看出,當(dāng)提取1 次時(shí),對(duì)OA和UA的提取不徹底,含量低于第2、3次提取;繼續(xù)提取,OA和UA的提取量基本保持不變,而且當(dāng)提取大于2 次時(shí),提取溶劑和提取時(shí)間增加,故提取2 次為宜。
2.2.6 正交試驗(yàn)優(yōu)化和驗(yàn)證實(shí)驗(yàn)結(jié)果
在以上單因素試驗(yàn)基礎(chǔ)上,以巴旦木青皮提取物中OA和UA提取量為指標(biāo),選擇提取劑體積分?jǐn)?shù)、料液比、提取時(shí)間和提取次數(shù),設(shè)計(jì)了L9(34)正交試驗(yàn),以確定OA和UA的最佳提取條件。結(jié)果和數(shù)據(jù)處理如表1、2所示。
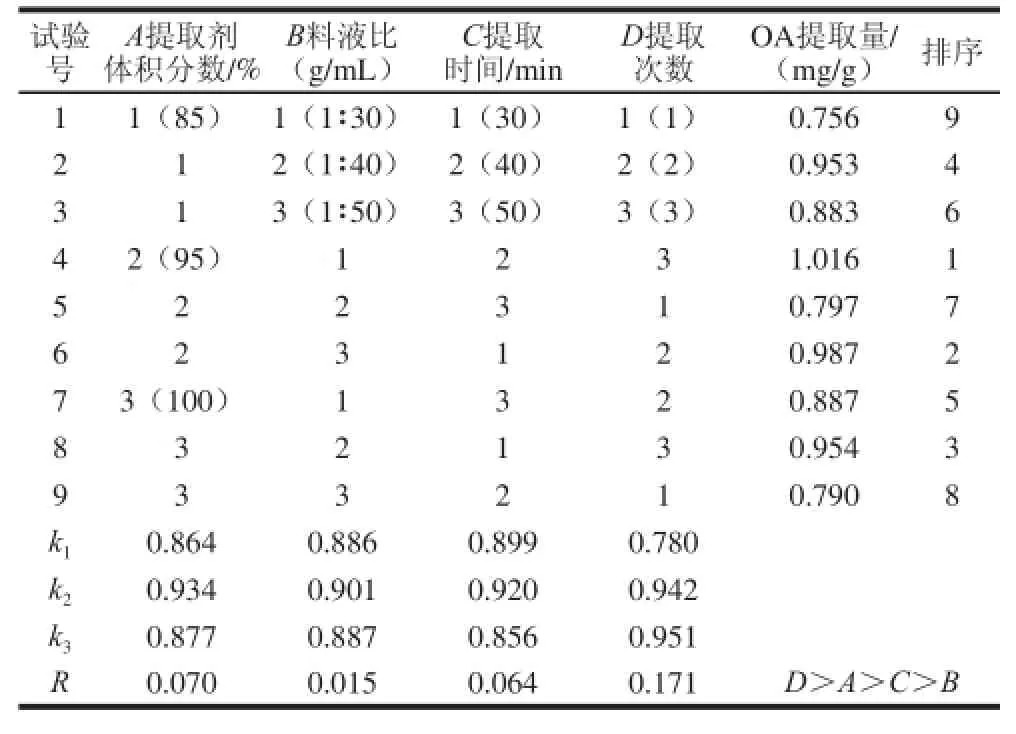
表 11 LL9(334)正交試驗(yàn)設(shè)計(jì)及結(jié)果(OOAA)Table 1 The design and results of L9((334) orthogonal tests for OA extraction
由表1可知,各因素對(duì)巴旦木青皮提取物中OA提取量影響的主次順序是:D>A>C>B,即提取次數(shù)是最主要因素,提取劑體積分?jǐn)?shù)料液比、提取時(shí)間是次要因素。由極差分析可得出最佳提取條件為A2B2C2D3,從正交試驗(yàn)表中得出最優(yōu)組合為A2B1C2D3,通過(guò)驗(yàn)證實(shí)驗(yàn)確定提取工藝組合為A2B2C2D3,即提取劑體積分?jǐn)?shù)95%、料液比1∶40、提取時(shí)間40 min及提取3 次。
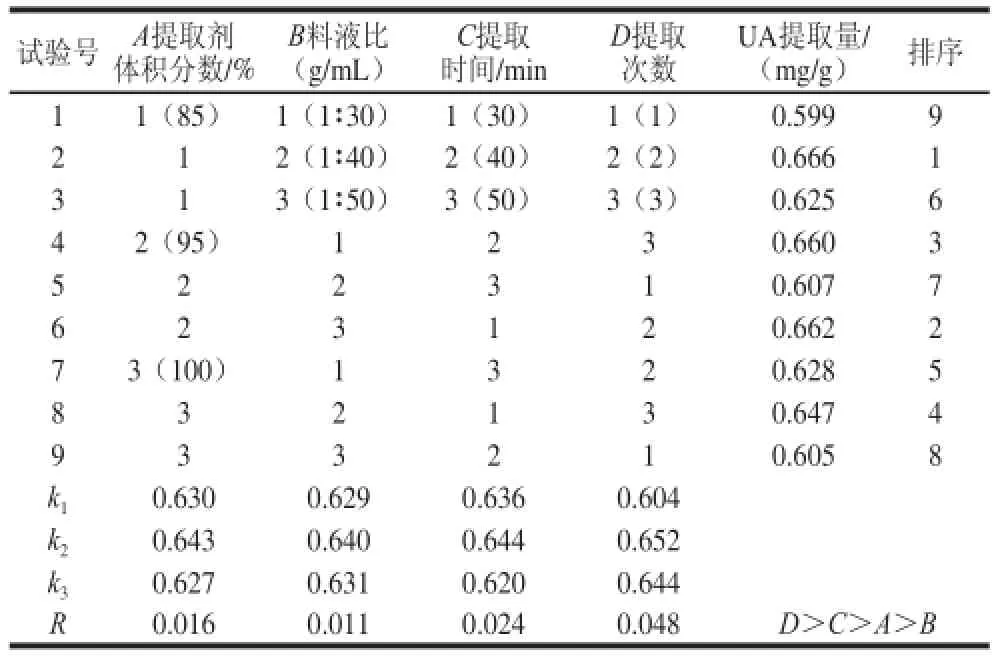
表 22 LL9(334)正交試驗(yàn)設(shè)計(jì)及結(jié)果(UUAA)Table 2 The design and results of L9((334) orthogonal tests for UA extraction
由表2可知,各因素對(duì)巴旦木青皮提取物中UA提取量影響的主次順序是:D>C>A>B,即提取次數(shù)是最主要,提取劑體積分?jǐn)?shù)料液比、提取時(shí)間是次要因素。由極差分析可得出最佳提取條件為A2B2C2D2,從正交試驗(yàn)表中得出最優(yōu)組合為A1B2C2D2,通過(guò)驗(yàn)證實(shí)驗(yàn)確定提取工藝組合為A2B2C2D2,即提取劑體積分?jǐn)?shù)95%、料液比1∶40、提取時(shí)間40 min及提取2 次。
在巴旦木青皮提取物中OA和UA同時(shí)存在,且二者屬于同分異構(gòu)體,性質(zhì)很相似,在提取過(guò)程中共存。由于巴旦木青皮提取物中OA含量較高,故提取條件以O(shè)A為主。因此巴旦木青皮提取物中OA和UA經(jīng)正交試驗(yàn)確定的最佳提取工藝組合為A2B2C2D3,即提取劑體積分?jǐn)?shù)95%、料液比1∶40、提取時(shí)間40 min及提取3 次。在此基礎(chǔ)上,對(duì)正交試驗(yàn)結(jié)果和單因素試驗(yàn)結(jié)果進(jìn)行驗(yàn)證實(shí)驗(yàn),由表3可知,在正交試驗(yàn)條件下,OA和UA含量要高于單因素試驗(yàn)結(jié)果,因此確定巴旦木青皮提取物中OA和UA最佳提取工藝組合為A2B2C2D3,即提取劑體積分?jǐn)?shù)95%、料液比1∶40、提取時(shí)間40 min及提取3 次。

表3 驗(yàn)證實(shí)驗(yàn)(OA、UA)Table 3 Experimental verififi cation of optimized extraction conditions
2.3 標(biāo)準(zhǔn)品及巴旦木青皮提取物中OA和UA的色譜分離
將0.2 mg/mL的OA和UA混合標(biāo)準(zhǔn)溶液在1.3.4節(jié)色譜條件下注入HPLC儀,如圖7A所示。將樣品進(jìn)行處理后用HPLC進(jìn)行分析,如圖7B所示。理論塔板數(shù)以O(shè)A和UA峰計(jì)均不低于6 000。當(dāng)甲醇和0.2%磷酸溶液配比為85∶15(V/V)時(shí),OA和UA分離度良好(R>1.5)且峰形較好。
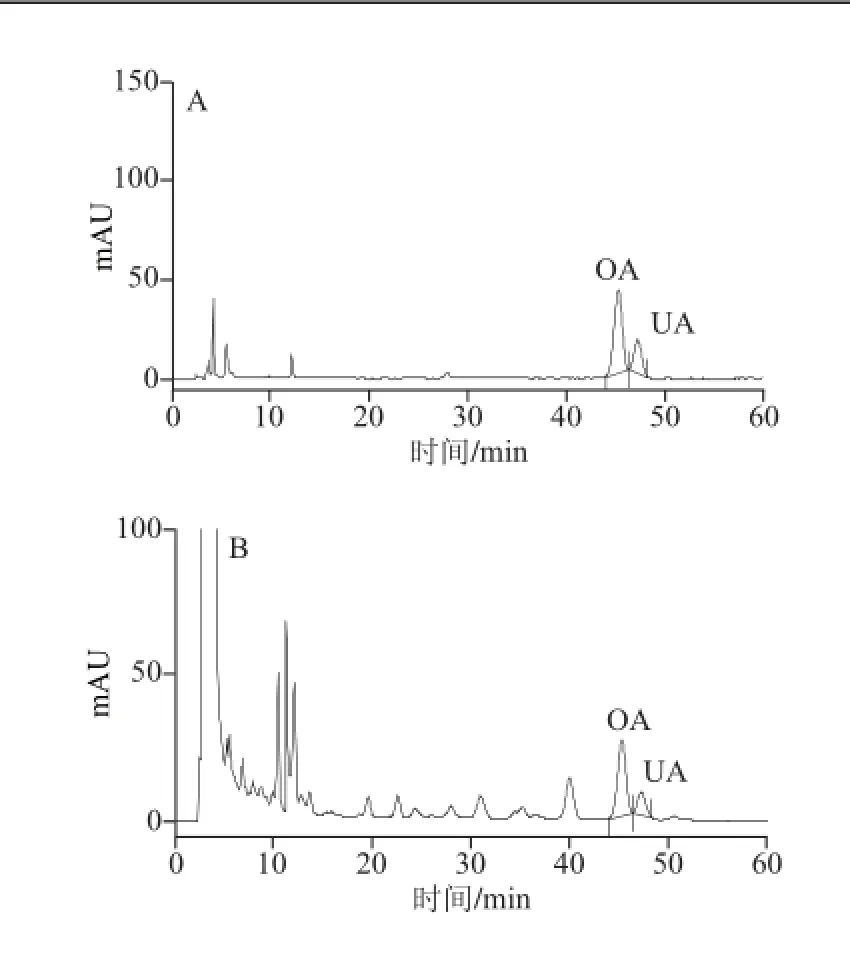
圖7 標(biāo)準(zhǔn)品(A)和巴旦木青皮樣品(B)HPLC色譜圖Fig. 7 HPLC chromatograms of mixed standards (A) and almond green husk (B)
2.4 方法學(xué)考察
2.4.1 標(biāo)準(zhǔn)曲線的繪制
對(duì)不同質(zhì)量濃度的標(biāo)準(zhǔn)溶液OA、UA分別自動(dòng)進(jìn)樣20 μL,按1.3.4節(jié)色譜條件測(cè)定,記錄峰面積。以每個(gè)標(biāo)準(zhǔn)工作溶液對(duì)應(yīng)的峰面積Y和其質(zhì)量濃度X進(jìn)行線性回歸分析,得到OA回歸方程:Y=3.144×108X+ 1.512×105,R2=0.999 9;UA回歸方程:Y=1.349×108X+ 1.365×105,R2=0.999 9。結(jié)果顯示OA和UA在0.005~0.5 mg/mL范圍內(nèi)線性關(guān)系良好。將最小質(zhì)量濃度的標(biāo)準(zhǔn)品溶液無(wú)限稀釋,按照1.3.4節(jié)色譜條件進(jìn)樣測(cè)定空白和稀釋的標(biāo)準(zhǔn)品溶液,計(jì)算信噪比,以3 倍信噪比對(duì)應(yīng)的標(biāo)準(zhǔn)品質(zhì)量濃度作為檢出限,以10 倍信噪比對(duì)應(yīng)的OA、UA標(biāo)準(zhǔn)品質(zhì)量濃度作為定量限,計(jì)算結(jié)果得出OA、UA的檢出限分別為0.38、0.41 μg/mL,定量限分別為1.28、1.43 μg/mL。
2.4.2 精密度實(shí)驗(yàn)結(jié)果

表4 精密度實(shí)驗(yàn)結(jié)果(n==55)Table 4 Results of precise test (n == 55))
分別取質(zhì)量濃度0.2 mg/mL和0.05 mg/mL的OA和UA標(biāo)準(zhǔn)液自動(dòng)進(jìn)樣20 μL,平行測(cè)定5 次,測(cè)定OA和UA峰面積積分值,計(jì)算平均值和相對(duì)標(biāo)準(zhǔn)偏差(relative standard deviation,RSD),由表4可知,OA的RSD分別為0.50%和0.89%;UA的RSD分別為0.28%和0.27%,說(shuō)明儀器精密度良好,滿足實(shí)驗(yàn)要求。
2.4.3 重復(fù)性實(shí)驗(yàn)
精確稱取相同質(zhì)量的樣品5 份,按1.3.1節(jié)制備巴旦木青皮提取液,分別進(jìn)樣20 μL,用HPLC儀測(cè)定峰面積,計(jì)算峰面積,由表5可知,OA的RSD為2.85%;UA的RSD為3.29%,說(shuō)明該方法的重復(fù)性較好。
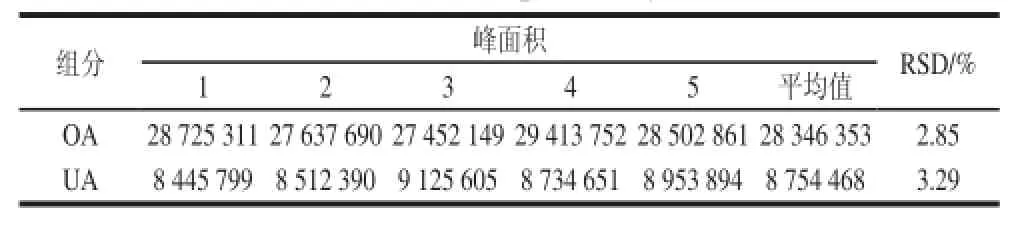
表5 重復(fù)性實(shí)驗(yàn)結(jié)果(n==55)Table 5 Results of repeatability test (n == 55))
2.4.4 回收率實(shí)驗(yàn)結(jié)果
在巴旦木青皮樣品中分別加入一定量的OA、UA標(biāo)準(zhǔn)品,進(jìn)行加標(biāo)回收率實(shí)驗(yàn)。由表6、7可知,OA的回收率在89.67%~94.85%之間,RSD在1.28%~3.16%之間;UA的回收率在88.67%~94.77%之間,RSD在1.07%~1.92%之間,可能的原因是由于標(biāo)準(zhǔn)物質(zhì)添加到樣品中存在基質(zhì)效應(yīng)導(dǎo)致回收率偏低,但不影響采用該方法測(cè)定巴旦木青皮提取物中OA和UA的含量。

表6 OA加標(biāo)回收率實(shí)驗(yàn)結(jié)果(n==33)Table 6 Results of recovery test for OA (n == 33))
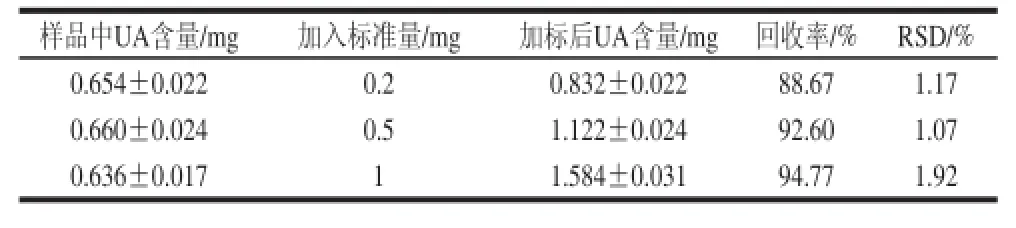
表7 UA加標(biāo)回收率實(shí)驗(yàn)結(jié)果(n==33)Table 7 Results of recovery test for UA (n == 33))
2.5 巴旦木青皮提取物中OA和UA含量測(cè)定
準(zhǔn)確稱取一定質(zhì)量巴旦木青皮粉末,按1.3.1節(jié)制備巴旦木青皮提取液,分別進(jìn)樣20 μL,按1.3.4節(jié)色譜條件測(cè)定(平行測(cè)定3 份),由表8可知,通過(guò)外標(biāo)法測(cè)得巴旦木青皮提取物中OA含量是0.101%,UA含量是0.068%。

表8 巴旦木青皮提取物中OA和UA含量的測(cè)定(Table 8 The contents of OA and UA in almonds green husk extract (n == 33)) %
3 討論與結(jié)論
OA和UA作為一種三萜類物質(zhì),在中藥材中共存,常用提取溶劑主要有甲醇、乙醇、氯仿等[26]。本實(shí)驗(yàn)通過(guò)對(duì)不同提取溶劑的考察,選用體積分?jǐn)?shù)95%乙醇溶液為提取劑,并采用正交試驗(yàn)設(shè)計(jì),對(duì)樣品提取過(guò)程進(jìn)行了單因素和正交試驗(yàn)優(yōu)化,確定最佳提取條件為提取劑體積分?jǐn)?shù)95%乙醇溶液、料液比1∶40、提取時(shí)間40 min及提取3 次;并采用質(zhì)譜儀對(duì)用最優(yōu)工藝提取出的巴旦木青皮提取物中OA和UA進(jìn)行了初步的鑒定。
OA和UA為三萜類同分異構(gòu)體,因結(jié)構(gòu)相似,分離檢測(cè)較困難。本實(shí)驗(yàn)采用紫外分光光度計(jì)對(duì)OA和UA在波長(zhǎng)190~400 nm處進(jìn)行掃描,最終確定波長(zhǎng)210 nm為檢測(cè)波長(zhǎng)。有文獻(xiàn)[27]報(bào)道采用HPLC分離OA和UA時(shí)流動(dòng)相通常為甲醇-水和乙腈-水。本實(shí)驗(yàn)參考文獻(xiàn)[28-29],分別考察了甲醇-水、甲醇-磷酸溶液、甲醇-醋酸溶液、乙腈-水、乙腈-磷酸溶液、乙腈-醋酸溶液等流動(dòng)相,結(jié)果表明采用甲醇-0.2%磷酸(85∶15,V/V)溶液時(shí)分離效果較好,可能的原因是在流動(dòng)相中加入一定比例的酸調(diào)節(jié)流動(dòng)相pH值,有助于改善色譜峰峰形,提高目標(biāo)物的分離度;進(jìn)一步對(duì)流速和柱溫進(jìn)行考察,結(jié)果顯示,當(dāng)流速為0.8 mL/min、柱溫為20 ℃時(shí),OA和UA基本可以分離,且基線較平穩(wěn)。
在上述色譜條件下測(cè)得巴旦木青皮提取物中的OA和UA的含量分別為0.101%和0.068%,精密度和準(zhǔn)確度均符合分析要求,重復(fù)性好,OA回收率在89.67%~94.85%之間,RSD在1.28%~3.16%之間;UA回收率在88.67%~94.77%之間,RSD在1.07%~1.92%之間,表明該方法準(zhǔn)確可靠,可用于巴旦木青皮提取物中OA和UA含量測(cè)定。
OA和UA主要存在于木瓜、夏枯草、女貞子等植物中,主要以游離形式或與糖苷結(jié)合的形式存在,二者的藥理活性有所差別,OA是臨床治療慢性病毒性肝炎和黃疸型肝炎較理想的藥物;UA具有多種生物活性;尤其在抗腫瘤、抗氧化、護(hù)肝、降血脂方面的作用顯著,通常利用HPLC對(duì)二者分離,使其起到獨(dú)特的藥理作用,歐洋等[30]采用HPLC對(duì)西藏木瓜中OA和UA含量進(jìn)行測(cè)定,測(cè)得木瓜樣品中OA、UA的含量分別為0.18%、0.49%。劉偉等[31]通過(guò)HPLC測(cè)定了河南夏枯草中OA、UA含量,測(cè)得河南夏枯草中OA和UA含量分別為0.08%和0.31%。通過(guò)與上述文獻(xiàn)對(duì)比,本實(shí)驗(yàn)所建立的測(cè)定OA與UA的HPLC方法與文獻(xiàn)中的方法基本一致,同時(shí)巴旦木青皮提取物中OA和UA的含量較高,表明采用本研究建立的HPLC方法對(duì)巴旦木青皮提取物中OA、UA的分離檢測(cè)有一定的研究?jī)r(jià)值。該方法為巴旦木青皮及其中藥制劑的質(zhì)量標(biāo)準(zhǔn)提供了參考方法和一定的科學(xué)依據(jù),同時(shí)也為其他天然產(chǎn)物同類化合物的研究提供了一種借鑒。
[1] 成建紅, 侯平, 李疆. 巴旦杏的產(chǎn)業(yè)發(fā)展及其研究進(jìn)展[J]. 干旱區(qū)研究, 2000, 17(1): 32-39. DOI:10.13866/j.azr.2000.01.007.
[2] 孫士偉, 張李華. 扁桃的開(kāi)發(fā)價(jià)值及栽培技術(shù)[J]. 中國(guó)新技術(shù)新產(chǎn)品, 2010(10): 228-228. DOI:10.13612/j.cnki.cntp.2010.10.168.
[3] 尤努斯江·吐拉洪, 馬木提·庫(kù)爾班, 木妮熱·依布拉音. 巴旦木的營(yíng)養(yǎng)保健作用研究進(jìn)展[J]. 中國(guó)食物與營(yíng)養(yǎng), 2008(10): 56-58. DOI:10.3969/j.issn.1006-9577.2008.10.018.
[4] 楊曉君, 韓海霞. 巴旦杏的近代研究[J]. 中國(guó)藥業(yè), 2009, 18(10): 85-86. DOI:10.3969/j.issn.1006-4931.2009.10.066.
[5] JEONG H G. Inhibition of cytochrome P450 2E1 expressionby oleanolic acid: hepatoprotective effects against carbon tetrachlorideinduced hepatic injury[J]. Toxicology Letters, 1999, 105(3): 215-222. DOI:10.1016/S0378-4274(99)00004-1.
[6] UDAYAMA M, OHKAWA M, YOSHIDA N, et al. Structures of three new oleanene glucuronides isolated from Lathyrus palustris var. pilosus and hepatoprotective activity[J]. Chemical and Pharmaceutical Bulletin, 1998, 46(9): 1412-1415. DOI:10.1248/cpb.46.1412.
[7] 王漢屏, 王立志. 木瓜齊墩果酸的研究進(jìn)展[J]. 食品科學(xué), 2007, 28(10): 621-624. DOI:10.3321/j.issn:1002-6630.2007.10.157.
[8] TEODORO T, ZHANG L, ALEXANDER T, et al. Oleanolic acid enhances insulin secretion in pancreatic β-cells[J]. FEBS Letters, 2008, 582(9): 1375-1380. DOI:10.1016/j.febslet.2008.03.026.
[9] 張新華, 朱萱. 熊果酸藥理學(xué)的最新研究進(jìn)展[J]. 中國(guó)中西醫(yī)結(jié)合雜志, 2011, 31(9): 1285-1289.
[10] OVESNA Z V, ACHALKOVA A, HORVATHOVA K, et al. Pentacyclic triterpenoic acids: new chemoprotective compounds minireview[J]. Neoplasma, 2004, 51(5): 327-333.
[11] 張立華, 張?jiān)? 孫蕾, 等. 鞣花酸和三萜類物質(zhì)在石榴不同器官中的分布[J]. 食品科學(xué), 2015, 36(6): 136-139. DOI:10.7506/spkx1002-6630-201506025.
[12] DU Hui, WU Jie, LI Hui, et al. Polyphenols and triterpenes from Chaenomeles fruits: chemical analysis and antioxidant activities assessment[J]. Food Chemistry, 2013, 141(4): 4260-4268. DOI:10. 1016/j.foodchem.2013.06.109.
[13] 嚴(yán)華, 王寶琹, 魯靜. 薄層色譜法分離齊墩果酸和熊果酸[J]. 藥物分析雜志, 2009, 29(12): 2168-2170. DOI:10.16155/j.0254-1793.2009.12.016.
[14] BANERJEE A, SANE R T, MANGAONKAR K, et al. Quantitation of oleanolic acid in Oldenlandia corymbosa L. whole-plant powder by high-performance thin-layer chromatography[J]. Journal of Planar Chromatograpy, 2006, 19(107): 68-72. DOI:10.1556/JPC.19.2006.1.12
[15] 楊劍芳, 路福平, 黃明勇, 等. 分光光度法測(cè)定山茱萸及其保健酒中三萜酸的含量[J]. 食品科學(xué), 2008, 29(6): 321-323. DOI:10.3321/ j.issn:1002-6630.2008.06.068.
[16] JANICSAK G. Gas chromatographic method for routine determination of oleanolic and ursolic acids in medicinal plants[J]. Chromatographia, 2003, 58(5/6): 295-300. DOI:10.1365/s10337-003-0058-y.
[17] ZHANG Shijuan. Determination of triterpenic acids in fruits by a novel high performance liquid chromatography method with high sensitivity and specifi city[J]. Food Chemistry, 2014, 146(1): 264-269. DOI:10.1016/j.foodchem.2013.09.056.
[18] WU Hongliang. Simultaneous determination of six triterpenic acids in some Chinese medicinal herbs using ultrasound-assisted dispersive liquid-liquid microextraction and high-performance liquid chromatography with fluorescence detection[J]. Journal of Pharmaceutical and Biomedical Analysis, 2015, 107: 98-107. DOI:10.1016/j.jpba.2014.10.031.
[19] YANG Ping, LI Yuqin, LIU Xia, et al. Determination of free isomeric oleanolic acid and ursolic acid in Pterocephalus hookeri by capillary zone electrophoresis[J]. Journal of Pharmaceutical and Biomedical Analysis, 2007, 43(4): 1331-1334. DOI:10.1016/j.jpba.2006.10.042.
[20] 謝越, 俞浩, 汪建飛, 等. 高效液相色譜法同時(shí)測(cè)定滁菊樣品中的9種酚酸[J]. 分析化學(xué), 2013, 41(3): 383-388.
[21] 黃浩, 鄒盛勤. 高效液相色譜法測(cè)定春根藤中的齊墩果酸和熊果酸[J]. 光譜實(shí)驗(yàn)室, 2012, 29(4): 2023-2026. DOI:10.3969/ j.issn:1004-8138.2012.04.018.
[22] 鄒盛勤, 孫偉. 反相高效液相色譜法同時(shí)測(cè)定柿葉中齊墩果酸和熊果酸[J]. 分析試驗(yàn)室, 2009, 28(4): 18-21. DOI:10.3969/ j.issn:1000-0720.2009.04.005.
[23] 王岱杰, 王曉, 耿巖玲, 等. 反相高效液相色譜測(cè)定不同品種皺皮木瓜中齊墩果酸和熊果酸含量[J]. 食品科學(xué), 2008, 29(10): 497-499. DOI:10.3321/j.issn:1002-6630.2008.10.118.
[24] 羅智敏, NAVARRO E, 陶燕鐸, 等. HPLC-DAD法測(cè)定血滿草中熊果酸和齊墩果酸的含量[J]. 天然產(chǎn)物研究與開(kāi)發(fā), 2011, 23(6): 1095-1098. DOI:10.3969/j.issn.1001-6880.2011.06.026.
[25] FU Quanjuan, ZHANG Lihua, CHENG N, et al. Extraction optimization of oleanolic and ursolic acids from pomegranate (Punica granatum L.) fl owers[J]. Food and Bioproducts Processing, 2014, 92: 321-327. DOI:10.1016/j.fbp.2012.12.006.
[26] 沈曉丹, 袁杰, 徐乃玉, 等. HPLC測(cè)定藍(lán)萼香茶菜中齊墩果酸和熊果酸的含量[J]. 中成藥, 2010, 32(12): 2182-2183. DOI:10.3969/ j.issn.1001-1528.2010.12.047.
[27] 趙永席, 馬國(guó)營(yíng), 梁恒. RP-HPLC-ELSD測(cè)定山茱萸中齊墩果酸與熊果酸的含量[J]. 中成藥, 2005, 27(11): 1314-1316. DOI:10.3969/ j.issn.1001-1528.2005.11.027.
[28] WóJCIAK-KOSIOR M, SOWA I, KOCJAN R, et al. Effect of different extraction techniques on quantification of oleanolic and ursolic acid in Lamii albi fl os[J]. Industrial Crops and Products, 2013, 44(2): 373-377. DOI:10.1016/j.indcrop.2012.11.018.
[29] WEI Mingchi, YANG Yuchao. Extraction characteristics and kinetic studies of oleanolic and ursolic acids from Hedyotis diffusa under ultrasound-assisted extraction conditions[J]. Separation and Purification Technology, 2014, 130: 182-192. DOI:10.1016/ j.seppur.2014.04.029.
[30] 歐洋, 馬靜, 張朝陽(yáng), 等. 西藏木瓜的鑒別及其齊墩果酸、熊果酸的測(cè)定[J]. 華西藥學(xué)雜志, 2014, 29(6): 670-672. DOI:10.13375/j.cnki. wcjps.2014.06.022.
[31] 劉偉, 丁海杰. HPLC測(cè)定夏枯草中熊果酸、齊墩果酸、迷迭香酸的含量[J]. 中成藥, 2008, 30(4): 577-580. DOI:10.3969/ j.issn.1001-1528.04.033.
Determination of Oleanolic Acid and Ursolic Acid in Almond Green Husk Extract by High Performance Liquid Chromatography
LI Weixia1, WEI Jia2, SU Yuhong1, WU Bin2, ZHANG Ping2,*
(1. College of Chemistry and Chemical Engineering, Xinjiang University, ürümqi 830046, China; 2. Institute of Agro-Products Storage and Processing, Xinjiang Academy of Agricultural Sciences, ürümqi 830091, China)
Oleanolic acid (OA) and ursolic acid (UA) were identifi ed by mass spectrometry (MS) in almond green husk extract. Further, a high performance liquid chromatographic (HPLC) method was established for the determination of the contents of OA and UA, and the extraction conditions were optimized using single factor and orthogonal array experiments. The HPLC conditions were set as follows: separation column, Platisil ODS C18(250 mm × 4.6 mm, 5 μm); mobile phase, methanol-0.2% phosphorus acid (85:15, V/V); fl ow rate, 0.8 mL/min; column temperature, 20 ℃; and detection wavelength, 210 nm. In the range of 0.005–0.5 mg/mL (R2= 0.999 9), both OA and UA presented a good li n ear relationship. The average recoveries of OA varied from 89.67% to 94.85% with RSD of 1.28%–3.16% (n = 3). The average recoveries of UA ranged from 88.67% to 94.77%, and the RSD was between 1.07% and 1.92% (n = 3). The optimum conditions for extracting OA and UA from almond green husk extract were as follows: 95% ethanol as extractant; solid/solvent ratio, 1:40 (g/mL); extraction time, 40 min; and 3 extraction cycles.
almond green husk; oleanolic acid (OA); ursolic acid (UA); high performance liquid chromatography (HPLC)
10.7506/spkx1002-6630-201610026
O657.72
A
1002-6630(2016)10-0151-07
李維霞, 魏佳, 蘇玉紅, 等. 高效液相色譜法測(cè)定巴旦木青皮提取物中齊墩果酸和熊果酸[J]. 食品科學(xué), 2016, 37(10): 151-157. DOI:10.7506/spkx1002-6630-201610026. http://www.spkx.net.cn
LI Weixia, WEI Jia, SU Yuhong, et al. Determination of oleanolic acid and ursolic acid in almond green husk extract by high performance liquid chromatography[J]. Food Science, 2016, 37(10): 151-157. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201610026. http://www.spkx.net.cn
2015-08-24
新疆特色林果貯運(yùn)保鮮及精深加工關(guān)鍵技術(shù)研究與示范項(xiàng)目(2011BAD27B01)
李維霞(1990—),女,碩士研究生,研究方向?yàn)樘烊划a(chǎn)物分析。E-mail:912861088@qq.com
*通信作者:張平(1964—),男,研究員,博士,研究方向?yàn)槭称房茖W(xué)。E-mail:zhangpingyys@163.com

