豬源大腸桿菌耐藥性與毒力的研究
曾俊棋,岳萬福
(浙江農林大學動物科技學院,浙江 杭州 311300)
Zeng Junqi,Yue Wanfu*
(Col lege of Animal Science and Technology,Zhej iang Agricul ture&Forest University,Zhej iang Hangzhou 311300)
豬源大腸桿菌耐藥性與毒力的研究
曾俊棋,岳萬福?
(浙江農林大學動物科技學院,浙江杭州311300)
為了有效預防豬腸道疾病的大面積感染,本試驗針對豬源大腸桿菌耐藥性與毒力開展研究。結果表明,被測大腸桿菌菌株對卡那霉素、阿莫西林、青霉素等抗生素具有耐藥性,對鏈霉素、磷霉素等抗生素具有敏感性,其對卡那霉素與青霉素的最小抑菌濃度較高,但對于氟苯尼考、慶大霉素、強力霉素與四環素,大腸桿菌菌株的最小抑菌濃度差異較明顯。EDL933大腸桿菌菌株中Stx2基因成功轉移到PS1、PS2、PS3大腸桿菌菌株的基因組中,并在相應菌株中得到表達,產生毒力蛋白,表明EDL933大腸桿菌菌株的Stx2毒力基因會發生基因水平轉移,以期為豬腸道疾病的防控提供科學依據。
豬;大腸桿菌;耐藥性;毒力
Zeng Junqi,Yue Wanfu*
(Col lege of Animal Science and Technology,Zhej iang Agricul ture&Forest University,Zhej iangHangzhou 311300)
畜禽大腸桿菌病已成為危害養殖業的最普遍發生且防治最棘手的疾病之一,如產志賀毒素大腸桿菌(Shiga toxin-producing Escherichia col i,STEC)能產生強烈毒素,嚴重危害畜禽健康,已成為全球性公共衛生問題的焦點,導致畜牧業經濟損失日趨嚴重[1-2]。雖然抗生素的應用對畜禽致病性大腸桿菌起到了一定的抑制作用,但抗生素的濫用卻導致了大腸桿菌耐藥性的擴散,這使得畜禽疾病的防治更為困難[3]。大腸桿菌的耐藥性分為固有耐藥和獲得耐藥[4]。固有耐藥是由細菌染色體基因決定,而獲得耐藥是指細菌在接觸抗生素后,通過改變代謝途徑使自身不被抗菌藥物殺滅的抵抗力,獲得耐藥可通過耐藥基因的傳代、轉移、傳播、擴散、變異形成高度和多重耐藥[5-6]。大腸桿菌在大量使用非必要抗生素的環境下,易產生耐藥性,并且其耐藥性會隨時間推移大幅度上升,最終導致耐藥菌株的出現[7]。大腸桿菌可通過噬菌體、質粒、轉座子等遺傳因子,使耐藥基因、毒力基因水平轉移至其他菌株[8]。本試驗對豬場大腸桿菌耐藥性和毒力展開研究,旨在闡明抗生素可促進大腸桿菌耐藥性的形成、大腸桿菌毒力基因水平轉移的可能性,以期為豬腸道疾病的防治提供理論依據。
1 材料與方法
1.1藥品和試劑試驗用抗生素,藥敏試紙,置于-20℃冰箱中備用。模式菌株EDL933,MG1655為微生物實驗室保存菌種。Kovacs試劑、甲基紅試劑、Luria-Ber tani(LB)培養基、三糖鐵和麥康凱等培養基所用原料均購自上海生工生物公司。PCR試劑盒、DL2000Marker、LBKan50、O157∶H7大腸桿菌血清試劑盒、DIG核酸檢測試劑盒、ELISA檢測試劑盒均購自寶生物工程(大連)公司。
1.2試驗方法
1.2.1大腸桿菌的分離在杭州市6個規模豬場采集豬糞樣。取6支5 mL滅菌離心管,編號1~6,用滅菌小鑰匙刮取豬大腸內少許糞便,裝入標記好的離心管中并立刻蓋上。采集的樣本經PBS稀釋后分別劃線接種于LB固體培養基,37℃培養24 h,然后各挑取15個單菌落接種于LB液體培養基培養24 h后,于麥康凱固體培養基上劃線培養,進行菌株篩選。取篩選獲得的具大腸桿菌性狀的LB液體培養基中的菌液,穿刺并劃線接種于三糖鐵斜面培養基作進一步觀察。挑取經篩選獲得的菌株各3個,分別接種于LB液體培養基,37℃培養24 h,備用。
1.2.2藥敏試驗采用紙碟法。先制備LB固體培養基平皿,在平皿上均勻涂布菌液。隨后,在該平皿上分別放置含供試抗生素的藥敏紙片。培養皿先正著放在溫箱中培養4 h后,倒置培養20 h,測量抑菌圈的大小,并進行統計,該試驗每個菌株,每種抗生素設3次重復,5個平行。卡那霉素、阿莫西林、鏈霉素、磷霉素、青霉素、氟苯尼考、慶大霉素、強力霉素與四環素等抗生素均購自南京都萊生物公司。
1.2.3最小抑菌濃度(M IC)測定分別取LB液體培養基中500μL各菌液于含4.5 mL LB液體培養基試管中混勻,將要檢測的6種抗生素都配成2 560μg/mL濃度,備用。取96孔培養板,第2~11孔加入用LB液體培養基稀釋好的菌液0.1 mL。然后于第1孔加入抗生素溶液0.2 mL,混合后吸0.1 mL加入第2孔中,用同樣的方法稀釋至第11孔,棄去0.1 mL。各孔中藥物濃度分別為2 560、1 280、640、320、160、80、40、20、10、5、2.5μg/mL。以第一孔作為對照組。37℃培養24 h,以目測法觀察渾濁度,找出第一個澄清的菌液孔,確定為最低抑菌濃度,試驗重復3次。
1.2.4大腸桿菌毒力基因Stx2的檢測取6個采樣點分離鑒定后的大腸桿菌,取單個菌落接種于3 mL的LB液體培養液,37℃培養24 h。熱毒力基因Stx2基因的上游引物:AATAGTATACGGACAGCGAT,下游引物:TCTGACATTCTGGTTGACGC。取0.5μL DNA作為10μL PCR擴增體系的模板,包含1μL的dNTP、0.5μL的上下游引物、0.2μL的Taq聚合酶、1μL的10×PCR Buf fer與6.3μL的滅菌蒸餾水,PCR反應條件為預變性(94℃、10 min)、變性(94℃、30 s)、退火(56℃、30 s)、延伸(72℃、40 s),循環數為30次,72℃最后延伸10 min。PCR反應產物用EB染色后在2%(W/V)的瓊脂糖凝膠電泳檢測,置于紫外檢測儀下觀察。
1.2.5菌落原位雜交篩選轉化形成的Stx2系大腸桿菌將EDL933大腸桿菌和含有慶大霉素的MG1655大腸桿菌在37℃下聯合培養24 h;加入慶大霉素80μg/mL進行培養;對新轉移得到的STEC大腸桿菌進行原位雜交,并且用DIG標簽標記Stx2基因進行原位雜交,將MG1655和經過10倍稀釋過的O157大腸桿菌一起放于80μg/mL慶大霉素的LB培養基上培養;將培養出的200~250個菌落,轉移至硝酸纖維素濾膜;隨后將硝酸纖維素濾膜移至LB-慶大霉素培養基上,在37℃的條件下培養3 h;培養過后,將已干燥的硝酸纖維素濾膜浸于10%的SDS溶液中,然后進行變性溶解和失性溶解,再用2倍的SSC溶液沖洗[17]。將硝酸纖維素濾膜在80℃的條件下烘烤2 h,將交叉結合的DNA與DIG標簽進行雜交結合;帶有Stx2基因的菌落,被DIG核酸檢測試劑盒檢測出來。從培養基中篩選出了3組被標記出的菌落,分別編號PS1、PS2、PS3。
1.2.6PCR證實新轉化形成的出血性大腸桿菌將有甘油冷凍保存的O157∶H7、MG1655大腸桿菌以及可能存在含有Stx2基因的陽性菌株,通過置于LB液體培養基在37℃、通風的條件下,過夜培養復壯。其中,EDL933設為陽性對照,而MG1655設為陰性對照。取200μL的上述過夜培養物在10 000 r/min的條件下離心3 min,然后重新懸浮在200μL無菌水中煮沸15 min。最后從各個菌液中初步提取DNA,取1μL DNA作為25μL PCR擴增體系的模板;而25μL PCR反應體系還包含200μM的dNTP、200 nM的各游引物和一個單位的Taq聚合酶。其中Stx2基因的上游引物序列為:GGCACTGTCTGAAACTGCTCC,下游引物序列為:TCGCCAGTTATCTGACATTCTG,目標序列長度為255 bp, PCR反應產物用EB染色后在2%(W/V)的瓊脂糖凝膠電泳檢測。
1.2.7ELISA檢測Stx2產物通過ELISA檢測試劑盒對新轉化形成的STEC毒性大腸桿菌(PS1、PS2、PS3)的毒力蛋白產物志賀毒素進行檢測,以及對PS1、PS2、PS3進行檢驗,并設立EDL933為陽性對照、MG1655為陰性對照,從而判斷PS1、PS2、PS3的Stx2毒力蛋白產生情況。ELISA的檢測要點為:標本的采取和保存;試劑的準備;加樣;保溫;洗滌;顯色和比色;定性測定。
1.2.8血清型鑒定將由甘油冷凍保存的O157∶H7、MG1655大腸桿菌以及新轉移產生的STEC大腸桿菌,置于LB培養基上,在37℃、透氣的條件下培養復壯。過夜培養后,在100℃的沸水中沸煮30 min,然后用O157∶H7大腸桿菌血清試驗盒來檢測O157血清類型。
1.2.9EDL933、MG1655與PS1-3包含O 157抗原基因的PCR檢測對EDL955大腸桿菌、MG1655大腸桿菌以及PS1、PS2、PS3大腸桿菌,按O157標志性抗原基因的上游引物序列:CGGACATCCATGTGATATGG,下游引物序列:TTGCCTATGTACAGCTAATCC設計引物,序列長度為259 bp,用于檢測大腸桿菌中O157抗原基因的存在情況,通過PCR擴增,之后進行瓊脂糖凝膠電泳以及溴化乙錠染色,最后再紫外檢測儀下觀察并拍照記錄。
2 結果與分析
2.1大腸桿菌的分離將從豬糞便中分離的致病性大腸桿菌,置于LB培養液中培養24 h,培養液呈混濁狀,試管的液面管壁上有菌環和白色沉淀物;在LB固體培養基上可觀察到灰白色、半透明、表面隆起、光滑濕潤、邊緣整齊的圓形菌落,直徑約1~3 mm;在麥康凱培養基上挑取粉紅色的菌落,經三糖鐵培養基培養,篩選出黃色的菌落。六株大腸桿菌分離菌分別通過吲哚試驗、甲基紅試驗、V-P試驗、枸櫞酸鹽利用試驗,鑒定均為大腸桿菌菌株。
2.2藥敏試驗由圖1分析得出,所選取的6組大腸桿菌(每組5個菌)對卡那霉素,阿莫西林、青霉素等抗生素具有耐藥性;對鏈霉素,磷霉素等抗生素具有敏感性。
2.3最小抑菌濃度測定由表1可知,6個采樣點的大腸桿菌對卡那霉素、青霉素都有很高的最小抑菌濃度,但是對于氟苯尼考、慶大霉素、強力霉素和四環素,來自杭州6個不同豬場的大腸桿菌菌株的最小抑菌濃度表現出較大的差異。
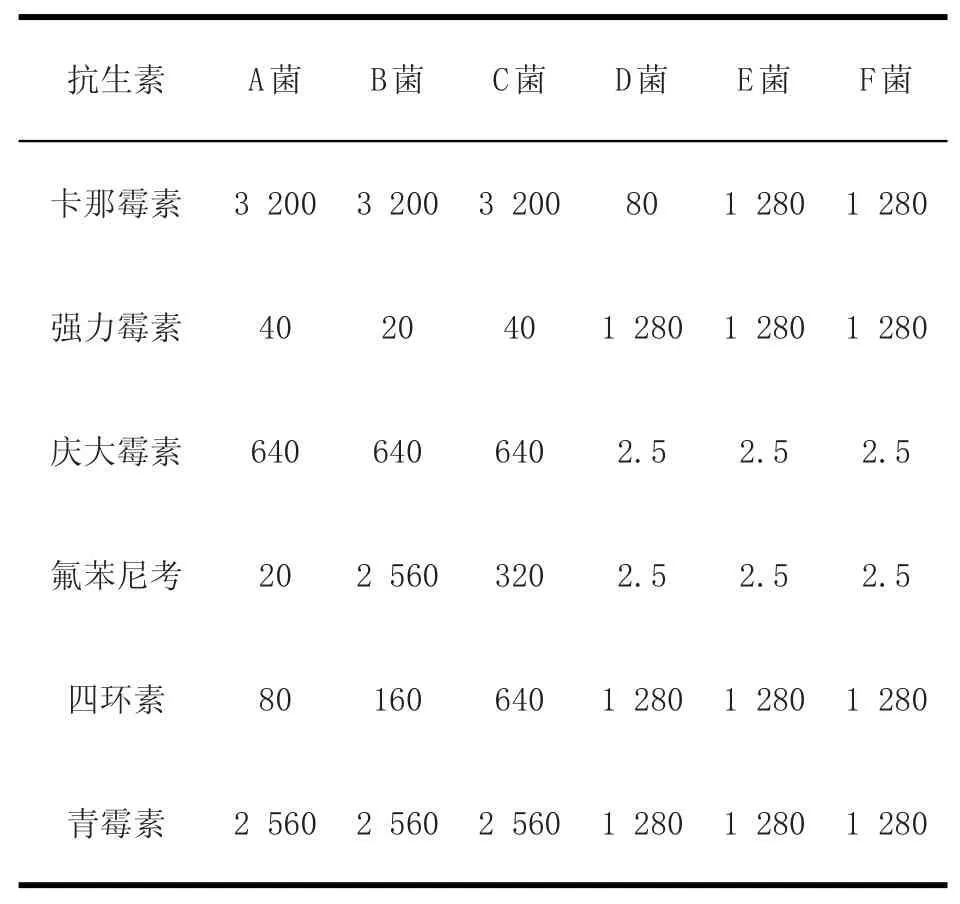
表1 六種抗生素對大腸桿菌的最小抑菌濃度Table1 The m inima l inhibitory concentration to E.co li o f six antibiotics μg/m L
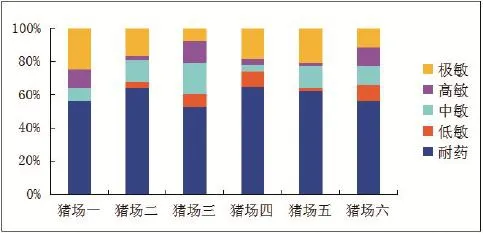
圖1 藥敏試紙試驗結果Fig.1 Drug sensitivity test result
2.4毒力基因S S t t x x22的檢測由圖2可知,用Stx2、Sta、Stb等基因引物分別對六個豬場分離到的大腸桿菌進行PCR測定,其中Stx2基因的序列長度為563 bp;其中有豬場分離得到的大腸桿菌PCR檢測到了Stx2毒力基因。
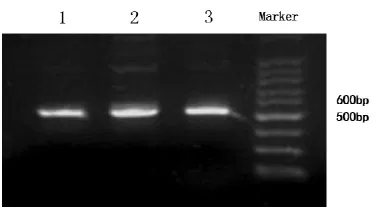
圖2 常規PCR檢測豬場大腸桿菌Stx2圖譜Fig.2 The Stx2 map detected by PCR of E.coli in pig farm in Quzhou
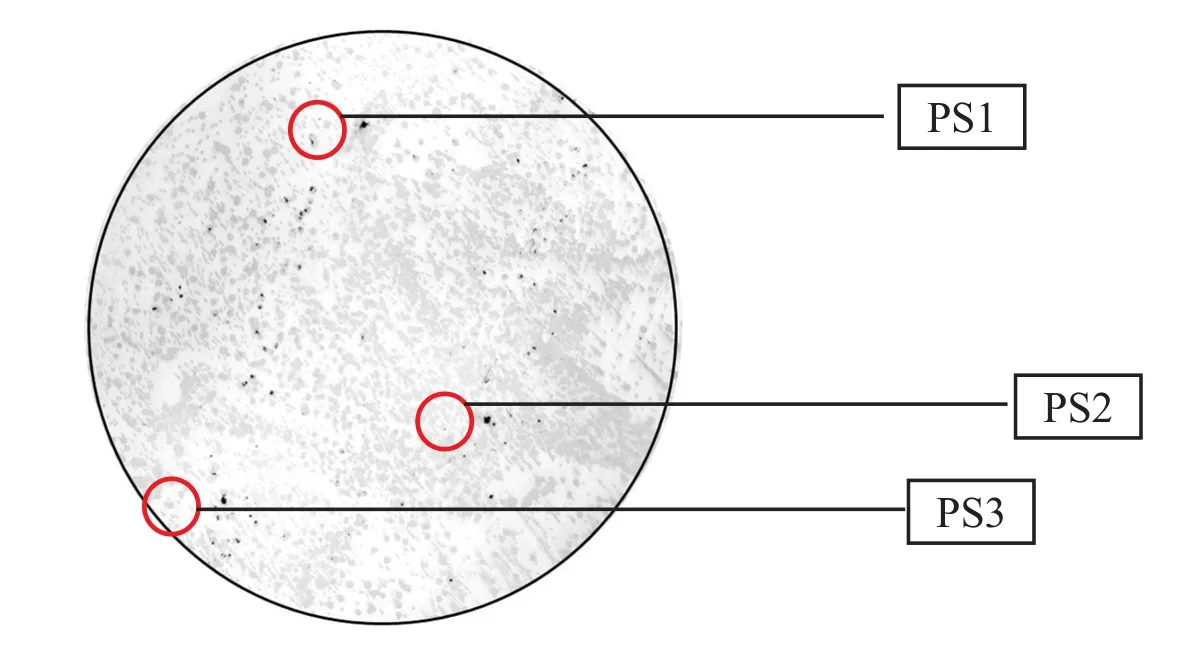
圖3 DIG標簽原位雜交Fig.3 DIG label in situ hybridization
2.5EDL933毒性大腸桿菌與MG1655無毒性大腸桿菌聯合培養由圖3可知,將EDL933毒性大腸桿菌與MG1655無毒性大腸桿菌聯合培養,并將這兩個菌種篩選分離后;用DIG標簽進行原位雜交得到結果,黑點為被DIG標簽所標記出的菌落(水平轉移率約為0.87%);從培養基中篩選出了3個被標記出的菌落,分別編號PS1、PS2、PS3。
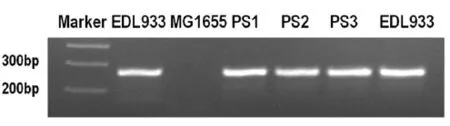
圖4 EDL933毒性大腸桿菌、MG1655無毒性大腸桿菌與PS1-PS3大腸桿菌的Stx2基因Fig.4 The Stx2 o f EDL933,MG1655 and PS1-PS3 detected by PCR
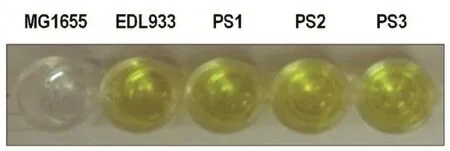
圖5 ELISA試驗結果Fig.5 The ELISA results
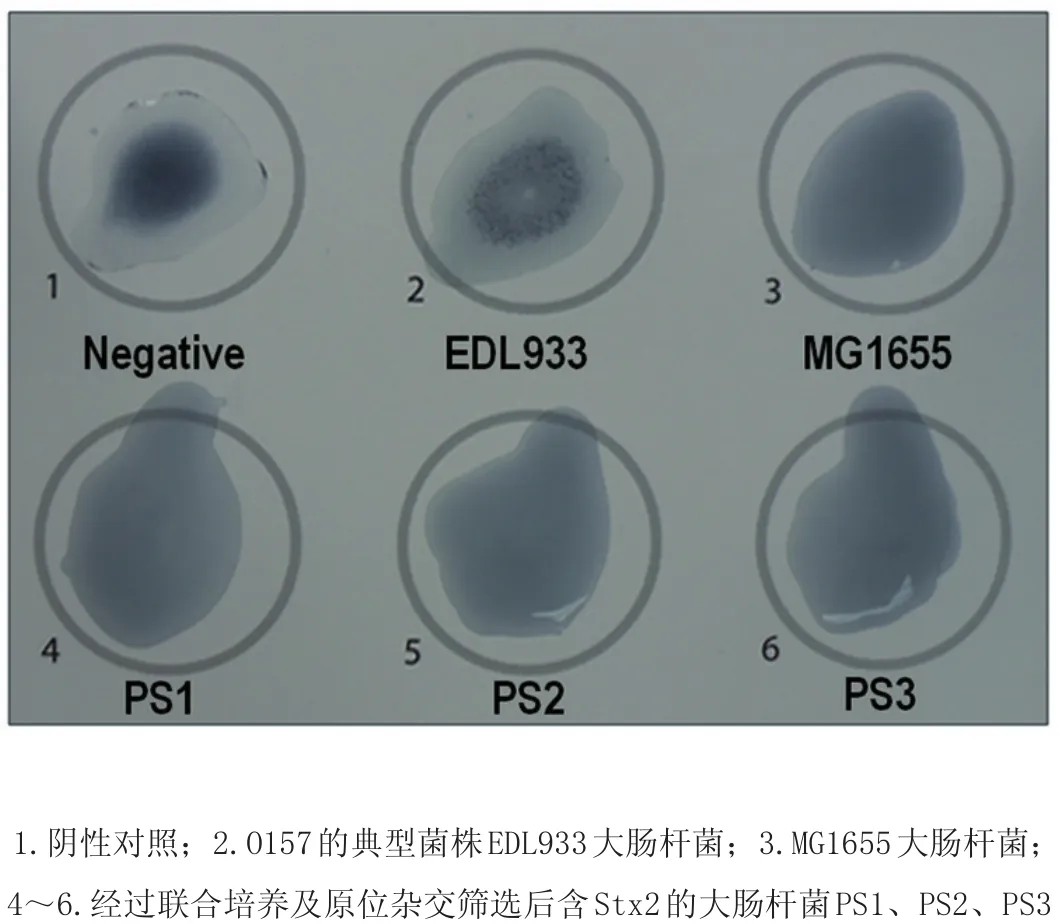
圖6 凝集反應結果Fig.6 The resu lts of agg lutination test
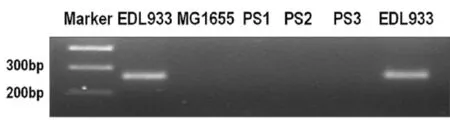
圖7 常規PCR檢測EDL933、MG1655以及PS1-3大腸桿菌中O157抗原基因Fig.7 The O157 antigen gene o f EDL933,MG1655 and PS1-3 E.co li detected by PCR
2.6EDL933、MG1655與PS1--PS3毒力基因的檢測由圖4可知,經過DIG標簽標記篩選得到的PS1、PS2、PS3三個菌落的大腸桿菌與EDL933毒力大腸桿菌都含有Stx2毒力基因。說明Stx2毒力基因水平轉移至MG1655無毒性大腸桿菌。
2.7ELISA試驗由圖5可知,EDL933毒性大腸桿菌及PS1、PS2、PS3大腸桿菌均可產生Stx2毒力蛋白,ELISA試劑盒的檢測結果顯示黃色,表明抗原Stx2基因表達產生的毒力蛋白。證實EDL933大腸桿菌中Stx2基因成功轉移到PS1、PS2、PS3大腸桿菌的基因組中,并在相應菌株中表達后產生毒力蛋白。
2.8凝集反應鑒定由圖6可知,用O157∶H7專用檢測試劑盒,對O157基因進行凝集反應試驗,表明EDL933毒性大腸桿菌發生凝集反應,而PS1、PS2、PS3大腸桿菌以及MG1655大腸桿菌未發生凝集反應;證明EDL933大腸桿菌含有O157抗原基因,而PS1、PS2、PS3大腸桿菌和MG1655大腸桿菌不含有O157抗原基因。說明PS1、PS2、PS3大腸桿菌中的Stx2毒力基因是由EDL933大腸桿菌轉入得到的。
2.9EDL933、MG1655以及PS1、PS2、PS3大腸桿菌的O157抗原基因檢測由圖7可知,用O157抗原基因的特異性引物,對EDL933、MG1655以及PS1、PS2、PS3大腸桿菌進行檢測。PCR反應觀察試驗結果,只有EDL933大腸桿菌中含有O157抗原基因, MG1665大腸桿菌及PS1、PS2、PS3大腸桿菌中均不含O157抗原基因。結合圖6可知,PS1、PS2、PS3大腸桿菌中所具有毒力基因是通過轉移得到的,并非本身含有的;PS1、PS2、PS3大腸桿菌是通過Stx2毒力基因水平轉移得到的新形成的STEC毒性大腸桿菌。
3 討論
大腸桿菌耐藥性不僅嚴重阻礙豬腸道疾病的防控與治療,而且可通過食物鏈將耐藥基因傳遞給人類,危害人類健康[9]。通過基因的水平轉移,獲得外源性基因是加快臨床耐藥菌株產生與擴散的重要原因,SOS介導的誘導毒素合成也使含Stx基因的前噬菌體解離增加,SOS誘導的抗生素的臨床應用可能與STEC疾病相關[10]。有豬場的大腸桿菌攜帶Stx2基因,可能是引起豬場仔豬腹瀉的病原體之一,大腸桿菌攜帶的Stx2基因具有水平轉移的能力,可導致正常的大腸桿菌也攜帶此毒力基因,進而轉化成STEC。在豬場腸道病菌防控方面,首先應改變豬飼料的營養結構,如玉米秸桿發酵飼料及有益微生物復合劑,利用微生物間的拮抗作用,提高豬體的免疫能力[11]。其次在豬飼料中應加入既具有促進豬生長,又能夠取代抗生素的微生態制劑、中草藥、酶制劑等飼料添加劑,減少抗生素的使用量,有效降低大腸桿菌耐藥性的積累[12];最后建立耐藥性的監測系統,根據監測數據指導獸醫臨床合理使用抗生素,采取聯合用藥、交叉用藥、輪換用藥的方法,停止使用那些耐藥水平很高的抗生素,使致病性大腸桿菌的耐藥水平下降[13],同時注意改善豬場環境衛生,對病死豬及其糞便進行無害化處理,防止腸道病菌擴散。
[1]蘇良科,嚴亞賢,陸承平.志賀毒素2型噬菌體Min27的stx2基因突變株構建及其感染特性[J].微生物學報,2008,11(48):1227-1233.
[2]Rey J,Sanehez S,Blanco J E.Prevalence,serotypesandvirulencegenesofShigatoxin-producing Escherichia col i isolated f romovine and caprine milk and other dairy productsinSpain[J].IntJFoodMicrobiol, 2006,107∶212-217.
[3]Mora A,Blanco M,Blanco J E,et al.Phage types and genotypes of shiga toxin-producing Escherichia col i O157∶H7 isolates f rom humansandanimalsinSpain∶Identi f ication andcharacterizationoftwopredominating phage types(PT2 and PT8)[J].J Cl in Microbiol,2004,42(9)∶4007-4015.
[4]嚴亞賢,華修國.大腸桿菌O157:H7的毒力因子的研究進展[J].畜牧與獸醫,2003,18(4):39-42.
[5]楊柳,王思蘆,羅音久.對規模化豬場大腸桿菌耐藥性的調查[J].四川畜牧獸醫,2006,22(5):24-25.
[6]孫鎏國,蔣鎖俊,姚德法.致病性大腸桿菌的耐藥性監測[J].上海畜牧獸醫通訊,2004,21(7):18-20.
[7]黎建平.病原性仔豬大腸桿菌的藥物試驗[J].畜牧獸醫雜志,1999,33(1):32-35.
[8]趙靜,楊漢春.規模化豬場大腸桿菌對耐藥性監測[J].中國獸醫雜志,1998,24(11):12-13.
[9]魏智.仔豬致病性大腸桿菌藥敏試驗[J].福建畜牧獸醫,2000,25(4):9-13.
[10]Kirii Y,Danbara H,Komase K,et al.Detection of enterotoxigenic Escherichia col i by colonyhybridizationwithbiotinylatedenterotoxin probes[J].J Cl in Microbiol,1987, 25(12)∶1962-1965.
[11]朱模忠.獸藥手冊[M].北京:化學工業出版社,2002:42-43.
[12]劉夢,黎建華.微生態制劑在獸藥上的現況解析[J].農民致富之友,2013,15(2):155-156.
[13]ImamovicL,MuniesaM.CharacterizingRecA-Independent Induction of Shiga toxin2-EncodingPhagesbyEDTATreatment[J].PLOS ONE,2012,7(2),e32393.
Study on drug resistance and virulence ofporcine originated Escherichia colistrains
In order to prevent widespread infection of swine intestinal disease ef fectively, Drug resistance and virulence of porcine originated Escherichia col i st rains was studied in the experiment.Resul ts showed that Escherichia coli st rains were resistant to Kanamycin,amoxici ll in,penicil l in antibiotics,etc and sensitivity to st reptomycin,fosfomycin antibiotics,etc. The minimal inhibitory concentration(MIC)of Escherichia coli strains was higher between kanamycin and penici l l in,there were the obvious dif ferences for MIC of Escherichia col i st rains to benzene nicol,f luoride,gentamycin,doxycycl ine and tet racycline.Stx2 gene of Escherichia coli strains EDL933 was successful ly t ransfer red to genome of Escherichia coli st rains PS1,PS2 and PS3 and it expressed in the corresponding st rain,then producing toxic proteins.It reveals that virulence genes of Escherichia col i st rains EDL933 could undergo horizontal transfer,so as to provide scienti f ic basis for intestinal disease prevention and cont rol of swine.
Swine;Escherichia col i;Drug resistance;Virulence
S858.31
B
1672-9692(2016)01-0038-07
2015-11-07
曾俊棋(1990-),男,碩士,從事動物藥理學研究。
岳萬福(1967-),男,博士,副教授,從事動物藥理學研究。
浙江農林大學校科研發展基金(2011FR009)資助。

