外源褪黑激素促進絨山羊皮膚毛囊相關基因表達差異的研究
劉 斌,楊 軍,阿云嘎,烏日格希拉圖,那順其木格,郝巴雅斯胡良,趙存發,李玉榮
(1.內蒙古自治區農牧業科學院,呼和浩特010031; 2.中國科學院昆明動物研究所,昆明 650223;3.鄂托克前旗農牧業局,鄂爾多斯 016200; 4.鄂托克前旗獸醫局,鄂爾多斯 016200;5.鄂托克前旗北極神絨牧業研究所,鄂爾多斯 016200)
?
外源褪黑激素促進絨山羊皮膚毛囊相關基因表達差異的研究
劉 斌1,2,楊 軍3,阿云嘎4,烏日格希拉圖4,那順其木格4,郝巴雅斯胡良5,趙存發1*,李玉榮1*
(1.內蒙古自治區農牧業科學院,呼和浩特010031; 2.中國科學院昆明動物研究所,昆明 650223;3.鄂托克前旗農牧業局,鄂爾多斯 016200; 4.鄂托克前旗獸醫局,鄂爾多斯 016200;5.鄂托克前旗北極神絨牧業研究所,鄂爾多斯 016200)
旨在通過對非長絨期阿爾巴斯型絨山羊進行褪黑激素埋植,研究褪黑激素對羊絨周期性生長的調控,以期借此延長絨山羊毛囊的興盛期,提高羊絨產量。將試驗羊隨機分成兩組:埋植褪黑激素的試驗組(T)和對照組(C),每組3只(試驗組(TI、T2和T3)和對照組(C1、C2和C3)),采集絨山羊的皮膚組織進行組織切片,染色觀察埋植褪黑激素對毛囊生長誘導作用。分別抽提兩組樣本總RNA,逆轉錄合成相應被標記的cDNA探針,采用Agilent綿羊的8×15K規格全基因組表達譜芯片進行雜交,篩選差異表達基因。利用實時熒光定量PCR技術進行驗證。結果表明,從組織學分析可觀察到埋植褪黑激素對毛囊生長具有明顯的促進作用;芯片數據顯示,篩選出差異表達的基因95個,其中61個表達上調、34個下調。GO分析基因數量分布情況:參與分子功能的基因占47.78%,參與生物學過程的基因占33.89%,組成細胞成分的基因占18.33%。與對照組的樣本相比,埋植褪黑激素后相關基因的差異性表達涉及毛囊生長及周圍皮膚附屬物形態發生等生物學過程。這些差異性表達的基因為絨山羊毛囊生長及周期性調控的基因功能研究提供極有價值的參考。
絨山羊;褪黑激素;基因芯片;基因差異表達
內蒙古絨山羊是重要的絨用動物,羊絨被用來制造奢侈針織物,擁有很高的經濟價值。絨山羊的毛被主要分為有髓的粗毛和無髓的絨毛兩種類型,它們分別由初級毛囊和次級毛囊產生,它們在結構和組成上非常相似,而在細度上存在明顯的差別,這種差別的產生是由相應毛囊的形態和尺寸決定的。羊絨的產量主要依賴于羊絨纖維生長的面積和長度,而這些是由次級毛囊的數量和生長周期決定的。因此研究外源褪黑激素(Melatonin,MLT)對絨山羊毛囊生長周期的調控,有利于探究光周期引起的神經——激素調節對于羊絨產量的影響,具有重要的理論意義及指導實際生產的價值。羊絨的差異除了受其遺傳因素影響外,季節性光周期影響羊絨的生長周期[1]。這種具有季節性的現象依賴于光周期對于體內內分泌的調節,松果體受到光照的刺激而分泌褪黑激素引起多種激素的釋放,直接影響羊絨的生長[2-3],因此研究激素對毛囊生長調控至關重要。大多數絨山羊在5~8月份(非長絨期)不長絨,羊絨在8月份開始生長,翌年2月份停止生長,4月底5月初開始脫落[4]。發生這種現象的原因可能是絨山羊神經系統受到短日照的刺激而產生一系列激素,作用于皮膚毛囊而調控羊絨的生長。褪黑激素分泌主要受光照影響,表現出明顯的“晝低夜高”節律變化,是調控毛皮動物毛發生長發育的主要因子[5-6]。體外培養下,MLT與催乳素(Prolactin,PRL)均具有促毛囊延伸的作用,外源MLT埋植于動物皮下可促進絨山羊在非產絨季節和產絨季節長絨,從而達到四季長絨,并顯著增加產絨量的目的。本研究系利用基因表達譜芯片技術,對埋植MLT絨山羊和正常對照絨山羊皮膚組織的差異表達基因進行篩選,探討兩種皮膚組織表達基因的差異及其可能的分子生物學規律,以期為進一步研究絨山羊絨毛生長機理提供理論基礎。
1 材料與方法
1.1 試驗動物及組織的處理
本研究在內蒙古鄂爾多斯市鄂托克前旗絨山羊增絨技術示范區進行試驗。選擇內蒙古白絨山羊(阿爾巴斯型)作為研究對象,在同一資源群體的同一品系群挑選體重差異不大、體況良好、繁殖性能正常的2周歲半同胞母羊3對,共6只。受試羊分為試驗組(3只,編號T1、T2、T3)采用埋植褪黑激素的方法進行增絨試驗,對照組(3只,編號C1、C2、C3)采用常規放牧飼養管理(每對同父本母羊分別進入試驗組和對照組)。參考已有的報道[7]并結合本團隊前期的研究結果,5月份按照2 mg·kg-1BW的劑量在耳后皮下埋植褪黑激素。所有羊采用常規放牧飼養管理,自由采食、飲水。6月份采集皮膚樣品,在體側部采取2.0 cm2左右的皮膚樣品,液氮中冷凍,-80 ℃冰箱保存備用。皮膚樣品除一部分留作基因芯片分析外,剩余皮膚組織制備石蠟切片,組織被二甲苯處理、酒精脫水后以石蠟包埋,于切片機上切成7 μm,進行伊紅——蘇木素(Sigma)染色,用顯微鏡觀察毛囊組織形態。
1.2 皮膚組織樣品RNA的提取、基因芯片雜交與數據分析
Trizol (Invitrogen,Gaithersburg,MD,USA)一步法提取皮膚組織塊中的總RNA,過柱純化,以Total RNA為模板進行反轉錄,以 Random Primer為引物進行KLENOW酶標記,標記產物用 PCR NucleoSpinExtract II Kit (MN)純化,純化后抽干。Cy5標記試驗組樣本,Cy3標記對照組樣本。采用Agilent 公司的G2519F綿羊基因表達譜芯片(芯片雜交試驗由北京基因芯片國家工程研究中心暨博奧生物有限公司協助完成),芯片規格8×15K,含有15 208個綿羊基因的表達譜芯片,該芯片無組織特異性,該芯片設計基于綿羊序列信息來自RefSeq、Goldenpa th、Ensembl和Unigene 等不同數據庫已知的基因信息,代表基因和轉錄本信息。芯片用Agilent G2565CA Microarray Scanner進行掃描,得到雜交圖片。采用Feature Extraction圖像分析軟件對芯片圖像進行分析,把圖像信號轉化為數字信號。對原始數據先用Lowess(Locally weighted scatterplot smoothing)等方法對信號值進行歸一化處理后,以Fold change>2倍或<0.5倍的標準進行差異基因篩選。若有3個以上生物學重復樣本,用SAM(Significance Analysis of Microarrays)軟件進行差異基因的分析[8]。
1.3 qRT-PCR驗證
利用實時定量PCR技術可以驗證埋植褪黑激素的絨山羊和自然條件下絨山羊皮膚組織的基因表達的差異。根據基因芯片分析的結果,從差異顯著的基因中挑選出具有代表性的兩個基因CSN2和PAX6進行qRT-PCR驗證。基因擴增所需引物的設計及制備依照表1列出的相關信息。RNA的提取同1.2。以GAPDH作為內參基因進行Real-time PCR 擴增。采用SYBR Green I熒光染色法測定各基因的相對定量表達。每個樣品至少3個重復,結果轉化為循環閾值(Ct)的相對擴增倍數。兩個樣本間的基因表達差異用 2-ΔΔCt的方法計算。
表1 qRT-PCR驗證試驗涉及基因的引物設計及相關信息
Table 1 Primer design and related information of qRT-PCR
2 結 果
2.1 組織學分析
為了保證組織切片結果與基因芯片分析的一致性,組織切片樣本來自用于基因芯片分析的同一塊皮膚組織。即埋植MLT以及自然光周期條件下絨山羊體側皮膚組織,從組織切片的形態上可以明顯看出經過埋植MLT后,非長絨期絨山羊皮膚中初級毛囊與次級毛囊數量顯著增多,尺寸增大,并向皮下延伸,毛囊增長,毛乳頭膨大,顯示出明顯的興盛期毛囊的形態特征(圖1 A);而自然光周期條件下,絨山羊的皮膚切片中,毛囊在形態上沒有生長活動的跡象,毛囊萎縮,一些毛囊中存在角質化毛干及空腔,顯示出休止期的形態特征(圖1 B)。從組織形態來看,埋植MLT對于毛囊進入興盛期具有明顯的誘導作用。
2.2 分層聚類分析
研究埋植MLT與正常光周期條件下,絨山羊皮膚及毛囊中相似的蛋白質編碼基因的表達模式的差異,采用Agilent 公司的G2519F綿羊基因表達譜芯片(8×15K),含有15 208個綿羊基因。通過埋植MLT條件下飼養的阿爾巴斯絨山羊體側皮膚樣本,與正常光周期絨山羊的皮膚樣本的芯片數據相比較,對原始數據用Lowess方法進行歸一化處理后,運用散點圖對數據的變異和誤差進行歸一化。散點圖反映數據歸一化以及表達差異分析的變化和誤差(圖2A~C)。進一步通過分層聚類的方法分析這些基因差異性表達(圖2D)。
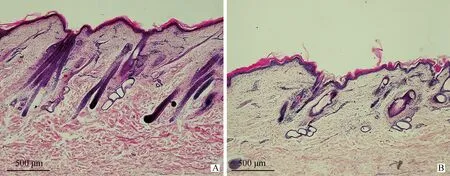
石蠟組織縱切切片蘇木素-伊紅染色。A.埋植MLT組;B.對照組。比例尺:500 μmLongitudinal section stained by hematoxylin-eosin.A.MLT embedment group;B.Control group.Scale bar:500 μm圖1 阿爾巴斯型絨山羊體側皮膚組織毛囊形態Fig.1 Hair follicle morphogenesis of body side skin tissue in ALPAS Cashmere goat
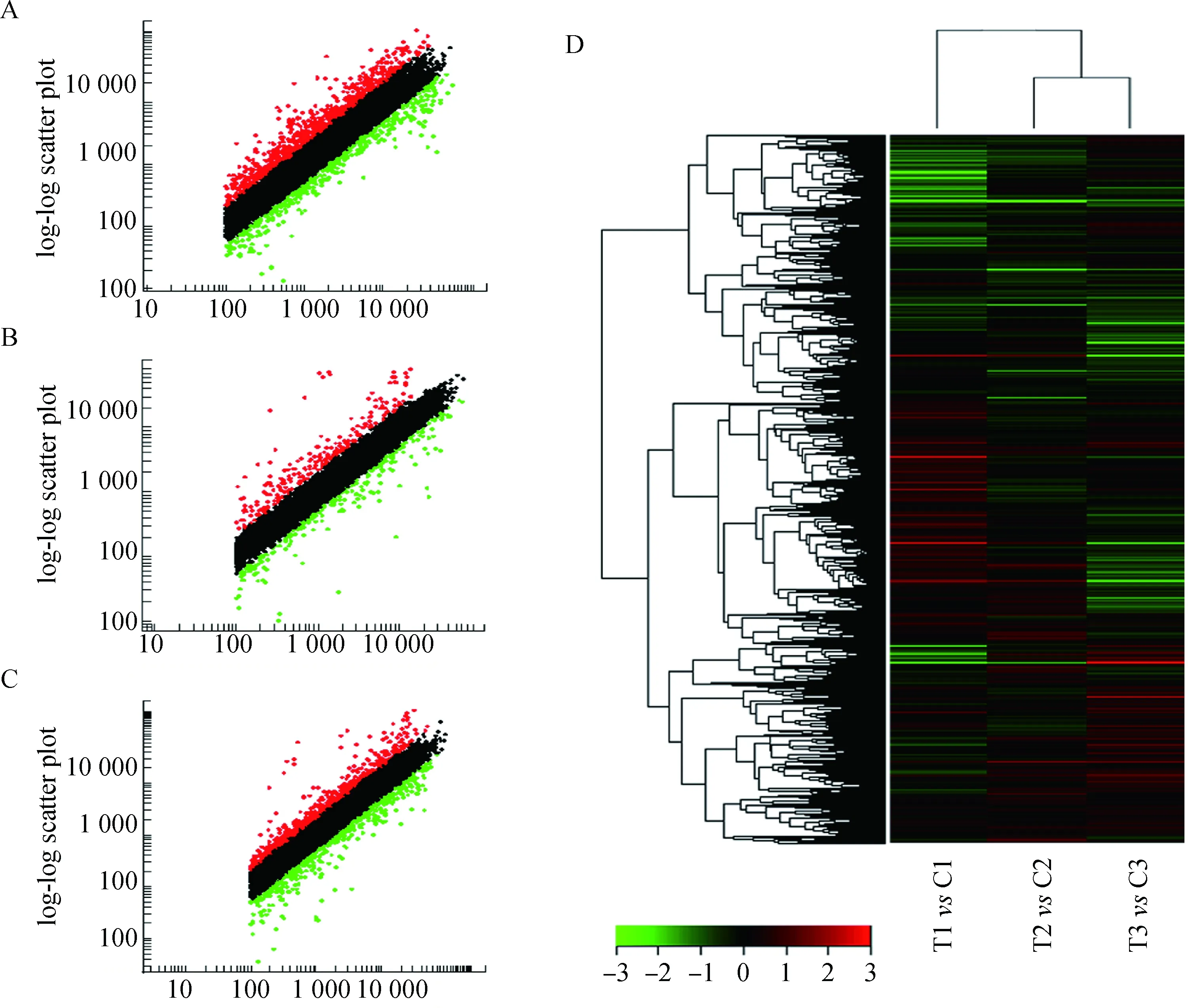
A~C.MLT埋植組與對照組3組樣本基因芯片散點圖;A. T1 vs C1; B. T2 vs C2; C. T3 vs C3; D.基因差異性表達的聚類圖譜,紅色表示埋植MLT試驗組(T1、T2、T3)相對于對照組(C1、C2、C3)表達上調,綠色表示埋植MLT試驗組(T1、T2、T3)相對于對照組(C1、C2、C3)表達下調A-C.Scatter plot;A. T1 vs C1; B. T2 vs C2; C. T3 vs C3; D.Hierarchical clustering analyses:The red color indicated the up-regulation of gene expression in the MLT group (T1,T2,T3) compared to that of the control group (C1,C2,C3).The green color indicates the down-regulation of genes圖2 基因芯片散點圖及分層聚類分析Fig.2 Visualization of clustered microarray data
2.3 Gene Ontology (GO) 分析
差異表達(Fold change≥2或≤0.5)基因95個,其中表達上調(≥2)基因61個和共同下調(≤0.5)基因34個。基于數據庫中基因的注釋情況,試圖尋找這些差異性表達的基因與山羊毛囊的生長調控相關性。GO分析結果顯示,埋植MLT條件下飼養的阿爾巴斯絨山羊相對于正常光周期基因表達的功能聚類。主要分為3大類:分子功能(47.78%)、生物學過程(33.89%)和細胞組成(18.33%)。6月份埋植MLT與正常對照絨山羊皮膚中差異表達基因具體信息見圖3。
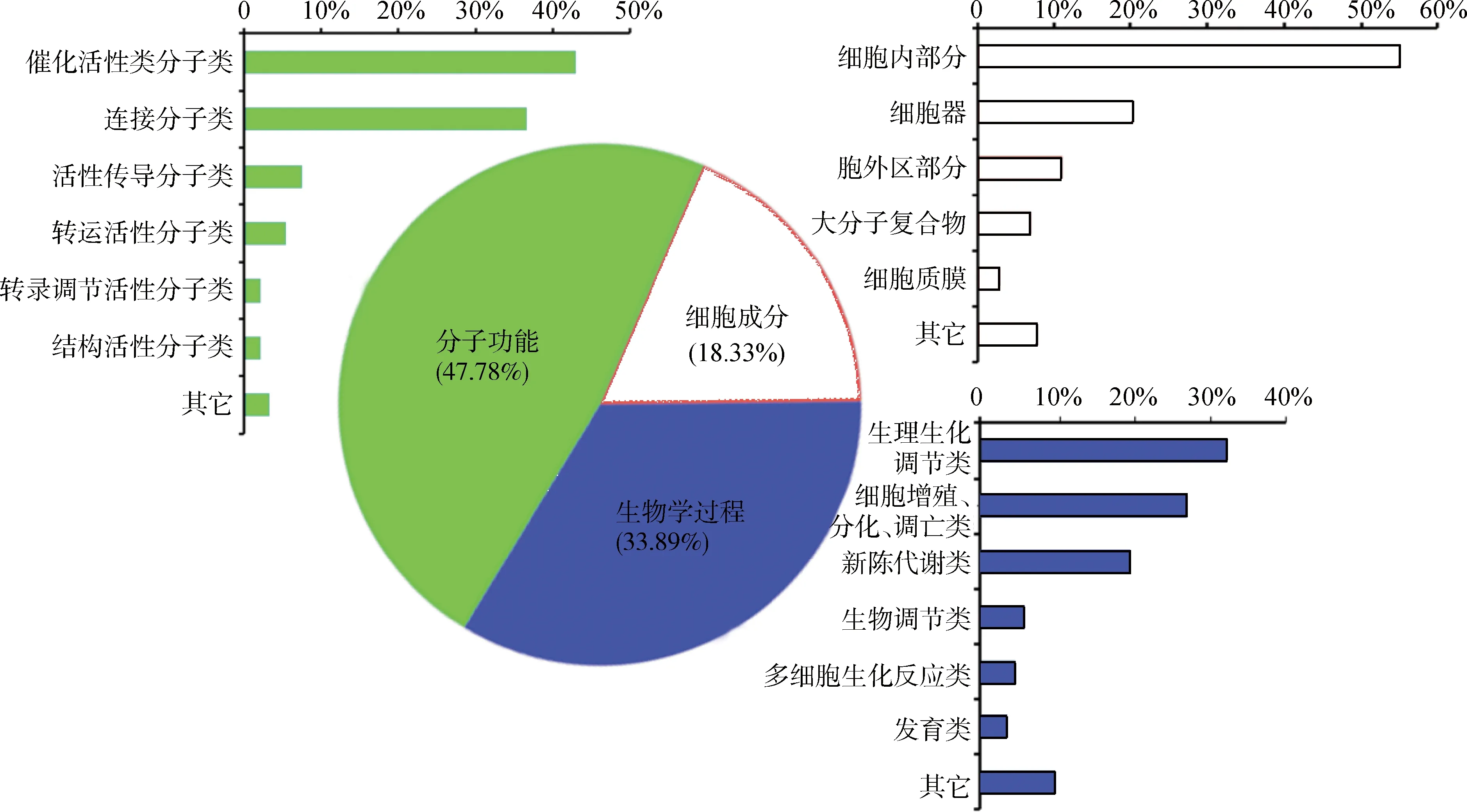
圖3 絨山羊差異表達基因的GO分析結果Fig.3 GO analyzing result of differentially expressed genes in Cashmere goat
2.4 差異表達基因分析結果
由于目前大多數基因還未得到詳細的注釋。根據已有的注釋,篩選出19個基因,其中9個上調,10個下調(表2,表3),可能涉及毛囊生長的不同階段。顯示出埋置MLT條件下,誘導絨山羊毛囊基因產生了差異性表達,從而影響毛囊自然的周期性活動,使毛囊提前進入興盛期,延長了羊絨的生長周期,達到增絨的目的。
2.5 qRT-PCR檢測
選取基因芯片數據中表達差異較明顯的2個基因PAX6和CSN2進行qRT-PCR檢測(圖4),對比分析這些基因的表達模式,雖然所選2個基因的mRNA 表達水平的變化與芯片的檢測結果顯示的表達倍數略有差別,但是二者的變化趨勢是一致的,反映基因芯片分析結果的可靠性。
3 討 論
關于褪黑激素對羊毛生長的影響,已有很多相關報道[9-10],但主要涉及組織學及相關基因分子生物學分析,缺少系統性的大量相關基因的研究。褪黑激素(MLT)是一種神經內分泌激素,在視交叉上核和外圍組織的協同下由松果體分泌[11-12]。MLT可以調節細胞內的過程(G蛋白)和第二信使的活動(例如cAMP、IP3、Ca2+)。在神經發育中,褪黑激素作為一個重要的細胞內信號調控基因表達。皮膚及毛囊附屬物(毛發、指甲、牙齒等)在胚胎發育過程中起源于外胚層細胞,與神經細胞是同源的,因此MLT對于皮膚及毛囊的調控模式也極有可能與其對神經發育相似。本研究在差異表達的基因中,NPY2R(神經肽Y受體)、ADCYAP1(腺苷酸環化酶活性肽)顯著上調,說明這兩種基因參與外源MLT引起的信號轉導過程,但對于下游基因以及毛囊再生調控的作用還需要進一步研究。
毛囊發育和再生受到各種生長因子、激素和信號分子的嚴格調控,Wnt信號通路是最重要的途徑之一[13-14]。Wnt蛋白信號通路及相關的分子信號轉導調控毛囊生長的周期性活動,作為其中關鍵一環,CTNNB1(β-catenin)是一種多功能的蛋白質,主要為介導細胞間黏附并參與基因的表達,其表達決定毛囊發育及再生的命運[15]。β-catenin是毛發形成中不可缺少的調節因子,并促進毛囊干細胞從休止期進入興盛期,進而啟動毛發周期[16]。在人類及小鼠的研究中已經證實Wnt/β-catenin途徑對于毛囊及牙齒的發育至關重要[17]。本研究數據分析顯示,相對于對照組羊皮膚組織,埋植MLT試驗組絨山羊樣本中CTNNB1(β-catenin)基因的表達差異極顯著,3組重復均顯示較高的表達比率。可以推測,Wnt/β-catenin信號通路響應非長絨期埋植MLT引起的一系列信號轉導,從而促進絨山羊絨毛進入興盛期,這一途徑可能是外源MLT引起羊絨生長的關鍵因素。
表2 絨山羊毛囊生長相關的上調基因
Table 2 The up-regulated genes related to Cashmere goat hair follicle growth
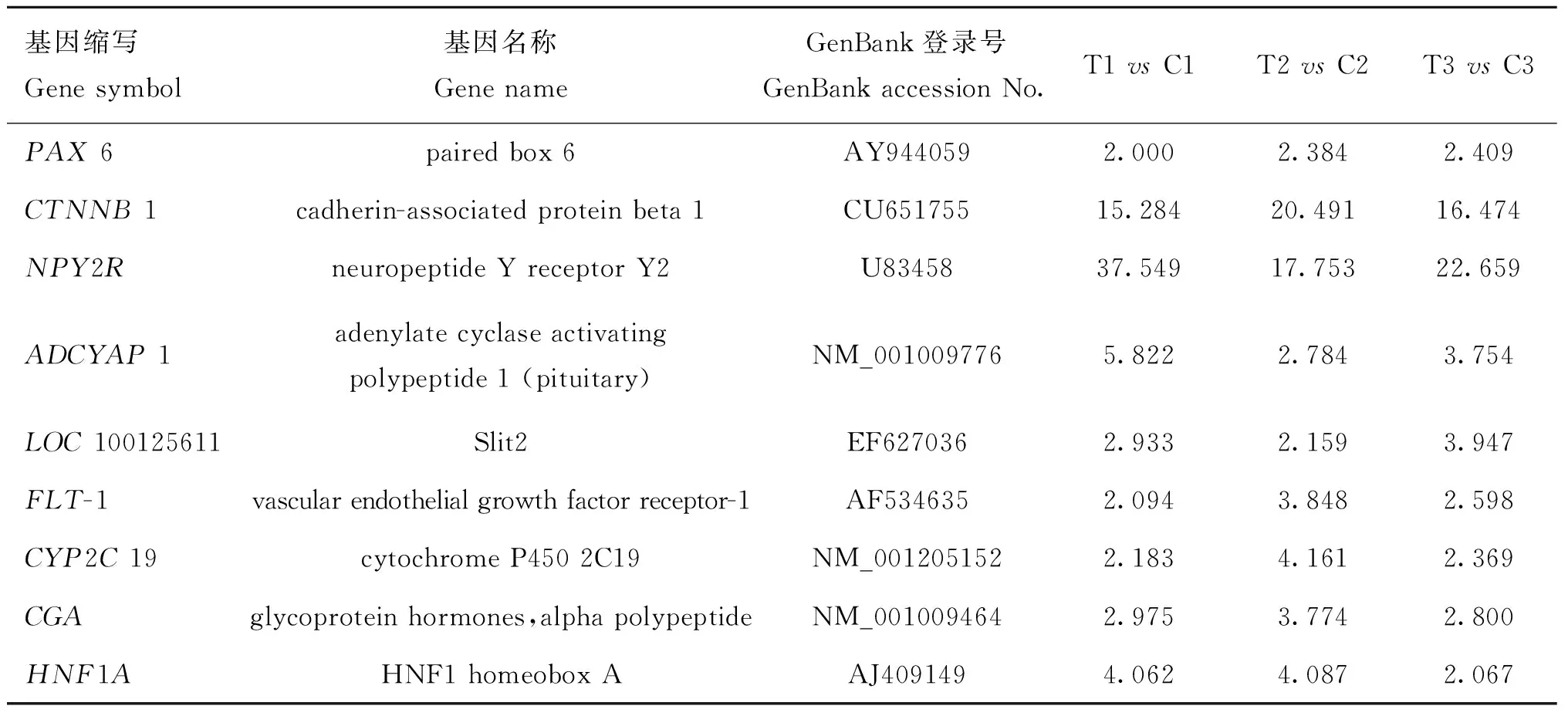
基因縮寫Genesymbol基因名稱GenenameGenBank登錄號GenBankaccessionNo.T1vsC1T2vsC2T3vsC3PAX6pairedbox6AY9440592.0002.3842.409CTNNB1cadherin-associatedproteinbeta1CU65175515.28420.49116.474NPY2RneuropeptideYreceptorY2U8345837.54917.75322.659ADCYAP1adenylatecyclaseactivatingpolypeptide1(pituitary)NM_0010097765.8222.7843.754LOC100125611Slit2EF6270362.9332.1593.947FLT-1vascularendothelialgrowthfactorreceptor-1AF5346352.0943.8482.598CYP2C19cytochromeP4502C19NM_0012051522.1834.1612.369CGAglycoproteinhormones,alphapolypeptideNM_0010094642.9753.7742.800HNF1AHNF1homeoboxAAJ4091494.0624.0872.067
表3 絨山羊毛囊生長相關的下調基因
Table 3 The down-regulated genes related to Cashmere goat hair follicle growth
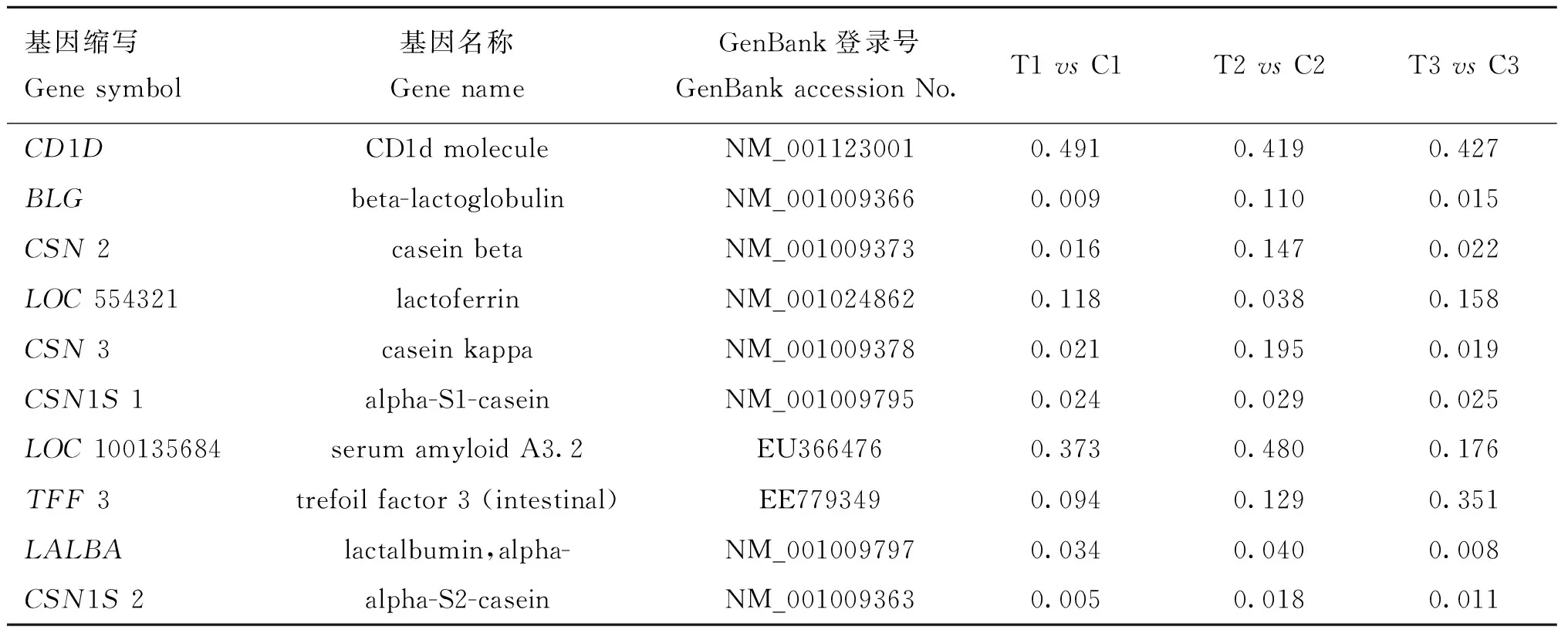
基因縮寫Genesymbol基因名稱GenenameGenBank登錄號GenBankaccessionNo.T1vsC1T2vsC2T3vsC3CD1DCD1dmoleculeNM_0011230010.4910.4190.427BLGbeta-lactoglobulinNM_0010093660.0090.1100.015CSN2caseinbetaNM_0010093730.0160.1470.022LOC554321lactoferrinNM_0010248620.1180.0380.158CSN3caseinkappaNM_0010093780.0210.1950.019CSN1S1alpha-S1-caseinNM_0010097950.0240.0290.025LOC100135684serumamyloidA3.2EU3664760.3730.4800.176TFF3trefoilfactor3(intestinal)EE7793490.0940.1290.351LALBAlactalbumin,alpha-NM_0010097970.0340.0400.008CSN1S2alpha-S2-caseinNM_0010093630.0050.0180.011
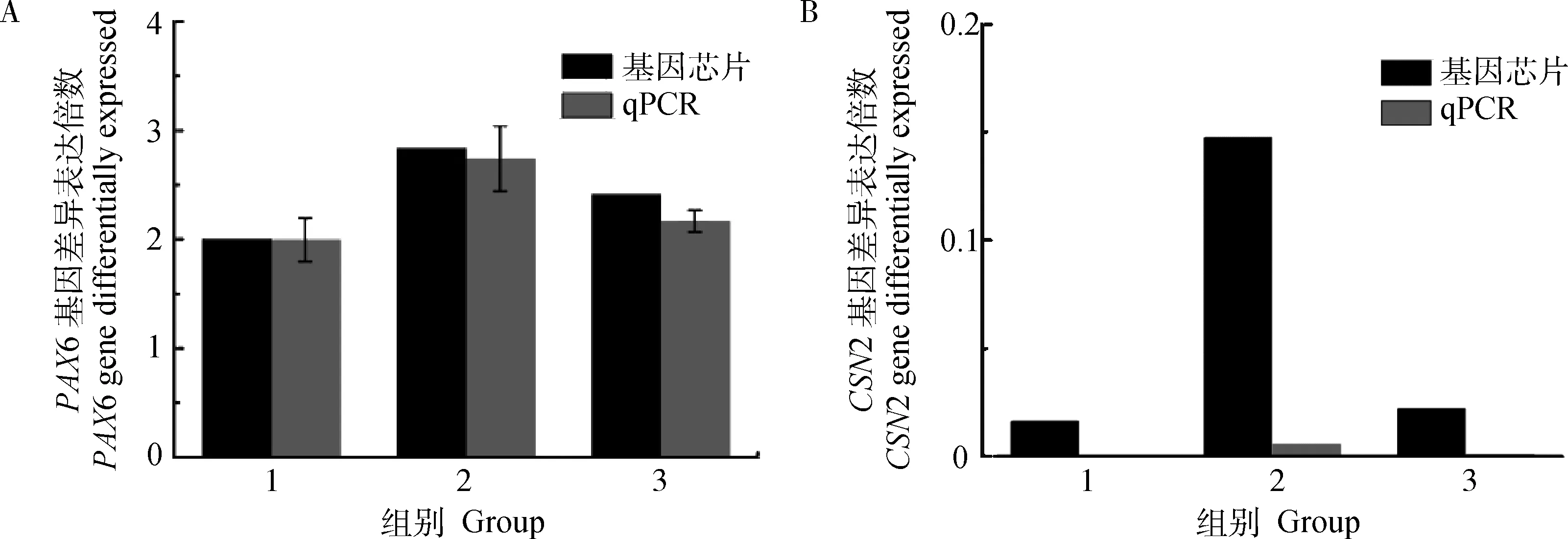
1. T1 vs C1; 2.T2 vs C2; 3. T3 vs C3圖4 qRT-PCR檢測基因差異表達倍數Fig.4 qRT-PCR verification results
本研究結果分析表明,PAX6具有明顯的表達上調。PAX6 是一個功能復雜的蛋白,參與細胞的許多生命活動,PAX6基因編碼的轉錄因子在動物胚胎從區域化到細胞類型分化的不同發育過程中起著重要作用。在細胞強烈增殖時,PAX6表達作為轉錄因子定位于細胞核內,而PAX6遷移至細胞質,喪失了轉錄因子的調節作用,表明PAX6可能轉錄調節下游的因子從而發揮調節細胞增殖的作用。PAX6 在神經系統的發育起重要調節作用[18],而毛囊在發育上起源于外胚層細胞,與神經系統是同源的,因此絨山羊毛囊周期性再生極有可能與PAX6調控神經系統發育有著相似的機制,而這一過程與MLT的分泌存在密切的相關性。CYP1A1(Cytochrome P4501A1)在小鼠皮膚中有少量的表達,相比之下更強的信號被發現于毛囊周圍的皮脂腺中[19]。本研究發現埋植MLT的試驗組山羊皮膚毛囊樣本中CYP2C19顯著上調,這可能與毛囊興盛期中,毛的生長活動以及毛囊附屬物相關結構的構建有關,這一現象還需要進行更加深入的研究。在發育過程中,VEGF(Vascular endothelial growth factor)參與調節血管的形成。VEGFR-2(Vascular endothelial growth factor receptor-2)存在于人類毛囊、皮脂腺、汗腺等細胞中,在毛囊的生長中發揮重要作用[20],表達于毛囊隆突部[21]并與K15、K19的陽性信號相關。但是VEGF對于羊毛生長的作用,目前還沒有明確的報道。本研究結果顯示,MLT埋置組毛囊興盛期皮膚中FLT1(Vascular endothelial growth factor receptor-1,VEGFR-1)差異性表達,VEGFR-1可能參與絨山羊毛囊的周期性重建,值得進一步深入研究。
4 結 論
本研究結果表明,在埋植MLT條件下參與絨山羊皮膚毛囊生長過程的基因會被調動起來,對比自然條件下的樣本發生差異性表達,這些基因中包括許多參與毛囊生長及毛囊周邊皮膚附屬物構建相關的基因,尤其是CTNNB1的表達,毛囊進入興盛期的主要原因可能是外源MLT引發一系列分子信號的轉導激活WNT/β-catenin途徑,決定毛囊進入興盛期,但其具體的分子機理是仍需進行更加深入的研究。本研究結果為褪黑激素相關信號通路對于毛囊生長的促進作用的分子機制提供證據,并為人工增絨方法在畜牧業生產中的實際應用提供理論依據。
[1] MCGREGOR B A.Nutrition,management and other environmental influences on the quality and production of mohair and cashmere:A review with particular reference to mediterranean and annual temperate climatic zones[J].SmallRuminRes,1998,28(3):199-215.
[2] GEBBIE F,FORSYTH I,ARENDT J.Effects of maintaining solstice light and temperature on reproductive activity,coat growth,plasma prolactin and melatonin in goats[J].JReprodFertil,1999,116(1):25-33.
[3] IBRAHEEM M,GALBRAITH H,SCAIFE J,et al.Growth of secondary hair follicles of the Cashmere goatinvitroand their response to prolactin and melatonin[J].JAnat,1994,185(Pt 1):135-142.
[4] 王 瀟,尹 俊.內蒙古白絨山羊毛囊干細胞巢的間接定位[J].農業生物技術學報,2014,22(3):326-332. WANG X, YIN J.Indirect location of hair follicle stem cell niche in Inner Mongolia White Cashmere goat[J].JournalofAgriculturalBiotechnology,2014,22(3):326-332.(in Chinese)
[5] MOELLMANN G,LERNER A B,HENDEE J R.The mechanism of frog skin lightening by acetylcholine[J].GenCompEndocrinol,1974,23(1):45-51.
[6] REPPERT S M,WEAVER D R,RIVKEES S A,et al.Putative melatonin receptors in a human biological clock[J].Science,1988,242(4875):78-81.
[7] CONG Y,DENG H,FENG Y,et al.Melatonin implantation from winter solstice could extend the cashmere growth phase effectively[J].SmallRuminRes,2011,99(1):48-53.
[8] TUSHER V G,TIBSHIRANI R,CHU G.Significance analysis of microarrays applied to the ionizing radiation response[J].ProcNatlAcadSci,2001,98(9):5116-5121.
[9] GHOSH S,SINGH A K,HALDAR C.Seasonal modulation of immunity by melatonin and gonadal steroids in a short day breeder goat capra hircus[J].Theriogenology,2014,82(8):1121-1130.
[10] ZHANG Q,LI J,CHEN Y,et al.Growth and viability of Liaoning Cashmere goat hair follicles during the annual hair follicle cycle[J].GenetMolRes,2014,13(2):4433-4443.
[11] FOULKES N S,ASSONE-CORSI P,BORJIGIN J,et al.Rhythmic transcription:the molecular basis of circadian melatonin synthesis[J].TrendsNeurosci,1997,20(10):487-492.
[12] LANOIX D,BEGHDADI H,LAFOND J,et al.Human placental trophoblasts synthesize melatonin and express its receptors[J].JPinealRes,2008,45(1):50-60.
[13] LI Y H,ZHANG K,YANG K,et al.Adenovirus-mediated Wnt10b overexpression induces hair follicle regeneration[J].JInvestDermatol,2013,133(1):42-48.
[14] MYUNG P S,TAKEO M,ITO M,et al.Epithelial Wnt ligand secretion is required for adult hair follicle growth and regeneration[J].JInvestDermatol,2013,133(1):31-41.
[15] CHEN D,JARRELL A,GUO C,et al.Dermal β-catenin activity in response to epidermal Wnt ligands is required for fibroblast proliferation and hair follicle initiation[J].Development,2012,139(8):1522-1533.
[16] ALONSO L,FUCHS E.Stem cells in the skin:waste not,Wnt not[J].GenesDev,2003,17(10):1189-1200.
[17] WANG B,LI H,LIU Y,et al.Expression patterns of WNT/β-CATENIN signaling molecules during human tooth development[J].JMolHist,2014,45(5):487-496.
[18] MAEKAWA M,TAKASHIMA N,ARAI Y,et al.Pax6 is required for production and maintenance of progenitor cells in postnatal hippocampal neurogenesis[J].GenesCells,2005,10(10):1001-1014.
[19] ROWE J M,WELSH C,PENA R N,et al.Illuminating role of CYP1A1 in skin function[J].JInvestDermatol,2008,128(7):1866-1868.
[20] MAN X Y,YANG X H,CAI S Q,et al.Expression and localization of vascular endothelial growth factor and vascular endothelial growth factor receptor-2 in human epidermal appendages:a comparison study by immunofluorescence[J].ClinExpDermatol,2009,34(3):396-401.
[21] WU X J,ZHU J W,JING J,et al.VEGF 165 modulates proliferation,adhesion,migration and differentiation of cultured human outer root sheath cells from central hair follicle epithelium through VEGFR-2 activationinvitro[J].JDermatolSci,2014,73(2):152-160.
(編輯 程金華)
Exogenous Melatonin Promotes Expression Differences of Skin Hair Follicles Related Genes in Cashmere Goat
LIU Bin1,2,YANG Jun3,A Yun-ga4,WU Ri-gexilatu4,NA Shun-qimuge4,HAO Ba-yasihuliang5,ZHAO Cun-fa1*,LI Yu-rong1*
(1.InnerMongoliaAcademyofAgricultural﹠AnimalHusbandrySciences,Hohhot010031,China;2.KunmingInstituteofAnimalScience,ChineseAcademyofSciences,Kunming650223,China;3.EtuokeqianqiBureauofAgricultureandAnimalHusbandry,Erdos016200,China;4.EtuokeqianqiBureauofVeterinary,Erdos016200,China;5.EtuokeqianqiArcticGodResearchInstituteofCashmereandLivestock,Erdos016200,China)
Effects of embedding melatonin for Arbas Cashmere goats in telogen phase on control of cashmere growth cycle were conducted in order to extend anagen phase and increase the cashmere production. Cashmere goats were selected and randomly divided into 2 groups,each group with 3 goats( the experiment group (T1,T2,T3) and the control group (C1,C2,C3)). Skin tissues of the treatment and control groups were taken and tissue sections were observed for the influence of embedding melatonin on the induction of hair follicle growth. The total RNA was extracted from the 2 groups of samples and synthesized marked cDNA probes by reverse transcription, and had microarray hybridization on 8×15 K(Agilent) sheep genome-wide expression profile to screen differentially expressed genes. The results were verified by real-time fluorescent quantitative PCR technology. Histological analysis showed that embedding melatonin could obviously promote hair follicle growth. Microarray data showed that there were 95 differently expressed genes, including 61 up-regulated and 34 down-regulated. GO analysis indicated that the genes of 47.78% participated in the molecular function, those of 33.89% were involved in biological processes, and those of 18.33% were associated with the composition of cell. Compared with the control groups, differential expression of related genes in treatment groups were involved in the hair follicle morphogenesis and biological processes of surrounding skin appendages. These differently expressed genes provide valuable reference to research Cashmere goat hair follicle growth and the function of the cyclical controlling genes.
Cashmere goat;melatonin;gene microarray;gene differential expression
10.11843/j.issn.0366-6964.2016.11.008
2016-04-01
內蒙古自治區自然科學基金項目(2014BS0333);國家自然科學基金項目(31260545);國家公益性行業(農業)科研專項(201303059);內蒙古農牧業科學院青年創新基金項目(2013QNJJM05)
劉 斌(1979-),男,博士,副研究員,主要從事絨毛用羊分子數量遺傳育種研究,E-mail:liubin0613@126.com
*通信作者:趙存發,研究員,主要從事絨毛用羊遺傳育種研究,E-mail:zhaocunfa@163.com;李玉榮,研究員,主要從事絨毛用羊遺傳育種研究,E-mail:yurong622003@126.com
S827.2
A
0366-6964(2016)11-2210-08

