成體小鼠心臟Sca-1+細(xì)胞體外分化潛能的實(shí)驗(yàn)研究
王 浩, 陳 浩, 張海波, 周春霞
上海交通大學(xué)醫(yī)學(xué)院附屬上海兒童醫(yī)學(xué)中心心臟外科,上海 200127
?
·論 著·
成體小鼠心臟Sca-1+細(xì)胞體外分化潛能的實(shí)驗(yàn)研究
王 浩, 陳 浩, 張海波, 周春霞*
上海交通大學(xué)醫(yī)學(xué)院附屬上海兒童醫(yī)學(xué)中心心臟外科,上海 200127
目的: 研究成體小鼠心臟Sca-1+細(xì)胞體外誘導(dǎo)分化的潛能。方法: 利用免疫磁珠分選法分離成體小鼠心臟Sca-1+細(xì)胞,通過BMP-2/FGF-4,TGF-β1及VEGF165等三種不同的體外誘導(dǎo)方法使其向心臟“三系”分化,并從細(xì)胞形態(tài)的變化、RT-PCR和免疫熒光染色等方面鑒定其分化潛能。結(jié)果: 經(jīng)BMP-2/FGF-4誘導(dǎo),小鼠心臟Sca-1+細(xì)胞發(fā)生形態(tài)改變,上調(diào)心肌細(xì)胞特征基因α-MHC、β-MHC、MLC-2a和MLC-2v的mRNA表達(dá),同時(shí)表達(dá)心肌特征性蛋白cTNT和cMHC。經(jīng)TGF-β1誘導(dǎo),小鼠心臟Sca-1+細(xì)胞亦發(fā)生形態(tài)改變,上調(diào)平滑肌特征基因α-SMA和Calponin的mRNA表達(dá),同時(shí)表達(dá)平滑肌特征性蛋白SMA、sMHC和Calponin的表達(dá)。經(jīng)VEGF165誘導(dǎo),小鼠心臟Sca-1+細(xì)胞同樣發(fā)生了形態(tài)改變,上調(diào)內(nèi)皮細(xì)胞特征基因CD31、vWF和VE-Cadherin的mRNA表達(dá),同時(shí)表達(dá)內(nèi)皮細(xì)胞特征性抗原CD31。結(jié)論: 成體小鼠心臟Sca-1+細(xì)胞在體外多種因素的分別作用下,能向心肌樣細(xì)胞、平滑肌樣細(xì)胞和內(nèi)皮樣細(xì)胞分化,具有心臟干細(xì)胞特性的多向分化潛能。
Sca-1;心臟;干細(xì)胞;誘導(dǎo)分化
成體心臟干細(xì)胞(cardiac stem cells,CSCs)或心肌前體細(xì)胞(cardiomyocytes progenitor cells,CMPCs)的發(fā)現(xiàn),拉開了人類心臟組織再生或修復(fù)的新序幕。利用自體或同種異體CSCs來修復(fù)缺血壞死心肌組織成為近年來研究的熱點(diǎn)[1-3],也無疑為先天性心臟病患兒構(gòu)建所需的組織工程心臟補(bǔ)片提供良好的種子細(xì)胞[4]。研究發(fā)現(xiàn),作為CSCs家族的重要成員, Sca-1+CSCs是成體心臟組織中居于優(yōu)勢地位的干細(xì)胞,其含量是c-kit+CSCs的100~700倍[5-6]。然另有文獻(xiàn)表明,心臟組織中的Sca-1+細(xì)胞多數(shù)是內(nèi)皮細(xì)胞[7],而非CSCs。前期研究中,我們通過免疫磁珠分選法從小鼠心臟組織中成功分離出較高純度的Sca-1+細(xì)胞[8],然而,該群Sca-1+細(xì)胞是否就是真正意義上的CSCs或CMPCs呢?我們將通過系列體外誘導(dǎo)分化的實(shí)驗(yàn)來探討其分化潛能,從而判定其細(xì)胞學(xué)特性,為后期組織工程心臟補(bǔ)片的研究提供理論和實(shí)踐基礎(chǔ)。
1 材料與方法
1.1 一般材料
1.1.1 實(shí)驗(yàn)動物 SPF級野生型ICR小鼠,3~4周齡,由上海斯萊克實(shí)驗(yàn)動物有限責(zé)任公司提供。
1.1.2 儀器與試劑 MiniMACS磁珠分選器(Miltenyi Biotech),MiniMACS磁珠分選柱(Miltenyi Biotech),熒光倒置顯微鏡(Leica),PCR儀(BioRad)。小鼠抗Sca-1-FITC 單克隆磁珠抗體(Miltenyi Biotech);重組人骨形態(tài)發(fā)生蛋白-2(BMP2),重組人成纖維細(xì)胞生長因子-4(FGF4),重組人轉(zhuǎn)化生長因子-β1(TGF-β1),重組小鼠血管內(nèi)皮細(xì)胞生長因子-165(VEGF165)均購自PeproTech;小鼠抗心肌MHC單克隆一抗,兔抗小鼠平滑肌MHC多克隆一抗,兔抗小鼠Calponin-1單克隆一抗均購自Abcam;大鼠抗小鼠CD31-生物素,鏈霉親和素-PE購自eBioscience;山羊抗小鼠心肌Troponin T多克隆一抗(Santa Cruz);兔抗小鼠平滑肌α-Actin單克隆一抗(Epitomics);TRIzol(Invitrogen);PrimeScript RT reagent Kit,TaKaRaTaq試劑盒購自TaKaRa。
1.2 實(shí)驗(yàn)方法
1.2.1 小鼠心臟Sca-1+細(xì)胞的分離提取和原代培養(yǎng) 利用膠原酶A消化小鼠心臟組織成單細(xì)胞懸液,再用免疫磁珠分選法篩選提取其中的Sca-1+細(xì)胞,按1×104/cm2將Sca-1+細(xì)胞接種于0.1%明膠包被的24孔培養(yǎng)板,加入生長培養(yǎng)液[9],37℃、5%CO2中靜置培養(yǎng)3 d。此后每3 d換培養(yǎng)液一次,待細(xì)胞生長至80%~90%匯合時(shí)消化傳代。
1.2.2 小鼠心臟Sca-1+細(xì)胞體外誘導(dǎo)分化 經(jīng)傳代擴(kuò)增的P4代Sca-1+細(xì)胞按1×104/cm2接種于6孔培養(yǎng)板中,37℃,5% CO2中靜置培養(yǎng),達(dá)70%~80%融合時(shí)開始誘導(dǎo)分化。
向心肌樣細(xì)胞分化:棄原培養(yǎng)液,加入BMP2/FGF4(濃度100 ng/mL)誘導(dǎo)分化液, 37℃,5%CO2中避光培養(yǎng);設(shè)立對照組(僅不含BMP-2/FGF-4)。誘導(dǎo)24 h,更換為普通培養(yǎng)液繼續(xù)培養(yǎng),每3 d換液一次,培養(yǎng)2周。
向平滑肌樣細(xì)胞分化:棄原培養(yǎng)液,加入TGF-β1(濃度10 ng/mL)誘導(dǎo)分化液,37℃,5% CO2中培養(yǎng);設(shè)立對照組(僅不含TGF-β1)。誘導(dǎo)組每3 d更換誘導(dǎo)液1次,對照組每3 d更換培養(yǎng)液1次,培養(yǎng)10 d。
向內(nèi)皮樣細(xì)胞分化:棄原培養(yǎng)液,加入VEGF165(濃度20 ng/mL)誘導(dǎo)分化液,37℃,5% CO2中培養(yǎng);設(shè)立對照組(僅不含VEGF165)。誘導(dǎo)組每3 d更換誘導(dǎo)液1次,對照組每3 d更換培養(yǎng)液1次,培養(yǎng)2周。

表1 PCR引物序列
1.2.3 誘導(dǎo)分化后鑒定 細(xì)胞免疫熒光染色:誘導(dǎo)后,誘導(dǎo)組和對照組細(xì)胞予以PBS漂洗5 min×3次,4%多聚甲醛固定20 min,PBS漂洗5 min×3次,0.3%TritonX-100透壁處理20 min(CD31染色除外),血清封閉30 min,去封閉血清,添加一抗,4℃孵育過夜,PBS漂洗5 min×3次,添加二抗,室溫避光孵育60 min,PBS漂洗5 min×3次,1∶1 000的DAPI染核1~2 min,PBS漂洗5 min×3次,鏡下觀察拍照。
RT-PCT檢測:誘導(dǎo)后,用TRIzol法抽提總RNA,同型小鼠的心肌組織設(shè)為陽性對照。利用PrimeScript反轉(zhuǎn)錄試劑盒逆轉(zhuǎn)錄合成cDNA;利用Takara Taq PCR試劑盒行PCR擴(kuò)增。PCR反應(yīng)條件:95℃預(yù)變性5 min,94℃變性1 min,退火40 s,72℃延伸50 s,30~32 cycles,72℃終末延伸7 min。使用2%的瓊脂糖凝膠電泳30~35 min后,凝膠成像系統(tǒng)檢測拍照。GAPDH為內(nèi)參。
2 結(jié) 果
2.1 小鼠心臟Sca-1+細(xì)胞體外向心肌樣細(xì)胞分化 鏡下顯示,P4代成體小鼠心臟Sca-1+細(xì)胞在BMP-2/FGF-4作用24 h后雖然細(xì)胞大小形態(tài)相仿,但折光性增強(qiáng),并開始呈一定趨向性排列(圖1B)。誘導(dǎo)1周后,大部分細(xì)胞呈長梭形,折光性強(qiáng),明顯的趨向性排列(圖1C)。誘導(dǎo)2周后,細(xì)胞生長甚密,仍表現(xiàn)出較強(qiáng)折光性,但未見自發(fā)跳動的細(xì)胞(圖1D)。而同期對照組細(xì)胞,形態(tài)梭形改變,無趨向性排列,折光性較弱(圖1E-G)。免疫熒光染色發(fā)現(xiàn),經(jīng)誘導(dǎo)后部分Sca-1+細(xì)胞表達(dá)心肌特征性結(jié)構(gòu)蛋白cTNT和cMHC,而對照組沒有表達(dá)(圖2)。RT-PCR結(jié)果同樣發(fā)現(xiàn),與對照組相比,經(jīng)誘導(dǎo)的Sca-1+細(xì)胞明顯上調(diào)α-MHC、β-MHC、MLC-2a和MLC-2v等成熟心肌特異基因的mRNA表達(dá)(圖3)。雖然在誘導(dǎo)分化2周后仍然沒有發(fā)現(xiàn)這些細(xì)胞發(fā)生自發(fā)的有節(jié)律搏動或者是簡單的搏動,但上述結(jié)果仍然提示我們,BMP-2/FGF-4能誘導(dǎo)成體小鼠心臟Sca-1+細(xì)胞向心肌樣細(xì)胞分化,反過來也說明成體小鼠心臟Sca-1+細(xì)胞具有向心肌細(xì)胞分化的潛能。
2.2 小鼠心臟Sca-1+細(xì)胞體外向平滑肌樣細(xì)胞分化 鏡下發(fā)現(xiàn),P4代成體小鼠心臟Sca-1+細(xì)胞在TGF-β1作用24 h后發(fā)生了形態(tài)學(xué)的改變,細(xì)胞變長呈梭形,折光性明顯增強(qiáng),且具明顯的趨向性排列,類似于“波峰-波谷”樣特征(圖4A)。誘導(dǎo)10 d后,細(xì)胞重疊生長,仍呈梭形改變,折光性強(qiáng),但排列不規(guī)律(圖4B)。而同期對照組細(xì)胞形態(tài)上沒有明顯改變(圖4C、4D)。免疫熒光染色同樣發(fā)現(xiàn),經(jīng)誘導(dǎo)的Sca-1+細(xì)胞表達(dá)平滑肌細(xì)胞特征性蛋白SMA、sMHC和Calponin較對照組明顯增強(qiáng)(圖5)。RT-PCR結(jié)果亦顯示,與對照組相比,經(jīng)誘導(dǎo)的Sca-1+細(xì)胞明顯上調(diào)平滑肌特異基因α-SMA和Calponin的mRNA表達(dá)(圖6)。上述結(jié)果提示,TGF-β1能有效誘導(dǎo)成體小鼠心臟Sca-1+細(xì)胞向平滑肌樣細(xì)胞分化。換言之,成體小鼠心臟Sca-1+細(xì)胞具有向平滑肌細(xì)胞分化的潛能。

圖1 BMP-2/FGF-4誘導(dǎo)P4代成體小鼠心臟Sca-1+ 細(xì)胞成心肌細(xì)胞分化的光鏡下形態(tài)
A: 誘導(dǎo)前Sca-1+細(xì)胞的形態(tài);B-D: BMP-2/FGF-4誘導(dǎo)后細(xì)胞在不同時(shí)間點(diǎn)的形態(tài)特征;E-G: 對照組在上述不同時(shí)間點(diǎn)同期的細(xì)胞形態(tài)。放大倍率 ×100

圖2 BMP-2/FGF-4誘導(dǎo)P4代成體小鼠心臟Sca-1+ 細(xì)胞成心肌細(xì)胞分化的免疫熒光染色鑒定
A: cTNT熒光染色結(jié)果(cTNT,綠色;DAPI,藍(lán)色);B: cMHC熒光染色結(jié)果(cMHC,綠色;DAPI,藍(lán)色). 白色箭頭所指為特異的陽性染色,放大倍率 ×400

圖3 BMP-2/FGF-4誘導(dǎo)P4代成體小鼠心臟Sca-1+
RT-PCR檢測心肌特異性轉(zhuǎn)錄因子GATA4、Nkx2.5和MEF2C,心肌細(xì)胞特征基因α-MHC、β-MHC、MLC-2a和MLC-2v的mRNA表達(dá). GAPDH為內(nèi)參
2.3 小鼠心臟Sca-1+細(xì)胞體外向內(nèi)皮樣細(xì)胞分化 鏡下觀察,P4代成體小鼠心臟Sca-1+細(xì)胞在VEGF165誘導(dǎo)24 h后亦發(fā)生了改變,細(xì)胞生長緩慢,大部分伸出偽足,但胞體大小形態(tài)沒有明顯改變,折光性有增強(qiáng)(圖7B)。誘導(dǎo)1周后,細(xì)胞生長密集,偽足漸退,形態(tài)以梭形為主,折光性強(qiáng)(圖7C)。誘導(dǎo)2周后,細(xì)胞生長甚密,仍表現(xiàn)出較強(qiáng)折光性,偽足消失,形態(tài)以卵圓形為主(圖7D)。而對照組細(xì)胞無明顯改變,無偽足形成(圖7E-G)。免疫熒光染色顯示,經(jīng)誘導(dǎo)后部分Sca-1+細(xì)胞能夠表達(dá)內(nèi)皮細(xì)胞特征性抗原CD31,而對照組沒有表達(dá)(圖8)。RT-PCR結(jié)果同樣發(fā)現(xiàn),與對照組相比,經(jīng)誘導(dǎo)的Sca-1+細(xì)胞能明顯上調(diào)內(nèi)皮細(xì)胞特異性基因CD31、vWF和VE-Cadherin的mRNA表達(dá)(圖9)。上述結(jié)果提示,成體小鼠心臟Sca-1+細(xì)胞在VEGF165的誘導(dǎo)下具有向內(nèi)皮細(xì)胞分化的潛能。

圖4 TGF-β1誘導(dǎo)P4代成體小鼠心臟Sca-1+細(xì)胞成平滑肌細(xì)胞分化的光鏡下形態(tài)
A-B: TGF-β1誘導(dǎo)后細(xì)胞在不同時(shí)間點(diǎn)的形態(tài)特征;C-D: 對照組在上述不同時(shí)間點(diǎn)同期的細(xì)胞形態(tài). 放大倍率 ×100

圖5 TGF-β1誘導(dǎo)P4代成體小鼠心臟Sca-1+ 細(xì)胞成平滑肌細(xì)胞分化的免疫熒光染色鑒定
A: SMA熒光染色結(jié)果(SMA,綠色;DAPI,藍(lán)色);B: sMHC熒光染色結(jié)果(sMHC,綠色;DAPI,藍(lán)色);C: Calponin熒光染色結(jié)果(Calponin,綠色;DAPI,藍(lán)色). 放大倍率 ×100
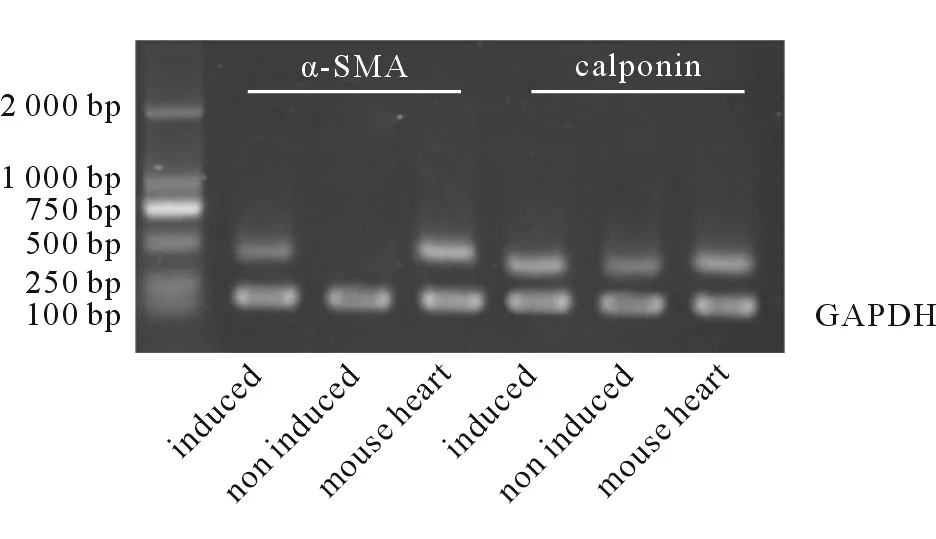
圖6 TGF-β1誘導(dǎo)P4代成體小鼠心臟Sca-1+細(xì)胞成平滑肌細(xì)胞分化的特異基因表達(dá)
RT-PCR檢測平滑肌細(xì)胞特征基因SMA、Calponin的mRNA表達(dá). Induced:TGF-β1誘導(dǎo)組;Control:非誘導(dǎo)對照組;GAPDH為內(nèi)參;mH:mouse heart

圖7 VEGF165誘導(dǎo)P4代成體小鼠心臟Sca-1+細(xì)胞成內(nèi)皮細(xì)胞分化的光鏡下形態(tài)
A: 誘導(dǎo)前Sca-1+細(xì)胞的形態(tài);B-D: VEGF165誘導(dǎo)后細(xì)胞在不同時(shí)間點(diǎn)的形態(tài)特征;E-G: 對照組在上述不同時(shí)間點(diǎn)同期的細(xì)胞形態(tài). 放大倍率 ×100
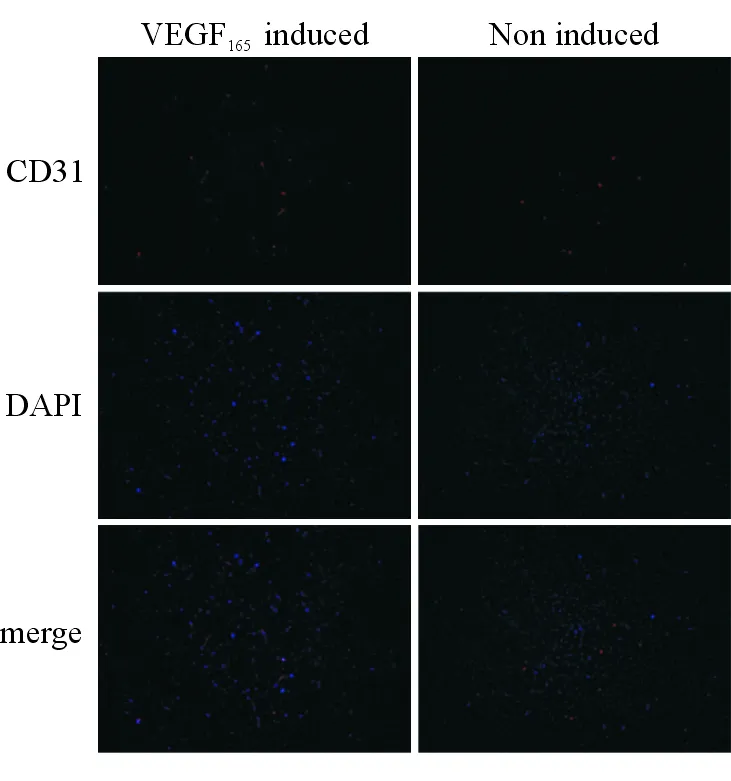
圖8 VEGF165誘導(dǎo)P4代成體小鼠心臟Sca-1+細(xì)胞成內(nèi)皮細(xì)胞分化的免疫熒光染色鑒定
CD31熒光染色結(jié)果(CD31,紅色;DAPI,藍(lán)色). 放大倍率 ×100

圖9 VEGF165誘導(dǎo)P4代成體小鼠Sca-1+細(xì)胞成內(nèi)皮細(xì)胞分化的基因表達(dá)檢測
RT-PCR檢測內(nèi)皮前體標(biāo)志Flk-1,內(nèi)皮細(xì)胞特征基因CD31、vWF和VE-Cadherin的mRNA表達(dá). GAPDH為內(nèi)參
3 討 論
經(jīng)過體外誘導(dǎo)分化實(shí)驗(yàn)我們發(fā)現(xiàn),在BMP-2/FGF-4的聯(lián)合作用下,成體小鼠心臟組織來源的Sca-1+細(xì)胞能夠表達(dá)成熟心肌的特征基因α-MHC、β-MHC、MLC-2a及MLC-2v,而且還表達(dá)心肌特征性結(jié)構(gòu)蛋白cTNT和cMHC。在TGF-β1的作用下,該群細(xì)胞能夠上調(diào)平滑肌特征基因α-SMA和Calponin的表達(dá),而且還表達(dá)平滑肌特征性蛋白SMA、sMHC和Calponin。同時(shí),在VEGF165的作用下,內(nèi)皮細(xì)胞特征基因CD31、VE-cadherin、vWF及表面抗原CD31都有明顯表達(dá)。因此,我們可以基本判定從成體小鼠心臟組織中篩選出來的Sca-1+細(xì)胞為CSCs,具有向心肌、平滑肌、內(nèi)皮等心臟“三系”分化的多向分化潛能。這與Wang等人的研究發(fā)現(xiàn)是一致的,他們通過建立小鼠心肌梗死模型發(fā)現(xiàn),在心梗發(fā)生的早期,梗死周邊區(qū)域的Sca-1+細(xì)胞數(shù)量顯著上升,而骨髓和血液中的Sca-1+細(xì)胞數(shù)量無論在心梗早期還是晚期都沒有明顯變化[10],這說明在成體心臟組織中可能駐守著自身固有的Sca-1+細(xì)胞。研究還發(fā)現(xiàn),Sca-1+細(xì)胞可以在心梗的環(huán)境中向內(nèi)皮和心肌細(xì)胞分化,通過促進(jìn)局部血管和心肌的再生來改善心梗后的心臟功能。
實(shí)驗(yàn)的結(jié)果是可喜的,但也存有遺憾與不足,我們在心肌的誘導(dǎo)效率方面還不滿意。Sca-1+CSCs不僅未能分化為有收縮功能的成熟心肌細(xì)胞,而且表達(dá)心肌特征蛋白cMHC或cTNT的細(xì)胞比例也很少。尋找高效的誘導(dǎo)方法一直是干細(xì)胞再生醫(yī)學(xué)領(lǐng)域里的熱點(diǎn)之一。考慮到干細(xì)胞實(shí)際分化成熟過程中的復(fù)雜性,僅依靠某一誘導(dǎo)因子或多個(gè)因子的簡單聯(lián)合,往往很難實(shí)現(xiàn)向心肌細(xì)胞這類具有復(fù)雜結(jié)構(gòu)和特殊生理功能的細(xì)胞去成熟分化,即使可能,效率也是極低的[11]。有研究人員為了模擬心肌分化成熟過程中所需的復(fù)雜條件,先在體外分離培養(yǎng)心肌細(xì)胞,再與干細(xì)胞或前體細(xì)胞共培養(yǎng),利用前者可能分泌的細(xì)胞因子來促使后者向成熟心肌分化。然而,這也不一定能實(shí)現(xiàn)干細(xì)胞向自發(fā)搏動的成熟心肌細(xì)胞轉(zhuǎn)變[12-14]。也有研究將CMPCs或CSCs直接移植到梗死心肌的缺血區(qū)域,雖然有向成熟心肌分化的可能,但是移植細(xì)胞的留存率低[15-16],從而使得總體的轉(zhuǎn)化率下降。
當(dāng)然,除了給予的誘導(dǎo)條件和生長環(huán)境外,干細(xì)胞自身的特性可能也是影響分化效率的重要因素之一。就CMPCs來說,van等人研究發(fā)現(xiàn),相比胚胎期CMPCs的多向分化能力,成體CMPCs更傾向于定向心肌的分化,而且由后者分化而來的心肌樣細(xì)胞具有更好的電生理功能[17],說明雖然胚胎期CMPCs具有多向分化的能力,但其成心肌分化的效率可能反不如定向心肌分化的成體CMPCs。另有文獻(xiàn)表明,具有多向分化能力的干細(xì)胞更接近于原始細(xì)胞,從而遠(yuǎn)離分化成熟的細(xì)胞[18]。同樣,我們實(shí)驗(yàn)中的Sca-1+CSCs亦具有多向分化的潛能,可能相比定向心肌分化的成體CMPCs更具原始特性,從而向成熟心肌的分化亦相對困難。當(dāng)然,對于心肌梗死的治療或組織工程心臟的構(gòu)建而言,絕不僅僅是成熟心肌細(xì)胞的堆砌,CSCs因其具有向心臟“三系”的多向分化潛能而擁有巨大的臨床應(yīng)用價(jià)值,目前已經(jīng)被全球多個(gè)中心運(yùn)用到Ⅰ期的臨床試驗(yàn)中[1-3]。然而,要真正實(shí)現(xiàn)對梗死心肌組織結(jié)構(gòu)和功能的生理修復(fù),最重要的還是要找到合適的體外培養(yǎng)體系和高效的誘導(dǎo)條件,使CSCs或CMPCs能夠朝著具有完全生理功能的成熟心肌或心臟細(xì)胞去分化,這也是我們未來工作中所需探討和深入研究的問題。
[ 1 ] Bolli R, Chugh AR, D’Amario D, et al. Cardiac stem cells in patients with ischaemic cardiomyopathy (SCIPIO): initial results of a randomised phase 1 trial[J]. Lancet, 2011, 378(9806):1847-1857.
[ 2 ] Makkar R, Schatz R, Traverse JH, et al. ALLogeneic Heart STem cells to Achieve myocardial Regeneration (ALLSTAR): the six month phase I safety results[J]. J Am Coll Cardiol, 2014, 64(11_S):TCT-152.
[ 3 ] Makkar R, Schatz R, Traverse JH, et al. ALLogeneic Heart STem cells to Achieve myocardial Regeneration (ALLSTAR): the one year phase I results[J]. Circulation, 2014, 130(Suppl 2):A20536.
[ 4 ] Gao Y, Jacot JG. Stem Cells and Progenitor Cells for Tissue-Engineered Solutions to Congenital Heart Defects[J]. Biomark Insights, 2015,10(Suppl 1):139-146.
[ 5 ] Beltrami AP, Barlucchi L, Torella D, et al. Adult cardiac stem cell are multipotent and surpport myocardial regeneration[J]. Cell, 2003, 114(6):763-776.
[ 6 ] Leri A, Kajstura J, Anversa P. Cardiac stem cells and mechanisms of myocardial regeneration[J]. Physiol Rev, 2005, 85(4):1373-1416.
[ 7 ] Valente M, Nascimento DS, Cumano A, et al. Sca-1+cardiac progenitor cells and heart-making: a critical synopsis[J]. Stem Cell Dev, 2014,23(19):2263-2273.
[ 8 ] 周春霞,張海波,陳 皓,等.小鼠Sca-1陽性心臟干細(xì)胞的分離提取和表型鑒定[J].醫(yī)學(xué)臨床研究,2015,32(6):1072-1077.
[ 9 ] Smits AM, van Vliet P, Metz CH, et al. Human cardiomyocyte progenitor cells differentiate into functional mature cardiomyocytes: an in vitro model for studying human cardiac physiology and pathophysiology[J]. Nat Protoc, 2009, 4(2):232-243.
[10] Wang X, Hu Q, Nakamura Y, et al. The role of the Sca-1+/CD31- cardiac progenitor cell population in post infarction left ventricular remodeling[J]. Stem Cells, 2006, 24(7): 1779-1788.
[11] Matsuura K, Nagai T, Nishigaki N, et al. Adult cardiac Sca-1-positive cells differentiate into beating cardiomyocytes[J]. J Biol Chem, 2004, 279(12):11384-11391.
[12] Pfister O, Mouquet F, Jain M, et al. CD31- but Not CD31+ cardiac side population cells exhibit functional cardiomyogenic differentiation[J]. Circ Res, 2005, 97(1):52-61.
[13] Rose RA, Jiang H, Wang X, et al. Bone marrow-derived mesenchymal stromal cells express cardiac-specific markers, retain the stromal phenotype, and do not become functional cardiomyocytes in vitro[J]. Stem Cells, 2008, 26(11):2884-2892.
[14] Gallo MP, Ramella R, Alloatti G, et al. Limited plasticity of mesenchymal stem cells cocultured with adult cardiomyocytes[J]. J Cell Biochem, 2007, 100(1):86-99.
[15] Khan M, Mohsin S, Avitabile D, et al. β-Adrenergic regulation of cardiac progenitor cell death versus survival and proliferation[J]. Circ Res, 2013, 112(3): 476-486.
[16] Li Z, Lee A, Huang M, et al. Imaging survival and function of transplanted cardiac resident stem cells[J]. J Am Coll Cardiol, 2009, 53(14):1229-1240.
[17] van Vliet P, Smits AM, de Boer TP, et al. Foetal and adult cardiomyocyte progenitor cells have different developmental potential[J]. J Cell Mol Med, 2010,14 (4):861-870.
[18] Wu SM, Fujiwara Y, Cibulsky SM, et al. Cibulsky, et al. Developmental Origin of a Bipotential Myocardial and Smooth Muscle Cell Precursor in the Mammalian Heart[J]. Cell, 2006, 127(6):1137-1150.
[本文編輯] 葉 婷, 賈澤軍
Experimental study on the differentiation potential of Sca-1-positive cells from adult mouse heart in vitro
WANG Hao, CHEN Hao, ZHANG Hai-bo, ZHOU Chun-xia*
Department of Cardiac Surgery, Shanghai Children’s Medical Center, Shanghai 200127, China
Objective: To study the differentiation potential of Sca-1+cells from adult mouse heart in vitro. Methods: We isolate Sca-1+cells derived from mouse heart by means of immunomagnetic cell sorting. By using three different kinds of differentiation inducing factors, including BMP-2/FGF-4, TGF-β1 and VEGF165, to induce Sca-1+cells to differentiated into the heart "three lines"invitro. The differentiation potential of the cells was identified from the changes of cell morphology, RT-PCR and immunofluorescence staining. Results: After BMP-2/FGF-4 induction, the mouse cardiac Sca-1+cells underwent morphological changes, up regulation of the mRNA expression of α-MHC, β-MHC, MLC-2a and MLC-2v, and the protein expression of cTNT and cMHC, which were the specific markers of cardiomyocytes. After TGF-β1 induction, these Sca-1+cells also had morphological changes, up regulation of mRNA expression of α-SMA and Calponin, and the protein expression of SMA, sMHC, and Calponin, which were the specific markers of smooth muscle cells. After VEGF165induction, the Sca-1+cells also underwent morphological changes, up regulation of endothelial cell specific gene CD31, vWF, and VE-Cadherin expression, and the expression of endothelial cell specific antigen CD31. Conclusions: Adult mouse cardiac Sca-1+cells can differentiate into cardiomyocyte-like cells, smooth muscle-like cells and endothelial-like cells under different inducing factors in vitro,which suggest these cells have multi-lineage differentiation potential as cardiac stem cells.
Sca-1; heart; stem cells; induced differentiation
2016-09-07 [接受日期] 2016-10-15
上海市浦東新區(qū)科技發(fā)展基金創(chuàng)新資金資助項(xiàng)目(PKJ2013-Y64). Supported by Pudong New Area Science and Technology Development Fund Innovative Foundation Projects of Shanghai (PKJ2013-Y64).
王 浩,博士,主治醫(yī)師. E-mail: haowang_nt@163.com
*通信作者(Corresponding author). Tel: 021-38626161, E-mail: zcxaparis@yahoo.com
10.12025/j.issn.1008-6358.2016.20160935
Q 28
A

