印片細胞學聯合快速免疫組化檢測在乳腺癌前哨淋巴結活檢術中診斷的應用
朱淑玲, 武彤彤, 方 勤, 楊清緒
惠州市中心人民醫院病理科,惠州 516001
?
印片細胞學聯合快速免疫組化檢測在乳腺癌前哨淋巴結活檢術中診斷的應用
朱淑玲, 武彤彤, 方 勤, 楊清緒*
惠州市中心人民醫院病理科,惠州 516001
目的: 探討乳腺癌前哨淋巴結活檢(SLNB)術中,印片細胞學(TIC)與快速免疫組化(RIHC)聯合應用診斷乳腺癌前哨淋巴結(SLN)轉移的價值。方法: 選擇89例乳腺癌患者,共281枚SLN ,在SLNB中行TIC和(或)RIHC檢測。RIHC檢查以廣譜細胞角蛋白19(pan-cytokeratin 19,pan-CK19)為指標。以術后石蠟切片診斷為對照,分析單獨TIC和TIC聯合RIHC診斷乳腺癌SLN轉移的陽性檢出率、敏感度、準確率、假陰性率。結果: TIC診斷乳腺癌SLN轉移的陽性檢出率為25.8%(23/89),TIC聯合RIHC診斷乳腺癌SLN轉移的陽性檢出率為36.0%(32/89),差異有統計學意義 (P<0.05)。TIC及RIHC診斷乳腺癌SLN轉移的特異度均為100.0%。單獨TIC檢查診斷乳腺癌SLN轉移的敏感度為69.7%(23/33),TIC聯合RIHC檢查的敏感度為97.0%(32/33),差異有統計學意義(P<0.001)。單獨TIC檢查診斷乳腺癌SLN轉移的假陰性率為30.3%(10/33),TIC聯合RIHC檢查的假陰性率為3.0%(1/33),差異有統計學意義(P<0.001)。結論: 乳腺癌SLNB中聯合應用TIC和RIHC檢查能提高乳腺癌SLN轉移的檢出率、敏感度和準確率。
乳腺癌; 前哨淋巴結; 印片細胞學; 快速免疫組化
前哨淋巴結(sentinel lymph node,SLN)是指局部淋巴結中最先接受淋巴引流的一個或少數幾個淋巴結。乳腺癌前哨淋巴結活檢 (sentinel lymph node biopsy,SLNB)可準確預測腋窩淋巴結的轉移狀況。SLNB陰性者可避免腋窩淋巴結清掃(axillary lymph node dissection,ALND),從而減少患者發生手臂及肩部并發癥,提高患者生活質量[1-2]。本研究應用印片細胞學(touch imprint cytology,TIC)和快速免疫組化(rapid immunohistochemistry staining,RIHC)技術對89例乳腺癌患者的281枚SLN進行檢測,比較術中單獨TIC與TIC聯合RIHC診斷乳腺癌SLN轉移的檢出率、敏感度、特異度,探討兩者聯合檢測乳腺癌SLN的可行性及臨床意義。
1 資料與方法
1.1 一般資料 惠州市中心人民醫院2013 年 1 月—12 月收治89例乳腺癌患者,共281枚SLN,在SLNB術中行TIC及RIHC檢測。患者均為女性, 年齡29~73歲,平均(49.10±7.65)歲。腫塊直徑≤5.0 cm,平均(2.73±0.66) cm。術后石蠟切片病理診斷:浸潤性導管癌71 例,浸潤性小葉癌 11 例,導管內癌伴微浸潤3例,髓樣癌 2 例,黏液癌2例。1.2 試 劑 即用型非生物素免疫組化 EliVisionTM super 檢測試劑盒購自美國 DAKO 公司;鼠抗人 CK19 單克隆抗體購自美國Sigma 公司。
1.3 方 法 將SLN沿長軸對分,兩切面分別印片行TIC檢測。1份用于RIHC檢查,檢測指標為廣譜細胞角蛋白19(pan-cytokeratin 19, pan-CK19);1份用于術后連續石蠟切片,切片行常規蘇木精-伊紅(H-E)染色。如SLNB術中RIHC和TIC均為陰性,不行ALND;如SLNB術中TIC和(或)RIHC為陽性,則行ALND。
RIHC檢查方法:(1)冰凍切片在甲醇中固定1 min,取出后自然晾干(約15 s);(2)加一抗(按1:50稀釋,稀釋液內加入1%小牛血清),37℃ 孵育5~10 min,用磷酸鹽緩沖液(PBS; 0.01 mol/L,pH 7.4)沖洗3次,每次10 s;(3)加入聚合物增強劑,37℃孵育5 min,用PBS沖洗3次,每次10 s;(4)加二抗,37℃孵育5 min,用PBS沖洗3次,每次5 s;(5)DAB 37℃染色1 min,用雙蒸水沖洗3次,每次5 s;(6)H-E復染15 s,45℃水浴15 s 返藍,封片后觀察。在操作過程中,嚴格控制沖洗的時間與次數,以防出現非特異性背景染色;每次滴加試劑前需將組織片上的PBS吸干,以防試劑稀釋,導致染色強度變弱或假陰性發生。免疫組化陽性判斷方法:由病理科醫師在顯微鏡下判讀,在淋巴結內見棕黃色染色上皮樣細胞且背景清晰即判斷為陽性。
1.4 統計學處理 使用SPSS 19.0 統計軟件進行數據分析,兩組間率的比較采用χ2檢驗。檢驗水準(α)為0.05。
2 結 果
2.1 SLN轉移癌檢出情況 以術后常規石蠟切片診斷為標準,計算單獨TIC和TIC聯合RIHC診斷乳腺癌SLN轉移癌的特異性和敏感性。89例患者中,33例患者的43枚SLN術后經常規石蠟切片檢查確診為陽性,238枚SLN確診為陰性;經TIC檢查,23例患者的29枚SLN診斷為陽性(圖1A),9例患者的14枚SLN診斷為假陰性;經TIC聯合RIHC檢查,32例患者的42枚SLN診斷為陽性,其陽性淋巴結中pan-CK19陽性表達(圖1B),1例患者的1枚SLN診斷為假陰性。
A: TIC檢測見轉移癌陽性淋巴結(×200); B: RIHC檢測見pan-CK19陽性表達(×400)
2.2 2種方法檢測乳腺癌SLN轉移的陽性檢出率、敏感度、準確度比較 TIC檢測乳腺癌SLN轉移的陽性檢出率為25.8%(23/89),TIC聯合RIHC的陽性檢出率為36.0%(32/89),差異有統計學意義(P=0.004)。TIC診斷乳腺癌SLN轉移的敏感度為69.7%,TIC聯合RIHC的診斷敏感度為97.0%,差異有統計學有意義(P<0.001)。TIC診斷乳腺癌SLN轉移的準確度為88.8%,TIC聯合RIHC診斷準確度為98.9%,差異有統計學意義(P<0.05)。單獨TIC檢查對SLN轉移癌的診斷假陰性率是30.3%,其中9例單獨TIC檢查未發現癌轉移的病例在進一步經RIHC檢查后發現癌細胞,pan-CK19在少量細胞中陽性表達,術后石蠟病理切片檢查證實在SLN中存在微小轉移灶;TIC聯合RIHC檢查的診斷假陰性率為3.0%。2種方法診斷假陰性率差異有統計學意義(P<0.05) 。具體見表1~表2。
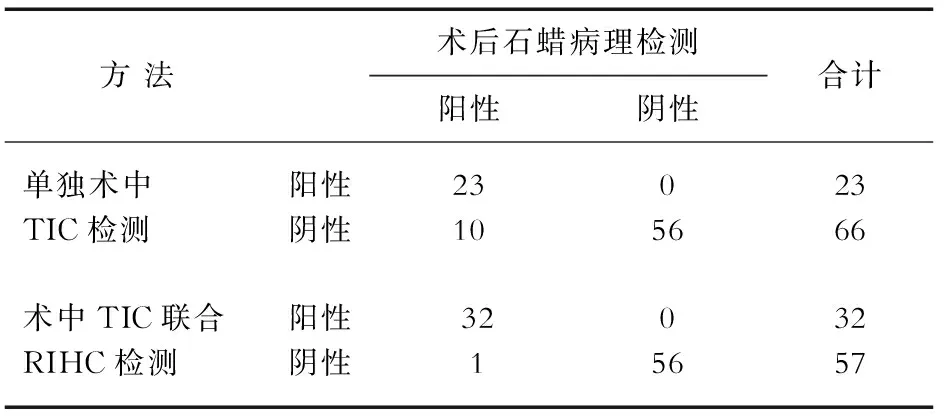
表1 TIC和TIC聯合RIHC與術后病理檢查結果的比較 n
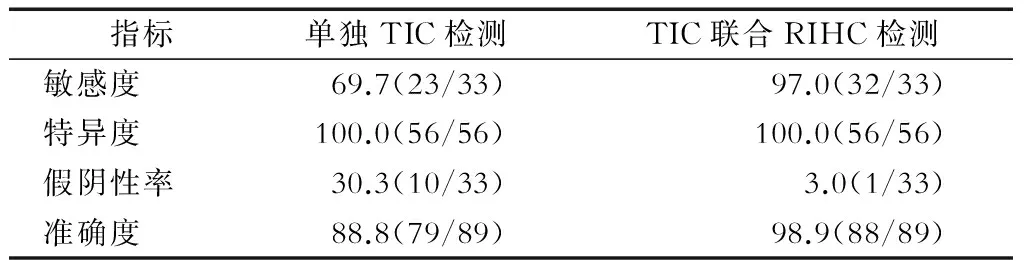
表2 單獨TIC和TIC聯合RIHC診斷的敏感性和特異性比較 %
3 討 論
腋窩淋巴結狀態是獨立判斷乳腺癌預后的重要因素之一。腋窩淋巴結無轉移者約占早期乳腺癌患者的70%以上,對這類患者應避免行ALND;ALND會導致這類患者術后出現患側上肢水腫、活動受限、局部疼痛等并發癥[1-2]。研究[3]證實,SLNB預測腋窩淋巴結轉移的準確度>95%[3-4]。SLNB的應用可使大部分腋窩淋巴結陰性的乳腺癌患者免行SLNB。目前,對于除T4期以外的乳腺癌腋窩淋巴結陰性浸潤的患者,SLNB替代ALND成為檢測SLN轉移癌的標準方法[5-6]。Orr等[7]認為,當SLN 轉移癌病理檢測的敏感度>90%時,轉移陰性的患者才可免行ALND。
目前,術中快速病理學檢查方法包括TIC、冰凍切片、RIHC、實時 RT-PCR等。傳統的SLNB術中診斷方法包括快速冰凍切片病理檢測和TIC檢查。術中快速冷凍切片診斷因切片的質量及深度、染色的質量、冰晶造成的細胞變形等問題,導致其診斷的不確定性及漏診率高。van de Vrande等[8]報告,快速冰凍病理檢查診斷SLN轉移癌的敏感度為71.6%。而TIC檢查因檢查中細胞數目較少、細胞容易脫落、診斷主觀性較強等原因,導致其診斷敏感性較低、對微轉移病灶的診斷假陰性率高。一項薈萃分析[9]顯示,TIC檢查診斷SLN轉移癌的敏感度為63%,其對SLN轉移和微轉移的診斷敏感度分別為81%、22%。因此,經快速冰凍病理檢查和TIC檢查的乳腺癌行ALND的比例較高。免疫組織化學技術是目前病理輔助診斷中最重要的技術。在乳腺癌SLN的檢查中,免疫組化檢查具有靈敏度、準確度高等優點[10],但是常規免疫組化檢查時間較長(4~20 h),而RIHC檢查則可避免這個問題。RIHC檢查對乳腺癌SLN轉移的診斷陽性率明顯高于快速冰凍切片和連續石蠟切片,而與常規免疫組化檢查差異無統計學意義,表明RIHC檢查結果可靠。實時RT-PCR 檢查快速、靈敏度高,但不能區分淋巴結內良惡性上皮細胞,假陽性率較高[11]。
綜上所述,本研究結果顯示,TIC檢查診斷乳腺癌SLN轉移的敏感度低、假陰性率高;而TIC聯合RIHC檢查診斷乳腺癌SLN轉移不僅敏感度高、假陰性率低,并且具有快速、及時的優點,值得在臨床推廣。
[ 1 ] Oldhirsch A, Ingle JN, Gelber RD, et al. Thresholds for therapies: highlights of the St Gallen International Expert Consensus on the primary therapy of early breast cancer 2009[J]. Ann Oncol, 2009, 20(8): 1319-1329.
[ 2 ] Giuliano AE, Hunt KK, Ballman KV, et al. Axillary dissection vs no axillary dissection in women with invasive breast cancer and sentinel node metastasis: a randomized clinical trial[J]. JAMA, 2011, 305(6): 569-575.
[ 3 ] Houvenaeghel G, Nos C, Mignotte H, et al. Micrometastases in sentinel lymph node in a multicentric study: predictive factors of nonsentinel lymph node involvement-Groupe des Chirurgiens de la Federation des Centres de Lutte Contre le Cancer[J]. J Clinl Oncol, 2006, 24(12): 1814-1822.
[ 4 ] Taffurelli M. Sentinel lymph node biopsy in breast cancer surgery[J]. Reviews in Health Care, 2011, 2(2): 101-112.
[ 5 ] Goldhirsch A, Winer EP, Coates AS, et al. Personalizing the treatment of women with early breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013[J]. Ann Oncol, 2013, 24(9): 2206-2223.
[ 6 ] Maguire A, Brogi E. Sentinel lymph nodes for breast carcinoma: an update on current practice[J]. Histopathology, 2016,68(1): 152-167.
[ 7 ] Orr RK, Hoehn JL, Col NF. The learning curve for sentinel node biopsy in breast cancer: practical considerations[J]. Arch Surg, 1999,134(7): 764-767.
[ 8 ] van de Vrande S, Meijer J, Rijnders A, et al. The value of intraoperative frozen section examination of sentinel lymph nodes in breast cancer[J]. Eur J Surg Oncol, 2009,35(3): 276-280.
[ 9 ] Chicken DW, Kocjan G, Falzon M, et al. Intraoperative touch imprint cytology for the diagnosis of sentinel lymph node metastases in breast cancer[J]. Br J Surg, 2006,93(5): 572-576.
[10] Giobuin SM, Kavanagh DO, Myers E, et al. The significance of immunohistochemistry positivity in sentinel nodes which are negative on haematoxylin and eosin in breast cancer[J]. Eur J Surg Oncol,2009,35(12):1257-1260.
[11] Tsujimoto M, Nakabayashi K, Yoshidome K, et al. One-step nucleic acid amplification for intraoperative detection of lymph node metastasis in breast cancer patients[J]. Clin Cancer Res, 2007,13(16): 4807-4816.
[本文編輯] 姬靜芳
Application of touch imprint cytology plus rapid immunohistochemistry staining in the intraoperative assessments of breast cancer sentinel lymph nodes (SLNs)
ZHU Shu-ling, WU Tong-tong, FANG Qin, YANG Qing-xu*
Department of Pathology, Huizhou Municipal Central Hospital,Huizhou 516001,Guangdong, China
Objective: To investigate the clinical values of touch imprint cytology (TIC) plus rapid immunohistochemistry staining (RIHC) in the intraoperative assessments of breast cancer sentinel lymph nodes (SLNs). Methods: A total of 281 SLNs from 89 patients of breast cancer were examined in this study. All those SLNs were evaluated with intraoperative touch imprint cytology and rapid immunohistochemistry staining. The RIHC indicator was pan-cytokeratin 19 (pan-CK 19). The two intraoperative methods are compared the results of SLNs metastases by postoperative routine pathological examination. Results: The detection rate of SLNs with TIC was 25.8% (23/89); the detection rate with touch imprint cytology plus rapid immunohistochemistry staining technique was 36.0%(32/89), which was much higher than touch imprint cytology(P<0.05). The specificity was both 100.0%. The sensitivity of TIC and TIC plus RIHC for detecting positive lymph node was 69.7% (23/33) and 97.0% (32/33), respectively. The sensitivity of TIC plus RIHC was significantly higher than that of TIC (P<0.001). The false negative rate of SLNs with TIC was 30.3% (10/33); the false negative rate with TIC plus RIHC was 3.0% (1/33), which was lower than TIC (P<0.001). Conclusions: Touch imprint cytology plus rapid immunohistochemistry staining can provide a reliable and precise result for the intraoperative assessment of breast cancer SLNs.
breast cancer; sentinel lymph node; touch imprint cytology; rapid immunohistochemistry staining
2016-05-28 [接受日期] 2016-07-25
朱淑玲,副主任技師. E-mail: 1760885423@qq.com
*通信作者(Corresponding author). Tel: 0752-2288244, E-mail: HZBINGLI@126.com
10.12025/j.issn.1008-6358.2016.20160630
短篇論著
R 365
A

