地塞米松致小鼠肌肉衰減綜合征模型建立
魯飛翔 李 軍 周仙杰 朱德生 劉慶春
(錦州醫科大學武警總醫院聯合培養基地,北京 100039)
?
地塞米松致小鼠肌肉衰減綜合征模型建立
魯飛翔 李 軍1周仙杰 朱德生1劉慶春
(錦州醫科大學武警總醫院聯合培養基地,北京 100039)
目的 通過研究地塞米松(DXM)對C57BL/6小鼠肌肉質量和肌肉功能的影響,探究理想的肌肉衰減綜合征小鼠的建模方法。方法 將23只6~7個月齡C57BL/6小鼠分為2組:對照組(0.9%生理鹽水)、實驗組(5 mg/kg DXM),連續皮下注射6 w。前2 w每3 d及后4 w每7 d測量小鼠攝食量、體重和體成分。最后一次給藥24 h后,利用水迷宮測量游泳速度和輪式跑臺測量掉落次數。結果 實驗組肌肉質量和肌肉功能較對照組顯著降低(P<0.05),實驗組攝食量與體重較對照組顯著增加(P<0.05)。結論 OXM能夠建立理想且可靠的肌肉衰減綜合征小鼠模型。
地塞米松;肌肉衰減綜合征;肌肉質量;肌肉功能
肌肉衰減綜合征最早由Rosenberg于1989年提出,泛指增齡性肌量減少和肌力下降〔1〕。2010年,歐洲老年人肌肉衰減綜合征工作組(EWGSOP)提出了目前廣泛使用的肌肉衰減綜合征的定義,即老年人骨骼肌質量、力量及功能下降的一種病癥〔2〕。構建肌肉衰減綜合征動物模型對進一步進行營養與運動干預及臨床研究具有重要意義。地塞米松(DXM)屬于糖皮質激素,具有抗炎、抗過敏和抗休克的功效,但長期注射會導致體重增加、肌肉萎縮、脂肪向心性堆積等副作用〔3〕。目前最精確的活體動物體成分測量儀器——Echo MRITM,準確監測肌肉量的變化情況,評價模型的建立效果。該儀器利用磁共振成像的原理,能夠測量活體實驗動物的脂肪、筋肉、自由水及總水含量,具有快速、精準、無需對動物進行麻醉等優點〔4〕。很少有關DXM建肌肉衰減綜合征鼠模型的研究,而且這些研究用的都是幼齡鼠,DXM作用于幼齡鼠不僅會使肌肉含量下降,也會造成體重下降〔5~8〕。DXM用于幼齡鼠的造模方法可能不符合很大一部分肌肉衰減綜合征老年人的體重反而高于健康老年人群的現象〔9〕,而且并沒有對肌肉力量和功能方面做出評價。本文探討皮下注射DXM誘導成年C57BL/6小鼠模型的效果,以期為構建理想的肌肉衰減綜合征小鼠模型提供實驗指導。
1 材料與方法
1.1 實驗動物 C57BL/6小鼠,雄性,23只,SPF級,6~7個月齡,體重(31.01±3.25)g,購自北京維通利華實驗動物技術有限公司,合格證號:SCXK(京)2012-0001。小鼠飼養于通風良好、清潔的動物房中,室溫(23±2)℃,相對濕度(50±5)%,12 h晝夜照明節律,所有小鼠均自由攝食、飲水。動物實驗經過動物福利委員會審批。
1.2 藥物 DXM磷酸鈉注射液(國藥集團榮生制藥有限公司,國藥準字H41020036)購自武警總醫院。儀器:Echo MRITM小動物體成分分析儀購自匯佳生物股份(中國)有限公司,Morris水迷宮和YLS-4C轉棒式疲勞儀均購自北京眾實迪創科技發展有限責任公司。
1.3 試劑配制 DXM磷酸鈉注射液規格(1 ml∶5 mg),DXM的配置:將1 ml DXM磷酸鈉注射液與9 ml 0.9%的生理鹽水混勻配成濃度為0.5 mg/ml的新鮮DXM。
1.4 動物分組與處理 購買的C57BL/6小鼠在實驗室適應性飼養1 w后進行稱重和排序,按隨機數字表分成2組,對照組11只,實驗組12只,每只小鼠分籠飼養,造模終止取材前禁食12 h,造模期間自由飲食飲水。造模期間每天分別對實驗組和對照組小鼠進行皮下注射0.9%生理鹽水和5 mg/kg DXM,皮下給藥體積均為0.1 ml/10 g,連續6 w。
1.5 體成分測量 準確稱量體重后,直接把未麻醉的小鼠放置在一定大小的透明塑料動物艙內(儀器配備,分40 g和80 g兩個型號,本實驗選用40 g型號的動物艙),然后將動物艙插入Echo MRITM側面的管狀空間,通過儀器專用的控制和分析軟件進行掃描,測量得到小鼠的筋肉、脂肪、自由水和總水含量。其中測量得到的筋肉含量能直接反映小鼠的整體肌肉量。
1.6 肌肉功能測試 Ⅰ水迷宮去平臺,加入適量牛奶,混勻直至水變成乳白色。將小鼠放入水中,水迷宮視頻分析系統記錄小鼠的游泳軌跡,計算小鼠90 s內游泳平均速度。Ⅱ參照并改進輪式跑臺造小鼠疲勞模型的方法,經摸索確定測試小鼠肌肉功能的轉速為25 r/min,每次10 min,共3次,每跑10 min休息1 min,計算小鼠在30 min內掉落的次數。
1.7 模型評鑒指標 造模期間每天觀察小鼠的一般狀態,主要包括精神狀態、毛發顏色、活動情況等;前2 w每3 d及后4 w每7 d測量體重和體成分,6 w后測量游泳速度和從輪式跑臺上掉落次數。實驗組肌肉質量和功能相比對照組降低顯著為造模成功。
1.8 統計學方法 采用SPSS17.0統計軟件進行單因素方差分析。
2 結 果
2.1 外觀形態觀察 注射生理鹽水和DXM后,各組給予充足的飼料和水,墊料每周換一次,保持干燥。對照組皮毛順滑且有光澤,精神狀態良好,較為活潑;而實驗組體型明顯肥胖,毛色光澤度較差,中間夾雜的白毛較多,反應遲緩,活動較少。
2.2 DXM對小鼠攝食量的影響 實驗組與對照組相比,每日攝食量顯著增加(P<0.01)。見表1。
2.3 DXM對小鼠體重的影響 造模第9天后,實驗組體重較對照組明顯增加(P<0.05)。21 d后,極顯著增加(P<0.01)。DXM誘導的肌肉衰減綜合征小鼠模型出現了明顯的體重增長。見表2。
2.4 DXM對小鼠體成分的影響 造模前各組筋肉含量差異無統計學意義,而在第3天實驗組筋肉含量相比對照組顯著降低(P<0.01),在第21天以后相比對照組明顯降低(P<0.05)。DXM能夠明顯降低小鼠肌肉量。見表3。從造模第6天開始,實驗組脂肪含量相比對照組顯著增加(P<0.01)。DXM能夠顯著增加小鼠脂肪含量。見表4。
2.5 DXM對小鼠肌肉功能的影響 造模6 w后,實驗組游泳速度〔(8.84±1.45)cm/s〕比對照組〔(10.70±0.91)cm/s〕顯著下降(P<0.01)。實驗組輪式跑臺掉落次數〔(21.70±6.54)次〕比對照組〔(3.73±1.83)次〕顯著增加(P<0.01)。DXM誘導的肌肉衰減綜合征小鼠模型肌肉功能顯著下降。
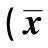
表1 各組造模后不同時間點每日攝食量情況±s,g)
與對照組比較:1)P<0.05,2)P<0.01;下表同
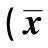
表2 各組造模前后體重變化±s,g)
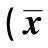
表3 各組造模前后筋肉含量變化±s,g)
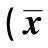
表4 各組造模前后脂肪含量變化±s,g)
3 討 論
肌肉衰減綜合征是與增齡相關的進行性骨骼肌質量下降,伴有肌肉質量和(或)肌肉功能減退的綜合征。肌肉衰減綜合征不但降低了老年人的活動能力和生活質量,也增加了跌倒及骨折風險〔10〕。糖皮質激素促進多種組織中的蛋白質分解,如肌肉、皮膚、淋巴和骨組織等。同時它抑制蛋白質的合成,使同化作用降低,因而出現負氮平衡,使肌肉和淋巴組織萎縮,傷口愈合緩慢等〔3〕。臨床研究證實,經糖皮質激素治療的患者,其肌肉含量明顯減少〔11〕。DXM是糖皮質激素中效價最高且作用持續時間最長的一種激素類藥物,因此利用DXM建立肌肉衰減綜合征模型具有周期較短且效果明顯等優點。DXM對成年鼠主要通過促進蛋白質降解而誘發肌肉衰退〔12〕。糖皮質激素刺激胃產生胃酸和胃蛋白〔13〕。DXM引起小鼠脂肪量增多可能是小鼠體重增加的主要原因。糖皮質激素通過促進肝臟脂肪從頭合成,增加循環中的脂肪流量,促進脂肪組織中脂肪的沉積〔14〕。本研究不僅采用了國際最先進的Echo MRITM精準地檢測小鼠的筋肉含量變化,還通過改進現有的行為學實驗設備及方法,采用兩種不同的方法探究DXM對小鼠肌肉功能的影響,實現了動物模型評價指標與臨床診斷標準的高度一致性。綜上,DXM不僅能夠明顯降低小鼠的肌肉質量,還能顯著降低小鼠的肌肉功能。DXM能夠建立理想且可靠的肌肉衰減綜合征小鼠模型。
1 Fielding RA,Vellas B,Evans WJ,etal.Sarcopenia:an undiagnosed condition in older adults.current consensus definition:prevalence,etiology and consequences.international working group on sarcopenia〔J〕.J Am Med Directors Assoc,2011;12(4):249-56.
2 Cruz-Jentoft AJ,Baeyens JP,Bauer JM,etal.Sarcopenia:European consensus on definition and diagnosis:report of the european working group on sarcopenia in older people〔J〕.Age Ageing,2010;39(4):412-23.
3 張海英,李玉珍.糖皮質激素類藥物的藥理特性及合理應用〔J〕.臨床藥物治療雜志,2004;2(3):36-42.
4 Galgani JE,Smith SR,Ravussin E.Assessment of EchoMRI-AH versus dual-energy X-ray absorptiometry to measure human body composition.〔J〕.Int J Obesity,2011;35(9):1241-6.
5 Nakao R,Yamamoto S,Yasumoto Y,etal.Dosing schedule-dependent attenuation of dexamethasone-induced muscle atrophy in mice〔J〕.Chronobiol Int J Biol Med Rhythm Res,2014;31(4):506-14.
6 Chiu CS,Weber H,Adamski S,etal.Non-invasive muscle contraction assay to study rodent models of sarcopenia〔J〕.BMC Musculosk Disord,2011;12(11):2060-0.
7 Troncoso R,Paredes F,Parra V,etal.Dexamethasone-induced autophagy mediates muscle atrophy through mitochondrial clearance〔J〕.Cell Cycle,2014;13(14):2281-95.
8 Macedo AG,Krug AL,Souza LM,etal.Time-course changes of catabolic proteins following muscle atrophy induced by dexamethasone〔J〕.Steroids,2015;107:30-6.
9 Orgel E,Mueske NM,Sposto R,etal.Limitations of body mass index to assess body composition due to sarcopenic obesity during leukemia therapy〔J〕.Leuk Lymph,2016:1-8.
10 Tanimoto Y,Watanabe M,Sun W,etal.Association of sarcopenia with functional decline in community-dwelling elderly subjects in Japan〔J〕.Geriat Gerontol Int,2013;13(4):958-63.
12 Thissen JP,Schakman O,Gilson H.Mechanisms of glucocorticoid-induced myopathy〔J〕.Bone,2009;45(4):S123-4.
13 仇洪影.糖皮質激素類藥物的作用機制和臨床應用〔J〕.中國中醫藥現代遠程教育,2010;8(4):90-1.
14 Cai Y,Song Z,Zhang X,etal.Increased de novo lipogenesis in liver contributes to the augmented fat deposition indexamethasone exposed broiler chickens (Gallus gallus domesticus)〔J〕.Comp Biochem Physiol Toxicol Pharmacol,2009;150(2):164-9.
〔2015-03-19修回〕
(編輯 苑云杰)
魯飛翔(1991-),男,碩士,主要從事肌肉衰減綜合征研究。
R332
A
1005-9202(2016)22-5542-03;
10.3969/j.issn.1005-9202.2016.22.021
1 北京大學實驗動物中心

