外源ABA對低溫不同光周期下四季秋海棠葉片花色素苷的誘導機理
郭美麗,王佳婉,王 珂,靳慧慧,張開明
(河南農業大學林學院,鄭州 450002)
?
外源ABA對低溫不同光周期下四季秋海棠葉片花色素苷的誘導機理
郭美麗,王佳婉,王 珂,靳慧慧,張開明*
(河南農業大學林學院,鄭州 450002)
以‘超級奧林匹克’四季秋海棠(‘Super Olympia’Begoniasemperflorens)為材料,于常溫(25 ℃/15 ℃)等日照條件下用0、5、10、50、100、500 μmol/L脫落酸(ABA)和低溫(15 ℃/6 ℃)不同光周期下用10 μmol/L ABA分別噴施各處理植株,對不同處理下植株的色素含量、內源激素含量及其酶活性進行比較分析,探討ABA對其葉片花色素苷合成的調控作用及其機理。結果顯示:(1)常溫等日照條件下,四季秋海棠葉片在5和10 μmol/L ABA處理后的第3~5天有明顯變紅趨勢,且花色素苷含量和內源ABA含量顯著增加,而內源赤霉素(GA)含量的下降幅度較為顯著,相應的花色素苷合成關鍵酶和運輸酶活性也顯著提高。(2)低溫條件下,四季秋海棠葉片花色素苷積累量與光周期密切相關,短日照處理的花色素苷積累量最大并顯著高于等日照和長日照,但等日照與長日照下花色素苷積累量無顯著差異;外源10 μmol/L ABA處理均可顯著提高低溫不同光周期下四季秋海棠葉片的花色素苷含量。(3)外施10 μmol/L ABA增加了低溫下長日照和等日照處理中DFR(二氫黃酮醇-4-還原酶)還原反應中H供體NADPH的含量,促使DFR和UFGT(糖苷轉移酶)的活性上調進而增加了花色素苷的含量;外施ABA處理均能夠提高低溫不同光周期處理組的內源ABA含量,降低內源GA的含量,與花色素苷的生成量相一致。研究表明,外源ABA能夠通過調節花色素苷合成的關鍵酶來影響花色素苷的合成,外施適宜濃度ABA能夠促進四季秋海棠葉片花色素苷的積累,可用于實際生產中的葉片著色調控管理。
四季秋海棠;脫落酸;花色素苷;低溫;光周期
花色素苷(anthocyanin)是一種黃酮類次生代謝物,是一類從紅到紫到藍的植物色素,一般產生于植物葉片。當外界環境改變使得葉綠素遭到破壞,其含量明顯下降時,色素也就隨之而產生了[1]。影響花色素苷生成的環境因素有很多[2],其中光照、溫度、旱澇、營養缺乏、激素、衰老等條件下都能影響花色素苷的形成。溫度一般通過影響色素合成關鍵酶的活性,從而調節花色素苷的合成以及色素之間的組成和比例[3]。溫度是影響葉片中花色素苷含量的重要因素。它不僅從基因轉錄水平上影響花色素苷合成,同時影響花色素苷的穩定[4]。低溫可以誘導一些植物體內花色素苷合成的相關基因的表達,使花色素苷含量升高,如使PAL(苯丙氨酸解氨酶)、CHS(查爾酮合成酶)、CHI(查爾酮異構酶)和DFR(二氫黃酮醇-4-還原酶)基因的轉錄水平升高幾倍;而高溫卻能抑制這些基因的表達,使花色素苷含量降低。光照也是影響彩葉植物葉色變化最重要的環境因素。它從強度、光質和光照時間等方面影響花色素苷的合成及調節相關酶的活性[5]。紫葉矮櫻、紫葉小檗等必須在全光照下才能發揮其彩葉的最佳色彩[6]。彩葉秋海棠的葉色在遮陰處呈暗綠色,在全光下則呈紅褐色[7]。光照是影響花青苷合成的最重要的外部因子,合成花青苷的4個關鍵酶,PAL、CHS、DFR、UFGT(糖苷轉移酶)都是光調節酶,都以光敏色素為受體[8]。已有研究表明,外源ABA處理不僅可以提高果實的成熟度,促進果實軟化和后熟衰老進程,而且在改善果實質量、促進果實著色方面也有明顯的效果。
四季秋海棠(Begoniasemperflorens)是城市綠化當中應用較廣的一種地被和花壇花卉,綠葉系列的‘超級奧林匹克’品種,能夠在外界環境(如強光、低溫等)的影響下積累花色素苷,而使葉片變紅。低溫對花色苷合成的促進是通過提高花色苷合成相關酶的活性, 也可通過強化結構基因的表達水平、 增加酶的含量來實現。脫落酸(abscisic acid, ABA)可提高一些植物的葉片或果實中 PAL、CHS、CHI、F3H(黃烷酮-3-羥基化酶)、UFGT 等酶的活性,促進花色苷合成[9]。如劉延吉等[10]發現ABA可提高南果梨(Pyrusussuriensis)PAL、CHI活性,促進果皮花色苷的積累。在低溫條件下,不同光周期與外源ABA對花色素苷的積累是否有存在互作關系,目前我們并不清楚。因此,本實驗中我們選用綠葉系列的‘超級奧林匹克’四季秋海棠品種作為材料,選用最適花色素苷積累的ABA激素濃度(10 μmol/L),研究外源激素ABA與不同光周期對花色素苷合成的影響。為花色素苷合成過程中的環境因子交叉作用的研究提供理論依據。
1 材料和方法
1.1 材料培養
參試材料‘超級奧林匹克’(‘Super Olympia’)綠葉系列的四季秋海棠品種,種子購于鄭州貝利得花卉有限公司。將種子播種于25 cm寬、200個孔的穴盤內,營養土內含有3∶1∶1(v / v / v)泥炭、蛭石和珍珠巖混合而成的基質。生長環境為氣溫25 ℃/18 ℃(白天/夜晚)、光周期16 h /8 h(白天/夜晚)、相對濕度70%~85%,待植株長至3~4片葉時,挑選形態長勢一致的幼苗分裝成幾組,以備實驗處理使用。
1.2 材料處理
1.2.1 常溫下不同濃度ABA處理 將分裝的幼苗放于光照培養箱內,生長環境為25 ℃/15 ℃(白天/夜晚)、等日照、空氣相對濕度70%~85%、光照強度800 lx。試驗設置0、5、10、50、100、500 μmol/L ABA 6個濃度處理組,每組進行4次重復,每天于早上9:00和晚上9:00對其葉片正反面進行2次ABA噴施。分別在處理的第0、1、3和5天進行拍照,并取正常功能葉片測定相關生理指標。
1.2.2 低溫不同光周期下外施ABA處理 根據以上實驗的結論選用10 μmol/L的 ABA濃度,并在白天/夜晚15 ℃/6 ℃低溫、光照強度為800 lx環境條件下進行不同光周期處理。試驗處理時要把花蕾去除,選擇生長基本一致的四季秋海棠綠葉品種植株。外源ABA處理設10 μmol/L ABA(ABA)和不噴施對照(CK)兩個水平,光周期設置長日照(L,白天/夜晚16 h/8 h)、等日照(Q,白天/夜晚12 h/12 h)和短日照(S,白天/夜晚8 h/16 h)3個水平,共組成CK+L(對照+長日照)、ABA+L(ABA+長日照)、CK+Q(對照+等日照)、ABA+Q(ABA+等日照)、CK+S(對照+短日照)、ABA+S(ABA+短日照)6個處理組合。每個處理3次重復,每個重復選取5盆植株進行試驗,處理時間為15 d。處理結束后取出拍照,并取足夠的正常功能葉立即置于液氮中,保存在-80 ℃的冰箱內,用于測定相關生理指標。
1.3 測定指標及方法
1.3.1 花色素苷含量 花色素苷含量測定參照Mita等[11]的方法加以改進。取樣0.1 g用液氮研磨,加1% HCl甲醇液放入2 mL離心管于4 ℃下保存24 h待測。13 000 g在 4 ℃離心15 min ,既可測定530 nm和650 nm處的吸光值A530和A650,按公式(A530- 0.25×A650)計算花色苷含量。
1.3.2 葉綠素含量 葉綠體色素含量參照Porra[12]的方法測定。各處理分別取0.2 g凍樣用2 mL的80%丙酮在遮光下提取,分光光度計(SHIMADZUUV-2401PC)測量662 nm、644 nm、445 nm處的吸光值A662、A644、A445,通過以下公式計算出葉綠素a(Chla)、葉綠素b(Chlb)和類胡蘿卜素(Car)的含量。
Chla=9.78×A662-0.99×A644
Chlb=21.4×A644-4.65×A662
Car=4.69×A445-0.268×(Chla+Chlb)
1.3.3 相關酶活性 (1)PAL和CHI活性 取0.3 g 凍樣加入5 mL提取液(0.05 mol/L Na2HPO4/KH2PO4pH 7.0,0.05 mol/L抗壞血酸,0.018 mol/L巰基乙醇),冰浴勻漿,4 ℃下15 000 g離心20 min,上清液為酶粗提液用于測定PAL、CHI活性。3次取樣重復。
PAL活性測定采用Lister[13]的方法。取0.5 mL粗酶液加入2.5 mL的反應液 (硼酸緩沖液pH 8.8,0.01 mol/L苯丙氨酸),置于34 ℃反應30 min,用三氯乙酸終止反應,在5 000 g離心5 min除去變性的蛋白質。反應生成的肉桂酸含量用在290 nm處的吸光值來表示。每分鐘光密度變化0.001所需的酶量為1活性單位。對照實驗用不加苯丙氨酸的反應液代替正常的反應液進行。
CHI活性測定采用Lister等[14]的方法進行。取0.75 mL的粗酶提液加入2 mL混合液(50 mmol/L Tris-HCl,pH 7.4,牛血清蛋白7.5 mg/mL,50 mmol/L KCN),然后加50 μL 1 mg/mL的查爾酮溶液置于34 ℃水浴30 min,另取同量的酶提液沸水浴10 min為對照,測定在381 nm吸光值的變化來表示CHI的活性。每分鐘光密度變化0.001所需的酶量為1活性單位。
(2)DFR和UFGT活性 粗酶液提取參照Murray[14]報導的方法加以改進。取樣品1 g加液氮研磨后,加入5 mL -20 ℃的丙酮混勻離心,棄去上清液,用4 mL -20 ℃丙酮再提取一次,沉淀用4 mL (0.1 mol/L硼酸緩沖液pH 8.8,5 mmol/L抗壞血酸)溶液提取,上清液為DFR和UFGT酶的粗提液。
DFR活性檢測實驗參照Stafford 和Lester[15]報導的方法。取0.5 mL酶提液加入0.6 mL反應混合液[(0.1 mol/L Tris緩沖液(pH 7.4),1 μmol/L脫氫櫟精(Dihydroquercetin),1 mmol/L NADPH,1單位的葡萄糖-6-磷酸脫氫酶以及6 μmol/L的葡萄糖-6-磷酸)]共1.1 mL,在34 ℃水浴1 h后,用1 mL的乙酸乙酯提取3次,合并提液,然后用0.2 mL的蒸餾水提取3次。乙酸乙酯部分用氮氣吹干,加入2.5 mL的正丁醇:鹽酸(95∶5 V/V)于95 ℃水浴30 min,在550 nm 測定吸光值,用來表示由無色花色素(leuocyanidin)向花色素轉變的量,取同量的酶提液沸水浴10 min為對照。每小時光密度變化0.001所需的酶量為1酶活性單位。
UFGT活性測定參照Lister和Lancaster[14]的方法。取酶液0.5 mL加入0.5 mL的反應液 [0.05 mol/L二甘氨酸緩沖液(pH 8.0),1 mmol/L的槲皮素和2.5 mmol/L的UDP-葡萄糖],反應液在34 ℃水浴30 min后,用0.75 mL 20% 三氯乙酸的甲醇溶液終止反應,于5 000 r/min離心5 min,上清液貯藏于-20 ℃待測。用高效液相色譜檢測櫟精的減少量并用其表示酶活性。
(3)谷胱甘肽-S轉移酶(GST)活性 每個處理取0.3 g 待測樣品加入1.8 mL的硼酸緩沖液, 離心后取上清液待測,利用南京建成生物工程研究所提供的谷胱甘肽-S轉移酶測定試劑盒提供的方法進行測定。
1.3.4 NADP+和NADPH含量 稱取約0.1 g組織樣品,加入0.9 mL酸性提取液,冰浴研磨,煮沸5 min,冰浴中冷卻后,10 000 g 4 ℃離心10 min,取上清液至另一新的離心管中,加入等體積的堿性提取液使之中和,10 000 g 4 ℃離心10 min,取上清液冰上保存供測定NADP+含量。另外,稱取約0.1 g組織樣品,加入0.9 mL堿性提取液,冰浴研磨,煮沸5 min,冰浴中冷卻后,10 000 g 4 ℃離心10 min,取上清液至另一新的離心管中,加入等體積的酸性提取液使之中和,10 000 g 4 ℃離心10 min,取上清液冰上保存供測定NADPH含量。NADP+和NADPH含量測定采用蘇州科銘生物技術有限公司試劑盒,按照相關試劑盒說明書進行相關操作。
1.3.5 ABA和GA含量 取樣之前,用自來水將葉片沖洗干凈之后,稱取0.3 g樣品(用液氮速凍后保存在-80 ℃的低溫冰箱中),加2 mL樣品提取液(80%甲醇,內含1 mmol/L BHT),在冰浴下研磨成勻漿,轉入10 mL試管,再用2 mL提取液分次將研缽沖洗干凈,一并轉入試管中,搖勻后放置在4 ℃冰箱中。4 ℃下提取4 h,1 000 g離心15 min(實驗中離心機型號LDZ5-2,4 000 r/min), 取上清液。沉淀中加1 mL提取液,攪勻,置4 ℃下再提取1 h,離心,合并上清液并記錄體積,殘渣棄去。將上清液用氮氣吹干,除去提取液中的甲醇,用樣品稀釋液定容每個處理取0.3 g 樣品樣進行ABA、GA的酶聯免疫檢測,利用中國農業大學提供的ELISA植物激素測定試劑盒提供的方法進行。
1.4 數據分析
用Statistic 5.0進行差異顯著性分析,用Excel 2007計算平均值和標準差,用OriginPro 7.5軟件制圖。
2 結果與分析
2.1 常溫等日照下不同濃度外源ABA對四季秋海棠葉片內源激素、色素含量及相關酶活性影響
在常溫(白天/夜晚:25 ℃/15 ℃)等日照條件下,葉面噴施系列濃度的ABA后,四季秋海棠葉片花色素苷相關合成酶(PAL、CHI、DFR、UFGT)和運輸酶(GST)活性以及花色素苷、光合色素和內源激素含量發生了不同程度的變化(表1、2)。首先,外源噴施ABA對四季秋海棠葉片花色素苷的誘導作用因濃度不同而異,即在低濃度下(5~10 μmol/L),隨著濃度的增加,外源ABA對花色素苷的誘導作用逐漸增強,葉片花色素苷含量分別比對照顯著增加39.32% 和55.06%(P<0.05),且在10 μmol/L ABA處理5 d之后,四季秋海棠的葉片表現出肉眼可見的紅色;而當噴施的ABA濃度較高(50、100和500 μmol/L)時,這種對花色素苷的誘導作用則消失,葉片花色素苷含量比對照不同程度降低。其次,花色素苷合成相關的PAL、CHI、DFR、UFGT和運輸酶GST活性的變化與花色素苷的含量變化特征相符:在外源噴施ABA 濃度較低(5、10 μmol/L)時,5種酶活性較對照顯著增加,且與施用ABA的濃度呈正相關;而當噴施的ABA濃度較高(50、100和500 μmol/L)時,5種酶活性與對照相比大多顯著降低,部分沒有顯著變化。第三,外源噴施不同濃度的ABA之后,對植物的內源激素含量也造成不同的影響,即顯著提高了內源ABA的含量,而顯著降低了內源激素GA的含量,特別是10 μmol/L外源ABA處理下,內源ABA顯著增加了60.93%,而內源GA卻顯著降低了38.35%。再次,與葉片花色素苷含量變化相對應,葉片葉綠素含量(a和b)和類胡蘿卜素含量與外源施用ABA的濃度呈現顯著的負相關,即隨著ABA 濃度的增加而逐漸降低,如500 μmol/L的ABA 施用5 d后,葉綠素a、b含量分別比對照顯著降低32.56%和29.73%,類胡蘿卜素則比對照顯著降低8.00%,說明噴施ABA能促使葉片中葉綠素降解。因此,我們在后續試驗中選取10 μmol/L的ABA為試驗濃度。
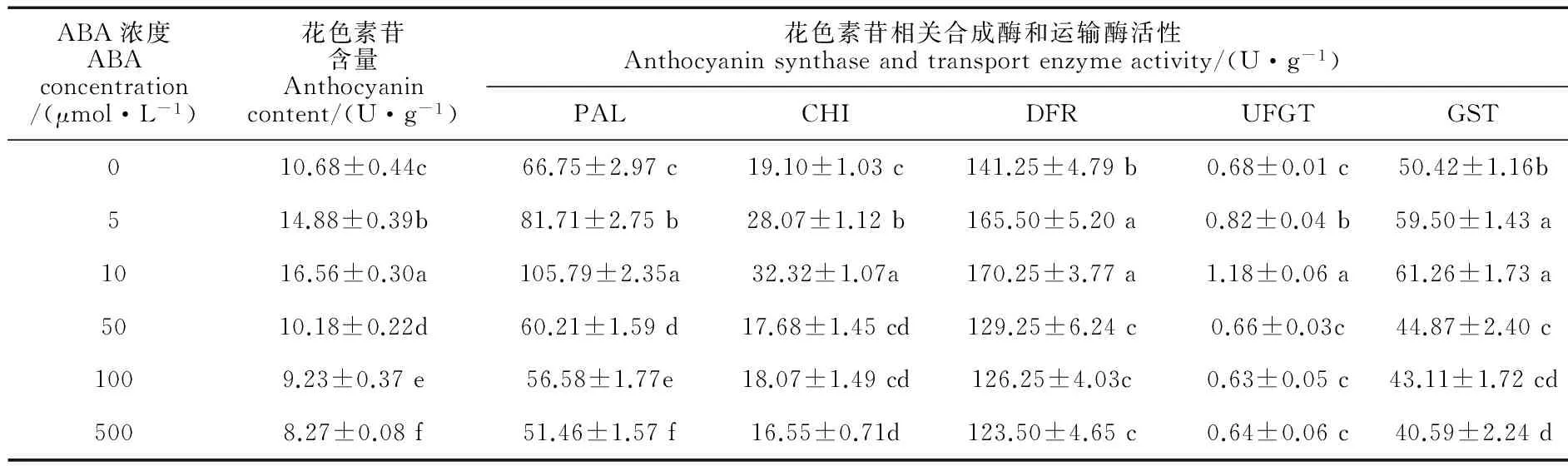
表1 常溫等日照下外源ABA處理對四季秋海棠葉片花色素苷含量及相關酶活性的影響
注:同列不同小寫字母表示處理間差異達到0.05顯著水平;下同
Note: Different letters in the same column indicate significant differences among treatments at 0.05 level; the same as below
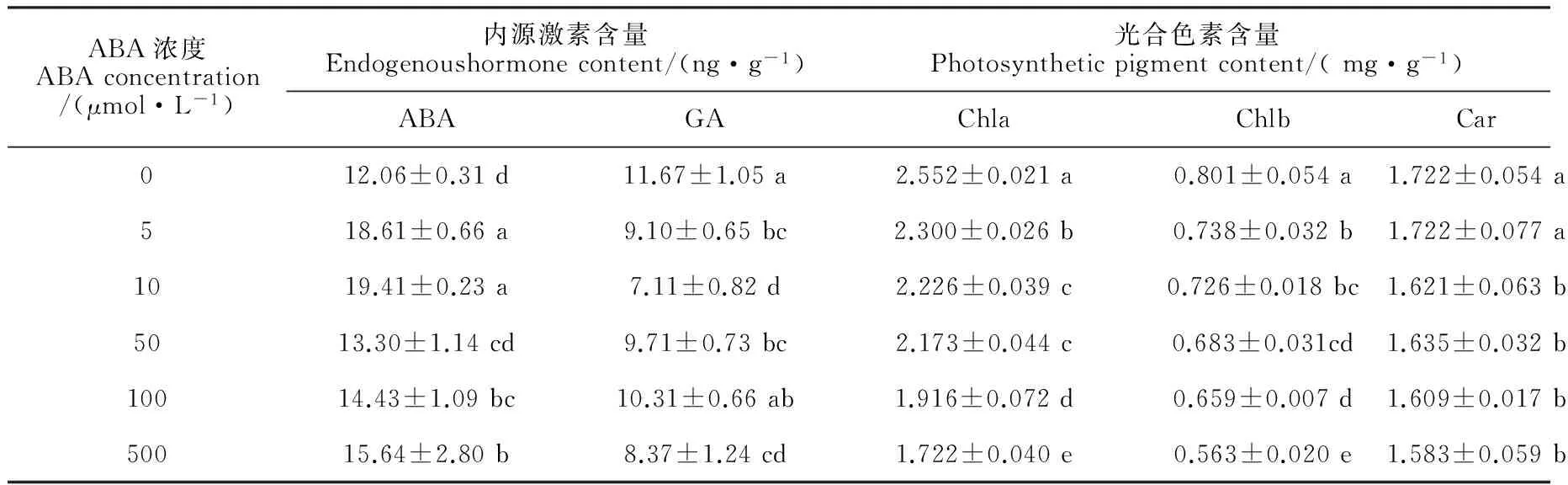
表2 常溫等日照下外源ABA處理對四季秋海棠葉片內源激素及色素苷含量的影響
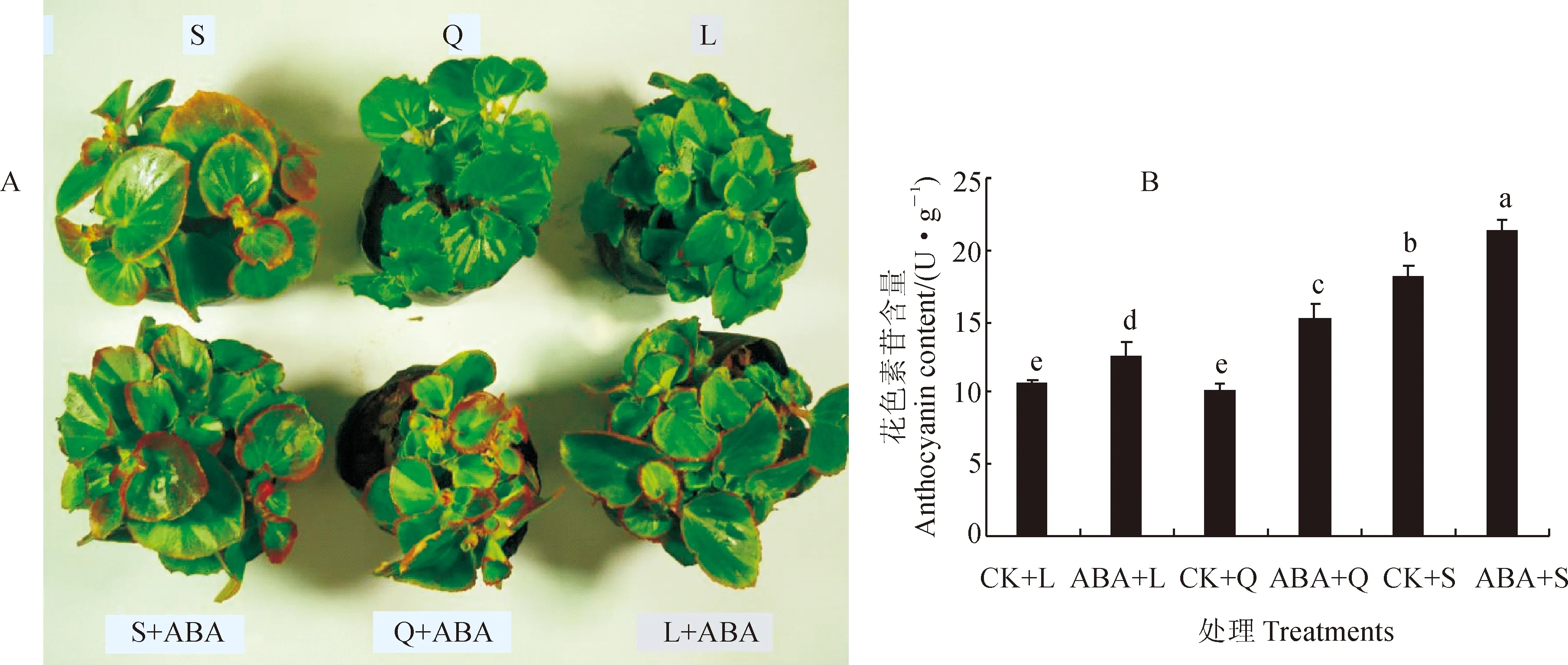
CK.不噴施ABA;L. 長日照(16 h/8 h);Q. 等日照(12 h/12 h);S. 短日照(8 h/16 h)。下同圖1 低溫不同光周期下外施10 μmol/L ABA對四季秋海棠花色素苷含量的影響CK.Control,without exogenous ABA;L. Long-day(16 h/8 h);Q. Intermediate-day(12 h/12 h);S. Short-day(8 h/16 h).The same as belowFig.1 Effect of 10 μmol/L exogenous ABA on anthocyamin content in leaves of B. semperflorens under low temperature and different photoperiodic treatment
2.2 低溫不同光周期下外源ABA對花色素苷含量及相關酶活性的影響
前期研究表明,四季秋海棠的綠葉品種‘超級奧林匹克’在秋季時葉片因積累花色素苷而變紅[16],這不僅是低溫的作用[17],也是短日照的作用,因為在不適宜光周期(長日照和等日照)下,即使給予低溫也不能誘導花色素苷合成[18]。在低溫條件下(白天/夜晚:15 ℃/6 ℃),短日照處理(S)促進了四季秋海棠葉片明顯變紅,而同期的長日照(L)和等日照(Q)處理并未使四季秋海棠葉片變紅(圖1,A);同時,短日照處理(CK+S)的花色素苷含量顯著高于其余處理,分別是長日照(CK+L)和等日照(CK+Q)處理的1.73和1.82倍(圖1,B)。在同樣的低溫下,同時外施10 μmol/L的ABA之后,不論是短日照(ABA+S)、等日照(ABA+Q)還是長日照(ABA+L),四季秋海棠葉片都呈現肉眼可見的紅色,同時它們葉片花色素苷含量較相應的對照處理(單獨低溫處理)顯著增加,但仍以短日照處理顯著較高(圖1,A、B)。相應地,四季秋海棠葉片花色素苷合成酶和運輸酶的活性也在噴施ABA之后較對照(單獨低溫處理)顯著增加,尤其是DFR和UFGT活性在長日照條件下噴施ABA之后分別提高了5.20%、7.57%,在短日照條件下分別增加了6.41%、18.71%,在等日照條件下分別提高了10.60%和19.20%;另外,各日照處理間相比較,仍以短日照處理葉片各相關酶活性顯著較高(表3)。這說明ABA在低溫和不適宜光周期條件下,直接促進花色素苷合成下游的DFR和UFGT酶的增加,進而促進了花色素苷的合成和積累,從而驗證了關于“低溫短日照條件下誘導四季秋海棠葉片合成花色素苷的關鍵物質基礎可能是ABA積累的推測。
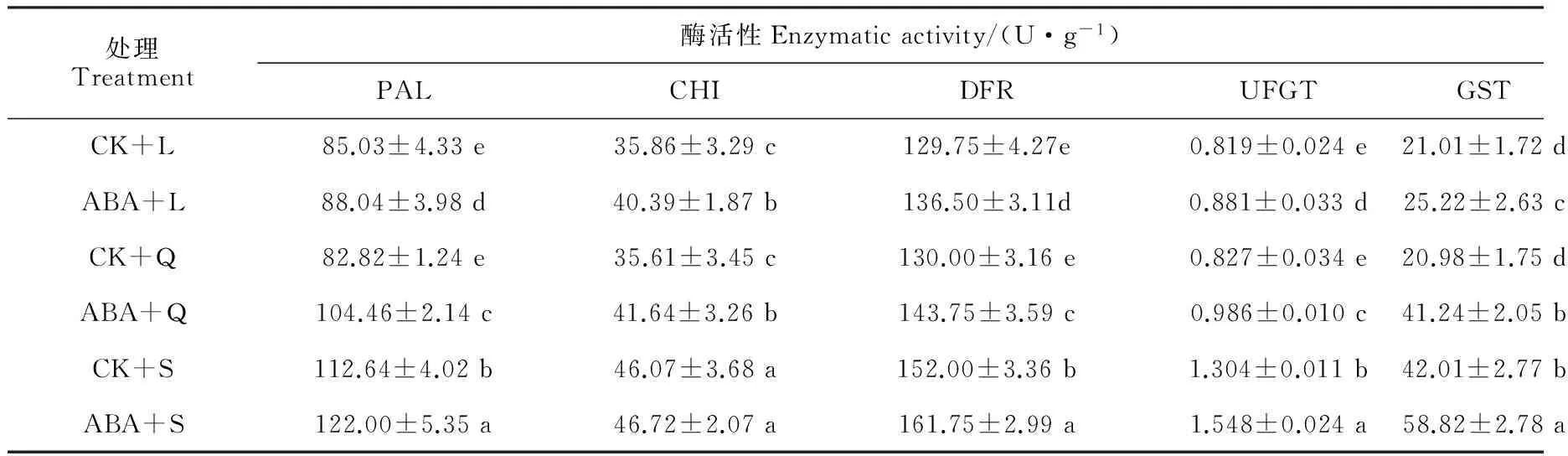
表3 低溫不同光周期下外施10 μmol/L ABA對四季秋海棠花色素苷相關合成酶和轉移酶活性的影響
2.3 低溫不同光周期下外源ABA對四季秋海棠葉片內源ABA和GA含量的影響
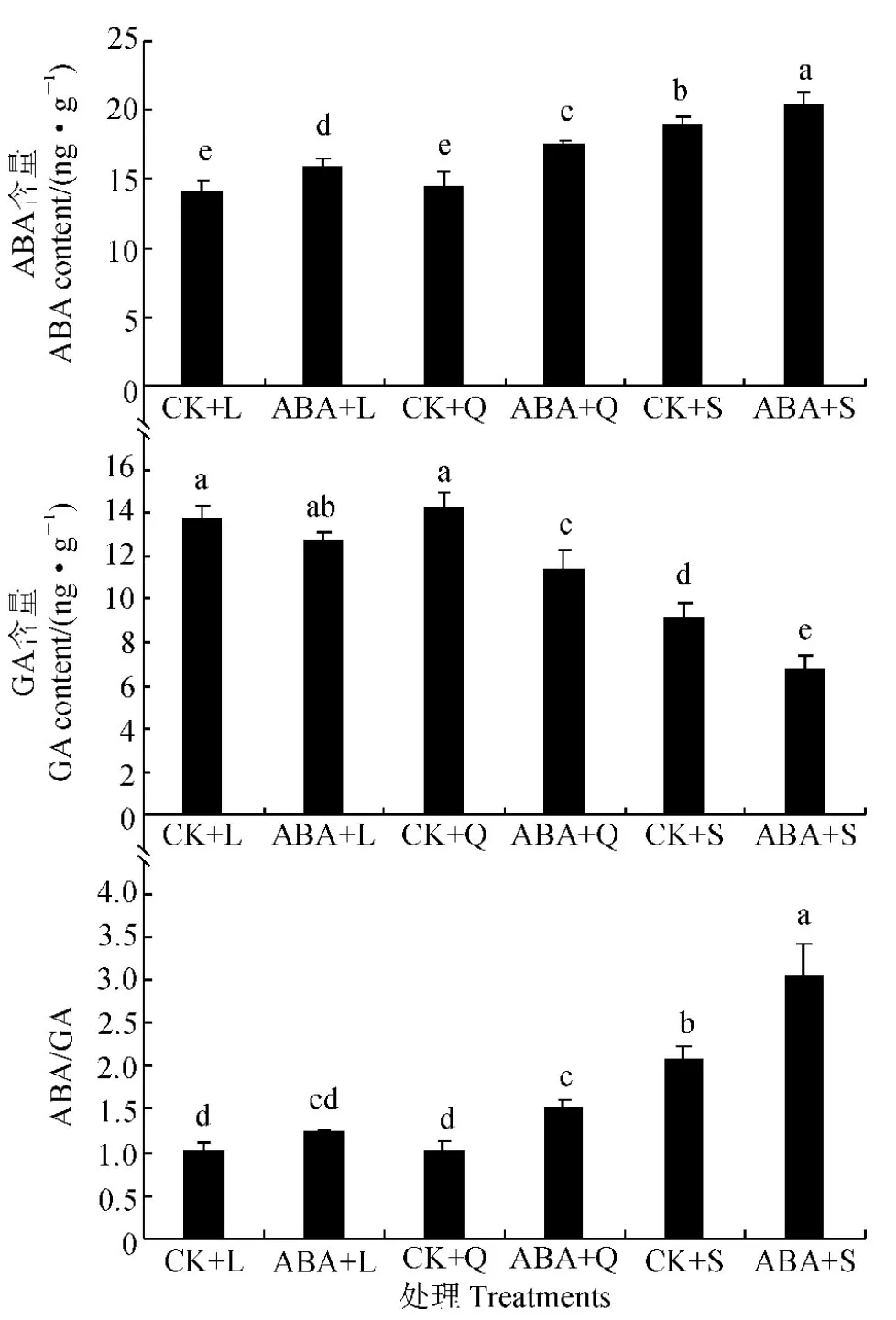
圖2 低溫不同光周期下外施10 μmol/L ABA后四季秋海棠ABA和GA含量Fig.2 ABA and GA contents under low temperature and different photoperiodic treatments with and without 10 μmol/L ABA on leaves of B. semperflorens
外源噴施ABA增加四季秋海棠葉片的內源ABA含量,而抑制內源GA含量,從而提高ABA/GA的比值(圖2)。其中,在單獨低溫條件下,短日照處理四季秋海棠葉片的內源ABA含量比長、等日照處理顯著較高,而內源GA含量澤顯著較低,從而致使其ABA/GA的比值也顯著較高;與單獨低溫處理對照組相比較,四季秋海棠葉片內源ABA含量在長、等、短日照處理分別顯著增加12.35%、20.00%、10.59%,而內源GA含量卻分別降低了7.61%、20.00%、25.00%,內源ABA/GA的比值則明顯上升。因此,外源ABA調整了植物體內源激素的比例,使植物體內具有較高的內源ABA含量和較低GA的含量,內源ABA/GA的比值顯著升高。
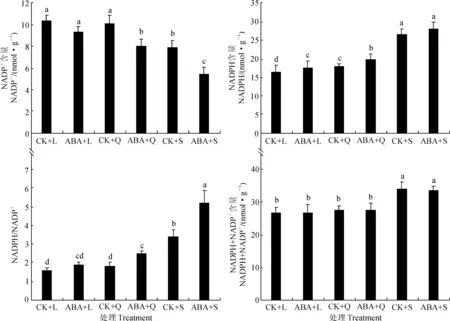
圖3 低溫不同光周期下外施10 μmol/L ABA對四季秋海棠葉片NADPH/NADP+比值變化Fig.3 NADPH/NADP+ ratio differences under low temperature and different photoperiodic treatments with and without 10 μmol/L ABA on leaves of B. semperflorens
2.4 低溫不同光周期下外源ABA對四季秋海棠葉片NADPH和NADP+含量的影響
在花色素苷合成的途徑中,DFR對花色素苷的最終形成起決定性作用,其反應需要NADPH參與[19]。由圖3可知,外源ABA雖未顯著提高低溫和不適宜的光周期(長、等日照)下四季秋海棠葉片的NADPH+NADP+的總量,但卻顯著增加了NADPH的含量(分別比對照提高了6.58%和11.72%),因此NADPH/NADP+比值顯著增加。這說明外源ABA處理后促進植物體內的NADP+向NADPH轉變,因此為DFR催化二氫類黃酮醇生成無色花青素提供H+,從而啟動了DFR的活性,進而促進花色素苷的合成。該結果驗證了我們的推測:低溫下不同光周期處理對四季秋海棠葉片花色素苷的誘導差異的物質基礎是ABA,即低溫短日照條件誘導四季秋海棠葉片合成花色素苷的關鍵物質基礎是ABA的積累。
3 討 論
通過考察外施ABA對四季秋海棠花色素苷合成的影響,發現不同濃度外源ABA處理下四季秋海棠花色素苷合成關鍵酶的變化趨勢與花色素苷含量的動態趨勢基本相吻合,較低濃度ABA(5~10 μmol/L)促進花色素苷合成酶(PAL、CHI、DFR和UFGT)及運輸酶(GST)活力的提高,進而提高了花色素苷的含量,表明ABA是通過調節花色素苷合成的關鍵酶來調控四季秋海棠葉片花色素苷的合成。而較高濃度的外源ABA(50、100、500 μmol/L)則對這些酶的活力沒有顯著影響,因此沒有花色素苷的生成。
在本試驗中,低濃度的外源ABA通過啟動花色素苷合成相關的酶(PAL、CHI、DFR和UFGT)和運輸酶(GST),顯著誘導了花色素苷在四季秋海棠葉片中的合成和積累。有研究表明,ABA的合成在果皮花色素苷的積累過程中起著關鍵的作用[20],900 mg/L的ABA處理能顯著提高葡萄果實中的花色素苷含量[21];雷鳴等也發現1 000 mg/L的ABA對紅地球葡萄果實的花色素苷具有明顯的促進作用[22]。本試驗研究表明低溫、不同光周期條件下外源10 μmol/L ABA明顯增加四季秋海棠葉片花色素苷的積累,這說明低溫不同光周期條件下10 μmol/L ABA對四季秋海棠葉片花色素苷的積累有明顯的促進作用,且花色素苷積累量與光周期密切相關,短日照時花色素苷積累量最大而長日照時積累量最小。
外施ABA處理能夠調節植物體內ABA和GA的平衡,進而調控花色素苷的形成[23],本試驗中外源ABA 對四季秋海棠葉片花色素苷的合成誘導可能是通過提高內源的ABA含量,并降低GA的含量來實現的。低溫條件下,只有短日照啟動了花色素苷合成及運輸相關的酶活性,并誘導花色素苷顯著積累,葉片顯著變紅,這可能與低溫和短日照條件能顯著誘導植物體內ABA含量增加有關。而在低溫條件下,長日照和等日照處理植株體內的ABA 含量較低,而GA含量較高,因此花色素苷相關的合成酶和運輸酶未被啟動,因此沒有花色素苷的合成。
花色素苷的生物合成過程中,要通過花色素苷合成關鍵酶(PAL、CHI、DFR 和 UFGT)相互協調,使花色素苷合成過程順利進行。郭磊等[24]研究發現ABA參與了花色素苷合成的調控,對花色素苷合成具有促進作用。ABA還能通過轉錄因子調控結構基因的表達,進而提高酶的活性,最終促進花色素苷合成。本試驗中,ABA處理后長日照和等日照下的四季秋海棠葉片花色素苷合成酶和運輸酶活性顯著提高,尤其是提高花色素苷合成途徑中下游的DFR和UFGT活性,DFR在花色素苷合成的途徑中發揮著關鍵作用,與花色的產生直接相關[25]。因此,噴施ABA能夠誘導低溫長日照和等日照處理下的四季秋海棠葉片合成花色素苷,關鍵因素可能在于對DFR活性的誘導。DFR是將二氫黃酮醇轉化為花色素反應的第一個酶,它以不同二氫類黃酮醇為底物,利用輔因子NADPH中的H將4位的羰基還原為羥基[18],以轉化生成相對應的不穩定的無色花青苷元,然后這些無色花青苷元在ANS,3GT催化下分別形成花青素、花葵素、花翠素。因此DFR活性的啟動與否與NADPH的含量有直接關系,NADPH含量及NADPH/NADP+比值的增加為DFR提供足夠的H供體,因此能啟動DFR活性。本試驗中,低溫短日照處理下葉片NADPH的含量較長日照和等日照處理的高,NADPH/NADP+的比例也較高,因此DFR活性被啟動,相應地,其下游的UFGT活性也顯著增加,花色素苷最終合成;而低溫長日照或等日照處理的植株,在外源噴施ABA之后,NADPH含量和NADPH/NADP+的比例顯著增加,因此DFR和UFGT被啟動,誘導花色素苷合成。
本試驗研究發現,低溫不同光周期條件下外施10 μmol/L ABA 增加了 四季秋海棠葉片NADPH/NADP+比值,這說明外施 ABA 增加了 DFR 還原反應的 H 供體的NADPH 含量,這可能是提高 DFR活性的一個重要因素。因此,DFR對花色素苷的最終形成起決定性作用。
綜上所述,不同濃度ABA對四季秋海棠花色素苷合成關鍵酶的變化趨勢與花色素苷含量的動態趨勢相吻合,較低濃度ABA促進花色素苷合成酶PAL、CHI、DFR和UFGT活力的提高,進而提高了花色素苷的含量,而較高的濃度則抑制了PAL、CHI、DFR和UFGT酶活力,抑制了花色素苷的生成,這說明ABA通過調節花色素苷合成的關鍵酶來影響花色素苷的合成。外源ABA在低溫不同光周期條件下能使花色素苷含量、相關酶活性、ABA/GA提高,但對葉綠素含量和GA含量卻有抑制作用,尤其在低溫短日照條件效果更顯著。因此,ABA處理可作為一種有效的方法,用于葉片著色機制的研究。
[1] 丁 銳.國外花色素苷的研究現狀與進展[J].漢中師范學院學報(自然科學),2004,22(2):73-78.
DING R. Advances on the research of anthocyanins at abroad [J].JournalofHanzhongTeachersCollege(Natural Science), 2004, 22(2):73-78.
[2] DOONER H K. What is anthocyanin[J].Mol.Gen.Genet, 1983,198:136-141.
[3] 于曉南,張啟翔.觀賞植物的花色素苷與花色[J].林業科學,2002,38(3):147-153.
YU X N, ZHANG Q X. Anthocyanin in ornamental plant and color ecpress[J].ScientiaSilvaeSinicae, 2002,38(3):147-153.
[4] 張學英,張上隆,駱 軍,等.果實花色素苷合成研究進展[J].果樹學報,2004,21(5):456-460.
ZHANG X Y, ZHANG S L, LUO J,etal. Advances in research on fruit anthocyanin synthesis [J].JournalofFruitScience, 2004,21(5):456-460.
[5] 李紅秋,劉石軍.光強度和光照時間對色葉樹葉色變化的影響[J].植物研究,1998,18 (2):194-205.
LI H Q, LIU S J. Effects of light intensity and illumination time on leaf colour variations of coloured leaf trees [J].BulletinofBotanicalResearch,1998,18(2):194-205.
[6] 張啟翔,吳 靜,周肖紅.彩葉植物資源及其在園林中的應用[J].北京林業大學學報,1998,18(2):194-205.
ZHANG Q X, WU J, ZHOU X H. Resource of color leaf plants and its application in Gardens [J].JournalofBeijingForestryUniversity,1998,18(2):194-205.
[7] SMITH L B, WASSHAUSEN D C. Begonia solimutata a new Brazilianspeciesw hose leaf color varies with light intensity [J].Begonian, 1990, 57: 151-152.
[8] JUZ G, LIU C L, YUAN Y B. Activity of chalcone synthesis and UGDP: falvonoid-3-glycosy transferaseinrelation to anthocyanin synthesis in apple[J].ScientiaHortieuhurae, 1995, 63: 175-l 85.
[9] 陳文龍,趙昶靈,支偉特,等.高等植物花色苷生物合成調控的研究進展[J].中國農學通報, 2013,29(33): 271-276.
CHEN W L, ZHAO C L, ZHI W T,etal. Progress of regulation of anthocyanin biosynthesis in higher plants[J].ChineseAgriculturalScienceBulletin,2013,29(33):271-276.
[10] 劉延吉,王 嵩,呂德國.ABA對南果梨花色素苷含量、合成酶及信號分子的影響[J].沈陽農業大學學報,2009,40(1):7-10.
LIU Y J, WANG S, Lü D G. Effect of ABA on anthocyanin, partial synthetic enzymes and signaling molecule Nanguo Pear [J].JournalofShenyangAgriculturalUinversity,2009,40(1):7-10.
[11] MITA S, MURANO N, AKAIKE M,etal. Mutants of Arabidopsis thaliana with pleiotropic effects on the expression of the gene for β-amylase and on the accumulation of anthocyanin that are inducible by sugars [J].ThePlantJournal, 1997, 11(11): 841-851.
[12] PORRA R J. The chequered history of the development and use of simultaneous equations for the accurate determination of chlorophyll a and b[M]. Discoveries in Photosynthesis. Springer Netherlands, 2005: 633-640.
[13] MURRAY J R, HACKETT W P. Dihydroflavonol reducatase activity in relation to differential anthocyanin accumulation in juvenile and mature phaseHederahelixL.[J].PlantPhysiology, 1991, 97: 343-351.
[14] LISTER C E, LANCASTER J E, WALKER J R L. Developmental Changes in Enzymes Biosynthesis in the Skins of Red and green apple cultivars[J].JournalofScienceFoodandAgriculture, 1996, 71: 313-320.
[15] STAFFORD H A, LESTER H H. Flavan-3-ol biosynthesis the conversion of (+)-dihydroquercetin and flavan-3, 4-cis-diol (leucocyanidin) to (+)-catechin by reductases extracted from cell suspension cultures of douglas fir [J].PlantPhysiology, 1984, 76(1): 184-186.
[16] ZHANG K M, LI Z, LI Y,etal. Carbohydrate accumulation may be the proximate trigger of anthocyanin biosynthesis under autumn conditions inBegoniasemperflorens[J].PlantBiology,volume,2013, 15: 991-1 000.
[17] ZHANG K M, GUO M L, HE D,etal. The inhibition effect and excessive carbon flux resulting from blocking anthocyanin biosynthesis under darkness inBegoniasemperflorens[J].PlantGrowthRegul., 2016, 35: 22-30.
[18] 王 珂.外部因素對四季秋海棠花色素苷合成的影響[D].鄭州:河南農業大學,2014.
[19] 張學英,張上隆,駱 軍,等.果實花色素苷合成研究進展[J].果樹學報,2004,21(5):456-460.
ZHANG X Y, ZHANG S L, LUO J,etal. Advances in research on fruit anthocyanin synthesis [J].JournalofFruitScience,2004,21(5):456-460.
[20] 李 明.ABA、S3007促進蘋果果實著色的研究[D].沈陽:沈陽農業大學,2005:20-25.
[21] 胡春霞,王 麗.ABA、BR對葡萄果實花色素苷和可溶性糖的影響[J].鞍山師范學院學報,2009,11(2):42-44.
HU C X, WANG L. Effect of ABA and BR on anthocyanin and soluble sugar of grape seeds [J].JournalofAnshanNormalUniversity, 2009, 11(2): 42-44.
[22] 雷 鳴,吳 江,等. ABA與NAA對紅地球葡萄果實形狀的影響[J].浙江農業科學,2008,2:153-155.
LEI M, WU J,etal. Effect of ABA and NAA of Hongdiqiu grape fruit shape [J].JournalofZhejiangAgriculturalSciences,2008, 2:153-155.
[23] 劉延吉,向文娟,田曉艷.南果梨愈傷組織及花青素誘導的初步研究[J].食品與生物技術學報,2008,27(3):83-87.
LIU Y J, XIANG W J, TIAN X Y. Study on inducing callus and cyaniding of Nanguo pear [J].JournalofFoodScienceandBiotechnology,2008,27(3):83-87.
[24] 郭 磊,蔡志翔,張斌斌,等.葉片噴施脫落酸對桃果實著色及相關基因表達的影響[J].植物營養與肥料學報,2013,19(6):1 463-1 469.
GUO L, CAI Z X, ZHANG B B,etal. Effect of foliar application of ABA on fruit coloration and expression of some related genes in peach [J].JournalofPlantNutritionandFertilizer, 2013,19(6):1 463-1 469.
[25] 周 琳,王 雁,任 磊,等.牡丹二氫黃酮醇4一還原酶基因PsDFR1的克隆及表達分析[J].植物生理學報,2011,47(9):885-892.
ZHOU L, WANG Y, REN L,etal. Cloning and expression analysis of dihydroflavonol 4-reductase genePsDFR1 from tree peony (PaeoniasuffruticosaAndr)[J].PlantPhysio-logyJournal, 2011,47(9):885-892.
(編輯:裴阿衛)
Mechanism of ABA-induced Anthocyanin Biosynthesis in Begoniasemperflorens under Different Photoperiods and Low Temperatures
GUO Meili, WANG Jiawan, WANG Ke, JIN Huihui, ZHANG Kaiming*
(Forestry College, Henan Agricultural University, Zhengzhou 450000, China)
Taking the ‘Super Olympic’BegoniaSemperflorensas material, at room temperature (25 ℃/15 ℃) under normal sunshine condition or low temperature (15 ℃/6 ℃) under the different photoperiods, we sprayed the plants with abscisic acid (ABA). The endogenous pigment content, hormone contents and enzyme activities were comparatively analyzed to discuss the effects of exogenous ABA on anthocyanin biosynthesis and its mechanism. The results showed: (1) at room temperature and normal sunshine condition, the leaves will get red obviously on the 3th days when applying ABA (5 and 10 μmol/L). The anthocyanin content and endogenous ABA content of pigment increased significantly, while the endogenous gibberellin (GA) content decreased significantly. The anthocyanin biosynthesis and trans portation also increased significantly. (2) Under the condition of low temperature, the anthocyanin accumulation was closely related to photoperiod and the anthocyanin accumulation was the largest in short day; The anthocyanin accumulation in sunshine condition also increased, but there was no significant difference between sunshine and long sunshine. (3) The addition of 10 μmol/L ABA treatment increased the content of H donor NADPH in DFR reduction under long day and sunshine condition. Under low temperature treatment, the activities of DFR and UFGT enzymes increased and then increased the anthocyanin content. In addition, exogenous ABA treatment could increase endogenous ABA content and decrease the content of endogenous GA in low temperature and different photoperiod treatments, which was consistent with the production of anthocyanin. The results showed that exogenous ABA can affect the synthesis of anthocyanins by regulating key enzyme in anthocyanin synthesis of flowers. The application of suitable concentration of ABA can promote theB.semperflorensleaf anthocyanin accumulation and can be used to control leaf coloring in actual production.
Begoniasemperflorens; abscisic acid; anthocyanin; low temperature;photoperiod
1000-4025(2016)10-1999-09
10.7606/j.issn.1000-4025.2016.10.1999
2016-05-19;修改稿收到日期:2016-10-15
國家自然科學基金(311101562)
郭美麗(1989-),女,碩士,主要從事園林植物生長發育與調控。E-mail:1278658212@qq.com
*通信作者:張開明,副教授,碩士生導師,主要園林植物生長發育與調控。E-mail:miss1199@126.com
Q945.18; Q945.78
A

