鹽酸氯苯胍在紅笛鯛體內的藥代動力學及殘留消除規律
湯菊芬,蔡 佳,黃 瑜,廖建萌,黃月雄,簡紀常
(1.廣東海洋大學水產學院,廣東 湛江 524088;2.廣東省水產經濟動物病原生物學及流行病學重點實驗室,廣東 湛江 524088;3.湛江市食品藥品檢測所,廣東 湛江 524022)
鹽酸氯苯胍在紅笛鯛體內的藥代動力學及殘留消除規律
湯菊芬1,2,蔡 佳1,2,黃 瑜1,2,廖建萌3,黃月雄1,2,簡紀常1,2
(1.廣東海洋大學水產學院,廣東 湛江 524088;2.廣東省水產經濟動物病原生物學及流行病學重點實驗室,廣東 湛江 524088;3.湛江市食品藥品檢測所,廣東 湛江 524022)
在水溫(28±2)℃、鹽度28 條件下,將鹽酸氯苯胍(Robenidine hydrochloride,ROBH)按30mg/kg 的劑量口灌紅笛鯛(Luthjanus sanguineus),用HPLC-MS/MS法研究ROBH在紅笛鯛體內的藥代動力學和殘留消除規律。結果表明:單劑量口灌給藥后,紅笛鯛血漿中ROBH的藥時數據符合一級吸收二室模型,藥物在血漿中的達峰時間tp為1.79 h,血藥濃度峰值Cmax為211.38 μg/L,藥時曲線下面積(AUC0-∞)為5 229.16 μg/(L·h),消除半衰期(t1/2β)為46.99 h。ROBH在紅笛鯛其他組織中分布較廣,消除速度較慢,肌肉、肝臟和腎臟的Cmax分別為37.58、863.02、1 063.24 μg/kg,tp均為1.5 h,AUC0-∞分別1 017.03、20 841.20、30 743.04 μg/(kg·h);t1/2β分別為26.35、14.05和24.31 h。連續5 d口灌給藥后,紅笛鯛血漿、肌肉、肝臟和腎臟中的藥物消除半衰期t1/2分別為46.14、36.11、28.62、26.92 h。以10μg/kg為最高殘留限量,肌肉作為食用靶組織,在本試驗條件下,建議休藥期不少于7 d。
鹽酸氯苯胍;紅笛鯛;藥代動力學;藥物殘留;消除
鹽酸氯苯胍(Robenidine hydrochloride,ROBH)化學名稱1,3-雙(對氯苯叉氨基)胍鹽酸鹽,屬胍基衍生物,分子式C15H14Cl3N5,相對分子質量370.67,可影響球蟲ATP,干擾蛋白質代謝,是一種抗球蟲藥,具有廣譜、高效、低毒、安全、適口性好等特點,對雞、兔的急、慢性球蟲病有良好療效。鹽酸氯苯胍在水產養殖上主要用于防治魚類的孢子蟲病[1-2]。目前,對鹽酸氯苯胍的研究主要集中在殘留檢測方面,其檢測方法主要有高效液相色譜法[3-5]、液質聯用法[6-9]等。ROBH在水產動物體內的藥代動力學和殘留消除研究尚未見報道。本研究以紅笛鯛(Luthjanus sanguineus)為試驗對象,研究ROBH在其體內的藥代動力學和殘留消除規律,為ROBH在鯛科魚類養殖中的規范應用提供理論依據。
1 材料與方法
試驗用魚購自湛江市南三島張高儀老板魚排,在廣東海洋大學東海島實驗基地暫養1周,經檢測確認體內無ROBH殘留。挑選健康、規格整齊 [體質量(256.35±9.18)g]的魚進行試驗。
試劑:ROBH標準品,純度98.5%,購自美國JK;甲醇、甲酸,色譜級;乙酸、無水硫酸鈉等均為分析純。
主要儀器液相色譜-質譜聯用儀(配有ESⅠ源),美國Thermo Fisher公司。
1.2 方法
1.2.1 ROBH標準溶液配制 用甲醇將ROBH標準品準確配制成1.0mg/mL,再用甲醇稀釋100倍,配制成質量濃度10μg/mL的標準儲備液,于–4℃冰箱儲存備用。
準確量取ROBH標準儲備液,用體積分數50%的甲醇溶液分別稀釋成1、2、5、10、20、50、100、250、500、1 000ng/mL等10個質量濃度梯度的標準工作液。
1.2.2 色譜條件 色譜條柱:Thermo Fisher Hypersil Gold C18(150mm×2.1mm,5μm );進樣體積:10 μL;柱溫:30℃;流動相:A為甲醇,B為5 mmol/L乙酸銨(含體積分數0.1%甲酸);流速:300 μL/min。洗脫程序見表1。
作為與醫學相關聯的學科,藥學教育的目標是培養從事藥物研發和藥學服務的專業人才。目前世界多國為加強藥學生的職業責任感,均采用了宣誓儀式。
1.2.3 質譜條件 參照文獻[10]稍加修改:噴霧電壓4 500 Ⅴ,鞘氣壓力45 kPa,輔助氣壓10 kPa,毛細管溫度350℃,碰撞壓200.0 mPa。質譜參數見表2。

表1 梯度洗脫程序Table 1 Gradient elution program %

表2 鹽酸氯苯胍的保留時間和質譜條件Table 2 HPLC retention time and optimized MS/MS conditions for ROBH
1.2.4 給藥及樣品采集 藥物代謝組:將紅笛鯛(試驗前停飼24 h)隨機分成15個組(分別與采樣時間點對應),每組10尾魚置于一個0.3 m3的玻璃桶中,另取魚數尾作為空白對照組。ROBH按30mg/kg劑量口灌實驗魚,于給藥后的 0.15、0.25、0.5、1、1.5、2、4、6、8、12、24、48、72、96、120 h時,每組取魚5尾,尾靜脈采血后快速取其肝臟、腎臟和背部肌肉。每尾魚血液于肝素鈉處理的離心管中,以5 000 r/min離心8min,取上清液于–20℃冰箱保存。肝臟、腎臟、肌肉分別于無菌離心管中,置–20℃冰箱保存備用。
殘留消除組:紅笛鯛隨機分成7組,每組魚10尾,按30mg/kg劑量連續口灌ROBH 5 d,分別在最后1次給藥后0.5、1、2、3、5、7、10 d采樣,采樣方法同藥物代謝組。
1.2.5 樣品處理 參照文獻[8-9]稍加修改:血漿和各組織在室溫下自然解凍,取血漿1mL,肌肉、肝2.0 g,腎臟0.2 g,剪碎,分別于離心管中,依次加入5mL甲醇(含體積分數1%甲酸)、4 g無水硫酸鈉,渦旋振蕩,超聲15min,以4 000 r/min離心10min,吸取上層清液后,殘渣重復上述操作1次,合并上清液,在40℃水浴中用氮氣吹干。用5.0mL甲醇溶解殘渣,渦旋振蕩,超聲15min,以4 000r/min離心10min,上清液用0.22 μm微孔濾膜過濾,濾液待上機檢測。
1.2.6 線性范圍和檢測極限測定 選質量濃度為1、2、5、10、20、50、100、250、500、1000ng/mL等10個標準工作液,按照1.2.2、1.2.3所確定的實驗條件,以峰面積為縱坐標,對應的標準溶液濃度為橫坐標進行線性回歸。
1.2.7 回收率和精密度測定 采用加標回收法,在空白樣品(血漿、肌肉、肝臟、腎臟)中分別加入5、50、100ng/mL的ROBH標準溶液,再按1.2.5處理樣品,每個濃度做6次平行。
1.2.8 數據處理 用Excel2003處理藥時數據,模型的擬合和參數推算用DAS3.0軟件處理。
2 結 果
2.1 方法驗證
2.1.1 線性范圍和檢測極限 ROBH為1~1 000ng/mL時,峰面與質量濃度有良好線性關系(圖1)。以3倍信噪比計算,檢出限為0.001mg/kg。
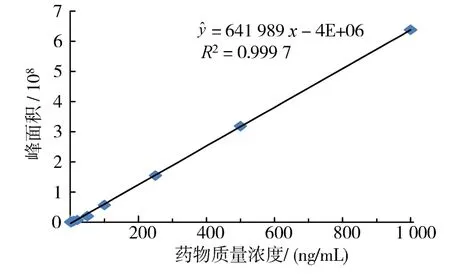
圖1 ROBH標準曲線Fig.1 Standard curve of ROBH
2.1.2 回收率和精密度 表3可見,ROBH在添加水平5、50、100ng/mL時,各組織加標平均回收率為 88.85%~116.78%,相對標準偏差為 2.96%~9.15%,說明樣品處理方法穩定,重現性好,可滿足各組織中樣品檢測要求。
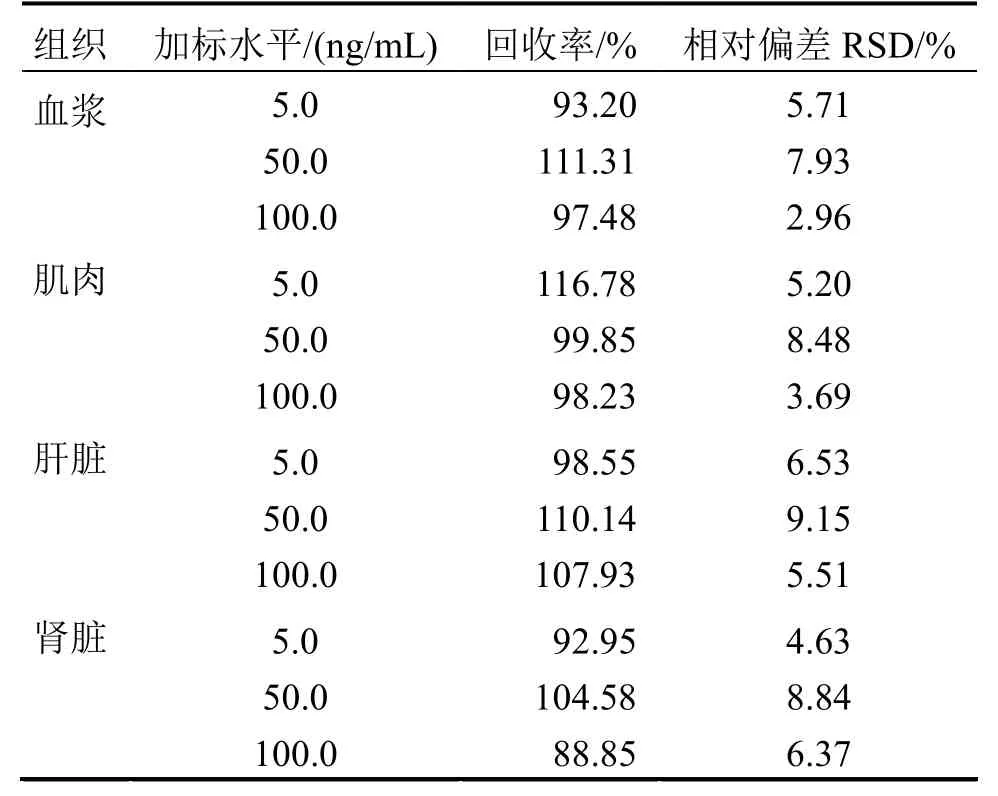
表3 紅笛鯛空白組織添加鹽酸氯苯胍的回收率和精密度Table 3 Recovery and accuracy of ROBH in blank tissues of Luthjanus sanguineus
2.2 ROBH在紅笛鯛各組織中的藥–時曲線
紅笛鯛按30mg/kg口灌ROBH后,藥-時曲線見圖2。從圖2可見,各組織中的藥-時曲線均呈雙峰現象,出峰時間(tp)血漿中分別為1.5和6 h,肌肉中分別為1.5和8 h,肝臟中分別為1.5和12 h,腎臟中為 1.5和 8 h,藥物峰值 cmax血漿中分別為235.77和201.51 μg/L,肌肉中分別為37.58和 33.23 μg/kg,肝臟中分別為863.02和702.47 μg/kg,腎臟中分別為1 063.24和975.48 μg/kg。
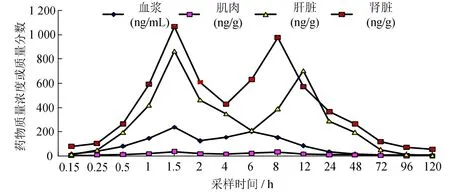
圖2 紅笛鯛口灌ROBH后組織中的藥 –時曲線Fig.2 Concentration-time curve of ROBH in tissues of Luthjanus sanguineus after oral administration
2.3 ROBH在紅笛鯛血漿中的藥代動力學參數
經DAS3.0軟件分析,ROBH血漿的藥 –時數據符合一級吸收二室模型,理論方程為C=290.17 e–0.12t+ 27.91 e–0.02t–318.08 e–1.09t,藥動學參數見表4。
2.4 ROBH在紅笛鯛其他組織中的藥代動力學參數
推算的ROBH在紅笛鯛體內組織中藥動學參數見表5。cmax和AUC0-∞:腎臟>肝臟>肌肉;MRT0-∞:肌肉>腎臟>肝臟;t1/2:肌肉>腎臟>肝臟。說明ROBH主要分布于腎臟和肝臟,在肌肉中平均駐留時間最長,消除半衰期明顯高于腎臟和肝臟。

表4 紅笛鯛口灌ROBH后血漿中的藥代動力學參數Table 4 Pharmacokinetic parameters in plasma of ROBH after oral administration to L.sanguineus

表5 紅笛鯛口灌ROBH后組織中的藥代動力學參數Table 5 Pharmacokinetic parameters in tissues of ROBH after oral administration to L.sanguineus
2.5 ROBH在紅笛鯛體內的消除
連續口灌5 d的藥物消除曲線見圖3,曲線方程及相關參數見表6。圖3和表6可見,ROBH殘留量在肌肉中最低,腎臟中最高。t1/2:肌肉>肝臟>腎臟>血漿,說明ROBH在紅笛鯛肌肉中消除最慢。
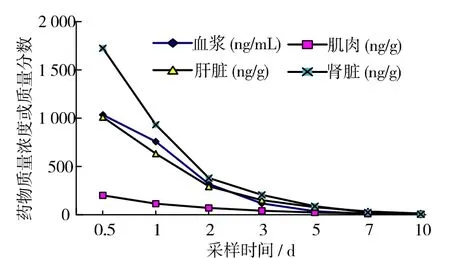
圖3 連續口灌5 d后組織藥物的消除曲線Fig.3 Elimination curve of ROBH in plasma and tissues of L.sanguineus after oral administration for five consecutive days

表6 ROBH在紅笛鯛組織中的消除規律及參數Table 6 Equation of elimination curve and parameters of ROBH in tissues after oral administration to L.sanguineus
3 討 論
3.1 ROBH在紅笛鯛組織中的藥–時曲線特征
紅笛鯛以30mg/kg單劑量口灌ROBH后,血漿和組織中的藥時曲線均出現明顯的雙峰現象。目前,關于口服藥物 c–t曲線的雙峰現象報道較多,認為引起該現象的主要原因是肝腸循環和非齊性吸收,兩峰相隔時間2~20 h[11-13]。藥物進入十二指腸后,可在小腸重吸收返回肝臟,形成肝腸循環,引起雙峰現象。口服藥物進入體內時,需經過胃腸道上、下兩個部位吸收,由于胃腸道的不同部位和管壁對藥物的通透性不同,也可導致雙峰現象[14]。此外,還可能與藥物的分布、重吸收有關,即當其他組織的藥物濃度高于血漿時,藥物可能轉移至血漿而引起血漿的另一個高峰[15]。由圖2可見,ROBH在吸收階段,肝臟和腎臟中的藥濃度明顯高于血漿,此時肝臟和腎臟中的ROBH可能轉移至血漿中,再隨血液分布于其他組織中而產生第2個濃度峰。
3.2 ROBH在紅笛鯛體內的藥代動力學特征
ROBH為驅蟲漁藥,目前尚未見ROBH在水產動物體內藥代動力學的研究報道。本研究在水溫(28 ±2)℃、鹽度28 條件下,將ROBH按30mg/kg的劑量口灌紅笛鯛后,紅笛鯛血漿中的藥時數據符合一級吸收二室模型,其血漿、肌肉、肝臟、腎臟中的藥物濃度均在1.5 h左右出現第1次峰值,cmax分別為211.380 0μg/L、37.58μg /kg、863.02μg/kg、1 063.24μg/kg,AUC0-∞分別為:5 229.16μg/(L·h)、1 017.03μg/(kg·h)、20 841.20μg/(kg·h)、30 743.04μg/(kg·h),說明ROBH口灌給藥時在紅笛鯛體內吸收較為緩慢,藥物多分布于肝臟和腎臟,血漿和肌肉中分布較少,大部分藥物經肝臟和腎臟直接排出。
t1/2β和MRT0-∞是反映藥物在動物體內消除快慢的重要參數。紅笛鯛單劑量口灌 ROBH后, t1/2β依次為:血漿(46.99 h)>肌肉(26.35 h)>腎臟(24.31 h)>肝臟(14.05 h),MRT0-∞依次為:血漿(129.72 h)>肌肉(41.29 h)>腎臟(39.19 h)>肝臟(27.62 h),說明ROBH在紅笛鯛體內血漿和肌肉中消除較緩慢,駐留時間較長。
3.3 連續口灌5 d后ROBH在紅笛鯛體內的殘留消除及休藥期
紅笛鯛連續5 d口灌給藥后,組織中的藥物殘留濃度依次為:腎臟>血漿>肝臟>肌肉,藥物t1/2β依次為:肌肉(46.14 h)>肝臟(36.11 h)>腎臟(28.62 h)>血漿(26.92 h),表明ROBH在紅笛鯛體內消除較為緩慢,肌肉中殘留消除最慢。班付國等[16]研究雞連續飼喂含500mg/kg氯苯胍的飼料7 d后停藥,在停藥后第3天,肌肉組織未檢出氯苯胍殘留,第5天各組織的殘留量均低于文獻[17]的規定,且殘留量脂肪中最高,其次為肝臟,肌肉中最低,表明氯苯胍在雞體內殘留消除較為緩慢。本研究結果與班付國等的結果基本一致,但ROBH在紅笛鯛體內的消除速度比氯苯胍在雞體內的慢,可能與研究對象對藥物的代謝速度不同有關。
目前,中國、歐盟及美國等均制訂了氯苯胍在動物源食品中的最高殘留限量。2002年,我國規定ROBH在雞脂肪、皮及其他可食用組織中的最高殘留限量(MRL)分別為 200、200、100μg/kg[17]。中國和歐盟等對水產品中 ROBH暫無明確的殘留限量要求。根據日本 2006年實施的食品中農業化學品殘留“肯定列表制度”要求,對于未制定最大殘留限量標準的農業化學品在食品中含量不得超過10μg/kg,對于已建立最高殘留限量標準的化學物質則在食品中含量不得超過最高標準[18]。本研究將ROBH的最高殘留限量暫定為10μg/kg,以肌肉作為食用靶組織,停藥后5 d時肌肉中的藥物濃度為 2.57 μg/kg,已低于設定的最大殘留限量,鑒于本研究未檢測魚皮中的藥物含量,為確保消費者的安全,將休藥期適當延長。因此,在本試驗條件下,建議ROBH在紅笛鯛體內的休藥期至少為7 d。
[1]吳仕輝,陳昆慈,戴曉欣,等.分散固相萃取/高效液相色譜法測定水產品中氯苯胍的殘留量[J].分析測試學報,2011,30(12):1356-1361.
[2]楊先樂,陸承平,戰文斌,等.新編漁藥手冊[M].北京:中國農業出版社,2005:204-241.
[3]李俊玲,劉學江,徐強,等.飼料中鹽酸氯苯胍的測定[J].飼料廣角,2003(15):20-23.
[4]劉勇軍,吳銀良,姜艷彬.高效液相色譜法測定雞組織與雞蛋中的鹽酸氯苯胍的殘留量[J].色譜,2010,28(9):905-907.
[5]莫金杰,劉娟,胡玉霞,等.HPLC法測定鹽酸氯苯胍原粉含量[J].畜牧市場,2011(2):19-20.
[6]DUBOⅠS M,PⅠERRET G,DELAHAUT P.Efficient and sensitive detection of residues of nine coccidiostats in egg and muscle by liquid chromatography electrospray tandem mass spectrometry[J].Journal of Chromatography B,2004,813(1/2):181-189.
[7]MATABUDUL D K,LUMLEYⅠ D,POⅠNTS J S.The determination of 5 anticoccidial drugs (nicarbazin,lasalocid,monensin,salinomycin and narasin) in animal livers and eggs by liquid chromatography linked with tandem mass spectrometry (LC-MS-MS) [J].Analyst,2002,127(6):760-768.
[8]KOT-WASⅠK A,WASⅠK A.Determination of robenidine in animal feeds by liquid chromatography coupled with diode-array detection and mass spectrometry after accelerated solvent extraction [J].Analytica Chimica Acta,2005,543(1/2):46-51.
[9]WⅠLGA J,KOT-WASⅠK K,NAMⅠE?NⅠK J.Comparison of extraction techniques of robenidine from poultry feed samples [J].Talanta,2007,73(5):812-819.
[10]OLEJNⅠK M,SZPRENGⅠER-JUSZKⅠEWⅠCZ T,JEDZⅠNⅠAK P.Multi-residue confirmatory method for the determination of twelve coccidiostats in chicken liver using liquid chromatography tandem mass spectrometry[J].Journal of Chromatography A,2009,1216(46):8141-8148.
[11]KROBOTH P D,SMⅠTH R B,RAULT R,et al.Effects of end-stage renal disease and aluminum hydroxide on temazepam kinetics[J].Clinical Pharmacology and Therapeutics,1985,37(4):453-459.
[12]PENTⅠKAⅠNEN P J,NEUⅤONEN P J,PENTTⅠLA A.Pharmaeokineties and pharmaeodynamies of glipizide in healthy volunteers [J].Ⅰnt J Clin Pharmacol Ther Toxieol,1983,21(2):98-107.
[13]黃月雄,湯菊芬,簡紀常,等.氟苯尼考在美國紅魚體內的藥代動力學和組織分布[J].廣東海洋大學學報,2014,34(3):58-64.
[14]FENG J,XU W,TAO X,et al.Simultaneous determination of baicalin,baicalein,wogonin,berberine,palmatine and jatrorrhizine in rat plasma by liquid chromatography–tandem mass spectrometry and application in pharmacokinetic studies after oral administration of traditional Chinese medicinal preparations containing scutellaria-coptis herb couple[J].Journal of Pharmaceutical and Biomedical analysis,2010,53 (3):591-598.
[15]王賢玉,宋潔,王偉利,等.氧氟沙星在吉富羅非魚體內的藥代動力學及殘留的研究[J].大連海洋大學學報,2011,26(2):144-148.
[16]班付國,吳寧鵬,李慧素,等.氯苯胍在雞組織中的殘留消除規律研究[J].中國獸藥雜志,2012,46(11):24-26.
[17]農業部235號公告.動物性食品中獸藥最高殘留限量[R],2002.
[18]吳曉峰,沈毅誠,孫蓓玲.日本“肯定列表制度”我國出口水產品面臨的嚴峻挑戰[J].中國動物檢疫,2006,23(6):49-50.
(責任編輯:劉慶穎)
Pharmacokinetics and Elimination Regularity of Robenidine Hydrochloride Residues in Luthjanus sanguineus
TANG Ju-fen1,2,CAⅠ-jia1,2,HUANG Yu1,2,LⅠAO Jian-meng3,QⅠN Qing-ying1,2,
HUANG Yue-xiong1,2,JⅠAN Ji-chang1,2
(1.Fisheries College,Guangdong Ocean University,Zhanjiang 524088,China; 2.Guangdong Provincial Key Laboratory of Pathogenic Biology and Epidemiology for Aquatic Economic Animals,Zhanjiang 524088,China; 3.Zhanjiang Food and Drug Inspection Institute,Zhanjiang 524022,China)
The pharmacokinetics and elimination regularity of Robenidine hydrochloride (ROBH) residues were investigated in tissues of Luthjanus sanguineus with a 30mg/kg body weight after oral administration at the water temperature of (28±2)℃ and salinity of 28 by HPLC-MS/MS method.The results showed that the date of ROBH concentration-time in plasma of L.sanguineus could be described as a two-compartment model with first-order absorption.The peak time (tp) was 1.79 h,and the maximum concentration (Cmax) was 211.38 μg/L,the area under the concentration-time curve(AUC0-∞) was 5 229.16 μg/(L·h),and the elimination hal-life (tl/2β) of plasma was 46.99 h.ROBH has a wide distribution in organizations of L.sanguineus and eliminated slowly.The Cmaxin muscle,liver and kidney were 37.58,863.02 and 1 063.24 μg/kg; tpwere all 1.50 h; AUC0-∞were 1 017.03,20 841.20 and 30 743.04 μg/(kg·h); tl/2βwere 26.35,14.05 and 24.31 h,respectively.After oral administration continuous with 30mg/kg dose for 5 days,the t1/2in plasma,muscle,liver and kidney of L.sanguineus were 46.14,36.11,28.62,and 26.92 h,respectively.Ⅰf the maximum residue limits (MRL) is 0.01mg/kg and the muscles as the edibletarget tissue,the withdraw period should not be less than 7 days under this experiment condition.
Robenidine hydrochloride; Luthjanus sanguineus; pharmacokinetics; drug residues; elimination
S943.231
A
1673-9159(2016)06-0033-05
10.3969/j.issn.1673-9159.2016.06.006
2016-05-16
農業部公益性行業專項(20120385);廣東省科技計劃(農業攻關)項目(2012B020308010)
湯菊芬(1964-),女,碩士,高級工程師,研究方向為水產動物病害防治。E-mail:tjf10002000@163.com
簡紀常(1964-),男,博士,教授,研究方向為水產經濟動物免疫學及病害控制。E-mail:jianjc@gmail.com

