遠東擬沙丁魚抗氧化肽對Caco-2細胞氧化應激損傷的影響
李亞會,吉 薇,吉宏武,2,3,蘇偉明,2,王晶晶
(1.廣東海洋大學食品科技學院,廣東 湛江 524088; 2.廣東省水產品加工與安全重點實驗室,廣東 湛江 524088;3.水產品深加工廣東省普通高校重點實驗室,廣東 湛江 524088)
遠東擬沙丁魚抗氧化肽對Caco-2細胞氧化應激損傷的影響
李亞會1,吉 薇1,吉宏武1,2,3,蘇偉明1,2,王晶晶1
(1.廣東海洋大學食品科技學院,廣東 湛江 524088; 2.廣東省水產品加工與安全重點實驗室,廣東 湛江 524088;3.水產品深加工廣東省普通高校重點實驗室,廣東 湛江 524088)
對遠東擬沙丁魚(Sardinops sagax)蛋白進行蛋白酶解和膜分離,得到分子質量100~3 000 u(F1)、3 000~ 10 000 u(F2)和大于10 000 u(F3)的多肽組分。在生化水平上測定各組分對1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-聯氮-二(3-乙基-苯并噻唑-6-磺酸)二銨鹽(ABTS)、羥基自由基和過氧自由基清除能力;在細胞水平上,以H2O2對Caco-2細胞的毒性及細胞內抗氧化體系的影響為檢測指標,篩選最適濃度的H2O2建立細胞氧化應激模型;在建立該模型的基礎上,進一步檢測蛋白多肽F1對氧化應激損傷細胞的修復功能。結果表明:組分F1對DPPH、ABTS、羥基自由基和過氧自由基清除能力最強,清除率分別為 56.03±0.14、86.26±0.32、38.34±1.70、54.85± 0.75;100 μmol/L的H2O2對細胞毒性作用較小,并可降低細胞中谷胱甘肽過氧化物酶(GSH-Px)、總抗氧化物歧化酶(T-SOD)、過氧化物酶(POD)的活性和谷胱甘肽(GSH)的含量,增加丙二醛(MDA)的含量,細胞氧化應激模型選擇H2O2濃度為100 μmol/L;在該模型條件下,F1對受損的Caco-2細胞中抗氧化體系中的GSH-Px、T-SOD、POD的活性和MDA、GSH的含量有一定恢復作用,可調節細胞中失衡的抗氧化體系。遠東擬沙丁魚多肽FⅠ對細胞氧化應激受損有一定保護作用。
遠東擬沙丁魚;抗氧化肽;Caco-2細胞;氧化應激
氧化應激(Oxidative Stress)是指細胞內產生過量的自由基或細胞內抗氧化防御系統受損導致氧自由基及其相關代謝產物聚集,最終引發多種疾病。目前,人們面臨的競爭和壓力越來越大,加之日益嚴重的環境污染,機體內自由基過量生成,產生氧化應激[1]。大量文獻表明[2],心血管疾病、老年癡呆和癌癥等疾病的發生一定程度上直接或間接與氧化應激損傷有關。抗氧化物質可消除過多的氧自由基,對氧化受損細胞有一定保護作用。近幾年,人們多關注源于天然產物、安全性高的抗氧化劑,如從玉米[3]、大豆[4]、牛奶[5]等酶解得到的抗氧化活性肽,牡蠣[2]、藍圓鲹[6]、蝦[7]等水產品蛋白酶解產物也是極佳的抗氧化活性肽來源。
遠東擬沙丁魚(Sardinops sagax)高蛋白,低脂肪,具有生長快、繁殖力強等[8]諸多優點,其蛋白酶解產物中含有豐富活性氨基酸[9],具有抗氧化、抗疲勞、抗免疫等生物活性。由于遠東擬沙丁魚直接食用價值較低,通常用作魚粉等動物飼料,造成資源浪費[10],因此對其進行深加工以提高利用價值有重要意義。本研究對遠東擬沙丁魚進行酶解與分離,得不同分子質量的多肽組分F1~F3,測定各組分對1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-聯氮-二(3-乙基-苯并噻唑-6-磺酸)二銨鹽(ABTS)、羥基自由基和過氧自由基清除能力,以最適濃度的H2O2為誘導劑建立細胞氧化應激模型,檢測多肽組分F1(100~3 000 u)對氧化應激損傷細胞的修復功能,為該魚種酶解產物在保健品中的應用提供理論基礎。
1 材料與方法
1.1 材料
遠東擬沙丁魚(Sardinops sagax),購于廣東省湛江市水產品批發市場。
人結腸癌細胞 Caco-2 購于上海通派生物科技有限公司;胎牛血清、二甲基亞砜(DMSO)、1640培養基、質量分數0.25%胰酶、青霉素、鏈霉素均購于GⅠBCO;噻唑藍(MTT)、TritonX-100均購于Amresco;風味酶(14萬u/g)、動物蛋白水解酶(14.5萬 u/g)購于南寧龐博生物工程有限公司;其他試劑為分析純。
主要儀器:MCO-175型CO2培養箱,美國熱電公司;全波長多功能酶標儀,美國熱電公司。
1.2 方法
1.2.1 遠東擬沙丁魚蛋白多肽的制備 將遠東擬沙丁魚(100 g)去頭、皮、骨及內臟,清洗后絞碎,勻漿,酶解3 h(溫度50℃,自然pH,分別添加質量分數0.5%的動物蛋白水解酶和質量分數0.1%的風味酶),在約95℃條件下加熱10min,以4 000 r/min離心,將上清液于管式離心機中脫油,再添加活性炭脫色,過孔徑250μm的篩,所得澄清液用截留分子質量為10 000 u和3 000 u的超濾膜超濾,再用反滲透膜去除小分子物質,最后得到分子質量區間分別為100~3 000 u(F1)、3 000~10 000 u(F2)和10 000 u以上(F3)的多肽樣品,分別在50℃條件下旋轉蒸發,冷凍、干燥后備用。
1.2.2 抗氧化活性的測定
1.2.2.1 DPPH自由基清除能力的測定 根據文獻[11]方法,將試劑比例稍作修改。將1.5mL不同濃度樣品溶液與等體積含0.2 mmol/L DPPH的95%乙醇混勻,在室溫下避光放置30min,于517 nm處測光密度(Ds)。空白組為1.5mL 體積分數95%的乙醇加入1.5mL雙蒸水,用超純水進行調零。DPPH自由基清除率Y:
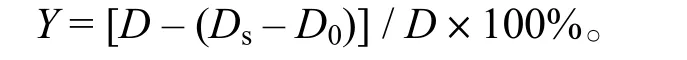
式中,Ds,樣品與1.5mL含0.2 mmol/L DPPH的體積分數95%乙醇反應后的光密度;D0,樣品與1.5mL體積分數95%乙醇反應后的光密度;D,雙蒸水和1.5mL 含 0.2 mmol/L DPPH 的體積分數95%乙醇反應后的光密度。
1.2.2.2 ABTS自由基清除能力的測定 根據文獻[12],處理時間稍作修改。將1mL 7.4 mmol/L的ABTS溶液與等體積2.6 mmol/L K2S2O4混合,避光靜置12 h,用pH 7.4的磷酸緩沖液(PBS)稀釋40~ 50倍,測734 nm處光密度,以稀釋倍數不同調整光密度范圍到 0.7±0.02,得 ABTS+工作液。將1 980μL ABTS+與20μL樣品混勻,靜置6min后,測定734 nm處光密度。ABTS自由基清除率Y:
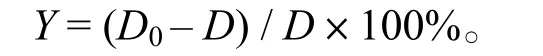
式中,D0,雙蒸水和ABTS+反應后的光密度;D,樣品和ABTS+反應后的光密度。
1.2.2.3 羥基自由基清除能力的測定 根據文獻[13-14],試劑配比稍作修改。在反應體系中加入0.5mL 9 mmol/L FeSO4溶液和1mL 9 mmol/L水楊酸–乙醇溶液,然后加入不同濃度樣品溶液1mL、雙蒸水5mL、8.8 mmol/L H2O20.5mL后,啟動反應。對照組中以1mL雙蒸水替換同體積的樣品,于37℃條件下保溫0.5 h。以雙蒸水為參比液,在510 nm處測定光密度,記為DS。羥自由基清除率Y:
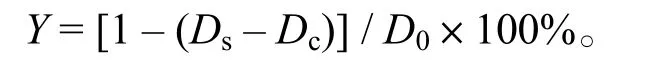
式中,Ds,樣品光密度;D0,采用雙蒸水代替樣品重復上述操作;Dc,雙蒸水代替雙氧水溶液。
1.2.2.4 過氧自由基清除能力的測定 根據文獻[4]方法,測定時間稍作修改。向4.5mL 50 mmol/L pH 7.2的Tris-HCl緩沖液中加入0.2mL樣品,于25℃下保溫10min,再加入在25℃預熱的6 mmol/L鄰苯三酚0.3mL。迅速搖勻后用紫外–可見分光光度計在320 nm處每隔30 s測定光密度1次,測定5min內光密度的變化,并求出光密度變化率ΔDs;另取同上試劑,用等體積水代替樣品(即含 Tris-HCl +水 + 鄰苯三酚),同時以Tris-HCl緩沖液作空白對照,測定方法同上,得變化率ΔD0。過氧自由基清除率Y:
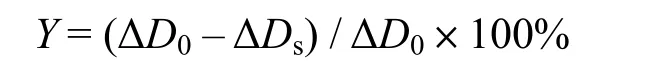
式中:ΔDs,樣品光密度變化率;ΔD0,不加樣品時的光密度變化率。
1.2.3 Caco-2細胞氧化應激模型的建立
1.2.3.1 Caco-2細胞培養 在無菌條件下,Caco-2細胞培養瓶中加入含體積分數10%胎牛血清和體積分數1% 雙抗的1640培養基置37℃、含體積分數5% CO2的培養箱中培養,隔天換培養液1次。待細胞貼壁生長至容器的 80%~90%后,用質量分數0.25%胰酶對其進行消化傳代,繼續培養。
1.2.3.2 H2O2對Caco-2細胞毒性作用 將5×104個/mL的Caco-2細胞接種于96孔板中,每孔接種200μL。在37℃、含體積分數為5% CO2培養箱中孵育 24 h,細胞貼壁生長后分別在培養板中添加50、100、200 μmol/L的H2O2,對照組添加等體積培養基,繼續孵育12、24 h后,按照MTT法測定細胞存活率。
1.2.3.3 H2O2對 Caco-2細胞抗氧化酶及非酶抗氧化物的影響 調整細胞濃度至1×105個/mL,接種到24孔板中,每孔加入1mL的細胞懸液,培養至細胞完全貼壁后進行實驗。實驗前吸出培養液,各孔加入0.9mL含體積分數5% FBS的培養基和0.1mL分別含0、50、100、200 μmol/L H2O2的培養基,每個濃度設置3個復孔,培養4 h后去培養液,將貼壁細胞用含體積分數1% Triton-X的PBS溶液裂解,以2 000 r/min離心10min,收集上清液即為細胞裂解液,置- 80℃下保存。
參照南京建成生物工程研究所的相應試劑盒說明書測定細胞裂解液內超氧化物歧化酶(SOD)、谷胱甘肽過氧化物酶(GSH-Px)、過氧化物酶(POD)活性和丙二醛(MDA)、谷胱甘肽(GSH)含量。
1.2.4 F1對Caco-2細胞氧化應激損傷的保護作用
在 Caco-2細胞氧化應激模型建立后,測定樣品F1對Caco-2細胞氧化應激損傷的影響,操作方法基本如1.2.3.3,但用 H2O2誘導氧化應激前,先加入不同濃度(100、200、400 μmol/L)的F1處理6 h,再測定細胞裂解液內 SOD、GSH-Px、POD 活性和MDA、GSH含量。
1.3 數據分析
所有實驗均重復3次,結果表述為平均值±標準差,采用Origin 8.6作圖和SPSS數據分析。
2 結果與分析
2.1 抗氧化活性的測定
多肽的濃度及分子質量是影響其抗氧化活性的兩個因素。一般而言,相同濃度的多肽隨著分子質量的減小,其對自由基清除能力逐漸增強[9]。圖1~4可見,同一組分隨著自身濃度的增加,其對各自由基的清除能力逐漸增強。在同一濃度條件下,不同分子質量區間的組分對DPPH、ABTS自由基均具有較強的清除能力(圖1、2),且F1相對于組分F2、F3,清除能力更強,清除率達到55%以上。圖3顯示,各組分對羥基自由基的清除能力相對較低,其中F1清除能力比F2、F3稍強,F3的清除能力最差,當F3質量濃度為10mg/mL時,清除率僅約10%。圖4表明,F1對過氧自由基的清除能力最強,當質量濃度為10mg/mL時,清除能力達到50%以上。綜上可見,隨著濃度增加,各組分對自由基的清除能力均逐漸增強,其中組分 F1對DPPH、ABTS、OH、O2自由基的清除能力最強。因此可初步判定分子質量為100~3 000 u的組分在生化水平上抗氧化活性較強。
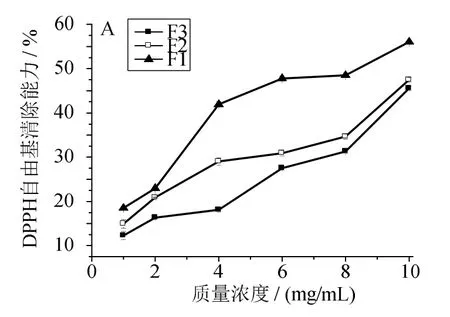
圖1 組分F1、F2、F3濃度對DPPH自由基清除能力的影響Fig.1 Effects of concentration of polypeptide F1,F2 and F3 on scavenging DPPH radical capacity
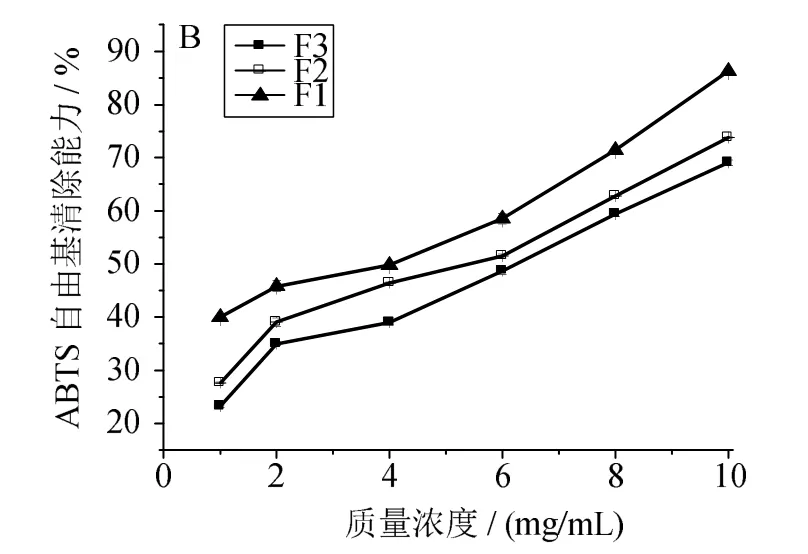
圖2 組分F1、F2、F3濃度對ABTS自由基清除能力的影響Fig.2 Effects of concentration of polypeptide F1,F2 and F3 on scavenging ABTS radical capacity
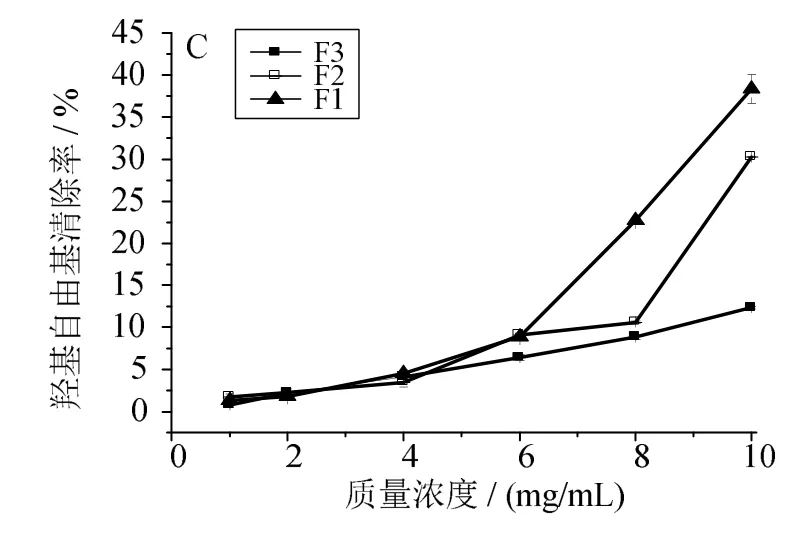
圖3 組分F1、F2、F3濃度對羥基自由基清除能力的影響Fig.3 Effects of concentration of polypeptide F1,F2 and F3 on scavenging hydroxyl radical capacity
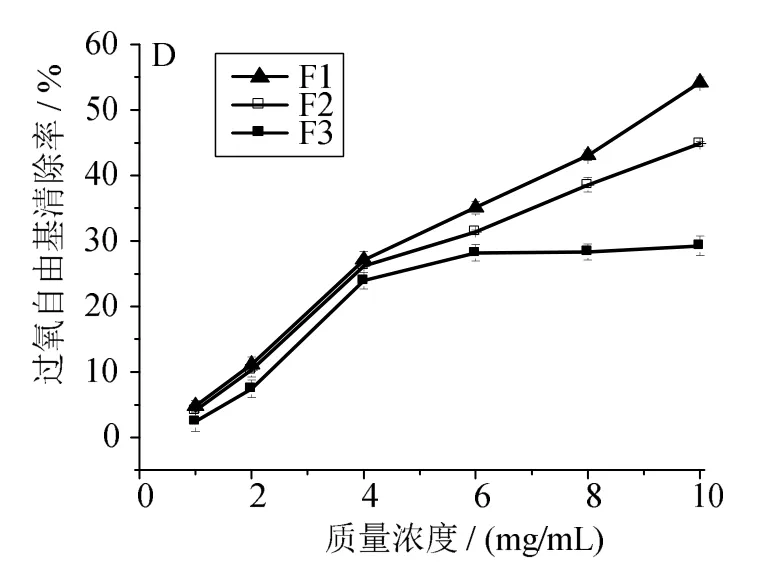
圖4 組分F1、F2、F3濃度對過氧自由基清除能力的影響Fig.4 Effects of concentration of polypeptide F1,F2 and F3 on scavenging peroxy radical capacity
大量研究表明,活性較強的抗氧化肽分子質量約為300~5 000 u。宋永相等[15]研究發現,分子質量小于1 000 u的海洋活性膠原肽抗氧化活性最強;WANG Bin等[13]發現,提取自貽貝(Mytilus edulis)肌肉的不同分子質量組分中,小于3 000 u的組分抗氧化活性最強;JⅠANG Haiping等[11]]亦從藍圓鲹(Decapterus maruadsi)肌肉蛋白中分離出分子質量分別為706.8、614.7 u抗氧化活性肽。本研究結果與前人結果一致。
2.2 細胞抗氧化應激模型結果
2.2.1 H2O2對細胞生長的影響 圖5可見,誘導劑H2O2在低濃度范圍(50、100 μmol/L)內對細胞無明顯毒害作用,細胞存活率達80%左右,但濃度為200 μmol/L時有一定毒性,細胞培養24 h后的存活率僅50%,說明H2O2對Caco-2細胞生長有一定影響,低濃度H2O2對細胞生長影響較小。目前MTT比色試驗測定細胞存活率是檢測細胞受氧化應激損傷程度的最常用方法[16],因此測定H2O2對Caco-2細胞生長的影響可為其模型的建立提供依據。

圖5 H2O2對細胞生長的影響Fig.5 Effect of H2O2on Caco-2 cells growth
2.2.2 不同濃度H2O2對Caco-2細胞抗氧化系統的影響 谷胱甘肽過氧化物酶(GSH-Px)、總超氧化物歧化酶(T-SOD)和過氧化物酶(POD)均為細胞抗氧化防御系統中重要酶類物質,對機體內的氧化與抗氧化動態平衡極為重要。GSH-Px可促進H2O2與 GSH反應生成水和氧化型谷胱甘肽(GSSG);T-SOD可清除超氧陰離子自由基,防止細胞受損;POD可清除細胞中的H2O2而保護細胞[17];GSH作為一種重要的非酶抗氧化劑,在保護細胞免受氧化應激損傷方面有舉足輕重的地位[18];氧自由基過量時,常發生脂質過氧化反應,丙二醛(MDA)是脂質過氧化的最重要產物,也是細胞產生氧化應激的重要標記物。已有研究表明,H2O2不僅可攻擊生物膜,還引發脂質過氧化反應,破壞生物膜的完整性,降低細胞內抗氧化酶系的活性[19]。
表1可見,添加H2O2處理后,細胞裂解液中抗氧化酶GSH-Px、T-SOD、POD活性增加,MDA含量增加,GSH含量降低。當H2O2濃度為50 μmol/L時,抗氧化酶活性及MDA、GSH含量與對照組差異無統計學意義(P>0.05);當濃度為 100、200 μmol/L時,抗氧化酶活性及MDA、GSH含量與對照組差異有統計學意義(P<0.05)。表明選用高濃度H2O2處理Caco-2細胞,可使細胞產生氧化應激,對細胞內的抗氧化酶體系有一定影響,對細胞有一定損傷作用。崔志文等[20]用100 μmol/L的H2O2建立的氧化應激模型可較好地測定鼠李糖乳酸桿菌(L.rhamnosus)對H2O2誘導的氧化應激的抗氧化作用。因此選擇100 μmol/L為氧化應激的誘導濃度。
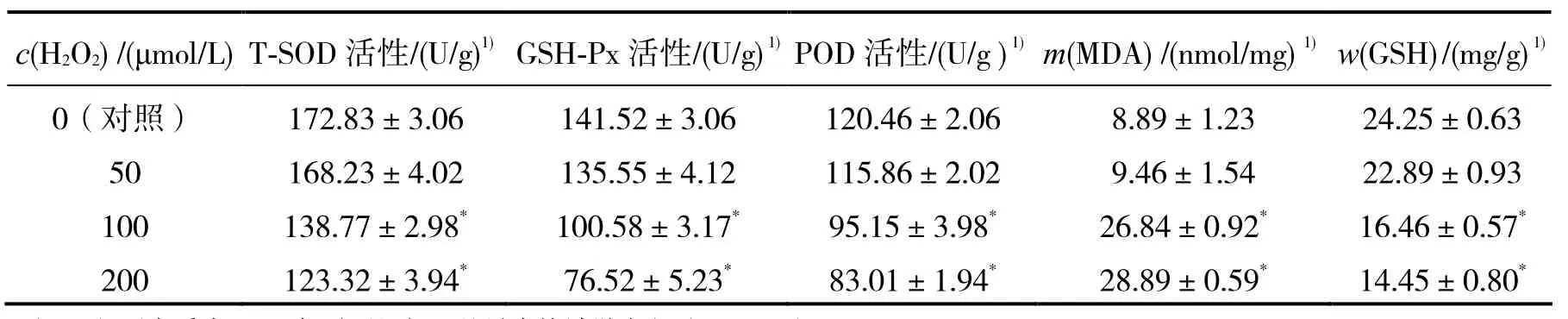
表1 H2O2對Caco-2細胞中SOD、GSH-Px、POD、MDA、GSH的影響Table 1 Effects of H2O2on SOD,GSH-Px,POD,MDA,GSH in Caco-2 cells
2.3 F1對Caco-2細胞氧化應激損傷的保護作用
經不同質量濃度的F1處理后再用100 μmol/L H2O2誘導,細胞中抗氧化酶及非酶抗氧化物的測定結果見表2。表2顯示,不同質量濃度的F1對細胞中抗氧化酶體系中的各酶活性和抗氧化物質 GSH含量有一定增加作用,且隨著質量濃度的增大(100~ 400 μg/mL),T-SOD、GSH-Px、POD的酶活性和GSH的含量也逐漸增大,差異有統計學意義(P <0.05);當F1質量濃度為100 μg/mL時,細胞MDA含量與對照組差異無統計學意義(P>0.05),隨著F1濃度增加,其對MDA的含量有降低作用(P <0.05),濃度越大(小于400 μg/mL),降低程度越大。
通過測定細胞中抗氧化酶含量變化來判斷是否具有氧化應激保護作用。KULLⅠSAAR等[21]通過檢測人體SOD及 GSH-Px的活性,判斷乳酸菌發揮的抗氧化作用大小,TAO等[22]研究發現,添加鼠李糖乳酸桿菌12 h時細胞上清T-SOD、GSH-Px、CAT 活性和細胞裂解液中SOD 活性、GSH含量顯著提高,初步判定鼠李糖乳酸桿菌對細胞氧化應激損傷的保護作用。本研究顯示,經過 F1處理后,F1可提高抗氧化酶活性及GSH含量,降低MDA含量,表明可一定程度上調節細胞內的抗氧化系統,抑制氧化應激過程中產生的自由基,使細胞氧化損傷得到一定程度的恢復。

表2 不同濃度的F1對Caco-2細胞氧化應激損傷的保護作用Table 2 Effects of F1 on SOD,GSH-Px,POD,MDA,GSH in H2O2-induced Caco-2 cells
3 結 論
遠東擬沙丁魚蛋白酶解組分F1、F2、F3均有一定的抗氧化活性,其中分子質量最小的組分 F1(100~3 000 u)抗氧化活性最強。細胞抗氧化應激結果顯示,以100 μmol/L的H2O2構建細胞氧化應激模型,F1對受損的Caco-2細胞抗氧化酶體系中的GSH-Px、T-SOD、POD活性和MDA、GSH含量有一定影響,可調節細胞中失衡的抗氧化酶體系,表明F1對氧化損傷的Caco-2細胞有一定修復功能。
[1]張海超.氧化應激對肉仔雞腸氧化損傷和屏蔽功能的影響[D].泰安:山東農業大學,2012.
[2]TAKAHASHⅠ H,HARA K.Cardiovascular diseases and oxidative stress[J].Rinsho Byori the Japanese Journal of Clinical Pathology,2003,51(2):133.
[3]ZHOU K,SUN S,CANNⅠNG C.Production and functional characterisation of antioxidative hydrolysates from cornprotein via enzymatic hydrolysis and ultrafiltration[J].Food Chemistry,2012,135(3):1192-1197.
[4]GⅠBBS B F,ZOUGMAN A,MASSE R,et al.Production and characterization of bioactive peptides from soy hydrolysate and soy-fermented food [J].Food ResearchⅠnternational,2004,37(2):123-131.
[5]POWER O,JAKEMAN P,FⅠTZGERALD R J.Antioxidative peptides enzymatic production,in vitro and in vivo antioxidant activity and potential applications of milk-derived antioxidative peptides [J].Amino Acids,2013,44(3):797-820.
[6]LⅠN L,LⅠ B F.Radical scavenging properties of protein hydrolysates from jumbo flying squid (Dosidicus eschrichitii Steenstrup) skin gelatin [J].Journal of the Science of Food and Agriculture,2006,86(14):2290-2295.
[7]張靜,劉書成,郝記明,等.酶解藍圓鲹魚肉蛋白制備小分子肽的工藝研究[J].廣東海洋大學學報,2009,29(4):54-57.
[8]王杏珠.日本遠東擬沙丁魚 Sardin melanostictus (Temniinek et Sehlegel) 開發利用的新技術[J].現代漁業信息,1994,9(9):13-15.
[9]毋瑾超,朱碧英.低值魚酶解蛋白的制取及其組成研究[J].水產科學,2001,20(4):7-10.
[10]何小慶,曹文紅,章超樺,等.波紋巴非蛤蛋白酶解產物的抗氧活性及分子量分布研究[J].現代食品科技,2014,30 (1):74-80.
[11]JⅠANG Hai-ping,TONG Tian-zhe,SUN Jian-hua,et a1.Purification and characterization of antioxidative peptides from round scad (Decapterus maruadsi) muscle protein hydrolysate[J].Food Chemistry,2014,154:158-163.
[12]LAN W C,TZENG C W,LⅠN C C,et al.Prenylated flavonoids from Artocarpus altilis:antioxidant activities and inhibitory effects on melanin production [J].Phytochemistry,2013,89(3):78-88.
[13]WANG Bin,LⅠ Li ,CHⅠ Chang-Feng,et a1.Purification and characterisation of a novel antioxidant peptide derived from blue mussel (Mytilus edulis) protein hydrolysate [J].Food Chemistry,2013,138(2/3):1713–1719.
[14]顏 軍,茍小軍,鄒全付,等.分光光度法測定 Fenton反應產生的羥基自由基[J].成都大學學報(自然科學版),2009,28(2):93-103.
[15]宋永相,孫 謐,王躍軍,等.海洋活性膠原肽的抗氧化性及對酪氨酸酶的抑制作用與初步分離研究[J].中國食品學報,2009,9(5):8-12.
[16]源瀚祺,黃慶華,李嬈玲.通過細胞模型體外評價抗氧化活性實驗方法研究綜述[J].廣東藥學院學報,2012,28(2):208-211.
[17]陳志飛.蛋清源抗氧化肽對 HEK293細胞氧化應激損傷的抑制作用及機制研究[D].長春:吉林大學,2015.
[18]WU G,FANG Y Z,YANG S,et al.Glutathione metabolism and its implications for health[J].The Journal of Nutrition,2004,134(3):489-492.
[19]HWANG Sam-Long,YEN Gow-Chin.Modulation of Akt,JNK,and p38 activation is involved in citrus flavonoid-mediated cytoprotection of PC12 cells challenged by hydrogen peroxide [J].Journal of Agricultural and Food Chemistry,2009,57(6):2576-2582.
[20]崔志文,黃琴,黃怡,等.鼠李糖乳酸桿菌對 Caco-2細胞抗氧化功能的影響[J].中國農業科學,2011,44(23):4926-4932.
[21]KULLⅠSAAR T,SONGⅠSEPP E,MⅠKELSAAR M,et al.Antioxidative probiotic fermented goats’ milk decreases oxidative stress-mediated atherogenicity in human subjects[J].British Journal of Nutrition,2003,90(2):449-456.
[22]TAO Y,DRABⅠK K A,WAYPA T S,et al.Soluble factors from Lactobacillus GG activate MAPKs and induce cytoprotective heat shock proteins in intestinal epithelial cells[J].American Journal of Physiology –Cell Physiology,2006,290(4):1018-1030.
(責任編輯:劉慶穎)
Effect of Antioxidant Peptide from Sardinops sagax on Oxidative StressⅠnjury on Caco-2 Cell
LⅠ Ya-hui1,JⅠ Wei1,JⅠ Hong-wu1,2,3,SU Wei-ming1,2,WANG Jing-jing1
(1.College of Food Science and Technology,Guangdong Ocean University,Zhanjiang 524088,China; 2.Key Laboratory of Advanced Processing of Aquatic Products of Guangdong Higher Education Institution,Zhanjiang 524088,China; 3.Guangdong Provincial Key Laboratory of Aquatic Product Processing and Safety,Zhanjiang 524088,China)
Polypeptides with different molecular weight F1 (100 –3 000 u),F2 (3 000 –10 000 u) and F3 (> 10 000 u) were prepared by the proteolysis and membrane separation from Sardinops sagax.At the biochemical level,the antioxidant activity of these fractions was determined by its capacities of scavenging DPPH,ABTS,OH and O2free radicals.At the cellular level,using cell toxic and the change of intracellular antioxidant system by the H2O2as testing indexes,the cell model of oxidative stress with the optimum concentration of H2O2was established.On the basis of the model,whether F1 can repair the Caco-2 cells oxidative damage or not was detected.The results showed that F1 had the highestactivity at the biochemical level.The DPPH,ABTS,OH,and O2free radicals capacity were (56.03±0.14)%,(86.26±0.32)%,(38.34±1.70)%,and (54.85±0.75)%,respectively.The toxic Effects of 100 μmol/L H2O2on Caco-2 cell was low and the antioxidant enzyme system of GSH-Px,T-SOD,and POD activity and the content of GSH decreased but the content of MDA increased .Ⅰt is indicated that the Caco-2 cells model of oxidative stress which was established by 100 μmol/L H2O2is the best.Under the condition of the model,F1 can repair the antioxidant enzyme system of GSH-Px,T-SOD,and POD activity and the content of MDA and GSH in damaged Caco-2 cells.The final result showed that F1 could adjust cell imbalance in antioxidant enzyme system and repair oxidative stress damage.
Sardinops sagax; antioxidant peptide; caco-2 cell; oxidative stress
TQ914.2;TQ936.1+6
A
1673-9159(2016)06-0094-06
10.3969/j.issn.1673-9159.2016.06.015
2016-04-19
廣東省高等學校學科建設專項資金資助項目(2013CXZDA020);廣東省省部產學研合作專項資金項目(2013B090600155);國家海洋公益性行業科研專項課(201305018)
李亞會(1989-),女,碩士研究生,研究方向為水產品深加工及貯藏工程,E-mail:13058369058@163.com
吉宏武(1962-),男,博士,教授,研究方向為海洋生物資源高值化利用,E-mail:Jihw62318@163.com

