低氧脅迫對西伯利亞鱘幼魚生理狀態的影響
王曉雯,朱 華,胡紅霞,馬國慶
( 北京市水產科學研究所,漁業生物技術北京市重點實驗室,北京 100068 )
低氧脅迫對西伯利亞鱘幼魚生理狀態的影響
王曉雯,朱 華,胡紅霞,馬國慶
( 北京市水產科學研究所,漁業生物技術北京市重點實驗室,北京 100068 )
為探究低氧脅迫對西伯利亞鱘幼魚的血液基礎指標、抗氧化和能量代謝相關酶活力的影響,以體質量為(19.46±4.9) g的西伯利亞鱘幼魚為研究對象,開展了低氧(2.3 mg/L)脅迫3 h和自高氧(18.5 mg/L)逐漸降至低氧(2.8 mg/L)又恢復到正常溶氧(7 mg/L),這兩種不同情況下的低氧脅迫試驗。檢測了血液紅細胞數、血紅蛋白質量濃度,以及肝臟和肌肉的抗氧化酶活力和鰓組織三磷酸腺苷酶活力。結果顯示,低氧脅迫下西伯利亞鱘幼魚血紅細胞數升高,血紅蛋白質量濃度、血液pH、肝臟和肌肉的超氧化物歧化酶和過氧化氫酶活力以及堿性磷酸酶活力均低于正常溶氧組,而鰓組織鈉/鉀—三磷酸腺苷酶活力無明顯變化。試驗結果顯示,急性低氧脅迫能較快使西伯利亞鱘幼魚血液紅細胞數目增加,并影響肝臟、肌肉的抗氧化應激及代謝相關酶活力,但是短時間內西伯利亞鱘幼魚可能還未實現鰓部的能量調節。
西伯利亞鱘;血液指標;抗氧化酶;三磷酸腺苷酶;堿性磷酸酶
溶解氧是水產養殖的一個重要環境因子,直接關系到魚類的生存、生長和代謝水平[1-3]。溶解氧水平降低會導致魚類攝食減少,生長緩慢,影響其免疫機能,甚至引起死亡[4-7]。急性缺氧和溶解氧劇烈變化作為魚類生活中不可避免的短期脅迫,對其生存產生重要影響。因此,魚類通過對生存環境的長期適應,獲得了很多耐受低氧的機制,如魚體可以提高呼吸頻率[8]、降低攝食量、增強血氧親和力[9]和提高血液循環率[10]來適應低氧環境。
水體中溶解氧水平過低或過高均可導致魚類發生強烈的應激反應。魚體則利用自身酶類抗氧化劑清除多余的活性氧簇,包括超氧化物歧化酶、過氧化氫酶及谷胱甘肽過氧化物酶等。有研究發現,缺氧及溶解氧含量的恢復過程中會導致變溫動物抗氧化酶活力的變化[11-13],低氧條件下魚體進行無氧呼吸,產生的副產物可能會抑制過氧化氫酶活力[14],導致魚體抗氧化機制相應發生變化[15]。
魚體在對環境進行適應的過程中,需要進行包括神經調節、膜流動性調節以及能量代謝調節等方面[16]的調節。鈉/鉀—三磷酸腺苷酶在離子轉運、能量代謝、物質運輸、營養吸收[17]以及信息傳遞方面發揮重要作用。王春枝等[18]在對鰱魚(Hypophthalmichthysmolitrix)組織急性低氧脅迫過程中發現低氧促進三磷酸腺苷酶活性升高,但當低氧超過自身調節范圍,三磷酸腺苷酶活性呈現下降趨勢。并有研究顯示,多種應激條件下機體三磷酸腺苷酶活性均發生改變,對應激條件比較敏感。但尚未見鱘魚的相關報道。
西伯利亞鱘(Acipenserbaerii),屬鱘科、鱘屬,介于軟骨魚類和硬骨魚類之間的軟骨硬鱗魚類,是我國引自歐洲的鱘魚種類,現已成為我國常見的鱘魚養殖品種,具有較高的經濟價值和研究價值。野生西伯利亞鱘生活在河流中,為半洄游性種群,耐低氧能力較弱。本研究以西伯利亞鱘幼魚為對象,探討其在急性低氧和由高溶解氧逐漸降低再恢復這兩種情況下魚體血液生化指標、抗氧化酶活力和能量代謝相關酶活力的變化情況,以豐富基礎研究數據,為鱘魚養殖生產提供理論依據。
1 材料與方法
1.1 試驗魚的來源與馴化
試驗用西伯利亞鱘幼魚購自北京市懷柔,于北京市水產科學研究所實驗室自凈化循環水槽中暫養7 d,水槽容量為直徑1 m,高0.8 m,實際水容積500 L,水溫(19.0±1.0) ℃,充氣以保證溶解氧≥6 mg/L,日投餌2次。從暫養7 d的西伯利亞鱘魚中挑選活力好、健康的個體進行試驗。
1.2 試驗方案
將挑選體質量為(19.46±4.9) g的試驗魚60尾隨機平分為溶解氧質量濃度(7.8±0.3)、(2.3±0.2) mg/L這兩個試驗組,每組3個平行;低氧組通過充入氮氣使溶解氧迅速地在1 h內降至(2.3±0.2) mg/L,并通過少量充入空氣保持低氧處理3 h。設置溶解氧質量濃度(7.8±0.3) mg/L為對照組,連續充入空氣,維持溶解氧質量濃度。
各試驗平行組隨機選取3尾魚,尾靜脈采血,置于含肝素鈉的離心管中,混勻。采血后解剖,取出肝臟、肌肉和鰓組織用液氮速凍后置于-80 ℃冰箱保存備用。
1.2.2 溶解氧變化試驗
于9:00,挑選體質量(15.9±4.7) g的試驗魚60尾平均放入3個試驗水槽,連續充液氧1 h,溶解氧升至19 mg/L,停止充氧,并充入氮氣使溶解氧緩慢降至4 mg/L后迅速降至2 mg/L,隨后停止充氮氣,繼續充液氧,在溶解氧水平為18.5 mg/L、7.5 mg/L、4.2 mg/L、2.8 mg/L以及恢復至7 mg/L時刻各平行組隨機取3尾魚采血取樣,整個溶解氧變化過程在8 h內完成。取樣時具體操作同1.2.1。
1.3 血液基礎指標的測定
取50 μL采集的抗凝血液,使用HANNA臺式酸度測定儀進行pH的測定。
取150 μL 采集的抗凝血液,使用商品試劑盒測定血紅蛋白質量濃度(微量游離血紅蛋白測定試劑盒,南京建成生物工程研究所),單位為g/L。
取10 μL抗凝血,用0.9%生理鹽水稀釋150倍,使用25×16型血球計數板對紅細胞進行計數。
式中,σy為地基中某點水平面上的垂直壓力,假定等于該處單位面積上部土柱的重量為與σy相應的垂直有效壓力,假定等于該處單位面積上部土柱的有效重量(浸潤線以下采用土的浮容重);αmax為地面最大地震加速度(9度地震采用0.4 g,8度地震采用0.2 g,7度地震采用 0.1 g);(△τf/)cr為根據土層三軸震動試驗資料求得發生液化時的震動剪應力比,取cr為40次。
紅細胞數/個·L-1=80小格內細胞總數/80×400×107×稀釋倍數
紅細胞血紅蛋白平均含量/g·個-1=血紅蛋白質量濃度(g/L)/紅細胞數(個/L)[19]
1.4 西伯利亞鱘肝臟和肌肉相關酶活力測定
總超氧化物歧化酶的測定采用黃嘌呤氧化酶法,其活力定義為每毫克組織蛋白在1 mL反應液中超氧化物歧化酶抑制率達50%時所對應的超氧化物歧化酶活力單位(U)。
過氧化氫酶活定義為每毫克組織蛋白每秒鐘分解1 μmol的H2O2的量作為一個活力單位(U)。
堿性磷酸酶活力定義為1分鐘內每克組織蛋白在37 ℃將1 μmol底物轉化為酚的量為1個活力單位(U)。
鈉/鉀—三磷酸腺苷酶的活力單位定義為每小時每毫克蛋白的組織中三磷酸腺苷酶分解三磷酸腺苷產生1 μmol無機磷的量作為1個酶活力單位(U)。
肝和肌肉總超氧岐化酶活力、過氧化氫酶活力,堿性磷酸酶活力、鰓鈉/鉀—三磷酸腺苷酶活力均使用試劑盒(南京建成生物工程研究所),按照相關說明書進行,采取可見光法,用UV/Vis-4802S型雙光束紫外可見分光光度計進行檢測。
1.4 數據處理
利用EXCEL和SPSS 13.0軟件對數據進行處理,所得數據用平均值±標準差表示,急性低氧試驗結果進行t檢驗;溶解氧劇烈變化試驗結果采用單因素方差分析進行組間顯著性分析,將不同溶解氧含量下的數據進行Duncan多重比較,以P<0.05作為差異顯著的標準。
2 結 果
2.1 低溶解氧對鱘魚血液pH的影響
經過3 h的急性低氧處理,測得溶解氧為(2.3±0.2) mg/L處理組鱘魚血液的pH為5.26±0.23,顯著低于溶解氧為(7.8±0.3) mg/L對照組的pH 6.4±0.36(P<0.05)。
溶解氧由18.5 mg/L降至4.2 mg/L過程中,鱘魚血液pH略微上升,而從4.2 mg/L繼續降至2.8 mg/L的過程中,鱘魚血液pH下降(圖1)。
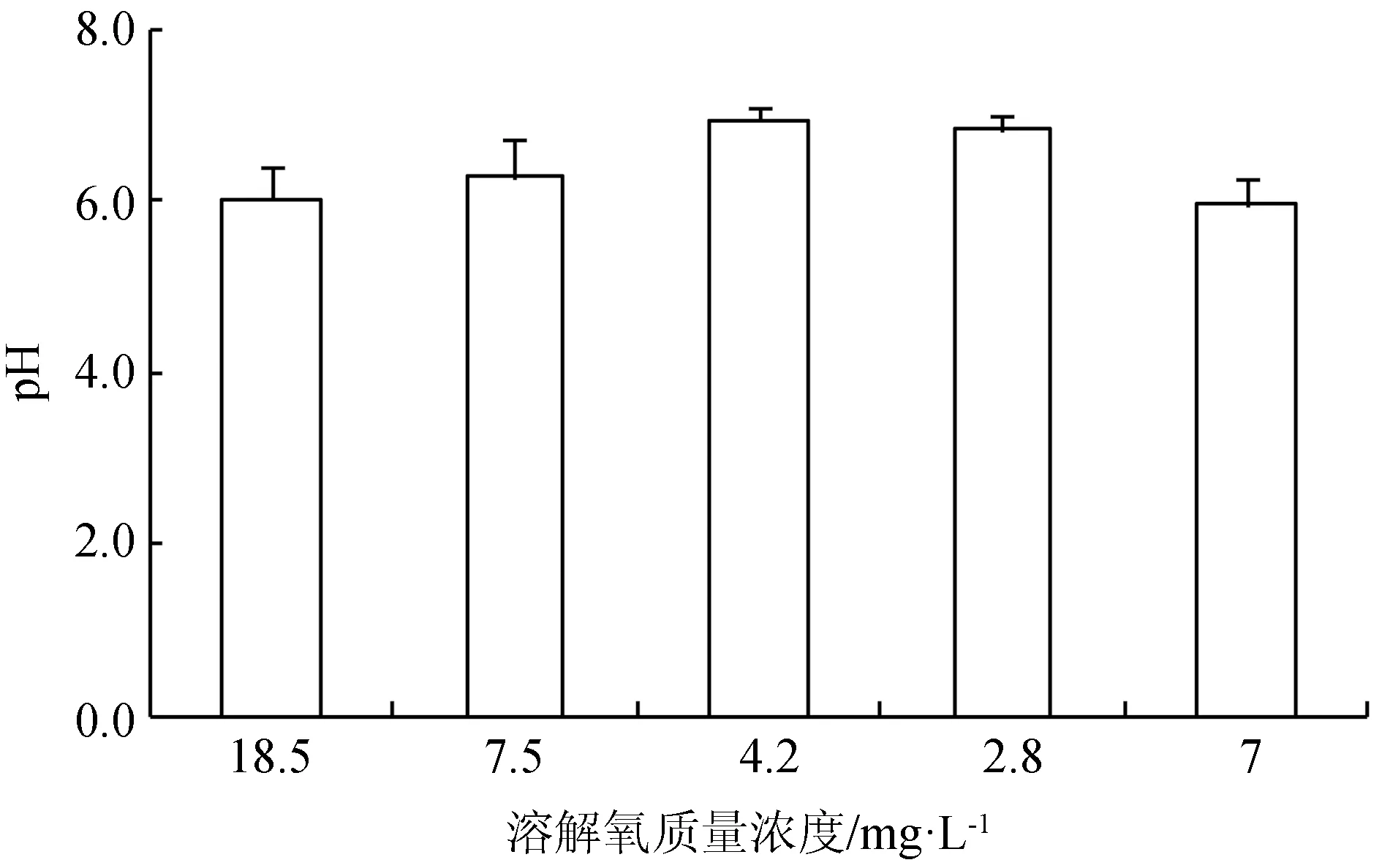
圖1 不同溶氧條件下西伯利亞鱘幼魚血液的pH
2.2 低溶解氧對鱘魚血細胞數和血紅蛋白質量濃度的影響
急性低氧處理3 h后,處理組紅細胞數目顯著高于對照組(P<0.05),而血紅蛋白質量濃度低于對照組(P<0.05),紅細胞血紅蛋白平均含量顯著低于對照組(P<0.05)。其中紅細胞數高于對照組10.6%,血紅蛋白質量濃度低于對照組31.3%(表1)。
在水體溶解氧質量濃度逐漸降低(由18.5 mg/L降至正常水平7.5 mg/L)的過程中,紅細胞數目減少,血紅蛋白質量濃度和紅細胞血紅蛋白平均含量無明顯變化;當溶解氧繼續降至4.2 mg/L 時,血細胞數目出現顯著升高(P<0.05),溶解氧迅速降至2.8 mg/L時,血細胞數目發生略微的減少,并且血紅蛋白質量濃度減小,此時魚體內可能產生無氧代謝,溶解氧再次恢復到7 mg/L時,血細胞數目得到恢復(圖2~圖4)。
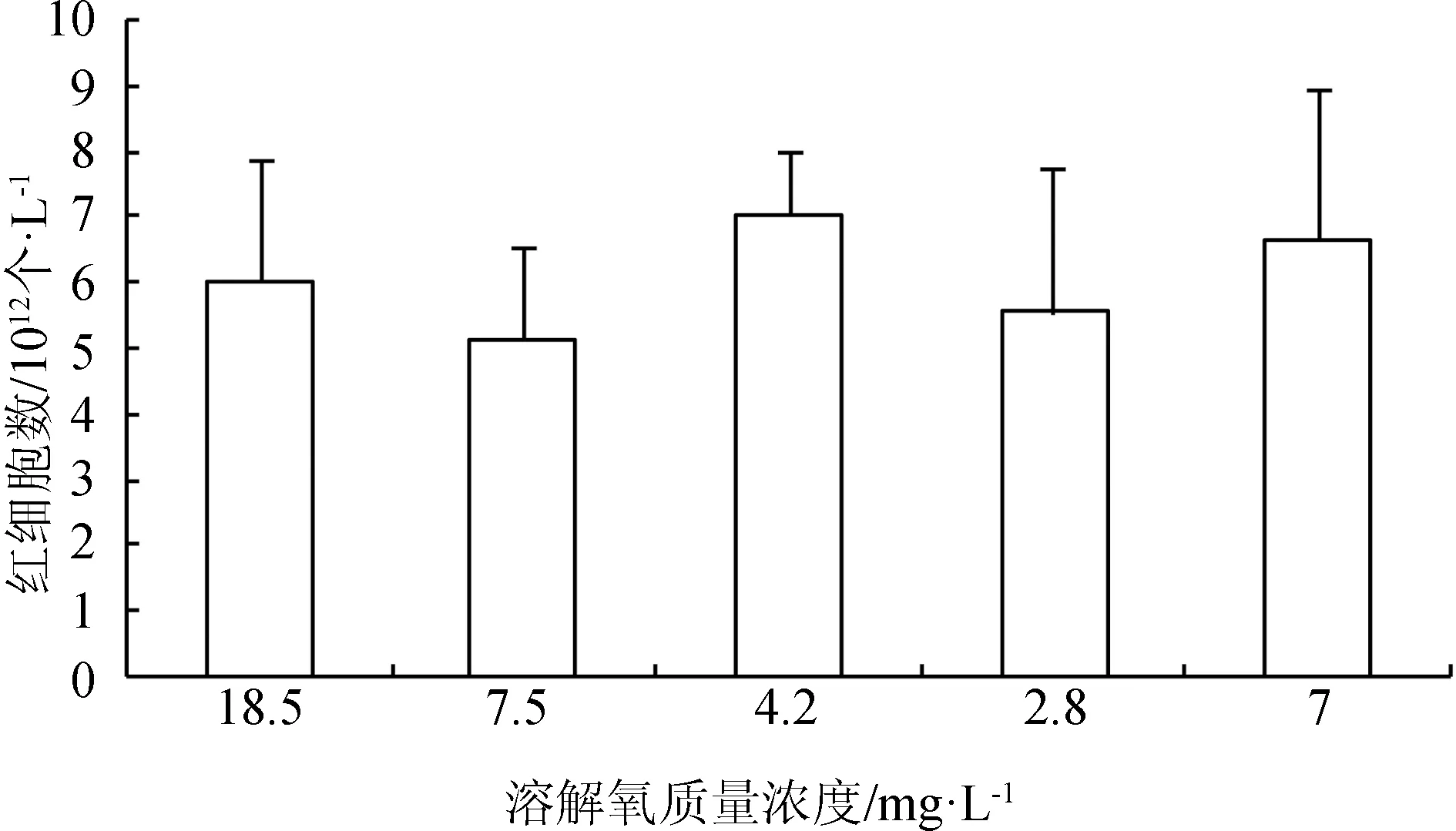
圖2 不同溶解氧水平下西伯利亞鱘幼魚血液紅細胞數
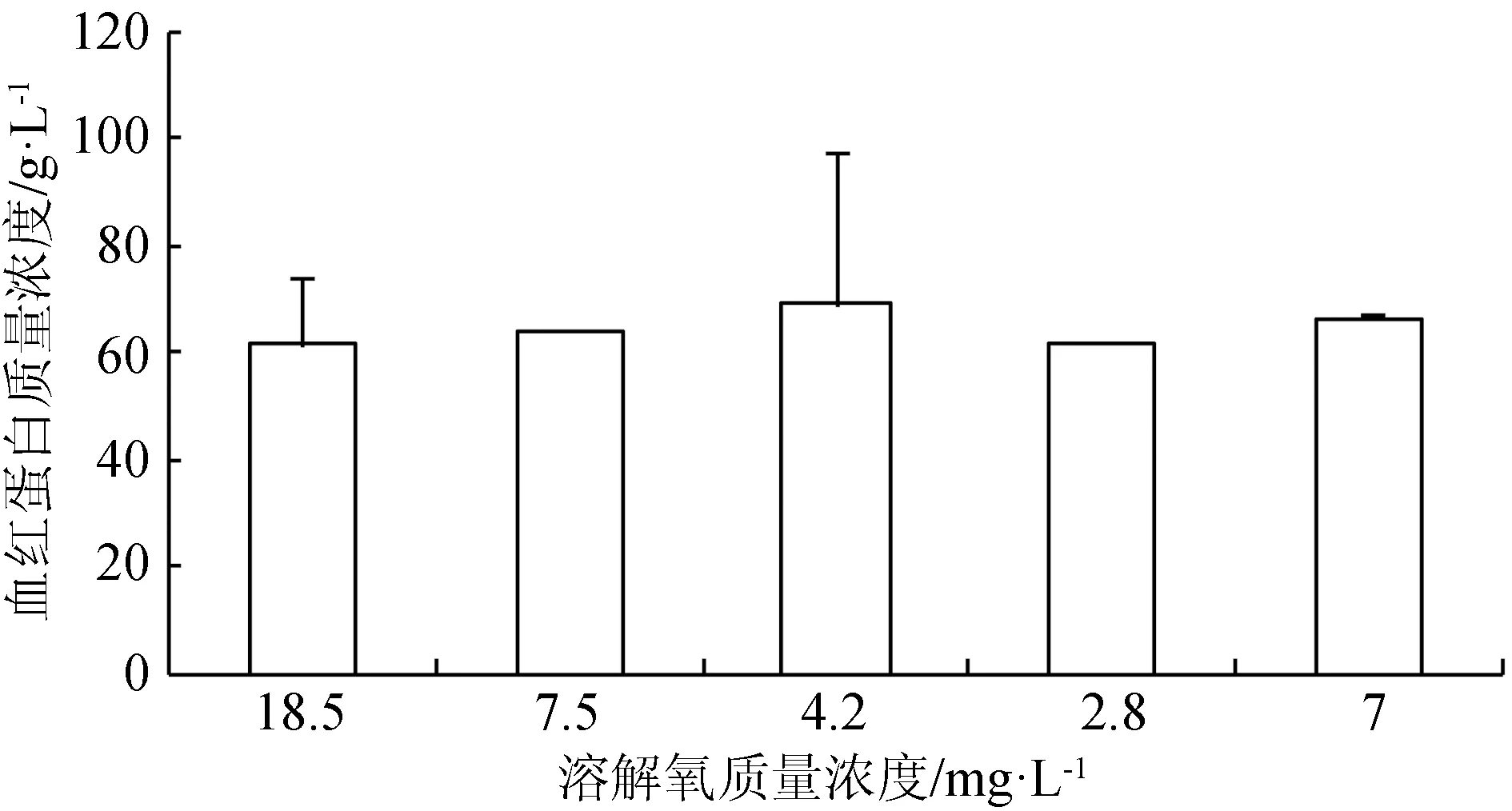
圖3 不同溶解氧水平下西伯利亞鱘幼魚血液血紅蛋白質量濃度
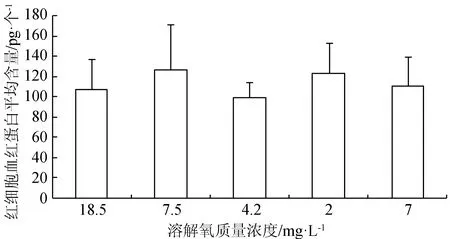
圖4 不同溶解氧水平下西伯利亞鱘幼魚血液紅細胞血紅蛋白平均含量
2.3 低溶解氧對鱘魚抗氧化酶活力的影響
在急性低氧脅迫3 h后,低氧處理組肝臟和肌肉的超氧化物歧化酶活力,過氧化氫酶活力均顯著低于正常溶解氧組(P<0.05)(表2)。
在溶解氧變化試驗中,西伯利亞鱘幼魚肝臟和肌肉組織的超氧化物歧化酶活力隨著溶解氧質量濃度降低,其活力降低,待溶解氧質量濃度恢復到7 mg/L時,超氧化物歧化酶活力明顯升高(圖5)。肝臟過氧化氫酶的變化規律與超氧化物歧化酶一致。隨著溶解氧質量濃度由18.5 mg/L降至7.5 mg/L時,肌肉的過氧化氫酶活力驟然升高,溶解氧質量濃度逐步降至2.8 mg/L的過程中,肌肉過氧化氫酶活力逐漸下降,當溶解氧質量濃度由2.8 mg/L恢復到7 mg/L時,肌肉過氧化氫酶活力顯著升高(P<0.05)(圖6)。

表1 急性低氧下西伯利亞鱘幼魚紅細胞數、血紅蛋白質量濃度和紅細胞血紅蛋白平均含量
注:同一列上標字母不同的數據間差異顯著(P<0.05).

表2 急性低氧試驗中鱘魚肝臟和肌肉的抗氧化酶和堿性磷酸酶活力
注:同一列上標注字母相同的數據間差異顯著(P<0.05).

圖5 不同溶解氧條件下西伯利亞鱘幼魚肝臟和肌肉超氧化物歧化酶活力注:圖中不同大寫字母代表不同溶解氧質量濃度的數據具有顯著性差異(P<0.05),以下各圖同.
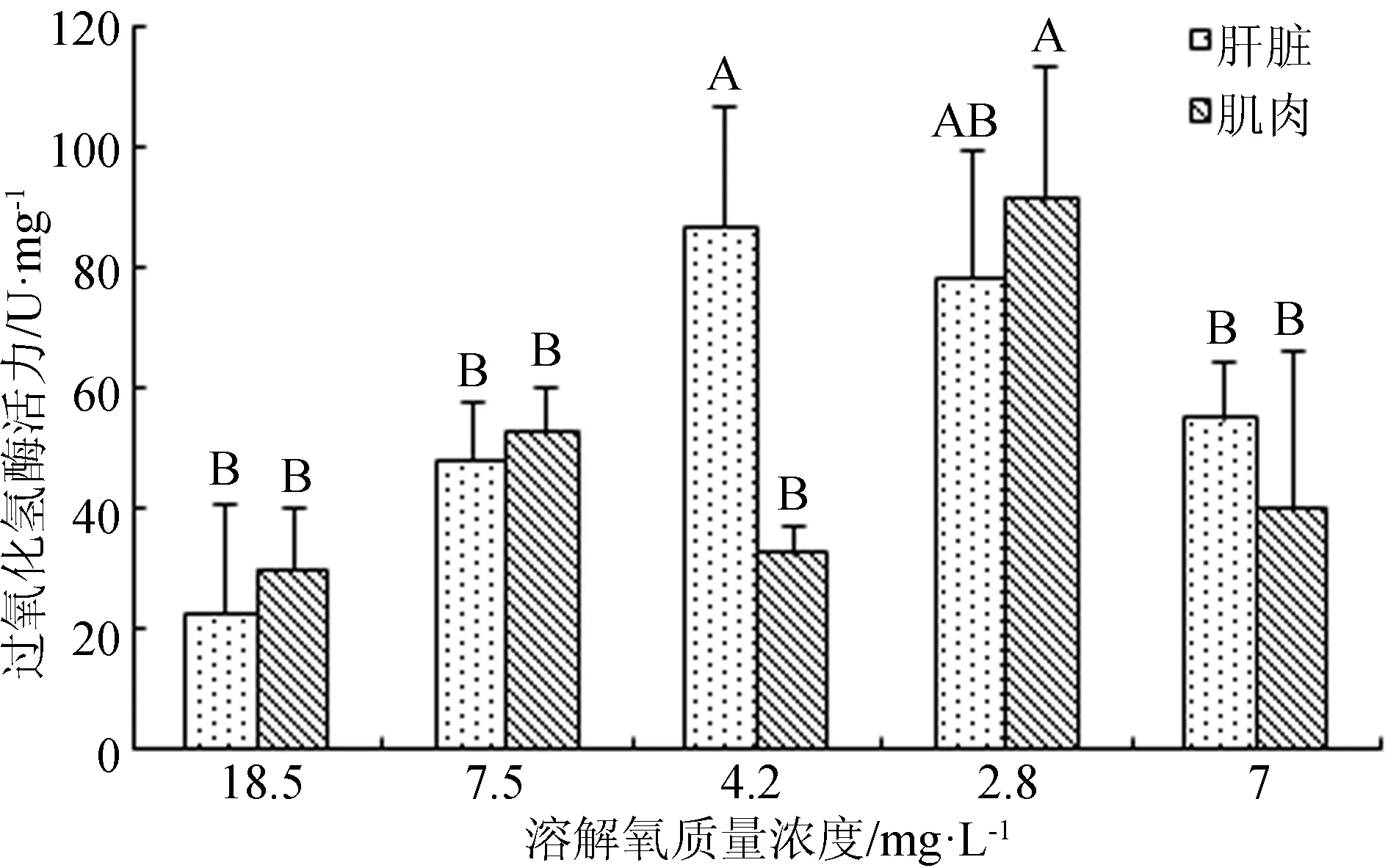
圖6 不同溶解氧條件下西伯利亞鱘幼魚肝臟和肌肉過氧化氫酶活力
2.4 低溶解氧對鱘魚能量、代謝相關酶活力的影響
急性低氧處理3 h,西伯利亞鱘幼魚鰓組織的三磷酸腺苷酶活力為(2.01±0.14) U/mg,對照組鰓部三磷酸腺苷酶活力為(2.78±1.07) U/mg,差異不顯著(P>0.05)。低氧處理組肝臟的堿性磷酸酶活力顯著低于正常溶氧組(P<0.05),而肌肉的堿性磷酸酶活力無顯著差異(P>0.05)(表2)。
在溶解氧變化過程中,西伯利亞鱘幼魚鰓組織三磷酸腺苷酶活力亦不存在顯著差異(P>0.05)(圖7)。而當溶解氧質量濃度由18.5 mg/L降至7.5 mg/L時,西伯利亞鱘幼魚肝臟和肌肉組織的堿性磷酸酶活力出現略微升高,當溶解氧質量濃度繼續降低,二者堿性磷酸酶活力逐漸下降,再次恢復到7 mg/L時,肝臟堿性磷酸酶活力顯著上升(P<0.05)(圖8)。
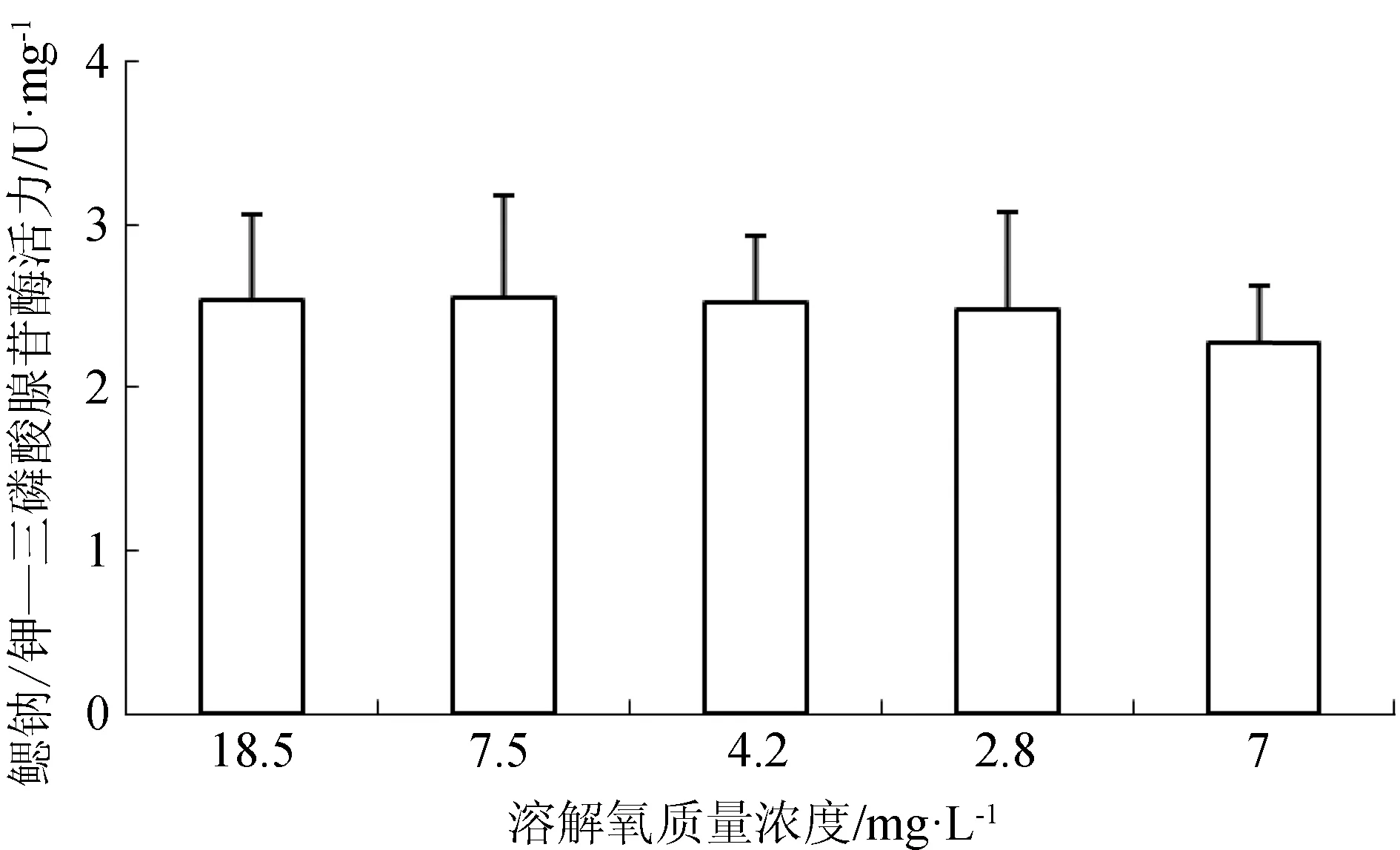
圖7 不同溶解氧水平下西伯利亞鱘幼魚鰓部三磷酸腺苷酶活力
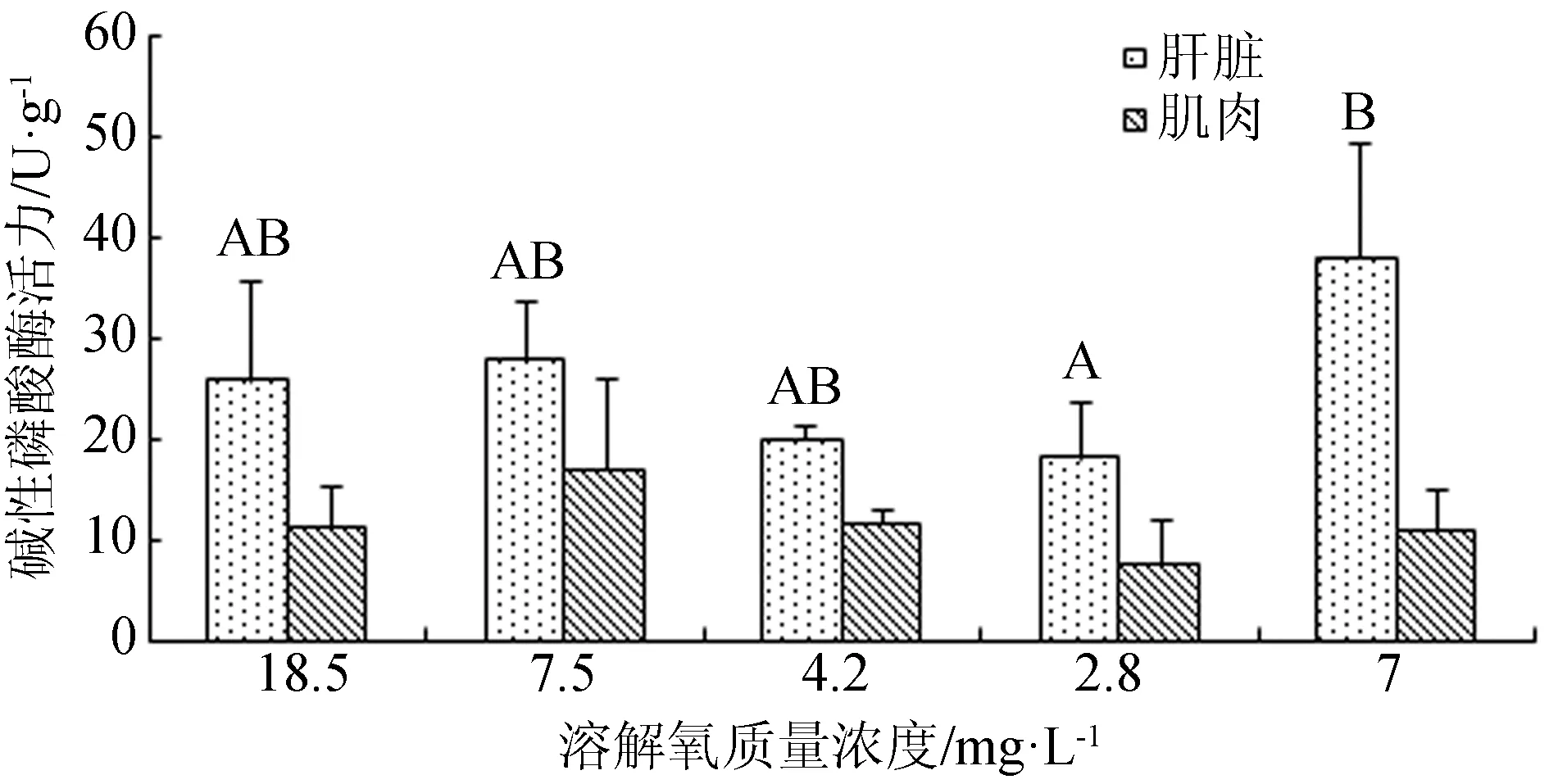
圖8 不同溶解氧條件下鱘魚肝臟和肌肉組織堿性磷酸酶活力
3 討 論
3.1 低氧脅迫對西伯利亞鱘幼魚血液基礎指標的影響
水體過飽和溶解氧或者過低溶解氧均對魚類的呼吸、代謝產生影響,導致魚類生長[1]、消化[2]、抗氧化等多種生理活動變化,也會引起血氧親和力[3]、血液中紅細胞數目、血紅蛋白含量[20]變化。有研究表明,經過30 d低氧馴化的鯉魚(Cyprinuscarpio)紅細胞數增加7%[21];經過12 h低氧馴化的大蓋巨脂鯉(Colossomamacropomum)紅細胞數增加53%,血紅蛋白含量幾乎增加1倍[22];鯽魚(Cyprinusauratus)幼魚經過2 h低氧處理,紅細胞數增加約100%,血紅蛋白增加約58%[23]。本研究結果顯示,經過3 h的急性低氧處理,西伯利亞鱘幼魚紅細胞數目顯著高于正常溶解氧狀態下的紅細胞數,超出10.8%,與以上結果一致,而血紅蛋白含量低于正常溶解氧狀態31.3%,這與鯽魚的研究結果不同。相比鯽魚,3 h的低氧馴化未引起西伯利亞鱘血液紅細胞、血紅蛋白含量發生較大程度變化,該結果提示鱘魚的低氧適應過程反應速度較鯽魚慢。當溶解氧質量濃度由18.5 mg/L降至7.5 mg/L時,血液紅細胞數減少,待溶解氧繼續降至4.2 mg/L時,紅細胞數顯著增加,溶解氧降至最低時,紅細胞數反而減少,整個溶解氧變化過程血紅蛋白含量無明顯變化,可見溶解氧由18.5 mg/L逐漸下降過程中,西伯利亞鱘血液的紅細胞數較血紅蛋白含量變化更靈敏。血紅細胞的氧親和力還與血液pH有一定關系,pH升高通常血氧親和力強,pH降低則會使血氧親和力減弱[24]。本試驗中,急性低氧處理3 h時,西伯利亞鱘血液pH顯著低于正常溶解氧條件下pH,而在溶解氧變化過程中,低溶解氧質量濃度下的血液pH稍高,但無顯著差異。溶解氧由18.5 mg/L降低過程中,溶解氧一定程度的降低可促進西伯利亞鱘幼魚紅細胞增加或從造血器官釋放到循環系統,但當溶解氧質量濃度低于一定值(本試驗中2.8 mg/L),可能超出魚體調節范圍,紅細胞數沒有增加,甚至有所減少。并且,短時間內溶解氧急劇變化,魚體血紅蛋白質量濃度和影響血氧親和力的pH尚未得到調整,此時魚體可能產生無氧呼吸。然而急性低氧處理3 h,西伯利亞鱘可能已實現自身調整以應對低氧脅迫,表現為增加血細胞數目,降低其在體內各組織的血氧親和力,卸載更多氧氣供給其他代謝反應,這與Wells等[22]對大蓋巨脂鯉的低氧馴化研究結果一致。
3.2 低氧脅迫對西伯利亞鱘幼魚抗氧化酶活力的影響
低氧環境下,魚體的無氧代謝會導致乳酸和丙二醛等代謝產物的積累,低氧脅迫往往引起魚體多種生理應激反應,并伴隨過量活性氧分子的產生,這些都對生物體產生氧化脅迫,甚至引起氧化損傷[7,25]。Lushchak等[13]的研究顯示魚類在低氧脅迫時會提高某種抗氧化酶活力,以提高其應對恢復正常溶解氧環境帶來的氧化應激能力。與之相反的是,本研究中,低氧處理3 h的鱘魚肝臟和肌肉組織超氧化物歧化酶和過氧化氫酶活力均顯著低于正常溶解氧組。而在溶解氧變化試驗中,隨著溶解氧質量濃度降低,肝臟超氧化物歧化酶和過氧化氫酶活力也隨之降低,待恢復到正常溶解氧水平7.8 mg/L時,這兩種抗氧化應激酶活力也得到恢復。然而肌肉超氧化物歧化酶活力在最低溶解氧處(2.8 mg/L)有所上升。綜上,在溶解氧變化試驗中,西伯利亞鱘幼魚在低溶解氧水平時,肝臟的抗氧化能力有所降低,可能是在低氧狀態下魚體代謝率降低,并且通過降低相關酶活力來保護肝臟,而此時肌肉相應地有較高的抗氧化力,以保證機體內活性氧分子不過分積累,這與彭銀輝等[26]對 魚(Lizahaematocheila)的研究結果一致。而在急性低氧脅迫維持較長時間(3 h)的條件下,魚體的肝臟和肌肉抗氧化功能可能受到影響,難以通過提高自身抗氧化酶來清除體內過量活性氧分子。
3.3 低氧脅迫對西伯利亞鱘幼魚能量、代謝相關酶活力的影響
魚類的各種生命活動需要機體能量的支持,三磷酸腺苷酶將三磷酸腺苷分解為二磷酸腺苷,并釋放能量供給生命活動,而三磷酸腺苷酶的合成及活性均受到水體溶解氧變化的影響。王春枝等[18]對低氧脅迫下鰱魚在心臟等組織中F1F0-三磷酸腺苷酶活性先升后降,認為在低氧應激條件下,通過自我調節促進鯉三磷酸腺苷酶活力升高,但當溶解氧降到一定程度,低氧造成鰱魚線粒體內膜損傷而影響能量代謝。鰓組織魚類的呼吸器官,是溶解氧進行氣體交換的場所,本研究探討了低氧脅迫下西伯利亞鱘魚的鰓部三磷酸腺苷酶活力,結果顯示急性低氧脅迫3 h以及在溶解氧變化過程中,鰓部三磷酸腺苷酶活力無明顯變化,可能低氧脅迫未引起魚體鰓部的能量調節。
堿性磷酸酶在魚體內是一種參與代謝調控的非特異性磷酸水解酶,參與鈣磷代謝,與機體的免疫密切相關[27-28],在機體的非特異性免疫反應中發揮重要作用。如果體內的堿性磷酸酶活力下降,則說明魚體在環境脅迫下生命代謝能力減弱或免疫調節功能下降。本研究檢測了在低氧脅迫下西伯利亞鱘肝臟和肌肉的堿性磷酸酶活力,結果顯示,急性低氧處理3 h,西伯利亞鱘肝臟堿性磷酸酶活力顯著低于正常溶解氧組。當溶解氧由18.5 mg/L降至7.5 mg/L時,西伯利亞鱘幼魚肝臟和肌肉組織的堿性磷酸酶活力略微升高,隨著溶解氧質量濃度繼續下降,堿性磷酸酶活力逐漸降低,溶解氧恢復到7 mg/L時,堿性磷酸酶活力顯著升高(P<0.05)。可見,低氧脅迫或者過高氧狀態下,西伯利亞鱘堿性磷酸酶活力降低,此時魚體代謝受到影響,非特異性免疫可能受到抑制,溶解氧質量濃度恢復后,魚體代謝恢復正常。
3.4 小結
本研究系統分析了急性低氧(2.3 mg/L)和由高氧(18.5 mg/L)逐漸到低氧(2.8 mg/L)再恢復至7 mg/L這兩種脅迫下,西伯利亞鱘幼魚紅細胞數、血紅蛋白含量、抗氧化酶和能量代謝相關酶活力的變化情況。試驗結果提示,西伯利亞鱘幼魚在低氧脅迫時,可較快增加血液紅細胞數量,并降低血紅蛋白質量濃度,以降低血氧親和力,來卸載更多氧氣供組織使用;魚體為保護肝臟,降低超氧化物歧化酶活力,而肌肉的超氧化物歧化酶活力在一定程度上有所升高;鰓部三磷酸腺苷酶活力并未增強,可能低氧脅迫未引起魚體鰓部的能量調節;西伯利亞鱘幼魚肝臟和肌肉堿性磷酸酶活力隨溶解氧降低而受到抑制,自身代謝調控和非特異性免疫受到影響。但從低氧狀態恢復到正常溶解氧狀態時,各項指標均能恢復到正常狀態,魚體并未受到嚴重影響。
[1] Wei L Z, Zhang X M, Huang G Q. Effects of limited dissolved oxygen supply on the growth and energy allocation of juvenile Chinese shrimp,Fenneropenaeuschinensis[J]. Journal of World Aquaculture Society, 2009, 40(4):483-492.
[2] 張釗, 李榮, 郭惠, 等.不同溶解氧水平對工廠化養殖大菱鲆生長及肌肉生化組分的影響[J]. 水產科學, 2014, 33(8):520-523.
[3] 胡國宏,孫廣華,朱世成,等.低溶氧量對懷頭鲇呼吸代謝耗氧率的影響[J].動物學雜志, 2002, 37(2):46-48.
[4] 沈凡, 樊啟學, 楊凱, 等. 不同溶氧條件下黃顙魚免疫機能及抗病力的研究[J].淡水漁業, 2010, 40(4):44-49.
[5] Chabot D,Dutil D. Reduced growth of Atlantic cod in non-lethal hypoxia conditions [J]. Journal of Fish Biology, 1999, 55(3):472-491.
[6] Karim M R, Sekine M, Ukita M. Simulation of eutrophication and associated occurrence of hypoxia and anoxia condition in a coastal bay in Japan [J]. Marine Pollution Bulletin, 2002, 45(1/12):280-285.
[7] Wihelm F D, Torres M A, Zaniboni-filhoe, et al. Effects of different oxygen tensions on weight gain, feed conversion, and antioxidant status in piaparaLeporinuselongates(Valeneiennes, 1847) [J]. Aquaculture, 2005, 244(1/4):349-357.
[8] Randall D. The control of respiration and circulation in fish during exercise and hypoxia [J]. Journal of the Royal Society of Medicine, 1999, 92(4):186-188.
[9] Silkin Y A, Silkina E N. Effects of hypoxia on physiological biochemical blood parameters in some marine fish [J].Journal of Evolutionary Biochemistry and Physiology, 2005, 41(5):527-532.
[10] Gamperl A K, Farrell A P. Cardiac plasticity in fishes: environmental influences and intraspecific differences [J]. The Journal of Experimental Biology, 2004, 207(15):2539-2550.
[11] Bickler P E, Buck L T. Hypoxia tolerance in reptiles, amphibians, and fishes: life with variable oxygen availability [J]. Annual Review of Physiology, 2007, 69(69):145-170.
[12] Lushchak V I, Bagnyukov T V, Lushchak O V, et al.Hypoxia and recovery perturb free radical processes and antioxidant potential in common carp (Cyprinuscarpio) tissues [J]. International Journal of Biochemistry and Cell Biology, 2005, 37(6):1319-1330.
[13] Lushchak V I, Bagnyukov T V. Effects of different environmental oxygen levels on free radical processes in fish [J]. Comparative Biochemistry and Physiology Part B, 2006, 144(3):283-289.
[14] Wu R S. Hypoxia: from molecular responses to ecosystem responses [J].Marine Pollution Bulletin, 2002, 45(1/12):35-45.
[15] Cooper R U, Clough L M, Farwell M A, et al. Hypoxic-induced metabolic and antioxidant enzymatic activities in the estuarine fishLeiostomusxanthurus[J]. Journal of Experimental Marine Biology & Ecology, 2002, 279(1/2):1-20.
[16] Johnton I A. Calcium regulatory protein and temperature acclimation of actomyosin ATPase from a eurythermal teleost(Carassois) [J]. Comparative Biochemistry and Physiology Part B,1979, 129(2):163-167.
[17] 馮廣朋, 莊平, 章龍珍, 等. 饑餓期間中華鱘幼魚血液與肝臟酶活力的變化[J].海洋漁業, 2011, 33(2):165-171.
[18] 王春枝, 李忠, 梁宏偉, 等. 低氧脅迫對鰱線粒體ATP酶活性及F1-δ基因表達的影響[J]. 中國水產科學, 2014, 21(3):454-463.
[19] 金麗, 趙娜, 周傳江,等.饑餓對胭脂魚血液指標及造血的影響[J]. 水生生物學報, 2012, 36(4):665-673.
[20] Cameron J N. The influence of environmental variables on the haematology of pinfish (Lagodonrhomboides), and striped mullet (Mugilcephalus) [J]. Comparative Biochemistry and Physiology, 1970, 32(2):175-192.
[21] Weber R E, Lykkeboe G. Respiratory adaption in carp blood influences of hypoxia, red cell organic phosphates, divalent cations and CO2on hemoglobin-oxygen affinity [J]. Journal of Comparative Physiology, 1978, 128(2):127-137.
[22] Wells R M G,Grigg G C, Beard L A, et al. Hypoxia responses in a fish from a stable environment: blood oxygen transport in the Antarctic fishPagotheniaborchgrevinki[J]. The Journal of Experimental Biology, 1989(141):97-111.
[23] 張曦, 付世建, 彭姜嵐, 等. 急性低氧對鯽魚幼魚血液基礎指標的影響[J]. 重慶師范大學學報:自然科學版, 2011, 28(4):19-22.
[24] Tetents V, Wells R M G. Antarctic fish blood: respiratory properties and the effects of thermal acclimation [J]. The Journal of Experimental Biology, 1984, 109(3):265-279.
[25] 洪磊,張秀梅. 環境脅迫對魚類生理機能的影響[J]. 海洋科學進展,2004, 22(1):114-121.
[26] 彭銀輝, 黃國強, 李潔, 等.溶氧水平對梭魚幼魚能量代謝與氧化應激的影響[J]. 廣西科學, 2013, 20(4):294- 298.
[27] 羅克. 動物粘膜免疫系統研究進展[J]. 福建畜牧獸醫, 2000, 22(5):44-49.
[28] Cheng T C. The role of lysosomal hydrolases in molluscan cellular response to immunologic challenge[G]// Bulla L A J, Cheng T C. Invertebrate Models for Biomedical Research. New York: Springer US, 1978:59-71.
EffectsofHypoxiaonPhysiologicalStatusofSiberianSturgeonAcipenserbaeriJuveniles
WANG Xiaowen, ZHU Hua, HU Hongxia, MA Guoqing
( Beijing Key Laboratory of Fishery Biotechnology, Beijing Fisheries Research Institute, Beijing 100068, China )
Effects of acute hypoxia stress and drastic changes in dissolved oxygen levels from 18.5 mg/L to 2.8 mg/L then recovery to 7 mg/L on blood parameters, antioxidant and metabolism were studied in Siberian sturgeonAcipenserbaeriwith body weight of (19.46±4.9) g. Erythrocyte count, total hemoglobin concentration, activities of antioxidant enzymes in livers and muscle, and activities of Na+/K+-ATPase in gills were measured in the experiment. The results showed that erythrocytic number was elevated, while hemoglobin concentration and pH of whole blood under hypoxia stress were lower than those in the control group. Hypoxia stress also depressed the activities of superoxide dismutase (SOD), catalase (CAT) and alkaline phosphatase (AKP) in juvenile sturgeon. Nevertheless, there were no obvious changes in the activities of Na+/K+-ATPase in gills of Siberian sturgeon juveniles. Based on the results above, it is suggested that hypoxia stress could easily lead to the enhancement of erythrocyte amount, also reduce the activities of antioxidant and metabolism enzymes in livers or muscle of the juveniles. However, sturgeon juveniles could not achieve energy adjustment in gills itself within a short time.
Acipenserbaeri; blood parameter; antioxidant enzyme; ATPase; AKP enzyme
10.16378/j.cnki.1003-1111.2016.05.001
S965.199
A
1003-1111(2016)05-0459-07
2015-10-23;
2016-04-18.
國家科技支撐計劃項目(2015BAD25B01,2012BAD26B05);現代農業產業技術體系北京市鱘魚、鮭鱒魚創新團隊項目(SCGWZJ20161102,SCGWZJ20161104);北京市農林科學院冷水性魚類科技創新團隊項目(JNKST201611).
王曉雯(1989—),女,助理工程師;研究方向:水產免疫生理. E-mail:wxw211@126.com.通訊作者:朱華(1972—),男,研究員;研究方向:水產養殖與生理生態. E-mail:zhuhua@bjfishery.com.

