404 Not Found
404 Not Found
電刺激對富脂性胰島素抵抗骨骼肌細(xì)胞糖代謝的影響
潘紅英 徐曉陽 賈章志
摘 要:棕櫚酸孵育C2C12細(xì)胞建立富脂性胰島素抵抗骨骼肌細(xì)胞模型,觀察一定強(qiáng)度的電刺激引發(fā)收縮對其糖代謝的影響。選用不同梯度濃度的棕櫚酸孵育分化5 d的C2C12細(xì)胞16 h,檢測各組細(xì)胞培養(yǎng)液中葡萄糖剩余量和細(xì)胞活性,選取合適的棕櫚酸濃度建立其誘導(dǎo)的胰島素抵抗細(xì)胞模型。隨后實驗分為4組:對照組(C組)、電刺激組(EPS組)、棕櫚酸組(PA組)、電刺激+棕櫚酸組(EPS+PA組),以15 V、30 ms、2 Hz的強(qiáng)度電刺激60 min,收樣測定細(xì)胞培養(yǎng)液葡萄糖剩余量、AMPK-α2 mRNA和GLUT4蛋白表達(dá)量。結(jié)果顯示,(1)0.5 mmol/L棕櫚酸溶液孵育16 h,與C組相比,LDH、MTT無顯著變化(P>0.05),葡萄糖剩余量明顯增加(P<0.05),加入胰島素刺激后,葡萄糖剩余量與刺激前相比無顯著性差異(P>0.05);(2)與C組相比,PA組葡萄糖剩余量顯著增加(P<0.05)、AMPK-α2基因表達(dá)顯著下降(P<0.05)、總GLUT4蛋白和膜GLUT4蛋白表達(dá)量顯著下降(P<0.05);(3)與PA組相比,EPS+PA組葡萄糖剩余量顯著減少(P<0.05)、AMPK-α2基因表達(dá)顯著升高(P<0.05)、肌管膜GLUT4蛋白表達(dá)量非常顯著增加(P<0.01)、總GLUT4蛋白量雖有所增加,但無顯著性變化(P>0.05)。結(jié)果說明:棕櫚酸(0.5 mmol/L)孵育分化5 d的C2C12細(xì)胞16 h,可以導(dǎo)致其富脂性胰島素抵抗的發(fā)生。15 V、30 ms、2 Hz的強(qiáng)度電刺激60 min,可以提高胰島素抵抗骨骼肌細(xì)胞對葡萄糖的吸收,增加AMPK-α2mRNA和GLUT4蛋白的表達(dá),有助于改善富脂性胰島素抵抗骨骼肌細(xì)胞的糖代謝。
關(guān) 鍵 詞:運動生物化學(xué);骨骼肌細(xì)胞;棕櫚酸;胰島素抵抗;電刺激;糖代謝;小鼠
中圖分類號:G804.7 文獻(xiàn)標(biāo)志碼:A 文章編號:1006-7116(2016)06-0129-06
Effects of electric stimulation on lipid rich insulin resisting the
sugar metabolism of skeletal muscle cells
PAN Hong-ying1,XU Xiao-yang1,JIA Zhang-zhi2
(1.School of Physical Education,South China Normal University,Guangzhou 510006,China;
2. Sports Science Research Institute of Guangdong Province,Guangzhou 510100,China)
Abstract: By using palmitic acid to incubate C2C12 cells, the authors established a model of lipid rich insulin resisting skeletal muscle cells, so as to observe the effects of contraction triggered by a certain intensity of electric stimulation on the cells sugar metabolism. The authors used different gradient concentrations of palmitic acid to incubate 5d differentiated C2C12 cells for 16h, measured glucose remaining amount and cell activity in the cell culture fluid of various groups, selected an appropriate palmitic acid concentration to establish a model of insulin resisting the cells, which was induced by such a concentration, then divided the experiment into 4 groups: a control group (C), an electric stimulation group (EPS), a palmitic acid group (PA), and an electric stimulation + palmitic acid group (EPS+PA ), applied an intensity of (15 V, 30 ms, 2 Hz) of electric stimulation for 60min, collected the samples and measured glucose remaining amount, AMPK-α2 mRNA and GLUT4 protein expression levels in the cell culture fluid, and revealed the following findings: 1) Comparing the group incubated with 0.5 mmol/L palmitic acid for 16 h with group C, LDH and MTT had no significant change (P>0.05), glucose remaining amount increased significantly (P<0.05), after adding insulin stimulation, glucose remaining amount had no significant difference as compared with that before stimulation (P>0.05); 2) Comparing group PA with group C, glucose remaining amount increased significantly (P<0.05), AMPK-α2 gene expression decreased significantly (P<0.05), total GLUT4 protein and membrane GLUT4 protein expression levels decreased significantly (P<0.05); 3) Comparing group EPS+PA with group PA, glucose remaining amount decreased significantly (P<0.05), AMPK-α2 gene expression increased significantly (P<0.05), myotube membrane GLUT4 protein expression level increased very significantly (P<0.01), total GLUT4 protein content had no significant change (P>0.05), although increased somewhat. The said findings indicate the followings: using palmitic acid (0.5 mmol/L) to incubate 5 d differentiated C2C12 cells for 16 h can cause the occurrence of resistance of their lipid rich insulin; an intensity of (15 V, 30 ms, 2 Hz) of electric stimulation for 60min can promote insulin resisting the glucose absorption by skeletal muscle cells, increase AMPK-α2 mRNA and GLUT4 protein expression, thus help improving lipid rich insulin resisting the sugar metabolism of skeletal muscle cells.
Key words: sports biochemistry;skeletal muscle cell;palmitic acid;insulin resistance;electric stimulation;glucose metabolism;mouse
胰島素抵抗(IR)是指胰島素的外周靶組織對胰島素的敏感性和反應(yīng)性降低,導(dǎo)致生理劑量的胰島素產(chǎn)生低于正常值的一種病理狀態(tài)[1]。IR與葡萄糖代謝異常密切相關(guān),因此改善胰島素抵抗及葡萄糖代謝紊亂,是防治2型糖尿病及相關(guān)代謝性疾病的重要途徑。骨骼肌作為機(jī)體最大的胰島素靶器官和葡萄糖利用的主要外周組織,是IR發(fā)生的主要場所。研究發(fā)現(xiàn),長期高脂飲食或短期脂肪酸大量輸入,以及機(jī)體因增齡引起的退化,均可引起骨骼肌脂肪含量增加,導(dǎo)致出現(xiàn)富脂性胰島素抵抗[2-3]。
電刺激是運動生理中常用的刺激方法,目前己廣泛應(yīng)用到與骨骼肌收縮有關(guān)的疾病預(yù)防和治療中。電刺激對已發(fā)生胰島素抵抗的骨骼肌細(xì)胞的作用如何,國內(nèi)外相關(guān)的研究很少。因此,本研究以C2C12小鼠骨骼肌細(xì)胞為研究對象,利用飽和脂肪酸棕櫚酸(PA)孵育誘導(dǎo)建立富脂性胰島素抵抗細(xì)胞模型,電刺激引起骨骼肌細(xì)胞收縮,觀察收縮對富脂性胰島素抵抗的C2C12肌管的糖轉(zhuǎn)運能力的影響,為下一步深入開展骨骼肌細(xì)胞胰島素抵抗電刺激方面的研究提供參考。
1 材料與方法
1.1 C2C12細(xì)胞培養(yǎng)、分化
小鼠骨骼肌肌母細(xì)胞系C2C12細(xì)胞購自南方醫(yī)科大學(xué),DMEM高糖培養(yǎng)基(含10%胎牛血清),37 ℃、體積分?jǐn)?shù)5% CO2培養(yǎng)箱中培養(yǎng),細(xì)胞生長密度達(dá)70%~80%時將所有細(xì)胞用0.25%胰蛋白酶消化后,以2×105/mL密度種到6孔培養(yǎng)板中,待細(xì)胞單層覆蓋培養(yǎng)板底面密度達(dá)95%左右,換成分化培養(yǎng)基(高糖DMEM,2%馬血清,質(zhì)量分?jǐn)?shù)1%青霉素/鏈霉素)開始進(jìn)行分化培養(yǎng),每天換液,并從加入分化培養(yǎng)基開始計算分化天數(shù)。
1.2 PA孵育建立IR骨骼肌細(xì)胞模型
細(xì)胞分化5 d后,換成1%BSA的低糖無血清培養(yǎng)液孵育12 h(饑餓處理)。培養(yǎng)板每孔分別加入0、0.25、0.5、0.75、1.0 mmol/L濃度的棕櫚酸(PA),孵育16 h,收取細(xì)胞和培養(yǎng)上清液。選取適當(dāng)參數(shù),建立IR細(xì)胞模型。
油紅O染色:PA孵育后,加入質(zhì)量分?jǐn)?shù)10%中性甲醛固定30 min,PBS沖洗3次,每孔加入新鮮配制的油紅O染液1 mL,室溫孵育2 h,觀察脂滴形成情況。棄去染色液,每孔加入1 mL質(zhì)量分?jǐn)?shù)4%的NP-40的異丙醇,反復(fù)吹打后每孔取出150 μL,按照南京建成生物工程研究所提供的脂質(zhì)形成檢測試劑盒說明測定脂質(zhì)含量。試劑盒由普利萊基因技術(shù)有限公司提供。
1.3 實驗分組和電刺激方案
饑餓處理后的肌管隨機(jī)分為4組,對照組(C組)、電刺激組(EPS組)、棕櫚酸組(PA組)、電刺激+棕櫚酸組(EPS+PA組)。C組和EPS組用分化培養(yǎng)基培養(yǎng)16 h,PA組和EPS+PA組用PA孵育16 h成IR肌管。 隨后分別對EPS組和EPS+PA組進(jìn)行電刺激,強(qiáng)度設(shè)為15 V、30 ms、2 Hz,時間60 min,刺激結(jié)束立即收樣;C組和PA組直接收樣。測定相關(guān)指標(biāo)。
1.4 細(xì)胞活性測定
細(xì)胞活力檢測試劑盒(MTT法)測定細(xì)胞活性,用酶聯(lián)免疫檢測儀(美國,BIO-RAD公司)570 nm處測定其光密度值,計算細(xì)胞存活率。乳酸脫氫酶(LDH)活性定量檢測試劑盒測定細(xì)胞膜完整性,440 nm波長處測光密度值,通過公式計算各組LDH濃度。試劑盒由南京建成生物工程研究所提供。
1.5 細(xì)胞培養(yǎng)液葡萄糖(G)剩余量測定
葡萄糖氧化酶-過氧化物酶法檢測上清液中剩余葡萄糖濃度,酶標(biāo)儀測定550 nm處光密度值,通過公式計算葡萄糖含量。在棕櫚酸孵育結(jié)束前30 min加入100 nm的胰島素(Ins)溶液或加入同溶劑的胰島素對照品(除了不含胰島素,其他溶液成分一樣)刺激。
1.6 腺苷酸活化蛋白激酶α2(AMPK-α2)mRNA的測定
采用實時定量PCR方法測定C2C12肌管中AMPK-a2 mRNA水平,引物由上海生工生物有限公司設(shè)計,抗體由北京博奧森生物技術(shù)有限公司提供。Trizol法提取肌管總RNA,mRNA反轉(zhuǎn)錄合成cDNA,然后進(jìn)行逆轉(zhuǎn)錄聚合酶鏈反應(yīng)(RT-PCR)。AMPK-α2上游引物5-TCCAAAGTCAGCTATCTTAGCGTT-3,下游引物5-CGTGGATTACTGTCACAGGCATAT -3。內(nèi)參上游引物5-TGATGTCACGCACGATTTCC-3,下游引物5-ACACTGTGCCCATCTACGAGG-3。在管中加20 μL反應(yīng)體系,Hema3200基因擴(kuò)增儀上反應(yīng)。以GAPDH為內(nèi)參,計算目的基因的相對表達(dá)量。
1.7 Western Blotting 測定葡萄糖轉(zhuǎn)運蛋白4(GLUT4)蛋白表達(dá)
收集細(xì)胞,加入裂解液,離心提取胞漿和胞膜蛋白。按照GLUT4蛋白檢測試劑盒說明書和檢測目的條帶大小來配制一定濃度的分離膠和5%濃縮膠。兔抗GLUT4,AMPK,一抗、二抗孵育后,TBST洗滌膜。使用ECL試劑盒發(fā)光,顯影,X線膠片壓片曝光,掃描定量各條帶的相對灰度值,β-actin為內(nèi)參蛋白,“目的蛋白相對含量=目的蛋白灰度值/β-actin內(nèi)參蛋白灰度值”。試劑盒由北京博奧森生物技術(shù)有限公司提供。
1.8 數(shù)據(jù)統(tǒng)計處理
SPSS17.0統(tǒng)計學(xué)軟件進(jìn)行處理。所有數(shù)據(jù)以“ ±s”表示,單因素方差分析檢驗各組數(shù)據(jù)間差異的顯著性,P<0.05為顯著性差異,P<0.01為非常顯著性差異。
2 結(jié)果及分析
2.1 不同濃度PA孵育后細(xì)胞活性和LDH活性變化
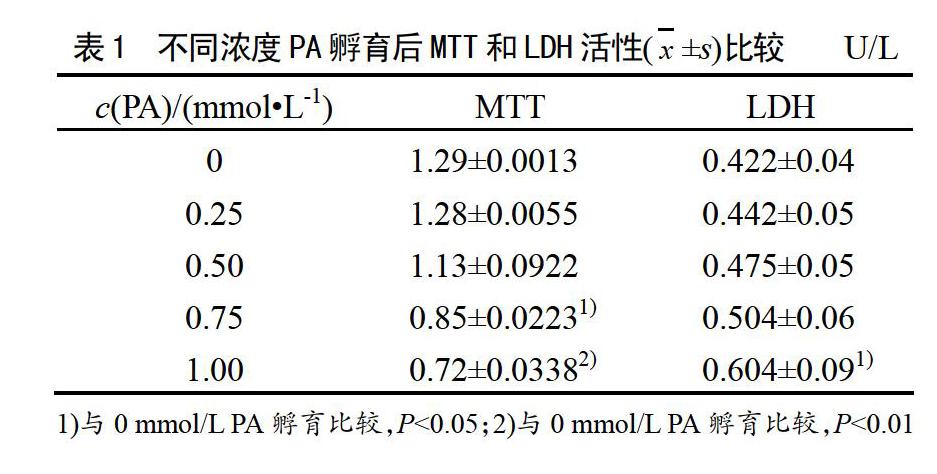
MTT法是檢測活細(xì)胞的數(shù)量和代謝活力的經(jīng)典方法,MTT值下降,提示活細(xì)胞數(shù)量減少,細(xì)胞生長受抑制。表1所示:低濃度(0、0.25、0.5 mmol/L)PA孵育16 h,細(xì)胞活性均增加,與0 mmol/L PA孵育相比,0.25、0.5 mmol/L孵育后MTT值雖有降低,卻無顯著性差異(P>0.05),0.75、1.0 mmol/L孵育后,MTT值降低顯著(P<0.05)。提示0.5 mmol/L以上濃度明顯抑制了細(xì)胞增殖。LDH是質(zhì)膜完整性的標(biāo)志,也是檢測細(xì)胞毒性的指標(biāo),酶活力越大,表示細(xì)胞受損程度越嚴(yán)重。表1結(jié)果顯示,與濃度0 mmol/L PA孵育相比,1.0 mmol/L孵育后LDH活性增加(P<0.05 ),而0.75 mmol/L以下的3個濃度孵育后,LDH活性均無顯著性差異(P>0.05),提示濃度1.0 mmol/L孵育后,肌管膜出現(xiàn)明顯損傷。
2.2 不同濃度PA孵育后C2C12肌管糖剩余量和脂質(zhì)含量的比較
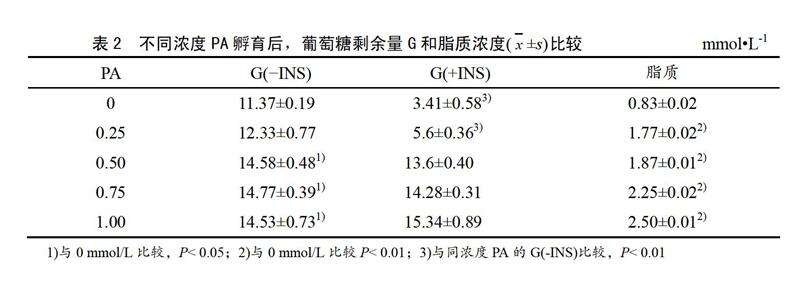
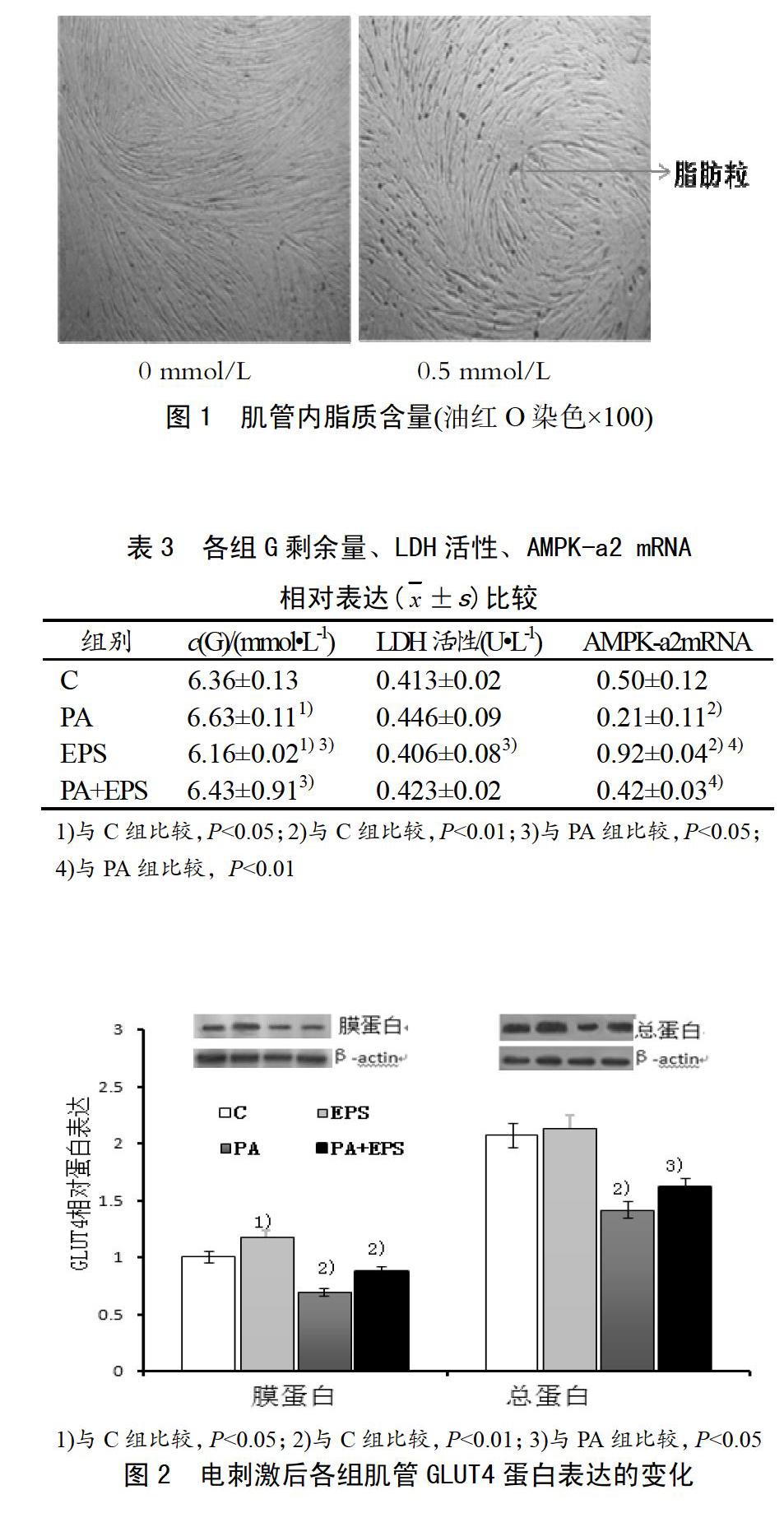
表2所示:16 h的PA孵育,濃度0.50、0.75和1.0 mmol/L上清中葡萄糖剩余量G與0 mmol/L相比顯著增加(P<0.05),脂質(zhì)含量非常顯著增加(P<0.01)。在PA孵育結(jié)束前30 min加入100 nmol/L胰島素溶液(+INS)刺激的各濃度中,濃度0、0.25 mmol/L與不加胰島素(-INS)刺激的同濃度PA孵育相比,葡萄糖剩余量顯著降低(P<0.01)。0.5 mmol/L PA孵育后,與0 mmol/L組相比,脂肪粒增多(見圖1)。
2.3 電刺激IR肌管后葡萄糖剩余量、LDH活性、AMPK-a2 mRNA的變化
表3結(jié)果顯示:EPS組肌管培養(yǎng)液中葡萄糖剩余量明顯低于對照組(P<0.05),PA組則高于對照組(P<0.05),EPS+PA組葡萄糖剩余量明顯低于PA組(P<0.05)。各組培養(yǎng)液中LDH活性與對照組相比都無顯著差異(P>0.05),但EPS組明顯低于PA組(P<0.01)。AMPK-a2mRNA 表達(dá),與對照組相比,PA組降低(P<0.05),而EPS組明顯增加(P<0.01),EPS+PA組與PA組相比也顯著增加(P<0.05)。
2.4 電刺激IR肌管,引起GLUT4蛋白表達(dá)的變化
圖2結(jié)果顯示:與C組相比,PA組膜GLUT4蛋白和總蛋白表達(dá)顯著性降低(P<0.01),EPS組膜GLUT4蛋白表達(dá)增加(P<0.05),總蛋白雖有增加確無顯著差異(P>0.05)。與PA組相比,PA+EPS組膜GLUT4蛋白表達(dá)顯著增加(P<0.01),總蛋白有所上升,但無顯著差異(P>0.05)。
3 討論
3.1 富脂性胰島素抵抗細(xì)胞模型的建立
研究骨骼肌富脂性胰島素抵抗發(fā)生機(jī)制,建立相關(guān)的胰島素抵抗模型尤為重要。分化后具有收縮功能的C2C12細(xì)胞,常被用做離體骨骼肌功能的研究。動物和人體實驗表明[2],無論是通過脂質(zhì)灌注還是慢性的高脂飲食,引起血中游離脂肪酸升高,均可導(dǎo)致骨骼肌出現(xiàn)富脂性胰島素抵抗。老年人易發(fā)生的胰島素抵抗也與骨骼肌線粒體功能異常,產(chǎn)生肥胖和脂質(zhì)堆積有關(guān)[3]。在引起胰島素抵抗的脂肪酸中,又以長鏈飽和脂肪酸棕櫚酸最為典型[4],且不同濃度的棕櫚酸對細(xì)胞的影響不同。在C2C12和L6細(xì)胞誘導(dǎo)分化前加入棕櫚酸孵育,可影響肌細(xì)胞分化,但分化后再加入棕櫚酸則不影響分化程度[5]。濃度為0.2~0.8 mmol/L的棕櫚酸孵育L6骨骼肌細(xì)胞8 h,細(xì)胞活性不變,但對棕櫚酸的吸收隨濃度增加[6]。而0.8、1.0 mmol/L濃度的棕櫚酸分別孵育到24和36 h,細(xì)胞活性出現(xiàn)降低[7]。也有研究發(fā)現(xiàn)0.75 mmol/L 棕櫚酸處理分化4 d的C2C12肌管16 h,GLUT4 mRNA水平和糖攝入均降低[8]。
本研究選取1 mmol/L以下的4個濃度梯度,孵育分化5 d的C2C12肌管16 h,發(fā)現(xiàn),高濃度(0.75、1 mmol/L)的棕櫚酸孵育后,細(xì)胞活性明顯降低,低濃度(0.25、0.5 mmol/L)的棕櫚酸孵育不會引起細(xì)胞活性下降和膜損傷。各組上清中葡萄糖剩余量與對照組相比均顯著性增加。在PA孵育結(jié)束前30 min加入100 nmol/L胰島素溶液刺激后,低濃度(0.25 mmol/L) PA孵育的肌管葡萄糖剩余量與同濃度不加胰島素刺激的PA組相比顯著減少(P<0.01);0.5 mmol/L 組則無顯著性變化。因胰島素刺激下對葡萄糖的代謝能力是判斷骨骼肌胰島素敏感性的主要指標(biāo)。故可推斷0.5 mmol/L PA孵育后,肌管對胰島素敏感性已降低,出現(xiàn)胰島素抵抗。油紅O染色也發(fā)現(xiàn),肌管內(nèi)紅色脂質(zhì)顆粒明顯增加,表明此時已引起肌管脂質(zhì)積累。即由此可以認(rèn)為,0.5 mmol/L的濃度PA孵育細(xì)胞16 h,可引起分化的肌管產(chǎn)生胰島素抵抗,是建模的適宜濃度。
3.2 電刺激對富脂性IR骨骼肌細(xì)胞葡萄糖代謝的改善作用
骨骼肌的收縮水平是底物代謝及轉(zhuǎn)錄事件的重要調(diào)節(jié)因子。不同的電刺激條件及強(qiáng)度會對骨骼肌細(xì)胞產(chǎn)生不同的影響[9]。Nedachi[10]認(rèn)為40 V、60 mmol/L、2 ms、1 Hz的強(qiáng)度較適合研究C2C12肌管收縮反應(yīng)時的代謝改變。Marotta[11]等以50 V、100 mmol/L、30 ms、3 Hz的強(qiáng)度電刺激C2C12 肌管90 min,發(fā)現(xiàn)肌管中糖原分解增加,糖原代謝相關(guān)酶活性改變。本研究前期研究發(fā)現(xiàn),15 V、60 mmol/L、30 ms,3 Hz的強(qiáng)度刺激分化5 d的C2C12肌管120 min,細(xì)胞膜沒有明顯損傷,且能通過AMPK途徑增加肌管糖攝入和糖轉(zhuǎn)運[12]。因此,本研究仍采取同樣的強(qiáng)度,觀察電刺激對富脂性IR肌管的影響。
結(jié)果顯示:電刺激60 min后,各組間細(xì)胞活性和細(xì)胞膜完整性無顯著性差異(P>0.05),即此強(qiáng)度不會對細(xì)胞造成損傷,適合對富脂性IR細(xì)胞的研究。但電刺激IR組肌管培養(yǎng)液中的葡萄糖剩余量明顯低于對照組(P<0.05)。胰島素抵抗的主要癥狀就是機(jī)體組織攝取和清除葡萄糖的能力低下。培養(yǎng)液中葡萄糖剩余量減少,表明電刺激引起的收縮可以有效地促進(jìn)IR肌管對培養(yǎng)液中葡萄糖的吸收和利用,調(diào)節(jié)胰島素抵抗肌管的糖代謝。
3.3 電刺激對富脂性IR骨骼肌細(xì)胞糖代謝相關(guān)因子的調(diào)控
GLUT4是骨骼肌葡萄糖轉(zhuǎn)運的主要轉(zhuǎn)運因子,其在細(xì)胞膜上載體的數(shù)量與細(xì)胞葡萄糖最大轉(zhuǎn)運能力呈正相關(guān)關(guān)系[13]。胰島素和收縮作用均可以促進(jìn)GLUT4 從細(xì)胞囊泡內(nèi)向細(xì)胞膜的轉(zhuǎn)運。然而,兩者調(diào)節(jié)葡萄糖轉(zhuǎn)運則是通過不同的信號途徑完成的[14-15]。在本研究中,胰島素抵抗組GLUT4膜蛋白和總蛋白表達(dá)量都明顯下降,電刺激組總GLUT4蛋白表達(dá)量變化不大,但肌膜GLUT4蛋白表達(dá)量卻顯著性增加,提示胰島素抵抗時,骨骼肌肌管GLUT4 膜蛋白轉(zhuǎn)位減少,導(dǎo)致細(xì)胞內(nèi)總 GLUT4蛋白貯存量降低。電刺激誘導(dǎo)的收縮可以促使骨骼肌細(xì)胞 GLUT4轉(zhuǎn)位,使骨骼肌細(xì)胞膜上轉(zhuǎn)運蛋白含量增加,從而增加機(jī)體轉(zhuǎn)運葡萄糖能力。在體研究也發(fā)現(xiàn),當(dāng)機(jī)體處于胰島素抵抗或2型糖尿病狀態(tài)時,骨骼肌中GLUT4蛋白表達(dá)明顯低于正常大鼠,而GLUT4的過表達(dá)則可以明顯改善胰島素抵抗的癥狀[16-17]。這與本研究的結(jié)果相吻合,其機(jī)制可能與運動激活細(xì)胞內(nèi)的能量開關(guān)分子——腺苷酸活化蛋白激酶(AMPK),后者進(jìn)而促進(jìn)GLUT4轉(zhuǎn)位有關(guān)。
為探討收縮運動對胰島素介導(dǎo)的葡萄糖攝取的變化,本研究檢測了骨骼肌收縮中對能量變化最敏感也最易被激活的AMPK-α2亞基。發(fā)現(xiàn)胰島素抵抗組AMPK-α2基因表達(dá)下降,而電刺激可引起其表達(dá)上升,提示適當(dāng)?shù)碾姶碳じ纳屏艘葝u素抵抗造成的AMPK-α2表達(dá)下降。近來有關(guān) AMPK在骨骼肌葡萄糖轉(zhuǎn)運中的機(jī)制仍未明了。有研究認(rèn)為,無論低強(qiáng)度或是高強(qiáng)度運動,AMPK-α2基因的缺失并不影響GLUT4 的轉(zhuǎn)位[18]。也有研究認(rèn)為,AMPK-α2是胰島素刺激下肌糖原合成的重要因子[19],運動訓(xùn)練激活A(yù)MPK-α2表達(dá),可明顯改善高脂飲食導(dǎo)致的胰島素抵抗[20]。結(jié)合本研究實驗結(jié)果,可以表明,不論是動物實驗還是細(xì)胞研究,收縮運動均可激活胰島素抵抗骨骼肌AMPK-α2表達(dá),調(diào)節(jié)糖代謝。但是阻斷AMPK-α2的表達(dá),電刺激胰島素抵抗的骨骼肌細(xì)胞,是否影響GLUT4的糖轉(zhuǎn)運,尚需進(jìn)一步實驗驗證。
棕櫚酸(0.5 mmol/L)孵育分化5 d的C2C12細(xì)胞16 h,可誘導(dǎo)其胰島素抵抗的發(fā)生。15 V、30 ms、2 Hz的強(qiáng)度電刺激60 min,可以提高富脂性IR骨骼肌對葡萄糖的吸收,增加AMPK-α2mRNA和GLUT4蛋白的表達(dá),有助于改善富脂性IR骨骼肌細(xì)胞的糖代謝。
參考文獻(xiàn):
[1] GOBATO A O,VASQUES A C,ZAMBON M P,et al. Metabolic syndrome and insulin resistance in obese adolescents[J]. Rev Paul Pediatr,2014,32(1):55-62.
[2] 任路平,宋光耀,劉娜,等. 高脂和高果糖飼料喂養(yǎng)大鼠肌細(xì)胞內(nèi)長鏈酯酷輔-A和含量及其與胰島素抵抗旳關(guān)系[J]. 基礎(chǔ)醫(yī)學(xué)與臨床,2011,31(9):1047-1048.
[3] 溫煦,王梅,張一民,等. 中國城鎮(zhèn)居民骨骼肌含量和骨骼肌力量在增齡過程中的變化[J]. 體育科學(xué),2010,30(3):36-41.
[4] OAKES N D,KJELLSTEDT A,TURNER N,et al. Roles of Fatty Acid over supply and impaired oxidation in Lipids accumulation in tissues of obese rats[J/OL]. J Lipids,2013,420754.doi:10.1155 .
[5] YANG M,WEI D,MO C,et al. Saturated fatty acid palmitate-induced insulin resistance is accompanied with myotube loss and the impaired expression of health benefit myokine genes in C2C12 myotubes[J]. Lipids Health Dis,2013,12:104.
[6] PIMENTA A S,GAIDHU M P,HABIB S,et al. Prolonged exposure to palmitate impairs fatty acid oxidation despite activation of AMP-activated protein kinase in skeletal muscle cells[J]. J Cell Physiol 2008,217(2):478-485.
[7] 楊寧寧,王佑民,陳冬,等. 棕櫚酸致大鼠L6肌細(xì)胞胰島素抵抗與JNK1活化的關(guān)系[J]. 安徽醫(yī)科大學(xué)學(xué)報,2012:241-244.
[8] JOV? M,PLANAVILA A,S?NCHEZ R M,et al. Palmitate induces tumor necrosis factor-alpha expression in C2C12 skeletal muscle cells by a mechanism involving protein kinase C and nuclear factor kappaB activation[J]. Endocrinology,2006,147(1):552-561.
[9] 劉永,潘其樂,羅冬梅,等. 電刺激對體外培養(yǎng)C2C12細(xì)胞抗氧化能力的影響[J]. 北京體育大學(xué)學(xué)報,2014,37(5):67-71.
[10] NEDACHI T,F(xiàn)UJITA H,KANZAKI M. Contractile C2C12 myotube model for studying exercise in ducible responses in skeletal muscle[J]. Am J Physiol Endocrinol Metab,2008,295(5):1191-1204.
[11] MAROTTA M,BRAG?S R,G?MEZ-FOIX A M. Design and performance of an electrical stimulator for long term contraction of cultured muscle cells[J]. Biotechniques,2004,36(1):68-73.
[12] 潘紅英,徐曉陽,郝選明,等. 電刺激對C2C12骨骼肌細(xì)胞糖代謝及其機(jī)制研究[J]. 體育科學(xué),2012,32(8):34-39.
[13] LAURITZEN H P,SCHERTZER J D. Measuring GLUT4 translocation in mature muscle fibers[J]. Am J Physiol Endocrinol Metab,2010,299:169-179.
[14] TAKENAKA N,YASUDA N,NIHATA Y,et al. Role of the guanine nucleotide exchange factor in Akt2-mediated plasma membrane translocation of GLUT4 in insulin stimulated skeletal muscle[J]. Cell Signal,2014,26(11):2460-2469.
[15] UEDA M,HAYASHIBARA K,ASHIDA H. Propolis extract promotes translocation of glucose transporter 4 and glucose uptake through both PI3K-and AMPK-dependent pathways in skeletal muscle[J]. Biofxctors,2013,39(4):457-466.
[16] DOS SANTOS J M,MORELI M L,TEWARI S,et al. The effect of exercise on skeletal muscle glucose uptake in type 2 diabetes: An epigenetic perspective[J]. Metabolism,2015,64(12):1619-6928.
[17] CUNHA V N,LIMA M P,MOTTA-SANTOS D,et al. Role of exercise intensity on GLUT4 content,aerobic fitness and fasting plasma glucose in type 2 diabetic mice[J]. Cell Biochem Funct,2015,33(7):435-442.
[18] 龔豪杰,陳大鵬,張楠,等. 不同強(qiáng)度運動對AMPKα2基因敲除小鼠骨骼肌葡萄糖運載體4表達(dá)的影響[J]. 中國運動醫(yī)學(xué)雜志,2010,29(4):467-471.
[19] LEE-YOUNG R S,BONNER J S,MAYES W H,et al. AMP-activated protein kinase (AMPK)α2 plays a role in determining the cellular fate of glucose in insulin-resistant mouse skeletal muscle[J]. Diabetologia,2013,56(3):608-617.
[20] ABBOTT M J,TURCOTTE L P. AMPK-α2 is involved in exercise training induced adaptations in insulin-stimulated metabolism in skeletal muscle following high-fat diet[J]. J Appl Physiol,2014,117(8):869-879.
