重瓣大巖桐離體培養的兩種途徑
閆海霞,蔣月喜,何荊洲,鄧杰玲,黃昌艷,王曉國,卜朝陽
(廣西農業科學院 花卉研究所,廣西 南寧 530007)
?
重瓣大巖桐離體培養的兩種途徑
閆海霞,蔣月喜,何荊洲,鄧杰玲,黃昌艷,王曉國,卜朝陽*
(廣西農業科學院 花卉研究所,廣西 南寧 530007)
以大巖桐的莖段、葉片、莖尖為外植體,以MS為基本培養基,附加不同濃度的激素組合進行離體培養研究。結果表明:適宜外植體滅菌的方法為先用75%的乙醇表面消毒10 s后再用0.1% HgCl2滅菌4~5 min,或者先用75%的乙醇表面消毒5 s后再用0.1% HgCl2滅菌6 min。3種外植體均可獲得組培苗,葉片通過愈傷組織誘導途徑可獲得組培小苗;莖段和莖尖通過不定芽途徑可獲得組培小苗。最適宜的愈傷分化培養基為MS+6-BA 0.50 mg/L+IBA 1.00 mg/L,適宜的不定芽增殖培養基為MS+6-BA 0.50 mg/L或者MS+6-BA 0.50 mg/L+IBA 1.00 mg/L,適宜的生根培養基為MS+IBA 1.00~2.00 mg/L,降低蔗糖含量有利于生根。MS+IBA 2.00 mg/L+AC 0.10 g/L有利于生根培養。
大巖桐;離體培養;外植體;愈傷分化
大巖桐(Sinningiaspeciosa)為苦苣苔科苦苣苔屬(也有學者認為屬大巖桐屬)的多年生球根花卉,又名新寧治花、落雪泥,原產巴西等國。20世紀30年代,我國對大巖桐開始進行引種,90年代,僅有少量生產[1]。近年來,大巖桐作為花卉市場的新寵,以其花大、色彩豐富深受大家的喜愛。大巖桐雖然單朵花期較短,但整株花期長,一年可多次開花,是觀賞價值極高的溫室盆栽花卉。大巖桐多采用種子繁殖或塊莖、扦插繁殖,但種子繁殖的后代變異大,易造成種性退化[2],而塊莖、扦插繁殖受限條件多,均不適合大巖桐種苗的產業化生產。組培快繁是種苗工廠化生產的有效手段,既保持了原有母本的特性,又不受季節和氣侯條件的限制,可周年生產,此外,還具有繁殖系數大、繁殖周期短的優點。目前,國內關于大巖桐組織培養成功的報道較多,其中包括單瓣大巖桐[3]、重瓣大巖桐[4-8]。研究所涉及的外植體種類較多,包括葉片[9-13]、嫩芽[14]、莖段[15]。彭海鳳等[11]研究表明:葉片愈傷組織的誘導、繼代培養基為MS+6-BA 2.00 mg/L+NAA 0.20 mg/L,生根培養基為1/2MS+IBA 0.20 mg/L+活性炭1.00 g/L。郭麗等[13]研究認為大巖桐葉片可通過兩種途徑建立起再生體系:愈傷誘導培養基為MS+6-BA 2.00 mg/L+NAA 0.20 mg/L,愈傷分化培養基為MS+6-BA 1.00 mg/L+NAA 0.10 mg/L,不定芽誘導培養基為MS+6-BA 0.50 mg/L+NAA 0.10 mg/L,生根培養基為1/2MS。也有以嫩芽為外植體的研究,王立鳳等[14]以嫩芽為材料通過愈傷誘導途徑建立了離體再生體系:最適宜的愈傷組織誘導培養基為MS+6-BA 0.30 mg/L+NAA 0.01 mg/L,最適宜的芽分化培養基為MS+6-BA 0.50 mg/L+NAA 0.01 mg/L。劉雪蓮等[15]以莖段為外植體進行研究發現:腋芽叢生誘導培養基為MS+6-BA 1.00 mg/L+NAA 0.20 mg/L,腋芽增殖培養基為MS+6-BA 3.00 mg/L+NAA 0.20 mg/L效果最佳,生根培養基為1/2 MS+NAA 0.20 mg/L。大巖桐的再生體系相關報道越來越多,但多數報道只注重其中一種再生體系途徑。本研究通過以葉片、莖尖以及不帶節的莖段為外植體,經過兩種不同的途徑,建立了大巖桐的高效離體再生體系,旨在為大巖桐的產業化開發提供理論依據,為建立大巖桐快速繁殖體系和工廠化育苗提供一定技術參數,為今后大巖桐遺傳轉化研究提供一定的參考。
1 材料和方法
1.1 供試材料
由廣西農科院花卉研究所提供的重瓣大巖桐。
1.2 試驗方法
1.2.1 外植體的表面消毒 選取生長健壯、無病蟲害的大巖桐葉片、莖段以及莖尖,用洗衣粉洗滌5~10 min后用流水沖洗30 min,葉片可用軟毛刷輕輕刷干凈。在超凈工作臺中,先用75%酒精表面消毒5~10 s,無菌水沖洗3~4次,再用0.1% HgCl2滅菌4~6 min,無菌水沖洗3~4次。將葉片切成0.5 cm×0.5 cm、莖段切成長0.5~1.0 cm接種于培養基中,每種處理方式接種數量為40個,每個處理重復3次。每天觀察其生長情況,10 d后統計污染與存活情況。污染率和存活率計算公式為:
污染率(%)=污染數/接種數×100%;
存活率(%)=存活數/接種數×100%
1.2.2 初代誘導 將3種不同類型的外植體接種在MS培養基上,每種處理方式的接種數為10個,每個處理重復3次。20 d觀察生長情況,并進行計算和分析。公式如下:
愈傷誘導率(%)=產生愈傷數/接種數×100%;
分化系數=分化數/接種數;
增殖系數=新芽數/接種數
1.2.3 愈傷組織的分化 將切割好的愈傷組織塊,接入添加了不同種類和濃度激素的MS培養基中,每種處理方式的接種數為10個,每個處理重復3次。以后每天觀察愈傷的變化,20 d后統計其愈傷組織分化數,篩選出最適愈傷分化培養基。
1.2.4 不定芽的增殖培養 將莖段經過初代培養獲得的腋芽切取下來,接在添加有不同種類和濃度激素的MS培養基中,每種處理方式的接種數為25個,每個處理重復3次。以后每天觀察不定芽的增殖變化,25 d后統計并篩選出最佳增殖培養基。
1.2.5 生根培養
1.2.5.1 不同激素組合配比對生根誘導的影響 將長約2 cm的試管苗,轉接于含有不同激素組合配比的MS培養基上,15 d后觀察生根情況,篩選出最適宜的激素組合配比。
1.2.5.2 蔗糖含量對生根誘導的影響 將未生根的組培苗接種在含有不同蔗糖含量的培養基上,觀察生根情況并分析蔗糖對生根誘導的影響。
1.2.5.3 活性炭對生根誘導的影響 將未生根的組培苗接種在含有不同濃度的活性炭培養基上,觀察生根情況并分析活性炭對生根誘導的影響。
1.2.5中的每種處理方式的接種數為25個,每個處理重復3次。生根率的計算如下:
生根率(%)=生根數/接種數×100%
1.2.6 煉苗移栽 將已經生根的組培苗放在室溫中2~3 d后除去瓶蓋,加入少量水將培養基軟化后取出,冼凈基部培養基,用800~1000倍的多菌靈溶液浸泡10 min,移栽到基質上,澆透定根水,15 d后統計移栽存活率。
1.3 統計分析
用統計軟件SPSS 19.0對試驗數據進行差異顯著性測驗(Duncan’s 多重比較)。
2 實驗結果
2.1 外植體的消毒
由表1可知,不同消毒方式對外植體的影響不同。從污染率分析,處理2和處理5、6間存在顯著差異,此時,處理2的污染率最低,為22.50%;處理6的污染率最高,為60.83%。從存活率分析,處理1、處理3、處理6之間存在顯著差異,處理2、3、4、5之間無顯著差異,其中,處理3的存活率最高,為66.67%。綜上可知,適宜外植體滅菌的方法為處理2、3、4,即先用75%的乙醇表面消毒10 s后再用0.1% HgCl2滅菌4~5 min,或者先用75%的乙醇表面消毒5 s后再用0.1% HgCl2滅菌6 min。
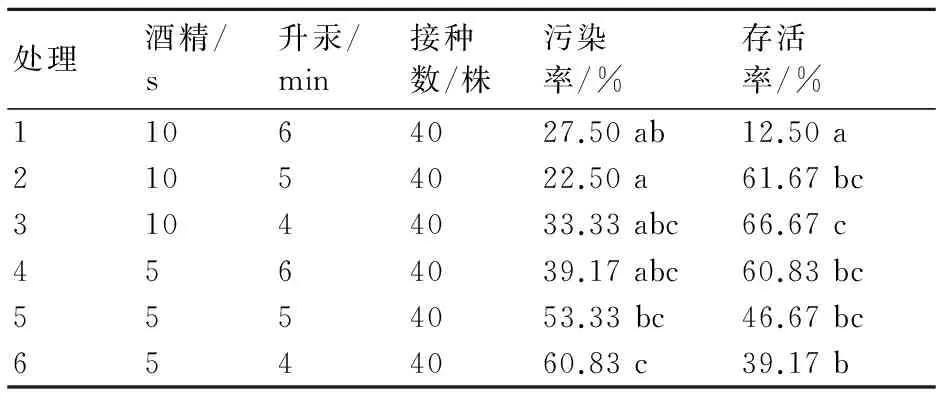
表1 不同消毒方法對大巖桐外植體的影響
2.2 初代誘導
由表2分析可知,以葉片為外植體時,愈傷誘導率為96.67%,分化數為0.57;以莖尖、莖段為外植體時,愈傷誘導率為0%,不定芽的增殖系數分別為0.33、2.57。由此可知,葉片誘導愈傷組織的能力最高,莖段誘導不定芽的能力最高,其次為莖尖。即表明葉片通過誘導愈傷組織可獲得組培小苗(圖1a);莖段和莖尖通過不定芽途徑可獲得組培小苗(圖1b)。
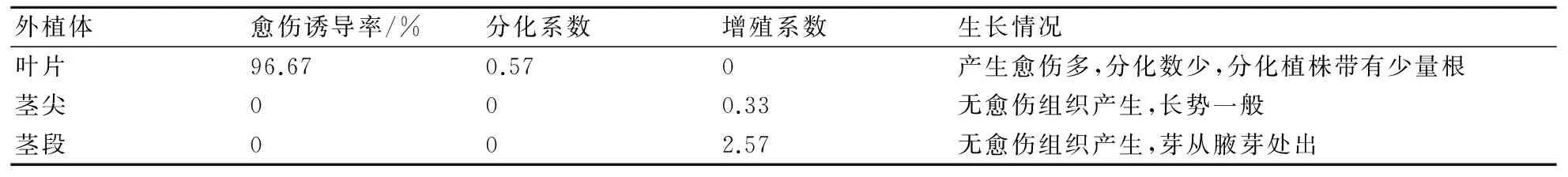
表2 大巖桐的初代培養結果
2.3 愈傷組織的分化
由表3分析可知,不同激素配比對愈傷的分化影響不同。F1和F5對愈傷的分化系數影響無顯著差異,F2和F6對分化系數影響無顯著差異,F3和F4、F6間分化系數無顯著差異,這表明隨著6-BA濃度的提高,其對愈傷分化的影響不顯著。F1和F2、F3、F4、F6間分化系數存在顯著差異,F2和F1、F3、F4、F5間分化系數存在顯著差異,這說明隨著6-BA濃度的升高,分化系數的變化略有差異。當6-BA濃度為0.10 mg/L或者1.00 mg/L時,隨著IBA的濃度增加,分化系數顯著升高,但當6-BA濃度為0.50 mg/L時,分化系數雖有所提高,但影響不顯著,此時F4的分化系數最高,生長情況也好。由此可見,大巖桐最適宜的愈傷分化培養基為MS+6-BA 0.50 mg/L+IBA 1.00 mg/L。
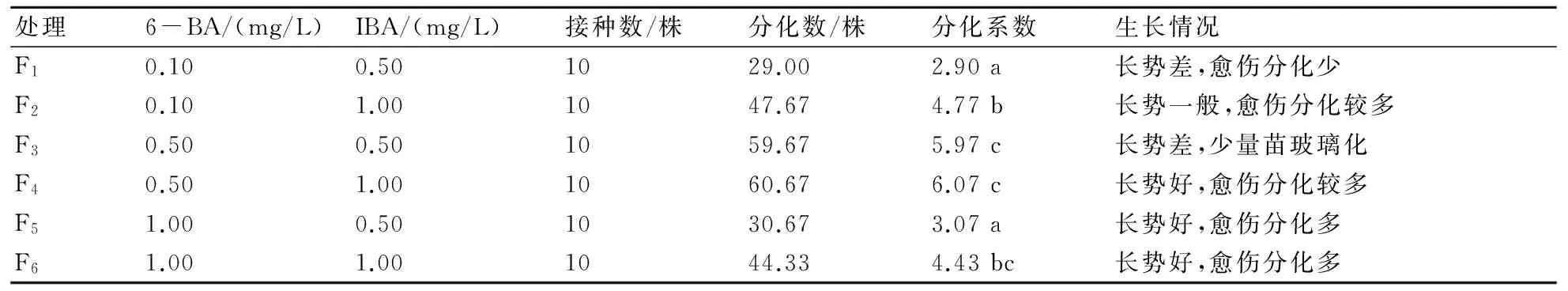
表3 不同激素組合對大巖桐愈傷組織分化的影響
2.4 不定芽的增殖培養
通過表4的分析可知,當僅添加了6-BA時,Z2與Z1、Z3的增殖系數存在顯著差異,Z2的增殖系數顯著高于Z1、Z3,增殖系數為3.49,植株長勢較好。在一定的6-BA濃度下,當添加激素為NAA時,Z6與Z4、Z5的增殖系數存在顯著差異,且隨著NAA濃度的升高增殖系數呈下降趨勢;在一定的6-BA濃度下,當添加激素為IBA時,Z8與Z7、Z9的增殖系數存在顯著差異,Z7與Z9的增殖系數無顯著差異,此時Z8的增殖系數最高,為4.03。綜合分析可知,Z8僅與Z2的增殖系數無顯著差異,與其他處理的增殖系數均有顯著差異,這表明,適宜重瓣大巖桐不定芽增殖的培養基為Z2、Z8,即MS+6-BA 0.50 mg/L或者MS+6-BA 0.50 mg/L+IBA 1.00 mg/L,增殖系數分別為3.49和4.03,植株長勢健壯(圖1c)。
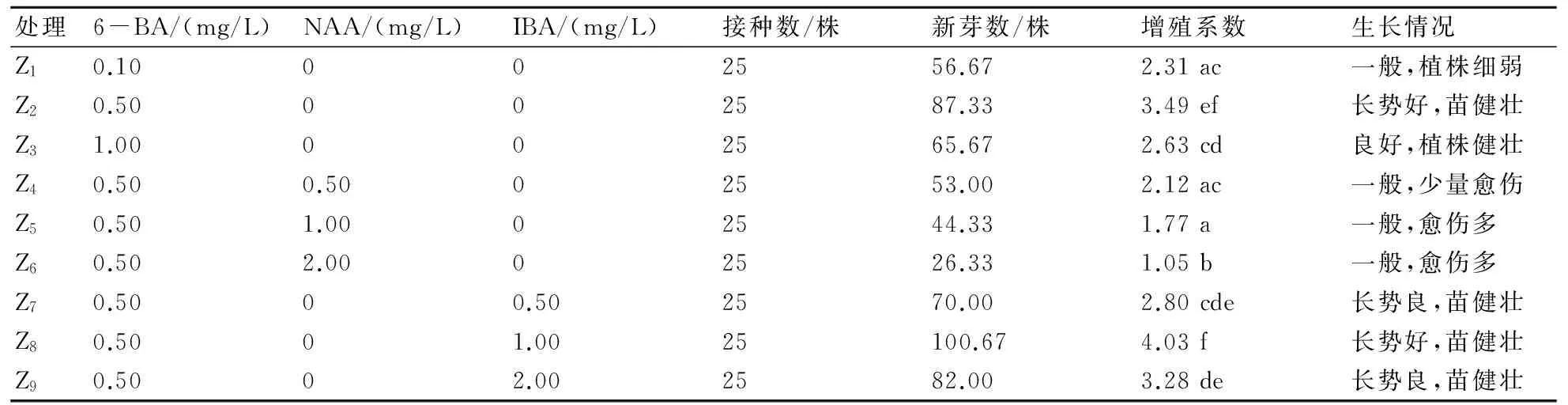
表4 不同培養基對大巖桐不定芽增殖培養的影響
2.5 生根培養
2.5.1 不同激素組合配比對生根誘導的影響 由表5分析可知,不同激素濃度對生根的影響不同。方差分析得出,6個處理的生根率無顯著差異,這表明重瓣大巖桐的生根受不同種類和濃度的激素影響不明顯,但是兩種激素對生根植株的生長情況影響差異較大,當激素為IBA時,生根量多,植株健壯;當激素為NAA時,生根率較IBA的生根率高,生根量較多,但是植株帶有愈傷,這種從愈傷產生的根系不利于植株的移栽,屬于無效根。由此可得,適宜重瓣大巖桐的生根培養基為MS+1.00~2.00 mg/L IBA,植株根多,植株健壯(圖4d)。
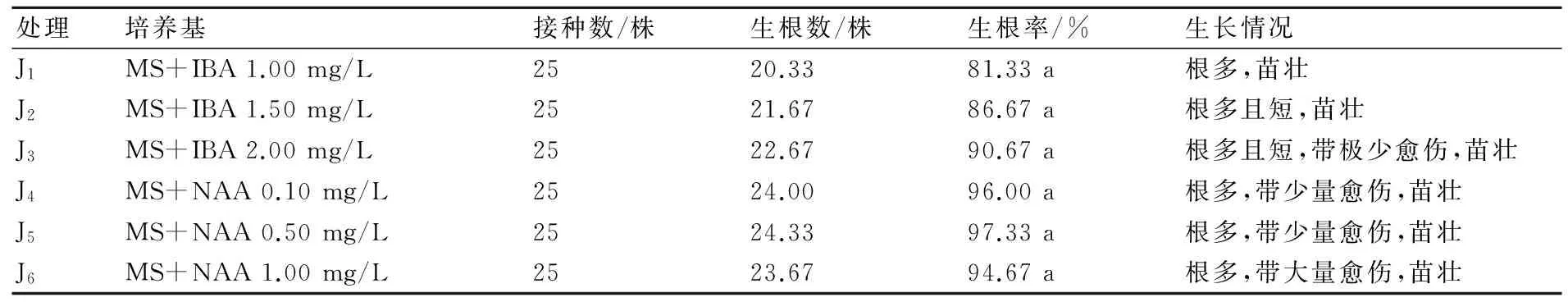
表5 激素對大巖桐生根誘導的影響
2.5.2 蔗糖含量對生根誘導的影響 由表6分析可知,蔗糖含量對生根有不同影響。方差分析得出,T1和T2對生根率的影響無顯著差異,T1的生根率高于T2;T1和T3、T4對生根率的影響有顯著差異,T2和T3、T4對生根率的影響也有顯著差異。在生根培養基MS+IBA 2.00 mg/L+蔗糖10 g/L上的生根率最高。此外,隨著蔗糖濃度的增加,生根率顯著降低。綜合分析后得出,降低蔗糖含量有利于生根,其中以MS+IBA 2.00 mg/L+蔗糖10 g/L的生根效果為佳。
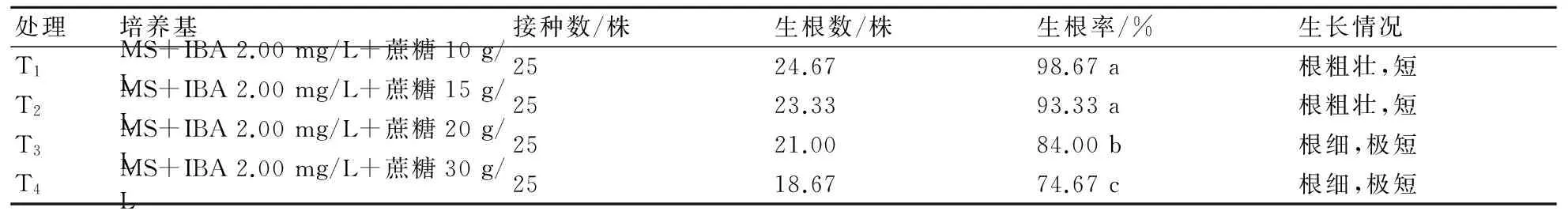
表6 蔗糖對大巖桐的生根誘導的影響
2.5.3 活性炭對生根誘導的影響
由表7可知,H1和H3、H4的生根率之間無顯著差異,H2與其他3個處理間存在顯著差異。H2的生根率最高,為98.67%,可見活性炭更有利于生根的誘導,尤其當活性炭含量為0.10 g/L時。由此可知,MS+IBA 2.00 mg/L+AC 0.10 g/L有利于生根培養。
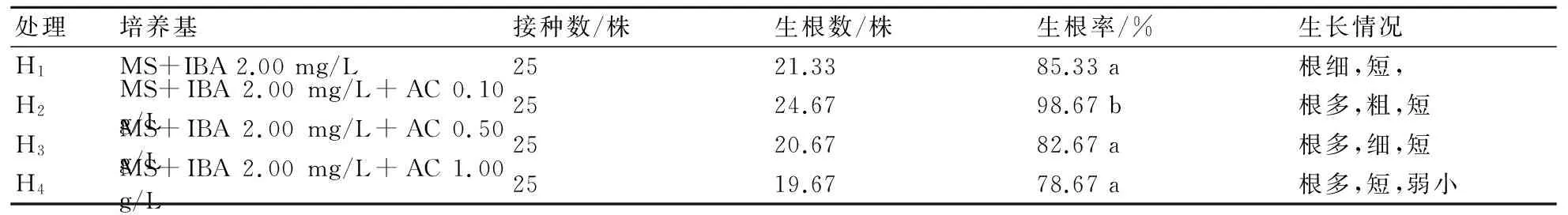
表7 活性炭對大巖桐生根誘導的影響
2.6 煉苗移栽
移栽后的重瓣大巖桐可在15 d存活,移栽存活率達到100%(圖1e)。大巖桐日常管理簡單,病蟲害極少。小苗初期葉片顏色偏淺黃,屬于正常現象,經過3個月左右,組培苗長成中苗(圖1f),再經過1個月的營養生長即可進入開花期(圖1g)。
3 討論與結論
重瓣大巖桐的滅菌時間較短,尤其是HgCl2的滅菌時間僅有4~5 min,這與前人的研究結果是一致的。如張艷萍等[10]用75%酒精棉球擦拭表面,再用0.1%的HgCl2溶液消毒5 min;但也有研究采用的消毒滅菌時間較長,例如王秀英等[4]用70%的酒精浸30 s結合HgCl2滅菌10~12 min。產生這種差異的原因主要是由植物自身的特性決定的。此外,重瓣大巖桐整株被毛,在消毒上有一定操作難度,從而影響了其消毒滅菌的效果,因此存活率未達到100.00%,污染率也未達到0,要達到更好的滅菌效果需要進一步研究實踐。
蔗糖、活性炭均對大巖桐的生根有影響。多數研究的生根培養基的蔗糖含量為30 g/L,但李愛華等[16]認為1/2MS+蔗糖15 g/L是最佳生根培養基。本實驗得出,降低蔗糖含量有利于生根,其中以MS+IBA 2.00 mg/L+蔗糖10 g/L的生根效果為佳。可見兩者之間有一定的一致性。此外,在培養基中添加一定的活性炭有利于提高生根率,在MS+IBA 2.00 mg/L+AC 0.10 g/L有利于生根培養,生根率顯著提高,這可能是活性炭一方面給生根提供了一個合適的暗環境,另一方面,活性炭可能吸附了某些抑制生根的物質,具體原因有待進一步研究。
本實驗通過愈傷組織途徑以及不定芽誘導途徑建立了重瓣大巖桐的高頻再生體系。適宜的外植體滅菌的方法為先用75%的乙醇表面消毒10 s后再用0.1% HgCl2滅菌4~5 min,或者先用75%的乙醇表面消毒5 s后再用0.1% HgCl2滅菌6 min。葉片通過誘導愈傷組織可獲得組培小苗;莖段和莖尖通過不定芽途徑可獲得組培小苗。最適宜的愈傷分化培養基為MS+6-BA 0.50 mg/L+IBA 1.00 mg/L,適宜的不定芽增殖培養基為MS+6-BA 0.50 mg/L或者MS+6-BA 0.50 mg/L+IBA 1.00 mg/L,適宜重瓣大巖桐的生根培養基為MS+IBA 1.00~2.00 mg/L,降低蔗糖含量有利于生根。MS+IBA 2.00 mg/L+AC 0.10 g/L有利于生根培養。

圖1 重瓣大巖桐組培苗生長情況
[1] 李發虎,蔡永敏,樊明壽,等.不同基質對于大巖桐移栽存活率的影響研究[J].中國農學通報,2009,25(1):112-114.
[2] 曹桂萍,王建美.大巖桐的組織培養與快速繁殖研究[J].山東農業科學,2002(5):16,22.
[3] 徐全樂,謝亞紅,劉文婷,等.大巖桐高頻再生體系建立的兩種途徑[J].園藝學報,2010,37(1):135-140.
[4] 王秀英,張大惠.重瓣大巖桐組織培養[J].黑龍江農業科學,2009(3):11-12.
[5] 吳綱.利用重瓣大巖桐葉片誘導再生植株試驗[J].江蘇林業科技,2002,29(3):23-24,33.
[6] 王福銀.重瓣大巖桐快速繁殖試驗[J].江蘇林業科技,2000,27(4):27-28.
[7] 韋獻雅,張其坤,饒春梅,等.重瓣大巖桐葉片離體培養及植株再生[J].北京農業,2008(1):34-35.
[8] 樸日子,曹后男,宗成文,等.重瓣大巖桐葉片離體培養高頻植株再生體系的建立[J].遼寧林業科技,2008(1):10-12,15.
[9] 任如意,趙金良,宗憲,等.大巖桐葉片組織培養及其組織學觀察[J].北方園藝,2008(6):183-185.
[10] 張艷萍,陳玉梁,張正英,等.大巖桐葉片離體再生培養研究[J].甘肅農業科技,2006(9):5-6.
[11] 彭海鳳,萬開軍,呂俊英.大巖桐的組織培養[J].信陽農業高等專科學校學報,2004,14(1):29-30.
[12] 秦麗,胡雪梅,廖青,等.觀賞植物大巖桐(Sinningiaspeciosa)組織培養體系的建立和優化[J].新疆農業科學,2007,44(3):336-339.
[13] 郭麗,朱飛雪,賈文慶.大巖桐高頻再生體系的研究[J].江蘇農業科學,2015,43(5):51-53,356.
[14] 王立鳳,石蘭英,楊靜.大巖桐的組織培養[J].河北農業科學,2012,16(6):31-33.
[15] 劉雪蓮,顧地州,高艷蕊,等.大巖桐腋芽叢生的誘導及植株再生[J].北方園藝,2008(7):222-223.
[16] 李愛華,熊春玲.大巖桐的組織培養及快速繁殖[J].湖北林業科技,2003(2):5-6.
(責任編輯:許晶晶)
Two Pathways for Isolated Culture ofSinningiaspeciosa
YAN Hai-xia, JIANG Yue-xi, HE Jing-zhou, DENG Jie-ling,HUANG Chang-yan, WANG Xiao-guo, BU Zhao-yang*
(Flower Research Institute, Guangxi Academy of Agricultural Sciences, Nanning 530007, China)
The leaf, shoot tip and stem ofSinningiaspeciosawere used as explants, and their isolated culture was conducted on the MS medium supplemented with different concentrations of plant hormones. The best sterilization conditions for explants were obtained as follows: 75% alcohol for 10 s plus 0.1%HgCl2for 4~5 min, or 75% alcohol for 5 s plus 0.1%HgCl2for 6 min. Tissue-culture seedlings could be obtained from the explant leaf through callus induction pathway, and could also be obtained from the explants stem and shoot tip through adventitious bud multiplication pathway. The best culture medium for callus differentiation was MS+6-BA 0.50 mg/L+IBA 1.00 mg/L; the best culture medium for adventitious bud multiplication was MS+6-BA 0.50 mg/L or MS+6-BA 0.50 mg/L+IBA 1.00 mg/L; the optimum culture medium for rooting was MS+IBA 1.00~2.00 mg/L, and low concentration of sucrose in MS was advantageous to rooting; the medium MS+IBA 2.00 mg/L+AC 0.10 g/L was beneficial to the culture of rooting.
Sinningiaspeciosa; Isolated culture; Explant; Callus differentiation
2016-07-08
廣西科學研究與技術開發計劃項目(桂科攻1598006-5-8、桂科能1598022-1-5-2);南寧市科學研究與技術開發計劃項目 (NC20152008-3);南寧市西鄉塘區科學研究與技術開發計劃項目(2015302);廣西農科院項目(農成轉2015009、2015JM04、 2015YT89)。
閆海霞(1981─),女,助理研究員,碩士,主要從事花卉新品種選育與示范推廣工作。*通訊作者:卜朝陽。
Q813.1.3
A
1001-8581(2016)11-0030-05

