豬融合抗菌肽基因雙質粒共轉化重組畢赤酵母菌的構建
陳 騫,萬小平,肖永樂,唐健雪,趙世紀,高 榮
(四川大學生命科學學院,生物資源與生態(tài)環(huán)境教育部重點實驗室,動物疫病防控與食品安全四川省重點實驗室,四川 成都 610064)
豬融合抗菌肽基因雙質粒共轉化重組畢赤酵母菌的構建
陳 騫,萬小平,肖永樂,唐健雪,趙世紀,高 榮*
(四川大學生命科學學院,生物資源與生態(tài)環(huán)境教育部重點實驗室,動物疫病防控與食品安全四川省重點實驗室,四川 成都 610064)
為構建高效表達的豬融合抗菌肽蛋白的重組酵母菌發(fā)酵表達體系,規(guī)模化生產制備新型免疫分子防控動物傳染病,本試驗從實驗室先前構建的pGAPZαA-P質粒中克隆出已構建好的豬融合抗菌肽CAMPs基因片段。通過Infusion技術,將CAMPs片段分別克隆入pPIC9K和pPICZαA真核表達質粒中,并通過PCR以及測序驗證,成功構建了pPIC9K-CAMPs和pPICZαA-CAMPs重組質粒。通過電轉化將線性化pPIC9K-CAMPs轉入畢赤酵母GS115基因組中,并篩選高拷貝菌株GS-PK-CAMPs。再將線性化pPICZαA-CAMPs轉入重組酵母GS-PK-CAMPs中,篩選出高拷貝菌株GS-PKZ-CAMPs。對重組酵母GS-PKZ-CAMPs進行誘導表達后作轉錄表達研究,檢測抗菌肽是否表達。最終結果顯示,成功獲得了GS-PKZ-CAMPs可誘導表達菌株,這給豬融合抗菌肽蛋白的大規(guī)模發(fā)酵制備和應用于動物傳染病的防治奠定了可靠的初步基礎。
豬抗菌肽;融合基因;共表達;雙質粒轉化;畢赤酵母
抗菌肽作為宿主防御肽,是機體天然的免疫保護屏障,不但具有良好的抗菌活性,還具有很強的穩(wěn)定性與安全性[1],因具有獨特的抗菌機制,微生物對其產生耐藥性的概率極低[2]。國內外的研究結果表明,抗菌肽不但能夠顯著提高動物的抗病能力,有的還能促進動物生長[3]。因此,抗菌肽作為新型抗感染分子制劑來替代抗生素,具有極大的應用價值。本研究通過Infusion方法將實驗室已構建好的豬融合抗菌肽基因分別插入pPIC9K和pPICZαA質粒,再將雙重組質粒電轉入畢赤酵母GS115中,并進行高拷貝菌株的篩選,對其進行初步的基因表達發(fā)酵研究,為今后高效生產制備抗菌肽奠定初步基礎。
1 材料和方法
1.1 材料
1.1.1 宿主菌、載體質粒 畢赤酵母GS115及其表達載體pPIC9K、pPICZαA,購買自Invitrogen公司,大腸桿菌DH5α為本實驗室保存,重組質粒pGAPZαAP為本實驗室構建,含豬融合抗菌肽基因。
1.2 表達載體的構建 根據(jù)已構建好的基因片段和載體酶切位點信息設計2對Infusion引物,保證CAMPs基因的PCR產物與載體有15 bp的同源序列:
(1)CAMPs-KF:5憶-GCTGAAGCTTACGTAGAAT TCATGAGAAGTGTGAAAA-3憶;
CAMPs-KR:5憶-AAGGCGAATTAATTCGCGG CCGCTTTAAATAGCGGCCGCCTAA-3憶;
(2)CAMPs-ZF:5憶-AGAGAGGCTGAAGCTGAAT TCATGAGAAGTGTGAAAACCAGCAAG-3憶;
CAMPs-ZR:5憶-TGTTCTAGAAAGCTGGCGGCCG CCTAATGGTGATGGTGATGATGCTT-3憶。
以pGAPZαA-P為模板,使用以上2對引物克隆出CAMPs-K和CAMPs-Z基因片段。使用EcoR I和Not I雙酶切載體pPIC9K和pPICZαA。使用Infusion技術,將CAMPs-K插入pPIC9K質粒中,將CAMPs-Z插入pPICZαA質粒中。最終獲得重組質粒pPIC9KCAMPs和 pPICZαA-CAMPs,使用特異性引物(CAMPs-KF和CAMPs-KR、CAMPs-ZF和CAMPs-ZR)以及通用引物(5憶AOX1、3憶AOX1)進行PCR驗證。將驗證后的重組質粒再經(jīng)測序驗證正確后轉入大腸桿菌DH5α中。
1.3 重組酵母GS-PK-CAMPs的構建 使用質粒大提試劑盒大量提取重組質粒pPIC9K-CAMPs,并使用Sal I將構建好的重組質粒pPIC9K-CAMPs線性化。參照畢赤酵母表達操作手冊,制作畢赤酵母GS115感受態(tài)細胞。將獲得的線性化質粒pPIC9K-CAMPs電轉化入制備好的畢赤酵母GS115感受態(tài)中,電轉化條件為:電壓1.5kV,電容25μF,電阻200Ω,電擊時間為10ms。待電轉化完成后,將轉化后的酵母細胞均勻涂布于MD平板中,30℃恒溫培養(yǎng)至轉化子出現(xiàn)。將轉化子挑選出置于含G418濃度梯度的YPD培養(yǎng)基中,進行高拷貝菌株的篩選。挑選耐G418濃度最高的菌株,命名為GS-PK-CAMPs。
1.4 重組酵母GS-PKZ-CAMPs的構建 使用質粒大提試劑盒大量提取重組質粒pPICZαA-CAMPs,并用Sac I將其線性化。后將線性化載體電轉入篩選出的GS-PK-CAMPs感受態(tài)中,感受態(tài)的制備及電轉化條件同1.3。涂布于含Zeocin濃度梯度及G418濃度為2.0mg/mL的YPD培養(yǎng)基中,進行高拷貝菌株的篩選。挑選耐Zeocin濃度最高的菌株,命名為GS-PKZCAMPs。使用酵母基因組提取試劑盒提取GS-PKCAMPs酵母基因組,使用CAMPs-KF和CAMPs-KR兩對引物對其進行CAMPs基因的擴增,驗證CAMPs基因是否成功插入酵母基因組中。
1.5 重組酵母GS-PKZ-CAMPs的基因表達分析 將1.4中構建的GS-PKZ-CAMPs通過BMGY擴大培養(yǎng),其培養(yǎng)條件為:30℃,220r/min,培養(yǎng)24h至OD為2~6,然后3 200 r/min,5 min離心,收集菌體,轉移至BMMY培養(yǎng)基誘導發(fā)酵表達,甲醇濃度為0.5%,30℃,220r/min誘導發(fā)酵24h后收集酵母菌體。使用Trizol混合細胞菌體后,用氯仿提取,離心后取上清,再用異戊醇提取,離心后取沉淀,經(jīng)乙醇漂洗,用DEPC水溶解RNA沉淀。使用TIANGEN公司的第一鏈反轉錄試劑盒,反轉錄得到重組畢赤酵母GS-PK-CAMPs總RNA的cDNA文庫。使用CAMPs-KF和CAMPs-KR兩對引物對其進行CAMPs基因的擴增,驗證CAMPs的表達情況。
2 結果與分析
2.1 表達載體的構建 CAMPs-K的目的基因片段大小為1 660 bp,CAMPs-Z的目的基因片段大小為1672bp,二者以pGAPZαA-P為模板的PCR擴增產物電泳圖如圖1所示,PCR條帶大小約為1700 bp,與預期一致,證明CAMPs基因被成功克隆。圖2為重組質粒pPIC9K-CAMPs和pPICZαA-CAMPs的PCR擴增電泳圖譜。通用引物的PCR結果顯示:兩個質粒在2100bp左右均有明顯條帶,與預期結果一致,證明CAMPs基因已被成功插入兩個載體。值得注意的是,通用引物的PCR在1000~1500bp處存在一條帶,經(jīng)Prime Premier軟件分析,為5憶AOX1引物在CAMPs片段距5憶端511bp處配對,與3憶AOX1引物形成一條長度為1158bp的PCR產物。最終,結果經(jīng)過測序驗證,插入序列正確。將二者成功轉入大腸桿菌,方便后續(xù)大量提取質粒。
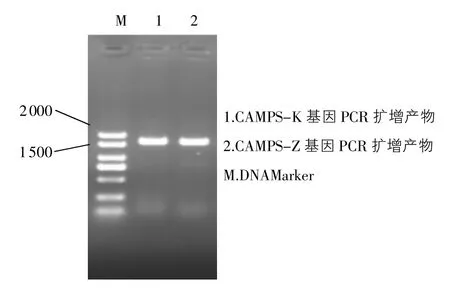
圖1CAMPs基因PCR擴增產物電泳圖(1%瓊脂糖凝膠)

圖2pPIC9K-CAMPs和pPICZαA-CAMPs重組質粒的PCR擴增產物電泳圖(1%瓊脂糖凝膠)

圖3GS-PK-CAMPs高拷貝菌株的篩選(G418濃度梯度,mg/mL)
2.2 重組酵母GS-PK-CAMPs的構建 通過大提質粒試劑盒,獲得了濃度為1.27 μg/μL的重組質粒pPIC9K-CAMPs,經(jīng)線性化后電轉入畢赤酵母GS115感受態(tài),然后涂于MD培養(yǎng)基中,3d后出現(xiàn)了許多轉化子,將轉化子用少量YPD培養(yǎng)基稀釋后涂于含G418濃度梯度的YPD平板上,3d后的生長狀態(tài)如圖3所示。最后成功篩選到了抗G418濃度為2.0mg/mL的菌株,并命名為GS-PK-CAMPs。
2.3 重組酵母GS-PKZ-CAMPs的構建 通過大提質粒試劑盒,獲得了濃度為1.12μg/μL的重組質粒pPICZαA-CAMPs,經(jīng)線性化后電轉入GS-PK-CAMPs感受態(tài)中,涂于含G418和Zeocin濃度梯度的MD平板中,3d后的生長情況如圖4所示。最后成功篩選到了抗Zeocin濃度為150μg/mL的菌株,并命名為GSPKZ-CAMPs。

圖4GS-PKZ-CAMPs高拷貝菌株的篩選(Zeocin濃度梯度,μg/mL)
2.4 重組酵母GS-PKZ-CAMPs的基因表達分析 重組酵母GS-PKZ-CAMPs經(jīng)過甲醇誘導表達后,提取其總RNA反轉錄成cDNA,經(jīng)PCR擴增后(電泳條帶見圖5)結果顯示:GS-PKZ-CAMPs轉錄組cDNA文庫PCR產物在2 000 bp左右存在明顯條帶,同時1 000 bp左右的條帶也符合重組質粒的通用引物PCR結果,證明轉錄組中存在有CAMPs基因,即CAMPs基因已被成功表達。

圖5GS-PKZ-CAMPscDNA文庫通用引物PCR擴增產物電泳圖(1%瓊脂糖凝膠)
3 討論
本試驗成功從實驗室已有的材料中提取出了CAMPs基因片段,并且通過Infusion技術成功將其插入pPIC9K和pPICZαA質粒中,獲得了重組質粒pPIC9K-CAMPs和pPICZαA-CAMPs。為了獲得大量的豬融合抗菌肽蛋白以供后續(xù)研究甚至產業(yè)化使用,我們通過設計畢赤酵母pPIC9K和pPICZαA雙質粒轉化系統(tǒng),在體內增加豬融合抗菌肽基因拷貝量,從而在一定程度上增加了其蛋白表達量。
該系統(tǒng)結合了抗性篩選和雙質粒轉化兩個步驟:從抗性篩選方面討論,pPIC9K質粒中含有的kana抗性在同源重組進入酵母基因組后會賦予酵母遺傳霉素抗性,參照Invitrogen公司的pPIC9K質粒產品說明,單拷貝的kana抗性基因能夠賦予畢赤酵母約0.25 mg/mL的遺傳霉素抗性,由于 kana基因與pPIC9K質粒的表達盒之間存在遺傳連鎖效應,故而可從酵母對遺傳霉素的抗性水平來篩選高拷貝量的重組子。同時,類似的遺傳連鎖效應對于pPICZαA和Zeocin也適用。
pPIC9K質粒經(jīng)過Sal I線性化后,能夠重組入畢赤酵母 GS115基因組的 his4基因位點中,而pPICZαA質粒經(jīng)Sac I線性化后,則能重組進入畢赤酵母GS115基因組的AOX1基因位點中。雙質粒轉化的優(yōu)勢在于,后轉化的pPICZαA質粒可以同源重組插入pPIC9K的5憶AOX1中。從而達到增加豬融合抗菌肽基因的拷貝數(shù)的目的[4]。
本試驗成功將構建的兩個重組表達質粒依次轉化入畢赤酵母GS115中,通過轉錄表達分析,確定豬融合抗菌肽基因能夠正確表達,對于大量表達豬融合抗菌肽蛋白有著重要意義。同時,抗菌肽融合蛋白可誘導表達體系建立,給豬融合抗菌肽蛋白的大規(guī)模發(fā)酵制備和應用于動物傳染病的防治奠定了可靠的初步基礎。
[1]Andreu D,Rivas L.Animal antimicrobial peptides: an overview[J].Biopolymers,1999,47(6):415-433.
[2]陳福,羅玉萍,龔熹,等.抗菌肽耐藥性研究進展[J].微生物學通報,2008,35(11):1786-1790.
[3]Bals R,Wang X,Meegalla R L,et al.Mouse β-defensin 3 is an inducible antimicrobial peptide expressed in the epithelia of multiple organs[J].Infection and Immunity,1999,67(7):3542-3547.
[4]王慧,竇文芳,張曉梅,等.應用雙質粒共表達體系提高融合蛋白GGH在畢赤酵母GS115中的表達量[J].生物工程學報,2011,27(7):983-989.
Construction of Recombinant Pichia Pastoris Transformed With Dual Plasmids for Fusion Genes of Porcine Antimicrobial Peptides
CHEN Qian,WAN Xiaoping,XIAO Yongle,et al.
(Life Science College of Sichuan University,Key Laboratory for Bio-Resource and Eco-Environment of Ministry Education,Key Laboratory for Animal Disease Prevention and Food Safety of Sichuan Province,Sichuan Chengdu 610064,China)
In order to construct high effective expression recombinant yeast to produce economically novel fusion porcine antimicrobial peptide in large scale for the control of animal diseases,the experiment was conducted to clone the fusion CAMPs genes from the recombinant pGAPZαA-P vector constructed early in our laboratory.Then the two fusion genes were respectively inserted into expression plasmid pPIC9K and pPICZαA by Infusion cloning technology.The recombinant plasmids,named as pPIC9K-CAMPs and pPICZα-A-CAMPs,were successfully constructed and confirmed by PCR and sequencing analysis.After that,the linearized pPIC9K-CAMPs was inserted into pichia pastoris GS115 by electroporation,and screened for highcopy strain named as GS-PK-CAMPs.Then linearized pPICZαA-CAMPs was inserted into recombinant yeast GS-PK-CAMPs and screened for high-copy strain named as GS-PKZ-CAMPs.Next,induced fermentation of GS-PKZ-CAMPs was carried out to detect the expression of CAMPs gene.The final result showed that the recombinant pichia GS-PKZ-CAMPs strains with dual plasmids transformation was successfully obtained,which lay the reliable basis for future production of fusion antimicrobial peptides to promote the control level of animal infectious diseases.
Porcine antimicrobial peptides;Fusion gene;Co-expression;Dual plasmids transformation;Pichia pastoris
S818.9
B
1001-8964(2016)12-0028-04
2016-06-20
陳 騫(1990-),男,廣西資源縣人,碩士研究生,研究方向:獸用抗菌肽相關研究和真核表達體系的構建。
*通訊作者:高 榮(1966-),男,四川西昌人,博士,教授,博士生導師,研究方向:動物免疫學、動物傳染病和微生物學、基因工程學等。

