CRISPR-dCas9系統在基因表達調控中的最新研究進展
羅 旻, 顧 華
(1. 上海市控江中學, 上海 200093; 2. 同濟大學 生命科學與技術學院, 上海 200092)
?
CRISPR-dCas9系統在基因表達調控中的最新研究進展
羅 旻1, 顧 華2
(1. 上海市控江中學, 上海 200093; 2. 同濟大學 生命科學與技術學院, 上海 200092)

CRISPR-Cas9系統自問世以來一直被廣泛地應用于基因組編輯技術中,直到人們通過點突變的方式將Cas9的RuvC和HNH剪切結構域失活得到dCas9后,這個系統又有了新的功能——調節基因的表達水平。研究者通過改變gRNA的結構,并與RNA結合蛋白配對,從而招募轉錄因子以調節基因的轉錄水平,達到影響基因表達的目的。本文主要討論了CRISPR-dCas9系統的結構特點、作用原理和目前對調節基因表達的最新研究進展,以期為此領域的研究者提供參考。
CRISPR; dCas9; 引導RNA; 協同激活因子
E-mail:gu_hua@tongji.edu.cn
0 引 言
微生物體持續不斷地受到外源DNA的侵染,使得它們不得不建立起一套防御系統來識別外源DNA和“自己”的DNA,并且將外源DNA“驅逐”出基因組,當然這套系統也允許某些對遺傳物質守恒有利的外源DNA整合到自己的基因組里,增強自身對外界環境的適應性。之前的研究中,CRISPR(clustered regularly interspaced short palindromic repeats)-Cas(CRISPR-associated)系統已經被證實能夠幫助微生物抵抗病毒與質粒的干擾。
CRISPR序列是一個高度多變的DNA序列,常包含一個550bp的leader 序列和一系列重復-間隙單位(repeat-spacer units)。重復序列長度在24-48bp,他們通常會形成二重對稱,因此會形成如發夾結構的二級結構,但不是回文結構,重復次數最高可達250 次。重復序列之間被26~72 bp 間隔序列(spacer)隔開, 間隔序列長度與細菌種類和CRISPR 位點有關,間隔序列能夠通過堿基互補配對的方式使外源DNA被降解。在CRISPR 位點附近, 存在一系列CRISPR相關基因(CRISPR-associated, Cas),在CRISPR 位點的第一個重復序列的上游定位有CRISPR 前導序列(leader sequence)作為啟動子啟動下游序列表達(見圖1)。當CRISPR序列轉錄時,Cas 蛋白加工CRISPR RNA成一個沉默RNA,這個沉默RNA就會對外來同源的DNA起到作用。Cas基因能夠編碼一個大的且多樣化的蛋白家族,這些蛋白攜帶核酸酶、解旋酶、聚合酶和多核酸結合蛋白的功能[1]。如今,隨著研究的深入進行,CRISPR系統已經成為了目前不可或缺的、精確性高的基因編輯工具。
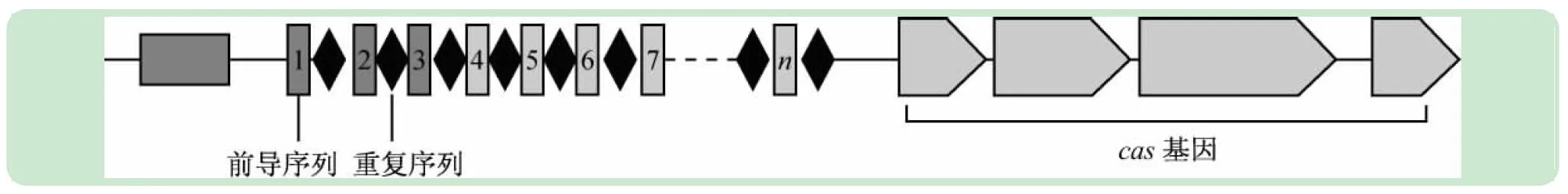
圖1 CRISPR基本結構示意圖(“n”表示不同來源的間隔序列)[2]
CRISPR-Cas9系統主要有三類,其中CRISPR II類系統是目前最為廣泛使用的RNA指導核酸內切酶技術,此系統有兩個主要的成分:引導RNA(guide RNA,gRNA)和核酸內切酶(Cas9)。其中,gRNA是由細菌的內源性crRNA和tracrRNA嵌合而成的人工合成RNA。在CRISPR基因序列中,重復-間隙單元能夠轉錄出crRNA的前體,在Cas9核酸內切酶或內源性RNA酶III的作用下形成crRNA。crRNA能夠與CRISPR基因座上編碼的tracrRNA結合形成RNA二聚體,引導Cas9識別并降解特異性的外源DNA序列[3]。因此gRNA既有crRNA的靶向特異性又有tracrRNA的輔助功能。當細胞內同時表達Cas9和gRNA時,兩者形成的復合物能夠對基因組DNA進行修飾編輯或造成永久性改變。
為了實現Cas9對靶向序列的切割,不僅需要gRNA與靶向序列的堿基互補配對,還要求靶向序列的下游存在原型間隔序列毗鄰區(Protospacer Adjacent Motif,PAM),兩個條件缺一不可。PAM序列與Cas9一樣,在不同的細菌物種中存在序列的多樣性。目前,最常見的CRISPR II類系統是在化膿性鏈球菌中發現,其中PAM序列為NGG[3]。有趣的是,只有來自于同一物種的Cas9、gRNA和PAM才能相互發揮作用。在gRNA的引導下,Cas9識別并在靶向基因的PAM上游剪切3-4個堿基,產生雙鏈缺口(Double Strand Break,DSB)[4],從而實現對基因組DNA編輯。
1 CRISPR-dCas9系統對基因表達水平的調控作用
CRISPR-Cas9是基因組調控技術中靈活性最強的系統之一。Cas9的核酸酶剪切活性取決于兩個結構域:RuvC和HNH。這兩個結構域分別負責切割DNA鏈的兩條鏈,并且這兩個結構域能夠單獨地被人工點突變失活。化膿性鏈球菌中存在一種Cas9 D10A突變體,這種鏈球菌的Cas9的RuvC失活(RuvC-),HNH仍有活性(HNH+);另一種Cas9 H840A的突變體的Cas9蛋白則呈現RuvC激活(RuvC+)和HNH失活(HNH-)的狀態,但這兩種突變體的Cas9仍然具有核酸酶活性,可對靶向序列進行剪切作用。當RuvC和HNH同時處于失活狀態時(D10A&H840A;RuvC-&HNH-),Cas9將不具有核酸酶活性,成為dCas9(dead Cas9)[5]。dCas9雖然沒有剪切DNA的能力,但仍然可以在gRNA的引導下與特定的DNA序列結合。由此,研究者們試圖利用dCas9能與DNA序列結合的能力將dCas9轉化為能激活基因表達的轉錄因子。
研究發現,dCas9只有通過與其他蛋白融合后,才能夠發揮轉錄因子的作用,促進或抑制基因的表達,并且不失去與gRNA結合的能力(見圖2)。例如:當轉錄激活子VP64與dCas9融合后,能夠促進靶向基因的表達[6]。但后續實驗證實,若直接將dCas9與VP64融合,只能較小程度地提高轉錄水平。人們試著將VP64與dCas9的氨基端和羧基端融合[3]或將dCas9與10拷貝數的VP64融合[14],均能提高CRISPR-dCas9對基因表達的促進作用。Chavez[16]等人構建出一種稱為VP64-p65-Rta 三次方激活子的蛋白與dCas9融合,改造后的VP64蛋白與dCas9融合能夠顯著地促進內源基因的轉錄水平。
當轉錄抑制子KRAB的Kox1結構域與dCas9融合后,能夠改善CRISPR系統的剪切作用[7]。若沒有蛋白與dCas9融合,dCas9則會干擾靶向序列的轉錄過程[4]。因此,若gRNA識別的基因位點在靶向基因的啟動子附近,研究者將可以通過人工合成的方式改變dCas9的結構,以實現對靶向基因表達的調控[3]。
除了對蛋白編碼區域的調節,CRISPR-dCas9系統同樣能夠作用于非編碼RNA(lncRNAs)。例如,在人白血病細胞K562中,5種lncRNAs(H19,MALAT1,NEAT1,TERC,XIST)都能夠在CRISPR-dCas9系統的介導下,顯著下調80%以上[16]。
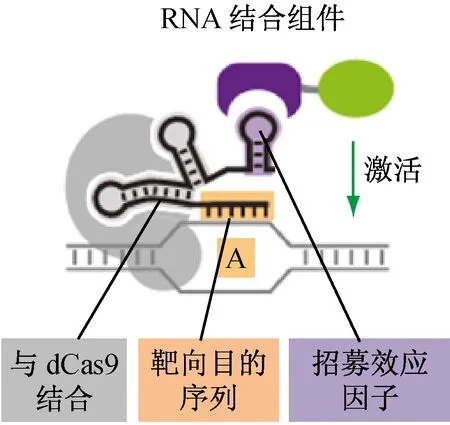
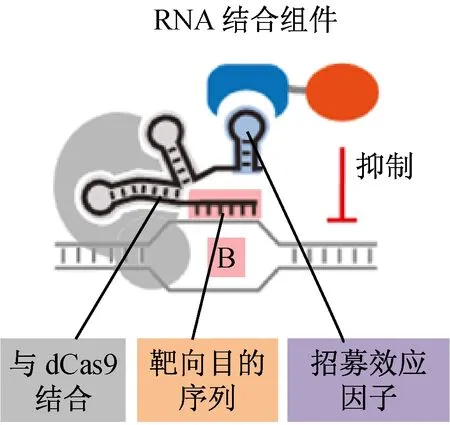
圖2 CRISPR-dCas9系統招募不同的轉錄因子促進或抑制基因的表達水平[11]
2 CRISPR-dCas9系統對調控基因轉錄作用的優化及應用
Perez-Pinera等人設計了4種特異性的gRNA,能夠與8個藥物治療有關的基因(ASCL1, NANOG, HBG1/2, MYOD1, VEGFA, TERT, IL1B, IL1R2)的啟動子結合。與表達dCas9-VP64和這4種gRNA的質粒共轉染到HEK293T細胞后,以上8種靶向基因的表達水平均上升,并且這4種gRNA在細胞中發揮協同效應。相比于蛋白質,這種通過RNA來識別目的基因序列的方式,能夠避免表觀遺傳對DNA序列修飾后帶來的局限性,例如甲基化的DNA序列仍然能夠被RNA識別。但是相比于TALEN技術,與相同的啟動子結合作用后,dCas9-VP64對于IL1 RN等幾個基因的激活水平較低[8]。因此,dCas9與轉錄因子形成的復合物對靶向基因表達的調節能力并不突出。
為了提高CRISPR-dCas9系統調節基因表達水平的能力,Konermann等人將單鏈引導RNA(single-guide RNA,sgRNA)的結構改變,使其成為多種轉錄因子的組裝場所,這種方法通過引入轉錄激活子以提高CRISPR-dCas9系統對基因表達的促進作用。他們找到了sgRNA的兩個可結合RNA結合蛋白的區域。sgRNA在添加了兩個適配體后,能夠通過適配體招募RNA結合蛋白(如VP60),RNA結合蛋白又能與轉錄因子的轉錄活化結構域結合,從而提高基因表達的水平。他們將這個系統命名為協同激活因子(synergistic activation mediator,SAM),通過實驗證明,相比于dCas9與轉錄激活子直接融合的方法,這個系統能夠將之前難以激活的12個基因的轉錄水平提高約100倍[9]。
為了證明這個系統的廣泛性,他們創建了人工sgRNA數據庫,這些sgRNA經過人為改造后能夠使超過23000個人類基因獨立地表達。通過這個系統,找到了黑色素瘤對PLX-4720的耐藥性的問題所在。之前的研究認為,PLX-4720之所以對黑色素瘤的治療失效,是由于黑色素瘤細胞的某些基因表達所致。通過人為設計特異性的sgRNA,研究者能夠單獨的控制基因的表達,由此也能找到致使黑色素瘤細胞耐藥的關鍵基因所在。可以預期,SAM將成為疾病治療的研究方法之一,引導人們將問題轉移到基因的表達上[9]。這種SAM系統也是根據天然的基因調節機制改良而來。增強子(enhancer),本質上是一段基因序列,通過與多種轉錄因子的結合能夠啟動基因的表達。另外,增強子和其他轉錄元件能夠產生一段長鏈非編碼RNA(long non-coding RNA,lncRNA),這種lncRNA能夠招募各種細胞調節因子,進而作用于組蛋白與DNA組成的染色質,調節基因的表達水平(見圖3)[10]。
后續的研究表明,通過改變dCas9或CRISPR RNA的結構能夠提高CRISPR靶向基因的轉錄效率。在同一細胞里可以同時使用多種改良的CRISPR RNA對基因的轉錄進行調節,從而控制細胞的代謝水平[11]。綜上所述,當CRISPR-dCas9系統中的sgRNA結構與lncRNA相似時,能使特定的多種效應分子蛋白組裝成一個大分子蛋白,并作用于基因組。
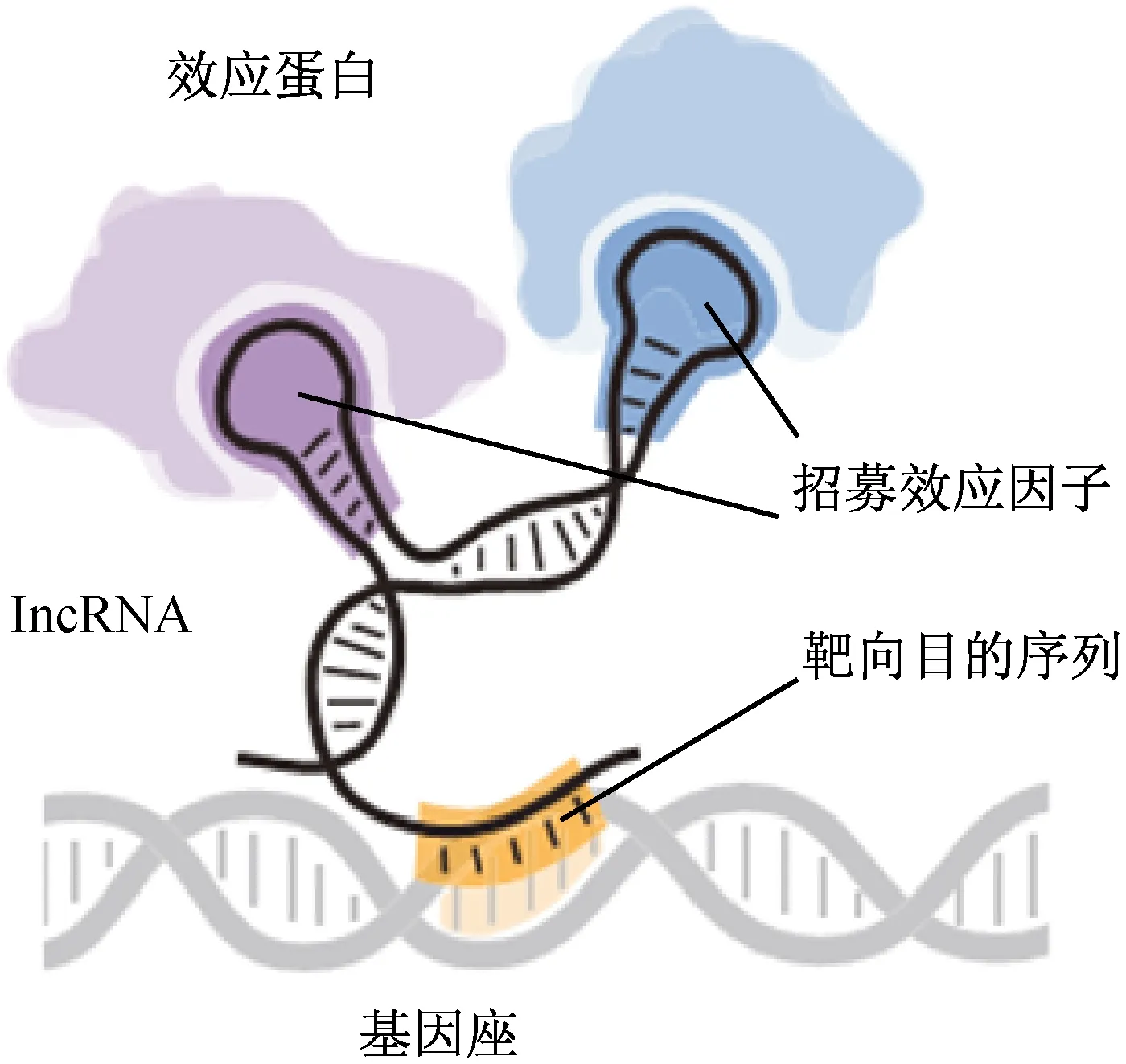
圖3 lncRNA招募各種細胞調節因子調節基因的表達[11]
3 討 論
盡管CRISPR-Cas9系統已經被廣泛地應用于基因組編輯技術中,但這項技術也存在著一定的缺陷:脫靶效應。在人類細胞中,當存在著5個堿基錯配的情況下,Cas9仍能實行切割功能[17]。在這個系統中,sgRNA是決定特異性的重要因素。Hsu[18]等人認為,在設計sgRNA時,在位點決定性的8-12bp內,至少有兩個堿基發生錯配。
近年來,RNAi技術被廣泛使用于基因敲除技術,但RNAi只能作用于mRNA,編碼mRNA的DNA只占總DNA的小部分,因此RNAi的適用范圍不大。另外,從細菌中發現的天然DNA結合域(DNA-binding domain,DBDs)也常被用于招募轉錄因子。人工合成的DBDs(如ZFs和TALENs)能夠精確地控制靶向基因的轉錄水平,但此技術耗時較長,脫靶現象以及載體的未知毒性嚴重阻礙了這種技術的發展[12]。因此,龐大的sgRNA數據庫及其可靠的、天然的調控機制使得CRISPR-dCas9技術更具有競爭力,CRISPR-Cas9系統不論在功能缺失還是功能獲得篩選中,都表現出更高水平的有效性和可靠性。與RNAi和DBDs技術相比,CRISPR-dCas9系統可以靶向編碼序列和調控元件,包括啟動子、增強子和轉錄microRNAs和長非編碼RNAs的元件。這一強大的遺傳工具的應用,無疑將大大加速生命領域的各項機理發現。南京大學的杜憶南等人在人源的tet-on MAVS轉基因293T細胞系中,利用dCas9/sgRNA靶向結合NF-κB、IRF3/7和cJun/ATF2轉錄因子在IFNB1啟動子區的順式作用元件,競爭性的阻止了轉錄因子對其的結合,達到阻斷信號通路的目的,首次證明了CRISPR-dCas9技術可用于內源順式作用元件的功能注釋[19]。
另外,CRISPR-dCas9系統的應用對于人類疾病的研究也有至關重要的作用。研究證實,93%的與性狀變異相關的疾病都存在蛋白編碼區域以外的基因表達異常[20]。因此,利用CRISPR-dCas9系統對基因的異常表達和非編碼RNA進行改造有利于后續的疾病研究工作。
[1] Philippe H, Rodolphe B. CRISPR/Cas, the Immune System of Bacteria and Archaea[J]. Science, 2010, 327(5962): 167-170.
[2] 吳彩云, 羅秉輪, 孫玉強. 基因組編輯新技術:CRISPR/Cas系統在生物基因組學中的研究進展[J]. 植物生理學報, 2015, 51 (12): 2063-2069.
[3] Sander J D, Joung J K. CRISPR-Cas systems for editing, regulating and targeting genomes[J]. Nature Biotechnology, 2014, 32(4): 347-355.
[4] Hsu P D, Lander E S, Zhang F.etal. Development and Applications of CRISPR-Cas9 for Genome Engineering[J]. Cell, 2014, 157: 1262-1278.
[5] Cheng A W, Wang H, Yang H.etal. Multiplexed activation of endogenous genes by CRISPR-on, an RNA-guided transcriptional activator system[J]. Cell research, 2013, 23(10): 1163-1171.
[6] Maeder M L, Linder S J, Cascio V M.etal. CRISPR RNA-guided activation of endogenous human genes[J]. Nature Methods, 2013, 10(10): 977-979.
[7] Gilbert L A, Larson M H, Morsut L.etal. CRISPR-Mediated Modular RNA-Guided Regulation of Transcription in Eukaryotes[J]. Cell, 2013, 154(2): 442-451.
[8] Pablo P P, Christopher M V.etal. RNA-guided gene activation by CRISPR-Cas9-based transcription factors[J]. Nature Methods, 2013, 10(10): 973-976.
[9] Konermann S, Brigham M D, Trevino A E.etal. Genome-scale transcriptional activation by an engineered CRISPR-Cas9 complex[J]. Nature, 2015, 517(7536): 583-588.
[10] Tsai M C, Manor O, Wan Y,etal. Long Noncoding RNA as Modular Scaffold of Histone Modification Complexes[J]. Science, 2010, 329(5992): 689-693.
[11] Zalatan J G, Lee M E, Almeida R,etal. Engineering Complex Synthetic Transcriptional Programs with CRISPR RNA Scaffolds[J]. Cell, 2015, 160(1-2): 339-350.
[12] Morbitzer R, Romer P, Boch J,etal. Regulation of selected genome loci using de novo engineered transcription activator-like effector (TALE)-type transcription factors[J]. Proc Natl Acad Sci U S A., 2010, 107(50): 21617-21622.
[13] Khalil A S, Lu T K, Bashor C J,etal. A synthetic biology framework for programming eukaryotic transcription functions[J]. Cell, 2012, 150(3): 647-658.
[14] Chakraborty S, Ji H, Kabadi A M,etal. A CRISPR/Cas9-based system for reprogramming cell lineage speci fication[J]. Stem Cell Reports, 2014, 3(6): 940- 947.
[15] Chavez A, Scheiman J, Vora S,etal. Highly efficient Cas9-mediated transcriptional programming[J]. Nat Methods, 2015, 12(4): 326-328.
[16] Gilbert L A, Larson M H, Morsut L,etal. CRISPR-mediated modular RNA-guided regulation of transcription in eukaryotes[J]. Cell, 2013, 154(2): 442-451.
[17] Fu Y F, Foden J A, Khayter C,etal. High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells[J]. Nat Biotechnol, 2013, 31(9): 822-826.
[18] Hsu P D, Scott D A, Weinstein J A,etal. DNA targeting specificity of RNA-guided Cas9 nucleases[J]. Nat Biotechnol, 2013, 31(9): 827-832.
[19] 杜憶南. 利用CRISPR/Cas9系統建立基因修飾豬以及在人細胞中對順式作用元件做注釋[D]. 南京: 南京大學, 2015: 1-133.
[20] Maurano M T, Humbert R, Rynes E,etal. Systematic localization of common disease-associated variation in regulatory DNA[J]. Science, 2012, 337(6099): 1190-1195.
·名人名言·
大學的榮譽,不在它的校舍與人數;而在于它一代一代人的質量。
——柯南特
The State of the Art of CRISPR-dCas9 System on Regulating Level of Gene Expression
LUOMin1,GUHua2
(1. Shanghai Kongjiang High School, Shanghai 200093, China;2. School of Life Science and Technology, Tongji University, Shanghai 200092, China)
CRISPR-Cas9 system has been widely considered as a promising genome editing technology in molecular biology research. The engineered dCas9 protein by inactivating RuvC and HNH nuclease domains of Cas9 protein plays a role in gene expression regulation. Researchers manipulated the structures of gRNA that can attract RNA binding proteins which fuse to different transcription factors for the purpose of activating or inhibiting gene transcription. This paper reviewed the structure, function, mechanism and current progress of CRISPR-dCas9 system in gene expression regulation.
CRISPR; dCas9; gRNA; SAM
2015-12-05
國家自然科學青年基金(81402399)項目資助
羅 旻(1998-),女,湖北宜昌人,高中學生,研究興趣:生物信息技術。E-mail:luomin_kj@sina.com
顧 華(1974-),女,江蘇吳縣人,博士,講師,研究方向:抗腫瘤和自身免疫疾病的生物醫藥開發。
Q-7
A
1006-7167(2016)03-0020-04

