家族型帕金森病α-突觸核蛋白突變體寡聚化對神經元毒性的影響
王 鵬 歷 春 王海鵬 蓋曉東
(北華大學基礎醫學院人體解剖學教研室,吉林 吉林 132013)
?
家族型帕金森病α-突觸核蛋白突變體寡聚化對神經元毒性的影響
王 鵬 歷 春1王海鵬 蓋曉東1
(北華大學基礎醫學院人體解剖學教研室,吉林 吉林 132013)
目的 觀察家族型帕金森病(PD)α-突觸核蛋白(α-Syn)突變體A53T和A30P聚集體對大鼠原代神經元的神經毒性。方法 取大鼠前腦皮質神經元進行原代培養,在培養基中加入體外孵育的α-Syn聚集體。培養14 d后,MTT法和神經元流式細胞術觀察神經元的細胞活力。免疫熒光染色后以激光共聚焦顯微鏡觀察細胞內聚集體的分布。硫磺素S染色觀察細胞內包涵體的形成。結果 加入α-Syn聚集體各組的原代神經元細胞活力較對照組降低(P<0.05),而加入突變體A53T和A30P聚集體的原代神經元細胞活力比對照組明顯降低(P<0.01);突變體A53T和A30P聚集體的原代神經元細胞活力下降較野生型α-Syn聚集體顯著(P<0.05)。突變體A53T和A30P聚集體對神經元的毒性作用,在1~14 d內隨培養時間而增加(P<0.05);在1~10 μmol/L濃度范圍內,隨濃度的增加而毒性增加(P<0.05)。突變體A53T和A30P聚集體可以進入原代神經元內,并可在細胞內聚集而形成硫磺素S染色陽性的斑塊。結論 家族型α-Syn突變體A53T和A30P聚集體對原代神經元具有神經毒性,此作用具有時間和劑量依賴關系。這一現象對闡明家族型PD的發病機制具有重要意義。
帕金森病;α-突觸核蛋白;寡聚體;原代神經元;神經毒性
目前研究認為,老化、遺傳和環境因素的相互作用是帕金森病(PD)發病的主要原因,而α-突觸核蛋白(α-Syn)作為廣泛存在的PD特征性病理變化——路易體(LB)的主要成分,被認為是引起PD發病的關鍵性蛋白。α-Syn在神經組織中表達豐富,正常情況下主要存在于神經元的突觸前神經末梢,參與多巴胺代謝及突觸可塑性調控等多種功能。通過對罕見的PD家系的研究,發現一種編碼α-Syn基因的SNCA錯義點突變(A53T、A30P、E46K、H50Q和G51D)可以直接引起家族性、早發性PD〔1,2〕。而聚集成纖維的α-Syn是LB的主要成分〔3〕。隨后,人們還發現SNCA的二倍體和三倍體變異也可以直接引起家族性、早發性PD,而該基因啟動子區的某些多態性則與散發性PD的發病風險相關。這些發現使人們相信α-Syn的異常聚集與PD的發病具有密切關系。體外研究結果表明,突變α-Syn比野生型α-Syn更容易發生錯誤折疊〔4〕,然而,家族型突變體α-Syn的異常聚集體對神經元有何種影響,是否具有比野生型α-Syn的聚集體更容易引起PD樣病變尚不明確。本研究觀察了家族型PD α-Syn突變體A53T和A30P聚集體對神經元的毒性,對家族型PD的發病機制提供了新的佐證。
1 材料和方法
1.1 主要試劑 DMEM(F-12)細胞培養基,購自GIBCO公司;胎牛血清(FBS)和馬血清(HS),購自GIBCO公司。蛋白分子量Marker,購自Pharmacia。BCA蛋白質定量試劑盒BCA Protein Assay Kit,購自寶生物公司。MTT法細胞活力檢測試劑盒,購自Promega公司。α-Syn單克隆抗體(ab138501),購自Abcam公司。其他均為化學分析純試劑。
1.2 實驗動物 新生24 h的Wistar大鼠40只,雌雄不限;購自中國人民解放軍軍事醫學科學院實驗動物中心,許可證號:SCXK-(軍)。
1.3 實驗方法
1.3.1 重組蛋白的克隆與純化 將野生型α-Syn和家族型突變體A53T、A30P的cDNA分別插入pET(21a),然后轉染至BL21(DE3)中,在含氨芐西林的YTA培養基中培養,誘導表達。表達的基因重組型蛋白經粗提后,經HPLC法進一步純化。純化后的蛋白用SDS-PAGE法鑒定,BCA法定量。
1.3.2 α-Syn聚集體的制備 終濃度100 μmol/L的野生型重組人α-Syn和家族型突變體A53T和A30P,置于PBS緩沖液中,37℃,1 000 r/min,震蕩孵育48 h。然后Western印跡法檢測鑒定。
1.3.3 原代神經元培養方法 將出生24 h內Wistar大鼠頭部埋置碎冰中約1 min,再放入75%酒精中浸泡30 s。斷頭,分離鼠腦。0.25%胰酶,在37℃下消化40 min。按2×105個/cm2接種于Φ35 mm培養皿中,或1×104/孔接種于膠原包被的96孔板中。
1.3.4 神經元活力的測定 在96孔板中培養的原代神經元經樣品處理后,培養至相應時間進行觀察。根據MTT法細胞活力檢測試劑盒操作指南,向待測的細胞培養基中添加反應液,20 μl/100 μl 培養基。5%CO2孵箱中,37℃,培養2 h。讀取490 nm波長處的吸光度值,進行統計分析。
1.3.5 神經細胞流式分析儀檢測 原代神經元經過寡聚體樣品處理14 d后,棄去培養基,0.25%胰酶消化;2 000 r/min,離心5 min收集細胞。預冷PBS洗滌細胞2次;用400 μl Binding Buffer懸浮細胞,調整細胞濃度約為1×106cells/ml,在細胞懸浮液中加入5 μl Annexin V-FITC,混勻后于4℃避光下孵育15 min。加入10 μl PI后輕輕混勻于4℃避光孵育5 min;1 h內以FACS Calibur流式細胞儀分析檢測。
1.3.6 Western印跡法和免疫熒光法鑒定α-Syn聚集體 將待測的α-Syn孵育后樣本行10% SDS-聚丙烯酰胺凝膠電泳,結束后轉膜、封閉。孵育一抗,抗人重組α-Syn單克隆抗體(1∶5 000),4℃孵育過夜。洗膜后加辣根過氧化物酶標記的二抗,室溫下孵育1 h。ECL法顯色并拍照。
原代神經元在confocal皿中培養至相應時間后,棄去培養基,0.01 mol/L PBS漂洗細胞,預冷4%多聚甲醛室溫固定30 min。含3% Triton X-100的PBS處理30 min。1% BSA,室溫下封閉1 h。α-Syn單抗(1∶1 000),4℃過夜。與相應熒光二抗在室溫下避光反應2 h。DAPI封片,晾干。激光共聚焦顯微鏡下觀察并拍照。
1.3.7 硫磺素S染色檢測胞內包涵體 經樣品處理的神經元用4%PFA固定,TBS洗滌 5 min×3次。0.3%硫磺素S,室溫孵育8 min。50%酒精洗滌5 min×3次,TBS洗滌5 min,1次。避光、晾干,封片,熒光顯微鏡觀察。
1.4 統計學方法 采用SPSS19.0軟件,組間比較用獨立樣本的t檢驗、單因素方差分析(one-way ANOVA)。
2 結 果
2.1 重組蛋白純化及寡聚體鑒定 經Western印跡法鑒定得到純度較高的野生型α-Syn、家族型突變體A53T和A30P的單體及聚集體(圖1)。根據分子量,α-Syn聚集體可見二聚體(36 kD)、三聚體(54 kD)、五聚體(90 kD)和八聚體(144 kD)。
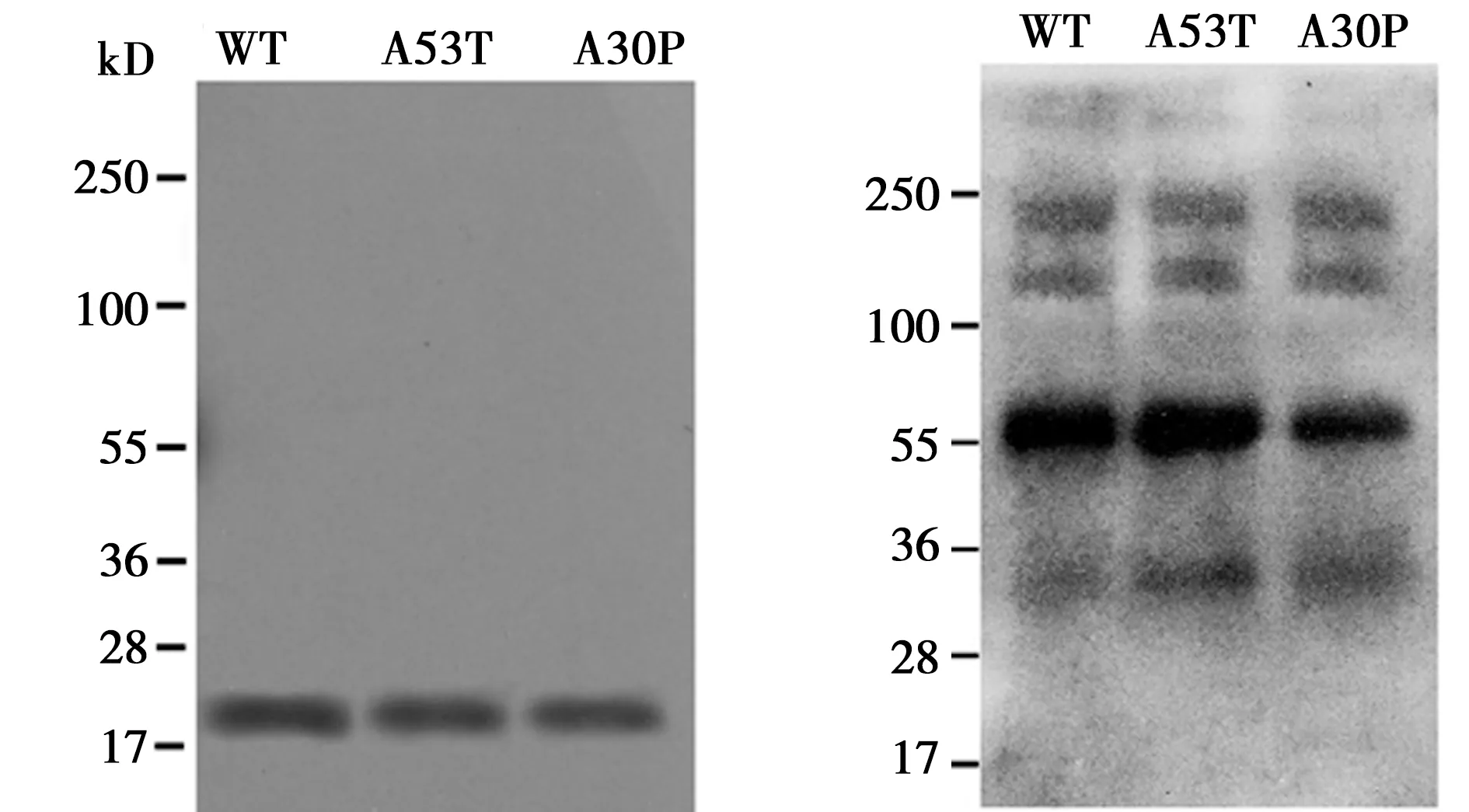
圖1 野生型α-Syn和A53T、A30P的Western印跡鑒定結果
2.2 家族型α-Syn突變體A53T、A30P的聚集體使原代神經元活力下降 向原代神經元培養基中添加終濃度為5 μmol/L的重組野生型α-Syn、A53T和A30P單體或寡聚體,培養14 d。MTT法結果顯示,加入α-Syn聚集體各組的原代神經元細胞活力(51.32%)比對照組(96.26%)降低(P<0.05),而加入突變體A53T和A30P聚集體的原代神經元細胞活力(17.82%、15.67%)比對照組(92.41%、91.02%)明顯降低(P<0.01);突變體A53T和A30P聚集體的原代神經元細胞活力下降較野生型聚集體顯著(P<0.05)。向原代神經元培養基中添加相應α-Syn聚集體,培養至第1、3、5、7、14天,MTT法觀察細胞活力變化,結果顯示神經元的細胞活力隨培養時間增加而降低(圖2)。向原代神經元培養基分別添加終濃度為1、2、4、8、10 μmol/L的寡聚體,培養14 d,寡聚體組的細胞活力均隨劑量的增加而降低(圖3)。流式細胞術結果顯示PD組總凋亡細胞數比對照組多29.85%,比NS組多16.07%。

與對照組比較:1)P<0.05,2)P<0.01;與WT-α-Syn單體組比較:3)P<0.05圖2 突變型α-Syn聚集體對神經元活力下降的效應具有時間依賴關系
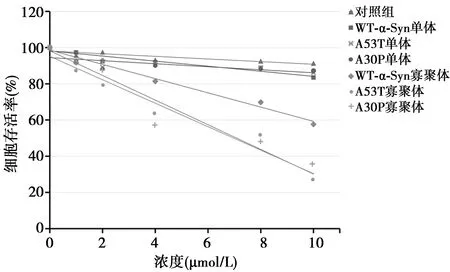
圖3 突變型α-Syn聚集體對神經元活力下降的效應具有濃度依賴關系
2.3 α-Syn聚集體在原代神經元中的分布 原代神經元經α-Syn單體或寡聚體處理后培養第14天,多聚甲醛固定,用α-Syn單抗進行免疫熒光染色,激光共聚焦顯微鏡觀察。結果顯示α-Syn單體和各寡聚體均可以進入神經元內,并在胞體和胞質均勻分布,見圖4。
2.4 α-Syn寡聚體在原代神經元內可形成淀粉樣變性斑塊 經α-Syn寡聚體處理的原代神經元培養14 d后,A53T和A30P組細胞內可形成明顯硫磺素S染色陽性的淀粉樣變性斑塊。對照組神經元內無陽性染色。野生型α-Syn聚集體組神經元細胞內有較弱的硫磺素S染色,見圖5。
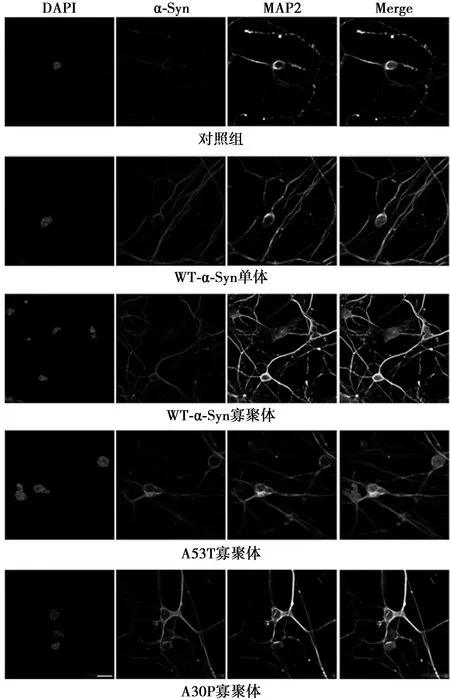
圖4 α-Syn聚集體在原代神經元中的分布(標尺=15 μm)
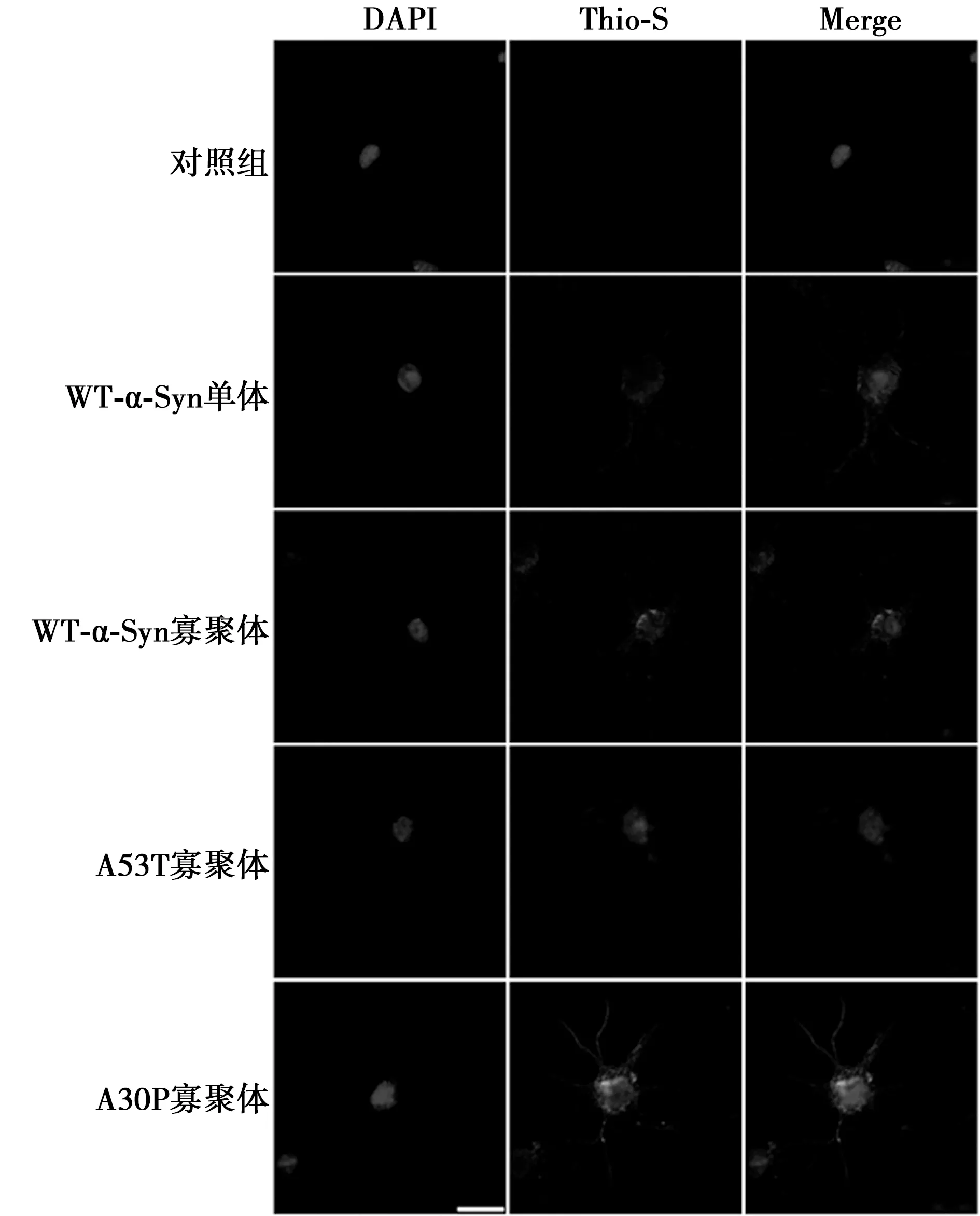
圖5 經家族型α-Syn突變體聚集體處理的神經元可形成硫磺素S染色陽性的淀粉樣斑塊(標尺=10 μm)
3 討 論
α-Syn的寡聚體被認為是其毒性形式。在PD的發病機制研究中,導致α-Syn蛋白構型異常并聚集的因素有很多。如基因突變型α-Syn,A30P和A53T在體外孵育較野生型α-Syn更易于形成寡聚體,A53T突變型可顯著加快纖維蛋白聚集物的形成〔5〕。α-Syn與微管蛋白也互為分子伴侶,通過促進微管蛋白的聚合,α-Syn能夠加速微管的形成〔6〕。我們的研究證實α-Syn對原代神經元早期的突起生長具有促進作用,并提高神經元的存活率〔7〕,而家族型突變體由于與微管蛋白的伴侶關系異常失去這一作用。我們進一步研究證實α-Syn的聚集體具有抑制神經元突起生長的作用〔8〕。本研究的實驗結果顯示α-Syn家族型突變體A53T和A30P的聚集體可以進入原代培養神經元內,從而產生神經毒性,使神經元活力下降。那么,A53T和A30P的聚集體神經毒性的機制是什么?已有研究揭示,α-Syn聚集體主要通過增加脂質雙分子層通透性,破壞突觸囊泡完整性以及細胞內外離子的平衡〔9〕、抑制蛋白酶體降解途徑、影響細胞吞噬功能,誘導炎性反應等機制造成神經元的損傷。另外,α-Syn聚集體影響胞內物質運輸,研究報道在α-Syn寡聚體大鼠病理模型中,紋狀體和黑質在神經細胞丟失前,即有突觸傳遞和軸漿運輸相關蛋白發生明顯變化,actin水平增加而α-微管蛋白水平降低〔10〕。我們的研究結果證實α-Syn家族型突變體A53T和A30P的聚集體在神經元內堆積形成硫黃素S染色陽性的淀粉樣斑塊,其機制可能與其損傷胞內微管系統,導致物質運輸紊亂有關。此研究結果為揭示α-Syn的生理功能以及在家族型PD的發病機制提供新的佐證,為預防和診斷PD提供了重要依據。
1 Lou H,Montoya SE,Alerte TN,etal.Serine 129 phosphorylation reduces the ability of alpha-synuclein to regulate tyrosine hydroxylase and protein phosphatase 2A in vitro and in vivo〔J〕.J Biol Chem,2010;285:17648-61.
2 Liu D,Jin L,Wang H,etal.Silencing alpha-synuclein gene expression enhances tyrosine hydroxylase activity in MN9D cells〔J〕.Neurochem Res,2008,33:1401-9.
3 Baba M,Nakajo S,Tu PH,etal.Aggregation of alpha-synuclein in Lewy bodies of sporadic Parkinson′s disease and dementia with Lewy bodies〔J〕.Am J Pathol,1998;152(4):879-84.
4 Conway KA,Lee SJ,Rochet JC,etal.Acceleration of oligomerization,not fibrillization,is a shared property of both alpha-synuclein mutations linked to early-onset Parkinson′s disease:implications for pathogenesis and therapy〔J〕.Proc Natl Acad Sci U S A,2000;97:571-6.
5 Ferreon AC,Deniz AA.Alpha-synuclein multistate folding thermodynamics:implications for protein misfolding and aggregation〔J〕.Biochemistry,2007;46(15):4499-509.
6 Alim MA,Hossain MS,Arima K.Tubulin seeds alpha-synuclein fibril formation〔J〕.J Biol chem,2002;277:2112-7.
7 王 鵬,許 潔,安思訓,等.突變型alpha突觸核蛋白對大鼠皮質神經元原代培養存活率的影響〔J〕.中國老年學雜志,2012;32(18):3952-4.
8 王 鵬,李 昕,陳予東,等.alpha突觸核蛋白寡聚體抑制大鼠原代培養神經元突起早期生長〔J〕.首都醫科大學學報,2014;35(5):587-91.
9 Bultron G,Kacena K,Pearson D,etal.The risk of Parkinson′s disease in type 1 Gaucher disease〔J〕.J Inherit Metab Dis,2010;33(2):167-73.
10 Chung CY,Koprich JB,Siddiqi H,etal.Dynamic changes in presynaptic and axonal transport proteins combined with striatal neuroinflammation precede dopaminergic neuronal oss in a rat model of alpha-synucleinopathy〔J〕.J Neurosci,2009;29(11):3365-73.
〔2015-12-19修回〕
(編輯 徐 杰)
吉林省科技廳項目(20150101128JC)
1 北華大學基礎醫學院病理學教研室
蓋曉東(1962-),女,教授,碩士生導師,主要從事腫瘤分子病理學研究。
王 鵬(1977-),男,博士,講師,主要從事人體解剖學和神經生物學基礎理論研究。
R74
A
1005-9202(2016)23-5786-04;
10.3969/j.issn.1005-9202.2016.23.007

