不同顏色果袋對葡萄花青苷合成的調控
冀曉昊,王海波,張克坤,王孝娣,史祥賓,王寶亮,鄭曉翠,王志強,劉鳳之
?
不同顏色果袋對葡萄花青苷合成的調控
冀曉昊,王海波,張克坤,王孝娣,史祥賓,王寶亮,鄭曉翠,王志強,劉鳳之
(中國農業科學院果樹研究所/農業部園藝作物種質資源利用重點實驗室,遼寧興城125100)
【目的】探明不同顏色果袋引起的光質差異對葡萄花青苷合成的影響,為葡萄專用果袋的研發提供理論依據。【方法】以5年生‘貝達’砧‘巨峰’葡萄為試材,于坐果后30 d分別套紅色、綠色、藍色和白色紙質果袋,以不套袋為對照,每8 d采樣一次,直至果實成熟。利用光纖光譜儀分析不同紙袋的透射光譜,高效液相法測定果實發育過程中果皮花青苷含量變化,同時利用熒光定量PCR技術分析花青苷合成途徑結構基因、、和調控基因以及光信號轉錄因子的表達差異。【結果】紅色紙袋、綠色紙袋和藍色紙袋分別在紅光、綠光和藍光波段具有選擇透過性,白色紙袋對光質的透過性沒有選擇性。不同顏色果袋對葡萄花青苷合成具有顯著性影響,紅色紙袋、綠色紙袋和藍色紙袋處理明顯推遲了葡萄的轉色期,并延緩了花青苷的積累,但到果實完熟期,花青苷含量表現為藍色紙袋>白色紙袋>對照>綠色紙袋>紅色紙袋。基因表達分析表明,、、和表達量均表現為先升高后下降,與花青苷積累規律相一致;不同顏色果袋均延緩了花青苷合成調控基因和結構基因、、表達量在果實發育早期的升高和后期的下降,在表達高峰到來前,總體表現為對照和套白色紙袋表達量較高,其次是套藍色紙袋,套綠色紙袋和套紅色紙袋表達量較低;表達高峰之后總體表現為套藍色紙袋和套白色紙袋表達量較高,其次是套綠色紙袋和套紅色紙袋,對照表達量最低。在果實成熟過程中在花青苷快速積累期和果實成熟后期有兩次表達高峰,與花青苷的積累規律和合成調控基因的表達規律基本一致,不同顏色果袋對的誘導效應不同,藍色紙袋誘導能力最強,紅色紙袋效果最差。【結論】藍色紙袋有利于葡萄花青苷合成,紅色紙袋效果較差。不同顏色果袋對果實花青苷積累的調控可能是通過影響光信號轉錄因子的表達,進而調控花青苷合成調控基因和結構基因、、等的表達,影響葡萄果皮花青苷的合成。
葡萄;套袋;光質;花青苷;基因表達
0 引言
【研究意義】著色是鮮食葡萄重要的外觀品質,不同品種有其獨特的色澤特征,紅色品種著色不足或著色過深都顯著影響其經濟效益。因此,開展鮮食葡萄著色調控的研究對指導葡萄生產具有重要意義。【前人研究進展】紅色品種葡萄著色的物質基礎是花青苷[1]。花青苷合成是通過類黃酮合成途徑,受結構基因和調控基因的控制[2]。葡萄花青苷的合成從轉色期啟動,首先形成不穩定的花青素,后經糖苷化、甲基化和酰基化修飾,最終形成穩定的花青苷,并通過膜轉運系統從細胞質進入液泡貯藏[3-6]。光是影響花青苷合成的重要因子[7],也是生產上調控果實著色的核心。一方面,可以通過套袋[8]、葉幕管理[9]、架遮陽網[10]和地面遮陰[11]等措施,削弱果實接受到的光照強度,減少花青苷合成,避免著色過深;另一方面,可以通過鋪反光膜[12]和補光[13],提高果實接受到的光照強度,增加花青苷合成,促進果實著色。另外,LED補光和利用膜(袋)改變透射光或反射光光譜組成的研究表明光質對果實花青苷合成和內在品質也有很大影響[14-18]。植物對光信號的響應是復雜而精細的,目前已知植物有3種類型的光受體[19-20]:光敏色素感受紅光/遠紅光(600—750 nm),隱花色素感受藍光(400—450 nm)和UV-A(315—400 nm),UVR8感受紫外光UV-B(280—315 nm)。HY5和COP1是光受體下游信號元件,廣泛參與了光形態建成和花青苷合成的調控[21]。光照條件下,HY5可以激活花青苷合成途徑相關基因的表達,特別是、和,它們的啟動子含有光響應元件[22-24],可以直接被光誘導表達;黑暗條件下,COP1可以泛素化降解HY5蛋白[25],從而抑制花青苷合成。【本研究切入點】葡萄套袋栽培可以改善果實外觀品質,提高果面的光潔度,減少農藥使用及降低農藥殘留,是環境友好型、優質化生產技術措施[26],但目前生產上使用的葡萄果袋僅僅改變了光照強度,光質選擇透過型葡萄專用果袋的研究還處于起步階段,果袋顏色對葡萄著色的影響及機理有待深入研究。【擬解決的關鍵問題】本研究以‘貝達’砧嫁接的鮮食葡萄主栽品種‘巨峰’為試材,在前期預試驗的基礎上,分析紅色、綠色、藍色和白色紙袋引起的光質差異對葡萄花青苷合成的影響,進一步分析花青苷合成途徑結構基因、、和調控基因以及光信號轉錄因子表達量變化,以探明不同顏色果袋引起的光質差異對葡萄果實花青苷合成的影響及調控機理,為光質選擇透過型葡萄專用果袋的研發提供理論依據。
1 材料與方法
試驗于2015—2016年在遼寧省興城市中國農業科學院果樹研究所葡萄課題組核心技術試驗示范園進行。
1.1 試驗設計
以5年生‘貝達’砧‘巨峰’葡萄為試材。株行距0.8 m×4.0 m,斜干水平龍干形整形,樹勢中等,樹盤覆蓋黑色地膜,行間自然生草,田間土肥水和病蟲害防治同常規。選擇生長勢相同的40株單株,從坐果后30 d(7月13日)開始套袋,每株隨機選擇大小相近的5串果穗分別進行不套袋(對照)、套白色紙袋、套紅色紙袋、套綠色紙袋和套藍色紙袋處理,從套袋日起每隔8 d采樣一次,每個果穗采2—4個果粒,直到果實成熟(9月15日)結束。采樣后立即剝取果皮,液氮冷凍后-75℃保存備用。
1.2 果袋透光性測定
不同顏色果袋透射光譜分析使用StellarNet?微型光纖光譜儀。
1.3 花青苷含量測定
花青苷含量的測定采用高效液相法。準確稱取0.5 g果皮,用20 mL 1%的鹽酸甲醇黑暗震蕩提取24 h,37℃旋轉蒸干,用1 mL 0.1%的鹽酸水溶液回溶,過0.45 μm有機濾膜。HPLC條件:所用儀器為Thermo Scientific?QExactive高分辨液質聯用儀,色譜柱為Acquity UPLC BEH C8(2.1 mm×50 mm,1.7 μm),流動相A液為乙腈,B液為1%甲酸水溶液。線性梯度洗脫:0→20 min,A液比例從6%→16%;30 min,A液比例為23.5%;40—45 min,A液比例為50%;46 min,A液比例降為6%。流速:0.3 mL·min-1。柱溫28℃,進樣量2 μL。PAD掃描波長范圍200—600 nm。標準品測定:1 mg錦葵素-3-葡萄糖苷(Malvidin 3-O-glucoside)(北京索萊寶生物科技有限公司)溶于1 mL提取液,進一步稀釋為0.1 mg·mL-1和0.01 mg·mL-1,分別上樣測定。根據樣品和標準品520 nm下的色譜圖峰面積計算相對于錦葵素-3-葡萄糖苷的濃度。試驗重復3次。
1.4 基因表達量分析
果皮RNA的提取采用CTAB法。取2 μL RNA使用FastQuant RT Kit(With gDNase)試劑盒(天根生化科技(北京)有限公司)進行反轉錄。使用SuperReal PreMix(SYBR Green)試劑盒(天根生化科技(北京)有限公司)對花青苷合成基因、、、和光信號元件的表達進行熒光定量分析。儀器為耶拿qTower 2.0熒光定量PCR儀,程序為:95℃ 15 min預變性;95℃ 10 s,60℃ 20 s,72℃ 20 s共40個循環;之后從60℃逐漸升溫到95℃制作溶解曲線,升溫幅度為6 s/℃。內參基因為葡萄看家基因,所有引物使用Primer Premier 6.0進行設計,由生工生物工程(上海)股份有限公司合成。引物序列見表1。每個樣品重復3次,相對表達量的計算采用2-ΔΔCT法[27]。

表1 葡萄花青苷合成相關基因和VvHY5的定量PCR引物序列
1.5 數據處理與分析
試驗數據統計分析使用SPSS 20,單因素方差分析采用Duncan法,顯著性水平設定為α=0.05。制圖采用Microsoft excel 2003軟件。
2 結果
2.1 不同顏色果袋的透光性分析
由表2可以看出,不同顏色果袋的透射光譜不同。紅袋、綠袋和藍袋分別在紅光(600—700 nm)、綠光(550—600 nm)和藍光(400—500 nm)波段有較高透光率,而在其他波段透光率較低,說明紅袋、綠袋和藍袋對可見光的透過有選擇性。白袋在各個波段透光率基本一致,說明白袋對光質的透過沒有選擇性。
2.2 果皮花青苷含量分析
由圖1可以看出,對照(不套袋)和白袋處理從7月29日開始快速積累花青苷,而綠袋和藍袋處理從8月14日開始快速積累,紅袋處理則是8月22日,說明紅袋、綠袋和藍袋明顯推遲了葡萄的轉色期。從轉色期至8月30日,是花青苷快速積累期,不同紙袋處理的花青苷含量均低于對照,但不同紙袋處理間存在顯著性差異,花青苷含量表現為藍袋>綠袋>紅袋。白袋處理雖然沒有推遲轉色期,但在8月30日花青苷含量低于藍袋處理。果實發育后期(8月30日至9月15日),果皮花青苷積累量均表現為先下降后上升,且不同套袋處理及其與對照的差異發生變化,差距逐漸縮小,9月15日花青苷的積累量表現為藍袋>白袋>對照>綠袋>紅袋。
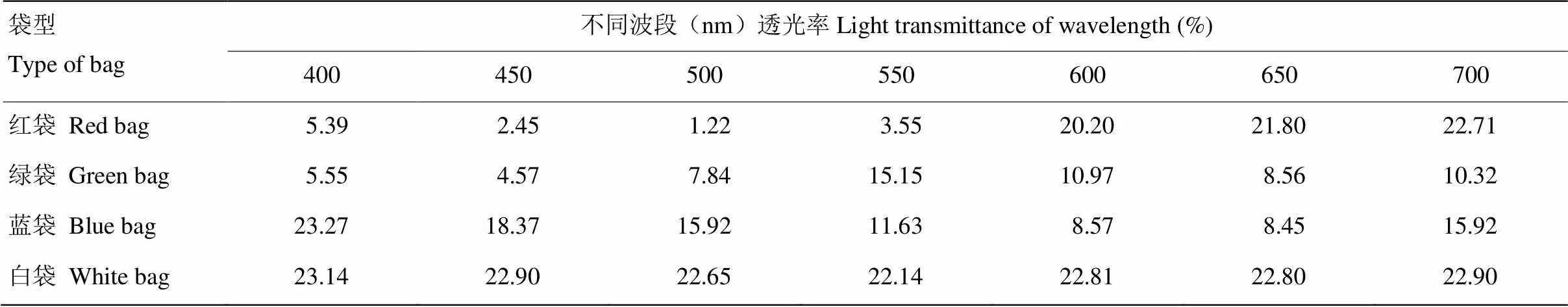
表2 不同顏色果袋400-700 nm波段透射光譜分析
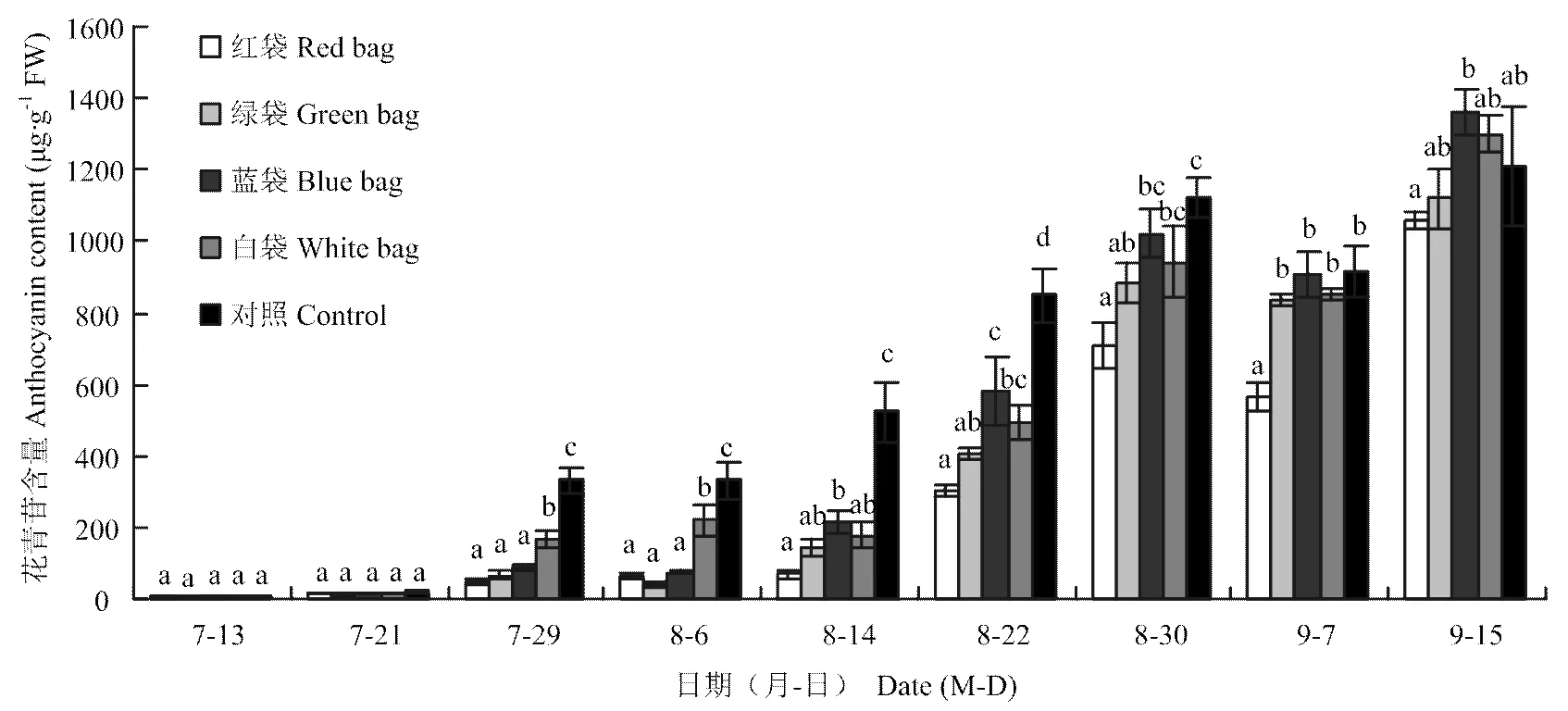
圖中所標不同小寫字母表示差異顯著(P<0.05) The different leter indicated extremely significant difference (P<0.05)
2.3 花青苷合成相關基因表達量分析
由圖2可知,套袋處理抑制或延緩了花青苷合成結構基因、、和調控基因表達量在果實發育早期的升高和后期的下降。在花青苷合成的初期(7月29日—8月6日),對照和白袋處理、和的表達量均高于其他3種套袋處理;隨著果實發育,紅袋、綠袋和藍袋處理、和的表達量快速升高,表現為藍袋>綠袋>紅袋,在8月22—30日接近甚至超過對照和白袋,這與藍袋、綠袋和紅袋處理果皮花青苷含量的快速上升相一致(圖1);8月30日后不同處理、和的表達量均有所下降,特別是對照,9月7—15日對照的表達量持續下降(和)或穩定在低值(),而4種紙袋處理的表達量依然較高,這可能是造成果實成熟后期套袋處理果皮花青苷含量接近甚至超過對照的原因。調控基因的變化規律與結構基因、和的變化規律基本一致,但的表達高峰早于、和,說明對、和的表達起重要的調控作用;另外在9月7日后略有升高,說明葡萄在過熟期(9月15日后)可能會有第二次花青苷合成高峰。
2.4 光信號轉錄因子表達量分析
是光信號途徑正調控因子。由圖3可以看出,在果實成熟過程中有兩次表達高峰,分別在花青苷快速積累期(8月6—14日)和果實成熟后期(9月7—15日),這與花青苷的積累規律和合成調控基因的表達規律基本一致(圖1、圖2)。8月14日前,4種紙袋處理表達量均低于對照,其中白袋處理表達量最高,略低于對照,其次為藍袋處理,紅袋和綠袋處理表達量較低;8月14日后,4種紙袋處理及對照的表達量均顯著下降,特別是對照和白袋處理,8月22—30日藍袋、紅袋和綠袋處理的表達量高于對照和白袋處理;9月7—15日出現第二次表達高峰,其中藍袋處理表達量最高,對照表達量最低。以上結果說明可能是通過參與了不同顏色果袋對葡萄果皮花青苷合成的調控,并且不同顏色紙袋對的誘導效應不同。
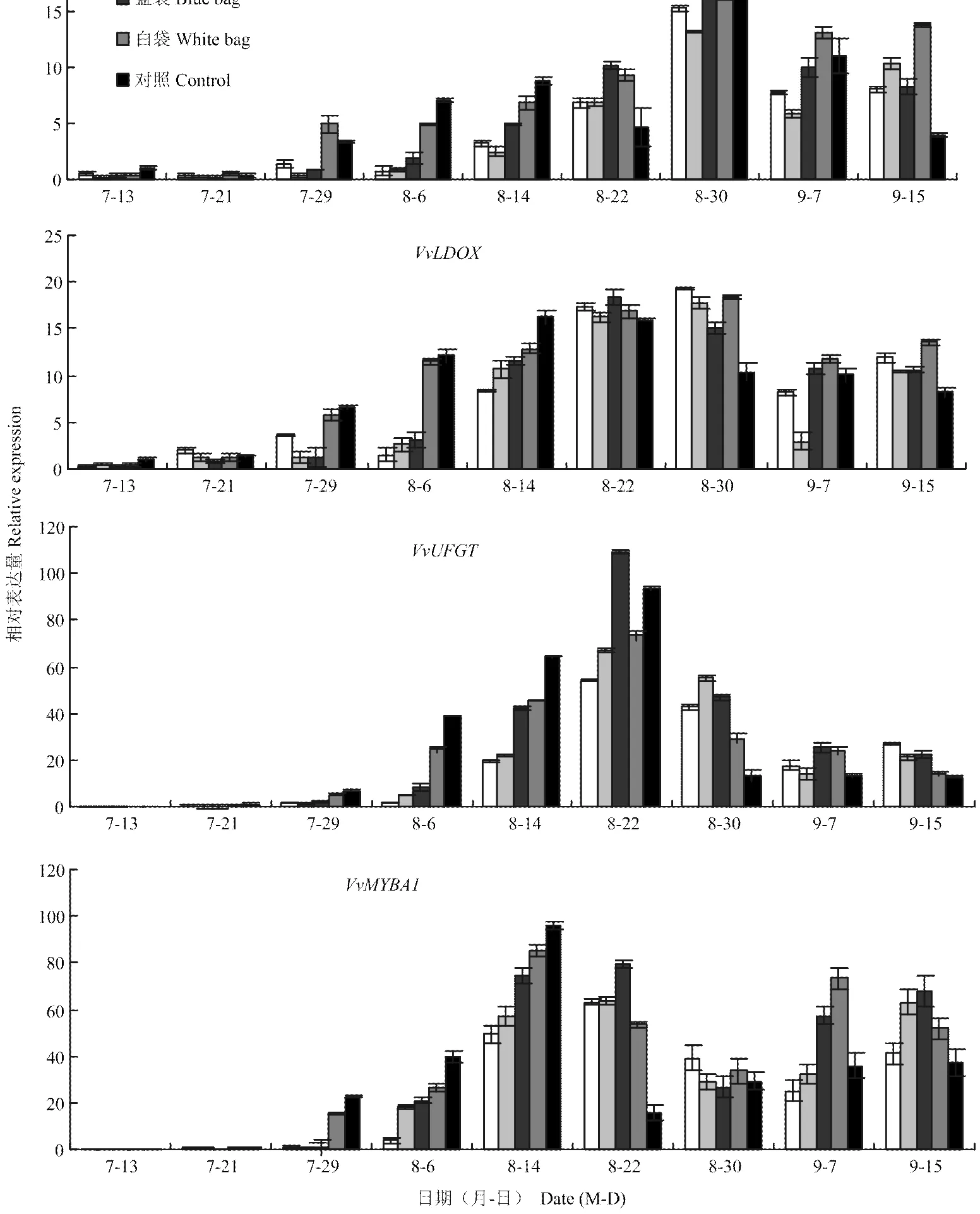
圖2 不同顏色果袋對花青苷合成相關基因表達量的影響
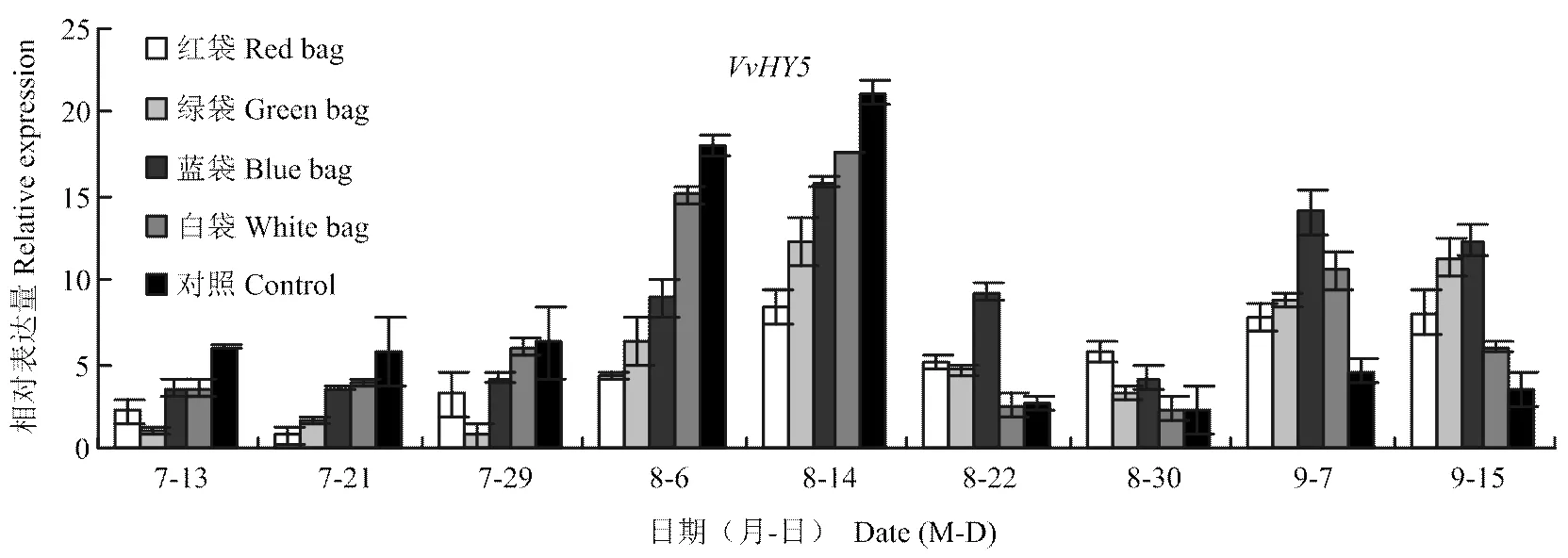
圖3 不同顏色果袋對光信號轉錄因子VvHY5表達量的影響
3 討論
越來越多的研究表明,光質調控是果實著色調控的有效手段。徐凱等[28]研究表明不同光質膜引起了‘豐香’草莓果實花青苷含量的差異,表現為紅膜>藍膜>黃膜>中性膜>綠膜;馬策等[29]研究表明不同顏色果袋對‘云紅梨2號’果皮花青苷組分沒有影響,但明顯改變了花青苷含量,表現為白袋>黃袋>紅袋>藍袋>紫袋>橙袋>綠袋,推測‘云紅梨2號’可能是光敏色素型和紫外光反應型;張斌斌等[18]研究表明不同顏色無紡布果袋對‘夕空’桃果皮花青苷含量的影響不同,表現為白袋含量最高,其次是藍袋和紫袋,黑袋含量最少。上述研究表明,改變果袋顏色是調控果實花青苷合成的簡單有效的方法。本研究發現紅色紙袋、綠色紙袋和藍色紙袋改變了透射光的光譜組成,顯著影響了‘巨峰’葡萄果皮花青苷含量,其中套藍色紙袋花青苷含量最高,而套紅色紙袋含量最低。這一結果與程建徽等[30]在‘紅地球’葡萄上的研究結果基本一致。趙文東等[31]研究表明,補藍光能明顯提高延遲栽培‘巨峰’葡萄果實花青苷含量,而補紅光效果較差。綜合前人及本試驗結果表明葡萄花青苷合成可能是藍光誘導型。
花青苷合成通過類黃酮合成途徑,是花青苷合成途徑早期結構基因。擬南芥、芥菜、歐芹等植物中研究表明,啟動子含有光響應元件ACE(ACGT- containing element)和MRE(MYB recognition element),受紫外光和藍光誘導表達[32-34];是花青苷合成途徑晚期結構基因,Gollop等[35]研究表明葡萄的表達受光誘導,啟動子序列分析發現有兩個Unit I光響應元件,分別可以結合bZIP和MYB轉錄因子;催化花青素合成的最后一步,是葡萄花青苷合成的關鍵基因,僅在紅色品種中表達[36];是葡萄花青苷合成重要調控因子,可以調控、和等結構基因的表達[37]。本研究中不同顏色果袋處理引起了花青苷合成結構基因、和以及調控基因的表達差異,在花青苷快速積累期,藍袋和白袋處理表達量較高,綠袋處理次之,紅袋處理較低,這可能是由于不同光質對葡萄花青苷合成基因表達的誘導能力不同。
不同波長的光被植物體內不同光受體感知,并通過光信號途徑調控植物生長發育和次生物質代謝[19,38]。編碼一個bZIP類型的轉錄因子,是第一個被發現促進光形態建成的轉錄因子[39]。Azuma等[40]研究表明葡萄的表達受光誘導,并且果實不同發育階段轉錄豐度不同。李慧峰等[41]研究表明蘋果能夠被白光、藍光、紫外光誘導,而紅光對表達沒有明顯誘導。但周波等[42]研究表明津田蕪菁幼苗在UV-A、藍光、紅光和遠紅光照射下的轉錄豐度幾乎沒有差異。本研究發現不同光質紙袋對‘巨峰’葡萄果皮表達的誘導效應不同,在花青苷快速合成期表現為白袋>藍袋>綠袋>紅袋,說明葡萄對光質的響應與蘋果類似,白光和藍光誘導能力較強,其次是綠光,紅光效果最差。本研究還發現在‘巨峰’葡萄果實發育過程中有兩次表達高峰,分別在花青苷快速積累期和果實成熟后期,說明的表達還與發育進程有關,且與花青苷的積累正相關。已有研究表明可以誘導擬南芥花青苷合成轉錄因子的表達[43]。本研究中是擬南芥的同源基因,其表達規律與基本一致,說明不同顏色紙袋可能是通過光信號轉錄因子調控的表達,進而調控花青苷合成途徑結構基因的表達,導致花青苷積累的差異。關于葡萄對的調控機制,有待深入研究。
4 結論
不同顏色果袋可以有效改變透射光的光譜特征,影響花青苷合成,調控葡萄著色。套藍色紙袋最有利于花青苷合成,而套紅色紙袋效果最差。不同顏色果袋對葡萄果實花青苷積累的調控可能是通過影響光信號轉錄因子的表達,進而調控花青苷合成調控基因和結構基因、、等的表達,影響果皮花青苷的合成。
References
[1] Liang Z C, Sang M, Fan P, Wu B H, Wang L J, Yang S H, Li S H. CIELAB coordinates in response to berry skin anthocyanins and their composition in vitis., 2011, 76(3): 490-497.
[2] 孫欣, 韓鍵, 房經貴, 上官凌飛, 王西成, 宋長年, 李曉穎. 葡萄漿果著色分子機理的重要研究進展. 植物生理學報, 2012, 48(4): 333-342.
Sun X, Han J, Fang J G, ShangGuan L F, Wang X C, Song C N, Li X Y. Important research progress of coloring molecular mechanisms in grape berry., 2012, 48(4): 333-342. (in Chinese)
[3] Yang Y, Labate J A, Liang Z, Cousins P, Prins B, Preece J E, Aradhya M, Zhong G Y. Multiple loss-of-function 5-O-glucosyltransferase alleles revealed in, but not in other vitis species., 2014, 127(11): 2433-2451.
[4] Fournier-Level A, Hugueney P, Verriès C, This P, Ageorges A. Genetic mechanisms underlying the methylation level of anthocyanins in grape (L.)., 2011, 11: 179.
[5] Rinaldo A R, Cavallini E, Jia Y, Moss S M A, McDavid D A J, Hooper L C, Robinson S P, Tornielli G B, Zenoni S, Ford C M, Boss P K, Walker A R. A grapevine anthocyanin acyltransferase, transcriptionally regulated by VvMYBA, can produce most acylated anthocyanins present in grape skins., 2015, 169(3): 1897-1916.
[6] Gomez C, Conejero G, Torregrosa L, Cheynier V, Terrier N, Ageorges A. In vivo grapvine anthocyanin transport involves vesicle-mediated trafficking and the contribution of anthoMATE transporters and GST., 2011, 67: 960-970.
[7] He F, Mu L, Yan G L, Liang N N, Pan Q H, Wang J, Reeves M J, Duan C Q. Biosynthesis of anthocyanins and their regulation in colored grapes., 2010, 15: 9057-9091.
[8] 李燦嬰, 常永義, 商佳胤, 葛永紅. 套袋對紅地球葡萄果皮色素和果實品質的影響. 中外葡萄與葡萄酒, 2006, 2(9): 9-12.
Li C Y, Chang Y Y, Shang J Y, Ge Y H. Effect of bagging on pigment of berry skin and fruit quality in Red Globe grape., 2006, 2(9): 9-12. (in Chinese)
[9] 成果, 陳立業, 王軍, 陳武, 張振文. 2種整形方式對‘赤霞珠’葡萄光合特性及果實品質的影響. 果樹學報, 2015, 32(2): 215-224.
Cheng G, Chen L Y, Wang J, Chen W, Zhang Z W. Effect of training system on photosynthesis and fruit characteristics of Cabernet Sauvignon., 2015, 32(2): 215-224. (in Chinese)
[10] 王枝翠, 孟祥云, 馮建榮, 潘立忠, 劉懷鋒. 不同顏色覆網對紅地球葡萄(L.)錦葵色素積累的影響. 石河子大學學報(自然科學版), 2013, 31(3): 276-282.
Wang Z C, Meng X Y, Feng J R, Pan L Z, Liu H F. Effect of color netting on malvidin pigment accumulation of red globe grape (L.)., 2013, 31(3): 276-282. (in Chinese)
[11] 孟祥云, 王枝翠, 王雨歌, 樊新民, 趙寶龍, 劉懷鋒. 地面遮陰對新疆紅地球葡萄果實著色的影響. 果樹學報, 2014, 31(1): 60-65.
Meng X Y, Wang Z C, Wang Y G, Fan X M, Zhao B L, Liu H F. Effects of terrestrial shading on the berry coloring of ‘Red Globle’ grape (L.) in Xinjiang., 2014, 31(1): 60-65. (in Chinese)
[12] 馬瑞娟, 張斌斌, 張春華, 蔡志翔, 顏志梅. 采取除袋鋪設反光膜對桃果實著色及相關基因表達的影響. 園藝學報, 2015, 42(11): 2123-2132.
Ma R J, Zhang B B, Zhang C H, Cai Z X, Yan Z M. Effect of bag removing with reflective film mulching before harvest on fruit coloration and expression of anthocyanin related genes in peach., 2015, 42(11): 2123-2132. (in Chinese)
[13] 趙海亮, 趙文東, 孫凌俊, 高圣華, 馬麗. 補光對延遲栽培‘巨峰’葡萄生長發育及光合熒光特性的研究. 中國農學通報, 2015, 31(1): 99-103.
Zhao H L, Zhao W D, Sun L J, Gao S H, Ma L. Study on supplemental lighting on the growing development and photosynthetic fluorescence characteristics of ‘Kyoho’ grape under delayed cultivation., 2015, 31(1): 99-103. (in Chinese)
[14] 陳強, 劉世琦, 張自坤, 崔慧茹, 郝樹芹, 劉忠良. 不同LED光源對番茄果實轉色期品質的影響. 農業工程學報, 2009, 25(5): 156-161.
Chen Q, Liu S Q, Zhang Z K, Cui H R, Hao S Q, Liu Z L. Effect of different light emitting diode sources on tomato fruit quality during color-changed period., 2009, 25(5): 156-161. (in Chinese)
[15] 劉林, 許雪峰, 王憶, 李天忠, 韓振海. 不同反光膜對設施葡萄果實糖分代謝與品質的影響. 果樹學報, 2008, 25(2): 178-181.
Liu L, Xu X F, Wang Y, Li T Z, Han Z H. Effect of different reflecting films on berry quality and sucrose metabolism of grape in greenhouse., 2008, 25(2): 178-181. (in Chinese)
[16] 劉帥, 袁登榮, 王志潤, 辛守鵬, 陶建敏. 選擇性光技術對‘陽光玫瑰’葡萄光合特性和果實品質的影響. 果樹學報, 2016, 33(2): 187-195.
Liu S, Yuan D R, Wang Z R, Xing S P, Tao J M. Effects of pink fluorescent filming and pink netting on the photosynthetic characteristics and fruit quality of ‘Shine Muscat’ grape., 2016, 33(2): 187-195. (in Chinese)
[17] Dussi M C, Sugar D, Wrolstad R E. Characterizing and quantifying anthocyanins in red pears and the effect of light quality on fruit color., 1995, 120(5): 785-789.
[18] 張斌斌, 馬瑞娟, 蔡志翔, 張春華, 顏志梅. 采前套袋微環境變化對桃果實品質的影響. 植物生理學報, 2015, 51(2): 233-240.
Zhang B B, Ma R J, Cai Z X, Zhang C H, Yan Z M. Effects of preharvest micro-environment inside baggs on peach fruit quality., 2015, 51(2): 233-240. (in Chinese)
[19] Chen M, Chory J, Fankhauser C. Light signal transduction in higher plants., 2004, 38: 87-117.
[20] Rizzini L, Favory J J, Cloix C, Faggionato D, O'Hara A, Kaiserli E, Baumeister R, Schafer E, Nagy F, Jenkins G I, Ulm R. Perception of UV-B by the Arabidopsis UVR8 protein., 2011, 332(6025): 103-106.
[21] Ang L H, Chattopadhyay S, Wei N, Oyama T, Okada K, Batschauer A, Deng X W. Molecular interaction between COP1 and HY5 defines a regulatory swich for light control of Arabidopsis development., 1998, 1: 213-222.
[22] Schulze-Lefert P, Becker-André M, Schulz W, Hahlbrock K, Dangl J. Functional architecture of the light- responsive chalcone synthase promoter from parsley., 1989, 1: 707-714.
[23] Gollop R, Even S, Colova-Tsolova V, Perl A. Expression of the grape dihydroflavonol reductase gene and analysis of its promoter region., 2002, 53(373): 1397-1409.
[24] Gollop R, Farhi S, Perl A. Regulation of the leucoanthocyanidin dioxygenase gene expression in Vitis vinifera., 2001, 161: 579-588.
[25] Lau O S, Deng X W. The photomorphogenic repressors COP1 and DET1: 20 years later., 2012, 17(10): 584-593.
[26] 王寶亮, 王海波, 王孝娣, 鄭曉翠, 史祥賓, 劉鳳之. 我國葡萄套袋技術研究進展. 北方園藝, 2014, 6: 188-190.
Wang B L, Wang H B, Wang X D, Zheng X C, Shi X B, Liu F Z. Research progress of grape fruit bagging technique in China., 2014, 6: 188-190. (in Chinese)
[27] Livak J, Schmitten T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod., 2001, 25: 402-408.
[28] 徐凱, 郭延平, 張上隆, 戴文圣, 符慶功. 不同光質膜對草莓果實品質的影響. 園藝學報, 2007, 34(3): 585-590.
Xu K, Guo Y P, Zhang S L, Dai W S, Fu Q G. Effect of light quality on the fruit quality of ‘Toyonoka’ strawberry (Duch.)., 2007, 34(3): 585-590. (in Chinese)
[29] 馬策, 肖長城, 胡紅菊, 黃小三, 張紹玲, 吳俊. 不同顏色果袋對‘云紅梨2號’果皮色澤形成的影響. 應用生態學報, 2014, 25(3): 813-818.
Ma C, Xiao C C, Hu H J, Huang X S, Zhang S L, Wu J. Effect of bagging with different colors on the fruit coloration of ‘Yunhongli No.2’ pear., 2014, 25(3): 813-818. (in Chinese)
[30] 程建徽, 魏靈珠, 雷鳴, 鄭婷, 吳江. 不同濾過膜袋對‘紅地球’葡萄果實品質的影響. 果樹學報, 2015, 32(1): 87-93.
Cheng J H, Wei L Z, Lei M, Zheng T, Wu J. Influences of different light filter film bags on berry quality in ‘Red Globe’., 2015, 32(1): 87-93. (in Chinese)
[31] 趙文東, 郭修武, 王欣欣, 孫凌俊, 趙海亮, 高圣華, 馬麗. 光質對延遲栽培巨峰葡萄果實品質的影響. 中國果樹, 2011(1): 20-22.
Zhao W D, Guo X W, Wang X X, Sun L J, Zhao H L, Gao S H, Ma L. Effect of light quality on berry quality in ‘Kyoho’ under delayed cultivation., 2011(1): 20-22. (in Chinese)
[32] Feinbaum R L, Ausubel F M. High intensity and blue light regulated expression of chimeric chalcone synthase genes in transgenicplants., 1991, 226: 449-456.
[33] Schulze-Lefert P, Dangl J L, Becker-André M, Hahlbrock K, Schulz W. Inducible in vivo DNA footprints define sequences necessary for UV light activation of the parsley chalcone synthase gene., 1989, 8: 651-656.
[34] Kaiser T, Emmler K, Kretsch T, Weisshaar B, Sch?fer E, Batschauer A. Promoter elements of the mustardgene sufficient for light regulation in transgenic plants., 1995, 28: 219-229.
[35] Gollop R, Farhi S, Perl A. Regulation of the leucoanthocyanidin dioxygenase gene expression in., 2001, 161: 579-588.
[36] Boss P K, Davies C, Robinson S P. Expression of anthocyanin biosynthesis pathway genes in red and white grapes., 1996, 32: 565-569.
[37] Kobayashi S, Ishimaru M, Hiraoka K, Honda C. Myb-related genes of the Kyoho grape () regulate anthocyanin biosynthesis., 2002, 215(6): 924-933.
[38] Endt D V, Kijne J W, Memelink J. Transcription factors controlling plant secondary metabolism: what regulates the regulators?, 2002, 61(2): 107-114.
[39] Chattopadhyay S, Ang L H, Puente P, Deng X W, Wei N. Arabidopsis bZIP protein HY5 directly interacts with light-responsive promoters in mediating light control of gene expression., 1998, 10(5): 673-683.
[40] Azuma A, Fujii H, Shimada T, Yakushiji H. Microarray analysis for the screening of genes inducible by light or low temperature in post-veraison grape berries., 2015, 84(3): 214-226.
[41] 李慧峰, 王小非, 冉昆, 何平, 王海波, 李林光. 蘋果光響應轉錄因子MdHY5表達及蛋白互作分析. 中國農業科學, 2014, 47(21): 4318-4327.
Li H F, Wang X F, Ran K, He P, Wang H B, Li L G. Expression and protein interaction analysis of light responsive bZIP transcription factor MdHY5., 2014, 47(21): 4318-4327. (in Chinese)
[42] 周波, 王宇, 孫梅, 李玉花. 津田蕪菁bZIP蛋白HY5 cDNA的克隆及表達特性. 分子植物育種, 2008, 6(1): 59-64.
Zhou B, Wang Y, Sun M, Li Y H. cDNA cloning of bZIP protein HY5 in Tsuda Turnip and its transcript expression analysis., 2008, 6(1): 59-64. (in Chinese)
[43] Shin D H, Choi M, Kim K, Bang G, Cho M, Choi S B, Choi G, Park Y I. HY5 regulates anthocyanin biosynthesis by inducing the transcriptional activation of the MYB75/PAP1 transcription factor in., 2013, 587(10): 1543-1547.
(責任編輯 趙伶俐)
The Grape Anthocyanin Biosynthesis Regulation by Different Color Fruit Bags
JI Xiao-hao, WANG Hai-bo, ZHANG Ke-kun, WANG Xiao-di, SHI Xiang-bin, WANG Bao-liang, ZHENG Xiao-cui, WANG Zhi-qiang, LIU Feng-zhi
(Fruit Research Institute, Chinese Academy of Agricultural Sciences/Key Laboratory of Germplasm Resources Utilization of Horticultural Crops, Ministry of Agriculture, Xingcheng 125100, Liaoning)
【Objective】The aim of this study was to ascertain the effect of different fruit color bags on grape anthocyanin biosynthesis and preliminarily clarify the mechanism, providing theoretical guidance for the development of grape fruit bags. 【Method】The experimental materials were five-year-old vines of ‘Kyoho’ grape using ‘Beta’ as rootstock, bagged with red, green, blue and white fruit paper bags 30 days after fruit setting, respectively, and no bagging as control. The berries were sampled every eight days from bagging to full mature stage. The fruit bag transmission spectrum analysis was tested with StellarNet?Black-Comet Spectrometers. Anthocyanin content in fruit peel was measured by HPLC. The expression of anthocyanin biosynthesis pathway structural genes,,, and regulatory geneand light signal transcription factorwere analyzed by real-time PCR. 【Result】Red bag, green bag and blue bag had selective permeability in red, green and blue band, while white bag had no selective permeability for light quality. Different color fruit bags significantly affected grape anthocyanin biosynthesis. Red bag, green bag and blue bag treatments significantly delayed grape variation, and delayed anthocyanin accumulation, but anthocyanin contents in blue bag and white bag treatments were higher than the control at last. RT-PCR analysis showed that the expression of,,andincreased first and then decreased, which was consistent with anthocyanin accumulation. Different color fruit bag treatments delayed the expression increase of,,andat the early stage of fruit ripening and also delayed their expression decrease at the late stage of fruit ripening. Their expression contents were higher in control and white bag treatment, followed by blue bag, green bag and red bag treatments before the expression peaks, while after the expression peaks, their expressions in control were lower than blue bag, white bag, green bag and red bag treatments. In anthocyanin rapid accumulation period and the late stage of fruit ripening,had two expression peaks, which was consistent with the variation patterns of anthocyanin accumulation and the expression ofduring fruit ripening. The induction ability of different color fruit bags onexpression was different, like that the blue paper bag was the strongest and the red paper bag was the worst.【Conclusion】Blue paper bag is of benefit to grape anthocyanin biosynthesis, while red paper bag is poor. The regulation of anthocyanin accumulation in grape by different color fruit bags is probably through the light signal transcription factor, and then regulated the expression of anthocyanin biosynthesis pathway regulatory geneand structural genes,and.
grape; fruit bagging; light quality; anthocyanin; gene expression
2016-04-29;接受日期:2016-06-27
國家現代農業產業技術體系建設專項(nycytx-30-zp)、農業部“948”重點項目(2011-G28)、中國農業科學院創新工程(CAAS-ASTIP- 2015-RIP-04)
冀曉昊,Tel:13610890936;E-mail:jixiaohao2006@163.com。王海波,Tel:13591963796;E-mail:haibo8316@163.com。冀曉昊與王海波為同等貢獻作者。通信作者劉鳳之,Tel:13904295109;E-mail:liufengzhi6699@126.com

