雷公藤內酯醇和纈沙坦對高糖誘導小鼠足細胞活性的影響
侯鵬超 洪郁芝 葉迅
雷公藤內酯醇和纈沙坦對高糖誘導小鼠足細胞活性的影響
侯鵬超 洪郁芝 葉迅
目的 觀察不同濃度高糖對小鼠足細胞活性的抑制作用,以及不同濃度雷公藤內酯醇(TP)和纈沙坦(Val)對高糖抑制后小鼠足細胞活性的影響,探討高糖對足細胞的損傷作用,以及有效的藥物干預濃度范圍。方法 將培養成熟的小鼠足細胞隨機分為對照組(11.1mmol/L葡萄糖)和不同濃度高糖組(16.1、21.1、26.1、31.1、36.1mmol/L),以上述濃度培養48h后采用CCK-8檢測足細胞活性的變化。取活性變化最大的濃度為高糖誘導濃度,在此基礎上隨機分為不同濃度的TP組(4、8、16、32、64ng/ml)和Val組(2×10-8、2×10-7、2×10-6、2×10-5、2×10-4mol/L),以上述濃度干預48h后,采用CCK-8檢測足細胞活性的變化。結果 (1)與對照組相比,除16.1mmol/L高糖組外,其余各高糖組的足細胞活性顯著減少,其中以26.1mmol/L葡萄糖組減少最為明顯(P<0.01)。(2)與26.1mmol/L葡萄糖組相比,TP組(除4ng/ml組外)和Val組(除2×10-8mol/L組外)足細胞活性部分恢復,其中以16ng/ml TP組和2×10-5mol/L Val組足細胞活性恢復最為明顯(P<0.01)。結論 一定濃度范圍的TP和Val可部分恢復受高糖抑制的小鼠足細胞活性。
高糖 雷公藤內酯醇 纈沙坦 足細胞 活性干預 CCK-8
糖尿病腎病(DN)是糖尿病重要的微血管并發癥之一,蛋白尿是DN的主要臨床表現和獨立進展因素,因此蛋白尿的發病機制一直是DN研究的重點和熱點。近年來腎小球濾過膜最外層足細胞逐漸引起了國內外學者的關注。足細胞轉分化(EMT)是指足細胞在高糖等有害刺激誘導下,可由上皮細胞向間充質細胞轉分化[1-2],從而改變形態、活性和功能。目前觀點認為足細胞EMT是導致DN蛋白尿的一個重要原因,而雷公藤內酯醇(TP)和纈沙坦(Val)可能具有抑制足細胞EMT,從而減輕蛋白尿的作用[3-4]。本研究探討TP和Val兩種藥物對高糖誘導下小鼠足細胞活性的影響,并試圖尋求藥物的最佳干預濃度,為后續進行機制研究打下基礎。
1 材料和方法
1.1 主要試劑和儀器 小鼠足細胞由英國倫敦大學國王學院Guy’s醫院贈送;Val原粉(2g/瓶)由瑞士諾華公司惠贈,TP原粉購自南京澤朗生物技術有限公司(10g/瓶,批號:ZL111012R)。RPMI 1640雙抗培養基,FBS購自美國Gibco公司,使用時分別配置成含10%FBS的生長培養基,不含FBS的同步化培養基及含2.5%FBS的實驗培養基;葡萄糖購自日本大冢制藥公司;CCK-8購自東仁化學科技(上海)有限公司;Heracell 240i細胞培養箱,Denley Dragon酶標儀為美國 Thermo Fisher Scientific公司產品。
1.2 方法
1.2.1 足細胞培養 液氮罐中凍存的小鼠足細胞復蘇后,置于5%CO2培養箱中33℃進行培養,每瓶除加入10%FBS的生長培養基5ml外,同時加入γ-干擾素500U。待細胞貼壁生長至80%以上,加入胰蛋白酶室溫下消化1~2min,待細胞變圓、間隙增寬時,終止消化,置37℃、5%CO2培養箱中培養(培養基不變,但不含γ-干擾素)使之分化成熟。37℃培養14~20d后,足細胞胞體變大,產生較多粗厚交錯的足突,成為分化成熟的“樹枝狀”足細胞。
1.2.2 足細胞CCK-8檢測標準的確定 將分化成熟且處于對數生長期的“樹枝狀”足細胞,按照以下數量接種于96孔板,1×103、2×103、4×103、8×103、10×103、20×103、40×103、80×103、100×103個/孔,各濃度均設置5個復孔培養12h待細胞貼壁生長后,吸走培養基,每孔加入含10%的CCK-8培養基100μl,分別孵育1、2、3、4h測OD450值。以每孔細胞數為橫坐標,以去背景OD450值為縱坐標,獲得細胞增殖標準曲線,從而確定CCK-8檢測的最佳細胞數和時間。
1.2.3 高糖誘導足細胞的活性測定 按照1.2.2結果,將對數生長期的足細胞以10×103個/孔數量接種于96孔板,培養12h待細胞貼壁生長后,用同步化培養基饑餓培養12h,再換用含有以下濃度葡萄糖的培養基,即11.1(對照組)、16.1、21.1、26.1、31.1、36.1mmol/L誘導48h,每個濃度設置5個復孔。吸走培養基后,每孔加入含10%CCK-8的培養基100μl,按照1.2.2結果孵育3h后測定OD450值,來明確高糖對足細胞活性的抑制作用,并獲得高糖的最佳誘導濃度。
1.2.4 TP或Val對高濃度葡萄糖環境下足細胞活性的影響 Val原粉以二甲基亞砜和無菌注射用水稀釋后配置成4ng/μl溶液,再稀釋成各實驗濃度;TP原粉以二甲基亞砜和無菌注射用水稀釋后配置成4×10-2mol/L溶液,再稀釋成各實驗濃度。足細胞接種培養同1.2.2,依據1.2.3的結果選用26.1mmol/L的高糖培養基誘導,并添加不同濃度TP或Val作為實驗組。TP組設置T1、T2、T3、T4、T5組,TP濃度分別為4、8、16、32、64ng/ml;Val組設置V1、V2、V3、V4、V5組,Val濃度為2×10-8、2×10-7、2× 10-6、2×10-5、2×10-4mol/L。每個濃度均設置5個復孔,干預48h后,按照1.2.2結果孵育3h,測定OD450值。同時按照1.2.3結果設置高糖模型對照組(MC組,葡萄糖濃度為26.1mmol/L)和正常對照組(NC組,葡萄糖濃度為11.1mmol/L),獲得藥物最佳干預濃度。
1.3 統計學處理 采用SPSS 13.0統計軟件,計量資料以表示;多組間比較采用單因素F檢驗;組間兩兩比較,方差齊時采用LSD-t檢驗,方差不齊時采用Tamhane’s T2檢驗。兩變量間相關性分析采用直線相關分析。
2 結果
2.1 足細胞CCK-8檢測標準的確定 以每孔細胞數為橫坐標,去背景OD450值為縱坐標,獲得小鼠足細胞增殖標準曲線。結果提示孵育3h,細胞數量10×102個~10×103個時,每孔細胞數目和去背景OD450值相關性最強(r=0.9995,P<0.01),考慮后續實驗需要干預48h,細胞需要維持一定數量,故以10×103個/孔接種最為合適,見圖1。
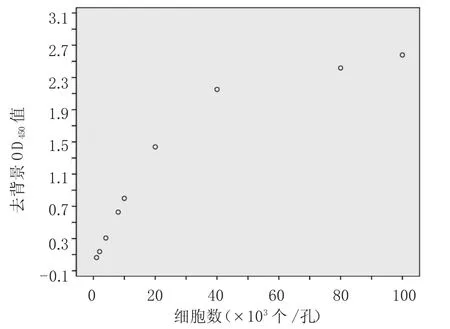
圖1 足細胞增殖標準曲線
2.2 不同濃度葡萄糖對足細胞活性的抑制作用 與NC組(11.1mmol/L葡萄糖組)相比,16.1mmol/L葡萄糖組足細胞活性無統計學差異(P>0.05),其余各組足細胞活性均顯著下降(P<0.05或0.01),其中以26.1、31.1mmol/L葡萄糖組下降最明顯(均 P<0.01);而26.1、31.1mmol/L葡萄糖組間比較,26.1mmol/L組下降更明顯(P<0.05);36.1mmol/L組足細胞活性出現明顯的反跳現象,與31.1mmol/L組比較具有統計學差異(P<0.01),見表1。由此得出后續實驗中的最佳葡萄糖糖誘導濃度為26.1mmol/L。

表1 不同濃度葡萄糖對足細胞活性的抑制作用
2.3 TP或Val對高濃度葡萄糖環境下足細胞活性的影響 與MC組比較,T1組足細胞活性無統計學差異(P>0.05),其余各組足細胞活性均有不同程度增加,均有統計學差異(P<0.05或0.01),其中以T3、T4組增加最顯著(均P<0.01);而T3、T4組間比較,T3組增加更明顯(P<0.05)。但與NC組比較,TP各濃度組足細胞活性尚未完全恢復(P<0.05或0.01),見表2。
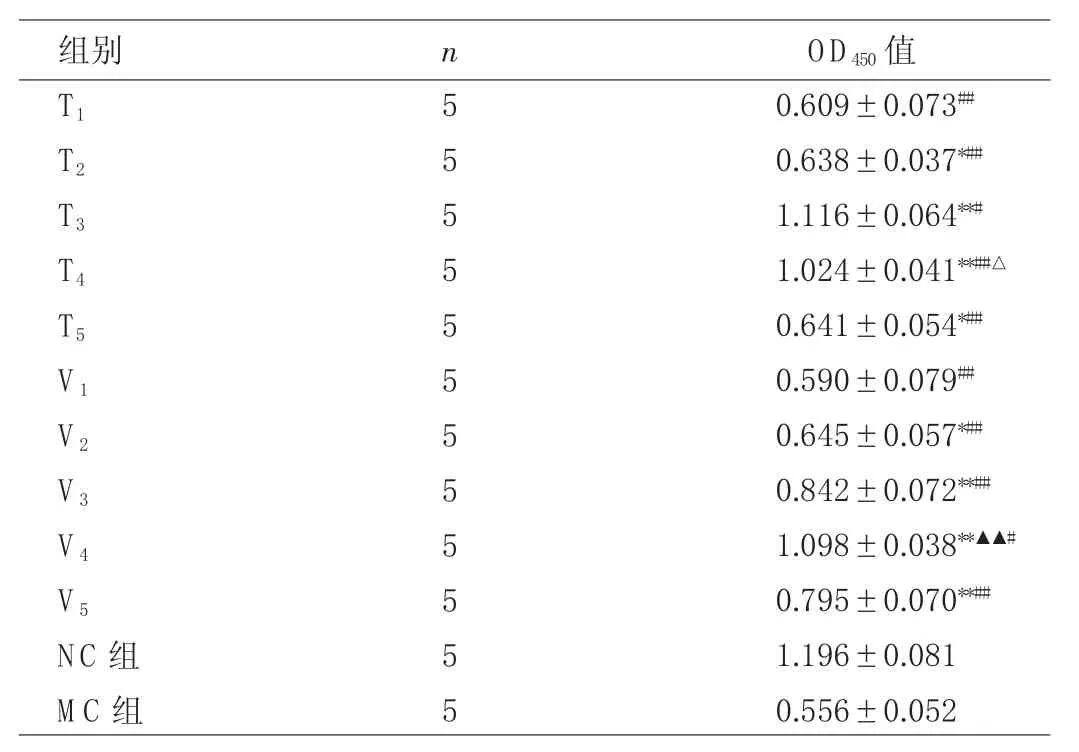
表2 TP或Val對高濃度葡萄糖環境下足細胞活性的影響
與MC組相比,V1組足細胞活性無統計學差異(P>0.05),其余各組均有不同程度增加,均有統計學差異(P<0.05或0.01);與V3組比較,V4組升高更明顯(P<0.01),V5組則無統計學差異(P>0.05)。與NC組比較,Val各濃度組足細胞活性尚未完全恢復(P<0.05或0.01),見表2。由此得出最佳TP干預濃度為16ng/ ml,最佳的Val干預濃度為2×10-5mol/L。
3 討論
足細胞EMT已經成為DN蛋白尿研究中的熱點,若能研究清楚并有效阻斷該過程,將為DN蛋白尿的防治開辟嶄新的前景。近來的研究顯示,高濃度葡萄糖可以激活轉化生長因子β1(TGF-β1)并通過TGF-β/Smad信號通路介導足細胞EMT的發生,并負反饋抑制Smad7的表達;同時檢測到足細胞EMT發生的證據,即上皮細胞標志蛋白如足細胞裂孔膜蛋白(nephrin和podocin)、腎病樣蛋白1抗體(NEPH1)、緊密連接相關蛋白ZO-1等的表達減少,以及間充質細胞標志蛋白desmin、纖維連接蛋白(FN)、整合素連接激酶(ILK)、基質金屬蛋白酶9(MMP-9)等表達增加[1,5]。發生EMT的足細胞,首先表現為足突減少、融合增加,其次細胞活性下降,導致與腎小球基底膜(GBM)的黏附作用下降而損傷濾過膜,形成早期蛋白尿;而長期的高濃度葡萄糖刺激除了加重足細胞EMT,還可直接導致足細胞發生壞死和凋亡[6]。目前認為足細胞EMT是早期和可逆的過程,因此阻斷該信號通路,將會有效緩解或逆轉足細胞EMT,從而可以減輕濾過膜損傷,防止蛋白尿的發生[7]。一些證據顯示TP和Val可能與足細胞EMT和TGF-β/ Smad信號通路關系密切。
TP具有強烈的抗炎和免疫抑制作用,研究認為DN蛋白尿的進展是一種炎癥反應,而且可被TP抑制,既往研究中已經獲得了較多的證實,目前認為其具體機制可能與抑制足細胞EMT有關。已有小鼠實驗證實,TP治療后足細胞原本稀少的足突再次變得粗厚茂密,而與足細胞EMT相關的足細胞裂孔膜蛋白(nephrin和podocin)的表達和分布都出現了不同程度增加,而間充質細胞標志蛋白desmin則明顯減少[4]。在另一項動物實驗中也證實了TP通過降低腎臟組織中巨噬細胞的堆積和滲透從而減輕足細胞的損傷和凋亡,并能減少骨橋蛋白和TGF-β1的表達[8]。以上研究結果均顯示了TP參與了抑制足細胞EMT的過程,但仍缺乏體外實驗相關證據,其作用機制是否與TGF-β/Smad信號通路有關尚未完全明了。
作為血管緊張素Ⅱ受體拮抗劑,Val一直被認為是通過血壓控制降低腎小球內壓和濾過率下降速度,從而起到減輕DN蛋白尿和保護腎臟的作用,但目前認為其可能存在降壓效果以外的降低蛋白尿的機制[9]。在高血壓合并DN的大鼠實驗中,觀察不同劑量的Val對大鼠血壓和蛋白尿的影響,發現當Val超過120 mg/(kg·d)時,大鼠血壓不再進一步下降,而蛋白尿卻持續減低[10]。同時在Val治療具有進行性蛋白尿表現的單腎切除DN小鼠時,不但顯示蛋白尿減少,還出現了腎臟纖維化相關因子血漿纖溶酶原激活物抑制劑-1(PAI-1)、FN、Ⅳ型膠原、TGF-β1等的表達減低,而足細胞EMT相關的足細胞裂孔膜蛋白(nephrin和podocin)表達明顯增加[9]。但Val的作用機制是否與抑制足細胞EMT和參與TGF-β/Smad信號通路相關仍缺乏相關體外實驗證據。本研究從細胞活性角度顯示TP和Val可逆轉發生了EMT的足細胞活性。實驗采用CCK-8檢測方法,根據試劑生成甲臜物數量與活細胞數量成正比,獲取去背景OD450值反映足細胞活性,并通過組間比較明確藥物干預作用,并取得最佳干預濃度。本法試劑單一,方便快速,對細胞無毒,靈敏度和重復性高于MTT法。
高濃度葡萄糖誘導研究發現,高濃度葡萄糖可促使足細胞活性下降,但隨著葡萄糖濃度的增高,足細胞活性產生波動。與NC組相比,26.1、31.1mmol/L組足細胞活性明顯下降,且兩者中以26.1mmol/L組下降更明顯。與NC組比較,36.1mmol/L組足細胞活性仍呈下降趨勢,但與31.1mmol/L組比較,足細胞活性反而出現了明顯回升,可能與足細胞對高濃度葡萄糖發生耐受有關。因此后續實驗選擇26.1mmol/L作為高濃度葡萄糖的干預濃度最具有意義。
藥物干預研究發現,TP和Val都可不同程度逆轉高濃度葡萄糖抑制的足細胞活性。與MC組相比,T3、T4、V3、V4、V5各組足細胞活性都有明顯恢復;而T3、T4兩組間比較,T3恢復更好;V3、V4、V5各組間比較,V4組恢復更好。與T4組相比,T5組出現了恢復減低;與T3組比較,T4組比恢復減低,這提示了TP逆轉足細胞活性的作用存在閾值,T3附近即是轉折點,超過轉折點濃度后足細胞活性反而降低,間接說明了雷公藤類藥物可能具有濃度依賴的不良反應。同樣V3組和V5組無差異,與V4組相比足細胞活性恢復減低,提示V4附近存在轉折點。與NC組相比,各藥物組細胞活性尚未完全恢復,均有統計學差異。因此,筆者認為TP濃度在8~64ng/ml和Val濃度在2×10-7~2×10-4mol/L為有效干預濃度范圍,其中以TP 16ng/ml和Val 2×10-5mol/L為最適干預濃度,但是TP和Val均可能存在濃度依賴的不良反應,尚需進一步研究證實。
本研究從足細胞活性角度表明,一定濃度范圍的TP和Val可部分逆轉高濃度葡萄糖抑制的小鼠足細胞活性,提示其對足細胞具有靶向保護作用,為進一步研究足細胞EMT和TGF-β/Smad信號通路相關因子提供了實驗基礎。
[1]Reidy K,Susztak K.Epithelial-mesenchymaltransition and podocyte loss in diabetic kidney disease[J].Am J Kidney Dis,2009,54 (4):590-593.
[2]Yamaguchi Y,Iwano M,Suzuki D,et al.Epithelial-mesenchymal transition as a potentialexplanation for podocyte depletion in diabetic nephropathy[J].Am J Kidney Dis,2009,54(4):653-664.
[3]Burns WC,Velkoska E,Dean R,et al.Angiotensin II mediates epithelial-to-mesenchymal transformation in tubular cells by ANG 1-7/MAS-1-dependent pathways[J].Am J PhysiolRenalPhysiol, 2010,299(3):F585-F593.
[4]Chen Z H,Qin W S,Zeng C H,et al.Triptolide reduces proteinuria in experimental membranous nephropathy and protects against C5b-9-induced podocyte injury in vitro[J].Kidney Int,2010,77 (11):974-988.
[5]Lee H S,Song C Y.Effects of TGF-beta on podocyte growth and disease progression in proliferative podocytopathies[J].Kidney Blood Press Res,2010,33(1):24-29.
[6]Lv Z,Hu M,Zhen J,et al.Rac1/PAK1 signaling promotes epithelial-mesenchymal transition of podocytes in vitro via triggering beta-catenin transcriptional activity under high glucose conditions[J].Int J Biochem CellBiol,2013,45(2):255-264.
[7]Liu Y.New insights into epithelial-mesenchymal transition in kidney fibrosis[J].J Am Soc Nephrol,2010,21(2):212-222.
[8]Ma R,Liu L,Liu X,et al.Triptolide markedly attenuates albuminuria and podocyte injury in an animal model of diabetic nephropathy [J].Exp Ther Med,2013,6(3):649-656.
[9]Zhou G,Cheung A K,Liu X,et al.Valsartan slows the progression ofdiabetic nephropathy in db/db mice via a reduction in podocyte injury,and renal oxidative stress and inflammation[J].Clin Sci (Lond),2014,126(10):707-720.
[10]Tominaga N,Robert A,Izuhara Y,et al.Very high doses of valsartan provide renoprotection independently of blood pressure in a type 2 diabetic nephropathy rat model[J].Nephrology(Carlton),2009,14(6):581-587.
Impact of triptolide and valsartan on inhibition of mouse podocyte activity induced by high glucose
HOU Pengchao,HONG Yuzhi, YE Xun.Department of Endocrinology,Guangxing Hospital Affiliated to Zhejiang Chinese Medicine University (Hangzhou Traditional Chinese Medical Hospital),Hangzhou 310007,China
Objective To investigate the impact of triptolide (TP)and valsartan (Val)on the inhibition of mouse podocyte activity induced by high glucose. Methods Matured mouse podocytes were cultured and randomly divided into control group (11.1mmol/Lglucose)and different high glucose groups(16.1,21.1,26.1,31.1 and 36.1mmol/Lglucose,respectively).Changes of podocyte activity were detected by CCK-8 after 48h incubated with different concentrations of glucose,and the appropriate concentration of glucose was screened.Then matured podocyte were randomly divided into different TP groups(4,8,16,32 and 64ng/ml TP,respectively)and Val groups(2×10-8,2×10-7,2×10-6,2×10-5and 2×10-4mol/L Val,respectively).The changes of podocyte activity were detected by CCK-8 after 48hrs incubation. Results Compared with controlgroup,the podocyte activity in different high glucose groups were significantly inhibited to varying degrees except that in 16.1mmol/L glucose group.The activity of podocyte was most significantly inhibited in 26.1mmol/L glucose group(P<0.01).Compared with the 26.1mmol/L high glucose group,the podocyte activity of different TP and Val groups were significantly up-regulated to varying degrees except those of 4ng/mlTP group and 2×10-8mol/L Val group.The activity of podocyte was most significantly up-regulated by the 16ng/ml TP and the 2×10-5mol/L Val,respectively(P<0.01). Conclusion Both triptolide and valsartan can partially rehabilitate the inhibition of mouse podocyte activity induced by high glucose.
High glucose Triptolide Valsartan Podocyte Activity impactCCK-8
2014-10-21)
(本文編輯:胥昀)
浙江省中醫藥科學研究基金計劃A類(2012ZA097);杭州市科委醫療衛生及重點專科專病科研攻關專項(20130733Q 16)
310007 杭州,浙江中醫藥大學附屬廣興醫院、杭州市中醫院內分泌科
葉迅,E-m ai l:yexunonl i ne@163.com

