miRNA-29c在大鼠腦缺血再灌注神經損傷中的保護作用與機制
葉 蓓,李 曼,程 翔,陳建珍,賀 芳,張立光
(1.蘇州衛生職業技術學院,江蘇 蘇州 215009;2.山東大學齊魯醫院,濟南 250012)
?
研究報告
miRNA-29c在大鼠腦缺血再灌注神經損傷中的保護作用與機制
葉 蓓1,李 曼2,程 翔1,陳建珍1,賀 芳1,張立光1
(1.蘇州衛生職業技術學院,江蘇 蘇州 215009;2.山東大學齊魯醫院,濟南 250012)
目的探討miRNA-29c在大鼠腦缺血再灌注神經損傷中的保護作用與機制研究。方法48只雄性SD大鼠隨機分為假手術組,模型組,miR-29c NC組,miR-29c inhibitor組,除假手術組外,其余三組均采用拴線法建立大鼠大腦中動脈局灶缺血再灌注損傷模型,并于術后24 h評價大鼠神經行為變化,檢測大鼠腦梗死體積,缺血側腦組織細胞凋亡情況,腦組織中miR-29c表達量,超氧化物岐化酶(SOD)活性,丙二醛(MDA)含量,含半胱氨酸的天冬氨酸蛋白水解酶3(Caspase 3),Caspase 8及Caspase 9活性,及Bcl-2,Bax,Bak1,cleaved caspase 3,cleaved caspase 8與cleaved caspase 9蛋白表達。結果與假手術組比較,模型組,miR-29c NC組中miR-29c表達量顯著提高,大鼠神經行為評分提高,腦梗死體積增加,細胞凋亡率提高,SOD活性降低,MDA含量,Caspase 3,Caspase 8及Caspase 9活性上升,Bcl-2表達量下調,Bax,Bak1,cleaved caspase 3,cleaved caspase 8及cleaved caspase 9表達量上調,差異均具有統計學意義(P<0.01)。與模型組及miR-29c NC組比較,miR-29c inhibitor組miR-29c表達量顯著降低,大鼠神經行為評分降低,腦梗死體積百分比減少,細胞凋亡率降低,SOD活性上升,MDA含量,Caspase 3,Caspase 8及Caspase 9活性降低,Bcl-2表達量上調,Bax,Bak1,cleaved caspase 3,cleaved caspase 8及cleaved caspase 9表達量下調,差異均具有統計學意義(P<0.01)。結論miR-29c對大鼠腦缺血再灌注神經損傷具有保護作用,與提高抗氧化能力及調控細胞凋亡相關蛋白表達有關。
miR-29c;腦缺血再灌注;細胞凋亡
缺血性腦血管病的發病率,致殘率及死亡率皆相當之高,且發病機制復雜。其可分為局灶性腦缺血及全腦缺血,前者指腦血管局部區域血流減少或被阻斷,后者是指在臨床上肺栓塞,休克,窒息所導致的。在缺血過程中,當血液恢復灌流后,會啟動一系列內源性的損傷,加重腦缺血的損傷,而這一過程稱之為腦缺血再灌注損傷[1-2]。這一損傷過程涉及腦血管微環境及神經細胞釋放大量氧自由基等有害因子,損害細胞生物膜結構,損傷細胞線粒體功能,最終導致細胞凋亡。因此,通過清除氧自由基產物,抑制細胞凋亡將對于腦缺血再灌注損傷后神經細胞的保護具有重要作用[2-3]。
miRNAs是一類長度約為18-25 nt高度保守的小RNA,能結合于其靶基因3’-UTR區域,進而抑制靶基因的翻譯,從而參與細胞生長,增值,分化與凋亡的調控。以往對于miRNA的研究主要集中于腫瘤的發生及免疫疾病中,近些年也陸續有研究發現miRNA與缺血性腦血管病關系密切。如Jeyaseelan等[4]研究顯示在大鼠局灶性大腦中動脈栓塞(MCAO)模型中,發現有106個miRNA異常表達。另外Dharap等[5]研究也表明MCAO大鼠中miRNA在各個檢測點中異常表達。上述研究報道均說明miRNA與腦缺血再灌注損傷密切相關,但涉及的具體調控機制尚不明確。此外miR-29c是一個與胚胎神經系統的發育生長密切相關的miRNA[6]。Huang等[7]研究發現降低miR-29c的表達,能顯著的抑制MCAO大鼠的腦梗死體積及細胞凋亡,但是其具體作用機制未知。所以本研究將以miR-29c為研究對象,探討miR-29c在大鼠MCAO中的神經保護作用及相關機制。
1 材料和方法
1.1 動物
48只雄性SD大鼠實驗動物由山東大學實驗動物中心提供【SCXK(魯)2009-0001】,清潔級,(200±20)g,室內溫度控制在(23±2)℃,大鼠自由飲食和攝水。實驗所在實驗室:山東大學齊魯醫院臨床基礎研究所【SYXK(魯)2010-0038】。
1.2 主要試劑及儀器
BCA法蛋白定量試劑盒,Annexin V-FITC細胞凋亡檢測試劑盒,小鼠抗GAPDH單克隆抗體購自碧云天生物技術研究所;兔抗Bcl-2,Bax,Bak1,多克隆抗體購自美國Abcam公司;Caspase 3,Caspase 8,Caspase 9活性檢測試劑盒購自南京凱基生物技科技發展有限公司;SOD活力,MDA含量試劑盒購自南京建成生物技術有限公司;miR-29c inhibitor(UAACCGATTTCAAAUGGUGCUA)及miR-29c NC(CAGTACUUUUGUGUAGUACAAA),購自上海吉瑪生物技術有限公司。電泳儀,轉印電泳儀,凝膠成像系統購自美國Bio-Rad公司;酶標儀購自瑞士瑞士TECAN集團公司;流式細胞儀購自美國BD公司。
1.3 分組及給藥[7]
將48只大鼠分為假手術組,模型組,miR-29c NC組,miR-21 inhibitor組。將miR-29c inhibitor及miR-29c NC溶解于人工腦脊液中,濃度為20 μmol/L,進行側腦室注射,注射速度為1 μL/min,總共5 μL。而假手術組及模型組用同樣方式給予人工腦脊液,給藥24 h后除假手術組外其余三組皆進行造模。1.4 造模[8-9]
參相關文獻將制成大腦中動脈阻塞(MCAO)模型,10%水合氯醛麻醉大鼠,使大鼠處于仰臥位,并正中切開大鼠頸部的皮膚,鈍性的將兩側肌肉分離,并進一步分離出右頸總動脈(CCA),右頸內動脈(ICA)及右頸外動脈(ECA),備線并結扎ECA及CCA,并用動脈夾夾住ICA遠端,同時在ECA近CCA處作一小切口,松開ICA的動脈夾,并將鈍性的尼龍線緩慢插入ECA,插入深度約為18 mm,實現大腦中動脈阻塞導致腦缺血,最后消毒并縫合皮膚,另外外留尼龍線線頭約1 cm。缺血2 h后,將尼龍線輕提,使線頭略有阻力,血流再通,以實現再灌注22 h。假手術組僅僅分離ECA,CCA及ICA,但不結扎CCA。
1.5 神經行為學評分[1]
于術后24 h,參考Zea Longa的5分制評分標準對各組大鼠進行神經功能評分。0分:沒有出現神經損傷癥狀;1分:左側前爪不能完全伸展;2分:向左側轉圈行走;3分:行走時向左側傾倒;4分:不能夠自發行走,同時意識喪失。
1.6 梗死體積測定
于術后24,將各組大鼠麻醉,并迅速斷頭取腦,將腦組織周圍小腦,嗅球等去除。對全腦進行切片,厚度約2 mm,立即浸入2%氯化三苯基四氮唑(TCC),置于37℃溫箱中避光染色30 min,染成紅色的是正常的腦組織,染成白色的梗死的腦組織。最后在10%甲醛中固定,并拍照。用Image-Pro Plus 6.0軟件進行分析計算腦梗死體積,并乘以腦片厚度2 mm,累計每只大鼠所有腦切片的腦梗死容積即得全腦梗死容積,并計算腦梗死體積百分比(brain infarct volume percentage,BIVP)。
1.7 RT-PCR檢測miR-29c表達
采用Trizol法抽提細胞總RNA,接著一步法RT-PCR逆轉錄,逆轉錄產物用于瓊脂糖凝膠電泳。引物由上海生工生物工程有限公司合成,如下:miR-29c 5’-UAGCACCAUUUGAAAUGGUUA-3’。反轉錄體系為:總RNA模板2 μL(1 μg)、dNTP混合物2 μL、MgCl22 μL、加EDPC補充蒸餾水至25 μL。反應參數為:95℃預變性 5 min, 95℃變性30 s,58℃退火30 s,72℃延伸30 s,循環次數為40。
1.8 SOD活性及MDA含量的檢測
取缺血側大腦組織進行勻漿,按照SOD活力,MDA含量試劑盒說明書進行檢測。
1.9 流式細胞術檢測缺血側腦細胞凋亡情況
取缺血側大腦組織進行勻漿,并用胰酶和膠原酶進行消化,獲得細胞懸液后,按照Annexin V-FITC流式細胞檢測試劑盒進行檢測,在1 h內進行流式細胞儀檢測。
1.10 Caspase 3,Caspase 8,Caspase 9活性的檢測
取缺血側大腦組織進行勻漿,按照Caspase 3,Caspase 8,Caspase 9活性試劑盒說明書進行檢測。
1.11 caspase 3, cleaved caspase 8,cleaved caspase 9,Bak1,Bax及Bcl-2蛋白的檢測
采用Western blot技術進行檢測。取缺血側大腦組織進行勻漿,并加入RIPA強裂解液,裂解,離心,收獲蛋白。采用BCA試劑盒檢測蛋白濃度。蛋白變性,上樣,進行十二烷基磺酸鈉凝膠電泳,濕法轉膜。一抗孵育,4℃過夜;二抗室溫孵育1-2 h。在凝膠成像系統中曝光。用“Quantity one”軟件分析各抗體條帶灰度值。
1.12 數據分析
2 結果
2.1 miR-29c inhibitor對MCAO大鼠腦組織中miR-29c表達量的影響
如圖1所示,與假手術組比較,模型組及miR-29c NC組大鼠腦組織中miR-29c表達量顯著提高,差異具有統計學意義(P<0.01);與模型組及miR-29c NC組比較,miR-29c inhibitor組大鼠腦組織中miR-29c表達量顯著降低,差異具有統計學意義(P<0.01)。
2.2 miR-29c inhibitor對MCAO大鼠神經行為評分的影響
如表1所示,與假手術組比較,模型組及miR-29c NC組大鼠神經行為評分均顯著提高,差異具有統計學意義(P<0.01);與模型組及miR-29c NC組比較,miR-29c inhibitor組大鼠神經行為評分顯著降低,差異具有統計學意義(P<0.01)。
2.3 miR-29c inhibitor對MCAO大鼠腦梗死體積的影響
如表1所示,與假手術組比較,模型組及miR-29c NC組大鼠腦梗死體積百分比均顯著增加,差異具有統計學意義(P<0.01);與模型組及miR-29c NC組比較,miR-29c inhibitor組大鼠腦梗死體積百分比顯著減少,差異具有統計學意義(P<0.01)。

注:A:假手術組;B:模型組;C:miR-29c NC組;D:miR-29c inhibitor組。與假手術組比較,**P<0.01;與模型組及miR-29c NC組比較,##P<0.01。
2.4 miR-29c inhibitor對MCAO大鼠腦組織中SOD活性,MDA含量的影響
如表2所示,與假手術組比較,模型組及miR-29c NC組腦組織中SOD活力降低,MDA含量提高,差異具有統計學意義(P<0.01);與模型組及miR-29c NC組比較,miR-29c inhibitor組腦組織中SOD活性提高,MDA含量降低,差異具有統計學意義(P<0.01)。
2.5 miR-29c inhibitor對MCAO大鼠腦缺血側細胞凋亡的影響
流式細胞儀結果顯示(見圖2),假手術組細胞凋亡率為1.95±1.12,模型組及miR-29c NC組細胞凋亡率顯著提高,分別為9.25±0.83、8.95±0.72,與假手術組相比,差異具有統計學意義(P<0.01);miR-29c inhibitor組細胞凋亡率為5.42±0.49,與模型組及miR-29c NC組比較,顯著降低,差異具有統計學意義(P<0.01)。
2.6 miR-29c inhibitor對MCAO大鼠腦組織中Caspase 3,Caspase 8及Caspase 9活性的影響
如表3所示,與假手術組比較,模型組及miR-29c NC組腦組織中Caspase 3,Caspase 8及Caspase 9活性提高,差異具有統計學意義(P<0.01);與模型組及miR-29c NC組比較,miR-29c inhibitor組腦組織中Caspase 3,Caspase 8及Caspase 9活性降低,差異具有統計學意義(P<0.01)。

注:A:假手術組;B:模型組;C:miR-29c NC組;D:miR-29c inhibitor組。
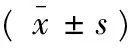
表1 miR-29c inhibitor對MCAO大鼠神經行為評分及腦梗死體積的影響Tab.1 Effect of miR-29c inhibitor on neurological behavior score and brain infarct volume percentage in MCAO rats
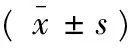
表2 miR-29c inhibitor對MCAO大鼠腦組織中SOD活性,MDA含量的影響Tab.2 Effect of miR-29c inhibitor on activity of SOD and level of MDA in MCAO rasts
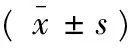
表3 miR-29c inhibitor對MCAO大鼠腦組織中Caspase 3,Caspase 8及Caspase 9活性的影響Tab.3 Effect of miR-29c inhibitor on activity of Caspase 3, Caspase 8 and Caspase 9 in MCAO rats brain tissue
2.7 miR-29c inhibitor對MCAO大鼠腦組織中cleaved caspase 3,cleaved caspase 8及cleaved caspase 9蛋白表達的影響
如圖3所示,與假手術組比較,模型組及miR-29c NC組腦組織中cleaved caspase 3,cleaved caspase 8及cleaved caspase 9蛋白表達量顯著提高,差異具有統計學意義(P<0.01);與模型組及miR-29c NC組比較,miR-29c inhibitor組腦組織中cleaved caspase 3,cleaved caspase 8及cleaved caspase 9蛋白表達量降低,差異具有統計學意義(P<0.01)。

注:A:假手術組;B:模型組;C:miR-29c NC組;D:miR-29c inhibitor組。與假手術組比較,**P<0.01;與模型組及miR-29c NC組比較,##P<0.01
2.8 miR-29c inhibitor對MCAO大鼠腦組織中Bak1,Bax及Bcl-2蛋白表達的影響
如圖4所示,與假手術組比較,模型組及miR-29c NC組腦組織中Bak1,Bax表達量顯著提高,Bcl-2表達量顯著降低,差異具有統計學意義(P<0.01);與模型組及miR-29c NC組比較,miR-29c inhibitor組腦組織中Bak1,Bax表達量顯著降低,Bcl-2表達量顯著提高,差異具有統計學意義(P<0.01)。

注:A:假手術組;B:模型組;C:miR-29c NC組;D:miR-29c inhibitor組。與假手術組比較,**P<0.01;與模型組及miR-29c NC組比較,##P<0.01。
3 討論
腦缺血后再恢復血供的過程中,腦血管微環境中會產生大量的損害因子,如氧自由基,這些氧自由基會損傷腦組織細胞生物膜結構,損傷線粒體DNA,損害細胞核DNA,使細胞內蛋白質及DNA大分子斷裂,從而誘發神經細胞啟動凋亡程序。所以發現一種有效的清除清除氧自由基,進而抵抗細胞損傷的物質將對腦缺血再灌注損傷后的神經保護具有重要作用[2-3]。
miR-29c是miR-29家族的一員,是Lagos-Quintina等在2003年研究神經細胞核糖核蛋白中發現的,并克隆獲得的miRNA。miR-29c位于人類1號染色體,在大鼠胚胎及出生時尚未見表達,在出生2周后表達增高,說明該miRNA在神經細胞中的特異性存在與表達, 并與胚胎神經的發育,生長,分化密切相關[6]。另外Shen等[10]研究顯示miR-29a,miR-29b及miR-29c在缺血再灌注損傷中異常表達,表達量差異最大的miRNA是miR-29c。Huang等[7]研究進一步表明往MCAO大鼠腦側左室注射miR-29c inhibitor或者miR-29c mimics,前者能夠降低腦梗死體積及細胞凋亡率,后者加重了腦缺血再灌注損傷。從而說明miR-29c與腦缺血再灌注損傷的關系密切。
本研究首先建立大鼠MCAO模型,并側腦室注射miR-29c inhibitor進行干預,接著于術后24 h檢測各組大鼠神經學行為評分,腦梗死體積及缺血側腦組織細胞凋亡情況,結果表明miR-29c inhibitor能顯著降低大鼠神經學行為評分,減小腦梗死體積,并抑制細胞凋亡,與Huang等[7]研究結果一致。同時MDA是細胞膜脂質被活性氧氧化后的副產物,是細胞遭受氧化應激損傷的生物標志物。SOD是細胞內主要的抗氧化酶,是清除氧自由基的主要物質,能抵抗氧自由基對細胞的損傷。所以本研究繼續探討miR-29c對MCAO大鼠腦組織中MDA含量及SOD活性的影響,結果表明miR-29c inhibitor能顯著的提高SOD活性,降低MDA含量,從而說明miR-29c inhibitor能清除腦缺血再灌注損傷所產生的氧化應激產物,并提高抗氧化酶活性。
腦神經細胞的凋亡是細胞主動有序的自然死亡形式,其發生可能與組織中抗凋亡和促凋亡基因的表達失衡有關。其中Bcl-2家族是目前研究最為廣泛的凋亡調控基因家族,Bcl-2是最常見的抑制凋亡基因,能與促凋亡基因Bax形成異源二聚體,或者Bax自身能形成二聚體,從而調控細胞的凋亡。而Bak1也是Bcl-2家族促凋亡蛋白的一員,能與Bax形成復合物,從而維持線粒體膜的穩定性,當上游凋亡信號傳遞下來后,Bak1能夠介導線粒體膜孔開放,使得線粒體中的細胞色素C釋放,并誘導Caspase信號級聯反應,最終使得細胞凋亡。Caspase正常情況下以無活性酶原形式存在于細胞內,激活主要通過以下2條信號通路[11-13]:(1)內源性途徑:細胞色素C從線粒體釋放到胞質后與dATP、凋亡蛋白酶激活因子(Apaf-1)結合成復合物,激活caspase 9,從而激活caspase 3;(2)外源性途徑:Fas膜受體系統激活caspase 8,從而直接激活caspase 3,這條途徑繞過了線粒體。當受到上游凋亡信號刺激時,Caspase的起始因子caspase 8及caspase 9被其它激酶所剪切或者自身發生切割作用后被激活,從而傳遞凋亡級聯信號,最終傳遞到caspase家族的執行因子caspase 3,最終導致細胞凋亡[11-13]。此外Huang等[7]研究證實Bak1是miR-29c的下游靶蛋白之一。Tiao等[14]研究表明miR-29c能通過下調Bax表達,上調Bcl-2表達,從而抑制阻塞性黃恒導致的肝細胞凋亡。Wang等[15]研究表明miR-29 inhibitor通過抑制Caspase 3表達,從而減輕長時間低溫循環導致的腦神經損傷。所以本研究繼續探討miR-29c對MCAO大鼠腦組織中caspase 3,caspase 8,caspase 9活性,cleaved caspase 3,cleaved caspase 8、cleaved caspase 9及Bax,Bcl-2、Bak1蛋白的表達,結果表明miR-29c inhibitor能顯著的上調Bcl-2表達,并降低cleaved caspase 3,cleaved caspase 8及cleaved caspase 9蛋白的表達,說明miR-29c inhibitor能通過調控細胞凋亡相關蛋白表達,同時抑制細胞內源和外源促凋亡通路共同抑制caspase 3的激活,從而抑制腦缺血再灌注損傷所導致的腦細胞凋亡。
[1] 閔昱源,馮彩華,高子軍,等.梓醇對大鼠腦缺血再灌注損傷的保護作用研究[J].現代生物醫學進展,2012,12(20):3805-3808.
[2] 王富明,徐虹,孫華.腦缺血再灌注損傷治療的實驗研究進展[J].醫學研究雜志,2015(02):12-15.
[3] 王光勝,耿德勤.腦缺血/再灌注損傷機制研究進展[J].醫學綜述,2011(24):3753-3756.
[4] Jeyaseelan K, Lim KY, Armugam A. MicroRNA expression in the blood and brain of rats subjected to transient focal ischemia by middle cerebral artery occlusion [J]. Stroke, 2008, 39(3): 959-966.
[5] Dharap A, Bowen K, Place R,etal. Transient focal ischemia induces extensive temporal changes in rat cerebral microRNAome [J]. J Cereb Blood Flow Metab, 2009, 29(4): 675-687.
[6] 黃昌發,劉小珊.微RNA miR-29與人類疾病[J].生命的化學,2010,30(2):250-255.
[7] Huang LG, Li JP, Pang XM,etal. MicroRNA-29c Correlates with Neuroprotection Induced by FNS by Targeting Both Birc2 and Bak1 in Rat Brain after Stroke [J]. CNS Neurosci Ther, 2015, 21(6): 496-503.
[8] 王榮亮,趙海蘋,羅玫,等.遠程缺血后適應對大鼠腦缺血再灌注損傷后MIP-1α表達的影響[J].中國比較醫學雜志,2013,23(8):24-29.
[9] 曾兆祿,韓繼超,薛云,等.針刺結合丹紅注射液對大鼠腦缺血再灌注損傷的保護作用[J].中國比較醫學雜志,2016,26(2):62-66.
[10] Shen B, Zhou S, He Y,etal. Revealing the underlying mechanism of ischemia reperfusion injury using bioinformatics approach [J]. Kidney Blood Press Res, 2013, 38(1): 99-108.
[11] 劉曉婷,王延讓,張明.線粒體介導細胞凋亡的研究進展[J].環境與健康雜志,2013,30(2):182-185.
[12] 王力儉,田可川,吳偉偉,等.細胞凋亡信號傳導通路的研究進展[J].中國畜牧獸醫,2011,38(10):132-135.
[13] 梁凱,曹秉振.線粒體調控的細胞凋亡研究進展[J].生物醫學工程與臨床,2014,18(5):501-505.
[14] Tiao MM, Wang FS, Huang LT,etal. MicroRNA-29a protects against acute liver injury in a mouse model of obstructive jaundice via inhibition of the extrinsic apoptosis pathway [J]. Apoptosis, 2014, 19(1): 30-41.
[15] Wang Y, Gu T, Shi E,etal. Inhibition of microRNA-29c protects the brain in a rat model of prolonged hypothermic circulatory arrest [J]. J Thorac Cardiovasc Surg, 2015, 150(3): 675-684.
The mechanism and protective effect of miR-29c on cerebral ischemia-reperfusion injury in rats
YE Bei1,LI Man2,CHEN Jian-zhen1,HE Fang1,ZHANG Liguang1
(1.Suzhou Health College of Jiangsu, Jiangsu Soochow 215009, China;2.Qilu Hospital of Shandong University, Jinan 250012, China)
Obejective To explore protective effect of miR-29c on cerebral ischemia-reperfusion injury in rats. Methods Forty eight SD rats were randomly divided into sham group, model group, miR-29c NC group and miR-29c inhibitor group. Except the sham operation group, the other three groups were established by using ligation of middle cerebral artery. Twenty four hours after the operation, neurological behavior score, cerebral infarction volume, cell apoptosis, the activity of superoxide dismutase (SOD), the content of malondialdehyde (MDA), cysteine aspartic acid protease 3 (caspase 3), caspase 8, caspase 9, and the expression of miR-29c, Bcl-2, Bax, Bak1, cleaved caspase 3, cleaved caspase 8 and cleaved caspase 9. Results Compared with sham group, neurological behavior score, cerebral infarction volume, cell apoptosis rate was increased, SOD th the expression of miR-29c, activity was decreased, the level of MDA, caspase 3, caspase 8 and caspase 9 activity was increased. The expression of Bcl-2 was down-regulated, the expression of Bax, Bak1, cleaved caspase 3, cleaved caspase 8 and cleaved caspase 9 expression was up-regulated in model group, miR-29c NC group. The differences were also statistically significant (P<0.01). Compared with model group, miR-29c NC group, the expression of miR-29c, neurological behavior score, cerebral infarction volume percentage, cell apoptosis rate was decreased, SOD activity was increased, the level of MDA, caspase 3, caspase 8 and caspase 9 activity was decreased. The expression of Bcl-2 was up-regulated, the expression of Bax, Bak1, cleaved caspase 3, cleaved caspase 8 and cleaved caspase 9 expression was down-regulated in miR-29c inhibitor group. The differences were also statistically significant (P<0.01).Conclusion miR-29c had a protective effect on cerebral ischemia-reperfusion injury in rats, which was related to improve the antioxidant capacity and regulation of apoptosis related protein expression.
miR-29c; cerebral ischemia-reperfusion; cell apoptosis
葉蓓(1979-),女,生理學碩士,講師。研究方向:哺乳動物中樞神經系統損傷的分子機制及保護作用。E-mail: 150795306@qq.com。
R-332
A
1671-7856(2016)11-0031-07
10.3969.j.issn.1671-7856. 2016.11.006
2016-07-12

