大米活性肽對H2O2誘導HUVEC氧化損傷的保護作用研究
梁 盈 王 榮 田明慧 黃 萍 蔣 鵬 吳 偉 林親錄
(稻谷及副產物深加工國家工程實驗室;中南林業科技大學,長沙 410004)
大米活性肽對H2O2誘導HUVEC氧化損傷的保護作用研究
梁 盈 王 榮 田明慧 黃 萍 蔣 鵬 吳 偉 林親錄
(稻谷及副產物深加工國家工程實驗室;中南林業科技大學,長沙 410004)
觀察和分析了RBP處理前后對氧化損傷的HUVEC細胞生長、凋亡及超微結構的影響。MTT檢測結果顯示:RBP保護組與正常對照組生長狀況相似、生長趨勢相同、增殖能力相當。HE染色結果顯示:RBP保護組細胞形態與正常對照組細胞形態相似,整體完整性較好,細胞形態及分布規則,細胞數較多,與損傷組比較保護作用明顯;細胞凋亡流式檢測結果顯示:損傷組凋亡率為93.7%,RBP保護組的細胞存活率占72.6%,比H2O2損傷組細胞存活率高出66.6%,保護作用明顯;掃描電鏡結果顯示:RBP保護組細胞損傷程度降低,完整性較好,胞間連接緊密,說明RBP對氧化損傷的HUVEC細胞有很好的保護作用。RBP在體外對H2O2誘導的HUVEC細胞氧化損傷有一定的保護作用。
大米活性肽 過氧化氫 人臍靜脈血管內皮細胞 保護作用
大米是世界上主要糧食作物之一,全球生產量極大,全世界一半以上、我國三分之二以上的人口以大米為主食。因此,大米蛋白是人類膳食中重要的蛋白源之一[1]。大米加工過程的副產物米渣,其蛋白質的質量分數在40%以上,其組成與大米蛋白相似[2],國外非常重視大米及其加工過程中產生的副產物的開發利用,并生產出了附加值很高的營養保健食品和化妝品[3-4]。近年來,國內也將此作為研究熱點,其進展較快,已有多種來源于大米蛋白的具有不同功能的大米活性肽(Rice Bioactive Peptide,RBP)[2-3]得到確認,其中經水解制備RBP的方法有少量報道[4-8],但僅在工藝方面有一定的研究,而對活性肽在分子、細胞、蛋白水平等方面的研究卻鮮有報道。本課題組近年來一直致力于研究RBP的抗氧化作用及對人臍靜脈血管內皮細胞(Human Umbilical Vein Endothelial Cell,HUVEC)增殖的影響[6,9-11]。H2O2是體內常見的正常代謝生成的活性氧,一定濃度的H2O2可以導致心肌細胞、紅細胞、肝細胞、內皮細胞和T細胞的氧化應激反應[12-13],進而使得HUVEC細胞受損。受損的內皮細胞是多種心血管疾病的共同病理生理學基礎,也是動脈粥樣硬化觸發的早期重要事件[14-15],因此保護內皮細胞功能,抑制內皮細胞凋亡是防治心血管疾病研究重點之一。本試驗在之前本課題組已篩選出的H2O2誘導HUVEC氧化損傷模型的最佳處理濃度、時間及RBP的最佳保護濃度、時間的基礎上[11],重復試驗得到相似生長曲線后,通過對細胞形態、凋亡及細胞表面超微結構的觀察測定,進一步在細胞功能水平上驗證了RBP對HUVEC的抗氧化作用,為將大米活性肽開發成抗氧化性功能因子或保健因子添加劑及多肽類藥物提供參考。
1 材料與方法
1.1 細胞系
人臍靜脈血管內皮細胞:湖南省長沙贏潤生物技術有限公司。
1.2 大米活性肽
課題組前期從米渣蛋白中分離鑒定出部分抗氧化活性肽[5,9],鑒定出一條氨基酸序列Lys-His-Asn-Arg-Gly-Asp-Glu-Phe,考慮到細胞體外培養對試驗過程中體系和操作的特殊條件[16],選用上海強耀公司生產的多肽作為試驗樣品(Lys-His-Asn-Arg-Gly-Asp-Glu-Phe),其氨基酸組成、排列順序等與本課題組分離出的米渣抗氧化活性肽基本一致。
1.3 試劑與儀器
二甲基亞砜(DMSO)、四氮唑藍(MTT)、胰蛋白酶、抗壞血酸(VC):Sigma公司;RPMI-1640培養基:Gibco公司;叔丁醇、戊二醛、H2O2、無水乙醇、Na2HPO4、KH2PO4、二甲苯:國藥集團化學試劑;胎牛血清:四季青生物工程有限公司;青、鏈霉素雙抗:中諾藥業有限公司;CO2培養箱:上海博訊醫藥設備廠;XDS-10型倒置顯微鏡:上海團結儀器制造有限公司;YDS-30B-125液氮罐:成都市金鳳液氮容器有限公司;HD-3型酶標儀:上海滬西儀器廠;YX280B高壓滅菌鍋:上海三申醫療儀器有限公司;JSM-6380LV型掃描電鏡:日本電子JEOL公司;FC500型流式細胞儀:貝克曼庫爾特有限公司。
1.4 RBP處理前后氧化損傷HUVEC生長曲線的測定[12]
試驗分組[11]:取3~5代對數生長期內且生長融合成單層的細胞[17],隨機分為6組(前期試驗已確定H2O2誘導HUVEC氧化損傷模型的最佳處理濃度、時間及RBP的最佳保護濃度、時間[11])。
1.5 大米活性肽對氧化損傷HUVEC細胞HE染色觀察檢測
將對數生長期的細胞接種在放有蓋玻片的6孔培養板中,按分組要求處理細胞。48 h后取出長有細胞的蓋玻片,Bouin’s固定液中固定過夜,乙醇脫色后加入蘇木素染色5~10 min,加入分化液分色5~10 s,流水沖洗,1%氨水返藍,50%~90%梯度乙醇溶液脫水,加入伊紅染色3~5 min,二甲苯透明,中性樹脂封片,顯微鏡觀察細胞形態變化,并進行拍照,保存[18]。
1.6 大米活性肽對氧化損傷HUVEC細胞凋亡流式檢測
取對數生長期的細胞消化制成105個/mL的細胞懸液至六孔板中,按分組處理,72 h后終止培養。1 mL 預冷PBS重懸,500 r/min,4 ℃離心5 min,傾出上清液加入100 μL預冷的Annexin V Binding Buffer,重懸細胞,再加入5 μL Annexin V-FITC和5 μL PI,室溫下避光反應15 min,加入400 μL預冷的Annexin V Binding Buffer,冰上避光放置,1 h內用流式細胞儀檢測[19]。
1.7 大米活性肽對氧化損傷HUVEC細胞掃描電鏡檢測
將對數生長期的細胞接種在放有蓋玻片的6孔培養板中,按分組要求處理細胞。48 h后取出長有細胞的蓋玻片,2.5%戊二醛于4 ℃固定2 h。50%~95%梯度乙醇脫水,通風廚內用叔丁醇置換出乙醇,將樣品放入臨界點干燥儀內進行干燥,掃描電鏡拍照保存[20-21]。
1.8 統計處理
各項試驗均操作3次。數據使用SPSS 統計分析軟件(17.0中文版)分析,均數±標準差表示(x±s)。多組間均數比較采用單因素方差分析(one-way ANOVA),各組間兩兩比較采用SNK-q檢驗。P<0.05 為差異有統計學意義,P<0.01為差異有顯著性意義。
2 結果與分析
2.1 RBP處理前后氧化損傷HUVEC的生長曲線
正常對照組細胞長勢良好,呈現“S”趨勢,大米活性肽、VC對照組細胞與正常對照組生長狀況相似,生長趨勢相同;H2O2損傷組細胞較對照組細胞出現明顯的生長抑制,48 h時抑制率達到54.4%;大米活性肽保護組、VC保護組細胞隨時間推移,細胞活力較損傷組顯著提高,48 h分別較損傷組存活率提高了81.9%、90.0%。說明大米活性肽表現出與VC能力相當的抗氧化保護活性,且對正常細胞生存活力沒有影響,可以相同濃度進行后續試驗。
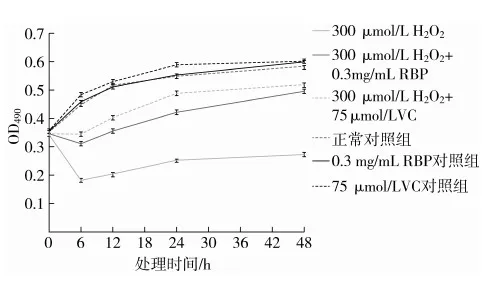
圖1 大米活性肽對氧化損傷 HUVEC 細胞生存活力的影響
2.2 RBP對氧化損傷HUVEC細胞HE染色觀察檢測
在不同處理液培養48 h后,正常對照組細胞形狀規則,呈現HUVEC典型細胞形態,梭狀、橢圓形,細胞邊緣清晰可見且透亮,細胞鋪展,胞內細胞器豐富,分布均勻,整體結構比較成熟,核質分區明顯,表現出典型的HE染色結果,質紅核藍,有多個核仁,核仁清晰,排列有序(圖2a)。RBP對照組細胞狀態與正常對照組基本一致,細胞內部核仁清晰可見且質紅核藍,細胞生長狀況良好(圖2b)。H2O2氧化損傷組細胞膜破裂,細胞形狀不規則,細胞形態發生了明顯變化,呈現出損傷狀態,且數目明顯減少,細胞拉長皺縮,胞內細胞器模糊不清,胞內物質外溢,呈極性狀;核藍可觀察到,但核質辨別不清;胞內的各種細胞器數量明顯減少,形狀改變,排列不規則,細胞核變小,核仁不清晰且數目減少;細胞質皺縮、拉長,HE染色較深(圖2c)。RBP保護組細胞形態與正常對照組細胞形態相似,整體完整性較好,細胞較成熟,雖然也有損傷但細胞膜完整,可看到核藍質紅,細胞器分布及形態規則,細胞數目較多,與損傷組比較保護作用明顯(圖2d)。
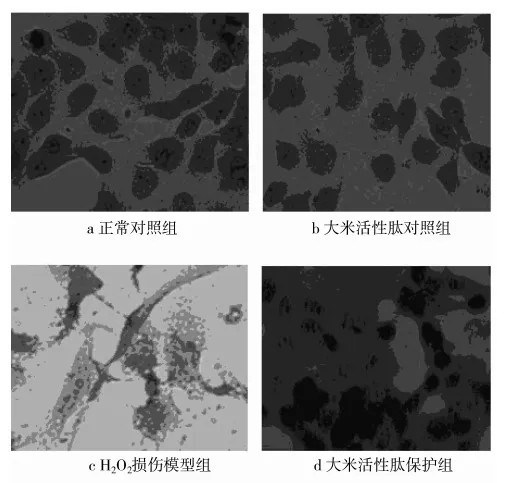
圖2 不同處理組細胞形態結構 (×200)
2.3 RBP對氧化損傷HUVEC細胞凋亡流式檢測
Annexin V檢測細胞凋亡的原理是,將Annexin V 經過綠色熒光FITC探針標記,正常細胞內與Annexin V反應的磷脂酰絲氨酸只分布于細胞膜的磷脂雙分子層內部,因此,如果是長勢良好的正常細胞是不會被FITC所標記的,即通過流式細胞儀檢測正常細胞處于左下象限,而當細胞受到損傷,細胞發生破裂時,細胞質膜內的磷脂酰絲氨酸向外翻出,立即與熒光染料結合,因此早期凋亡細胞分布在右下象限。PI是一種核酸染料,它不能穿過完整的細胞膜,但是可以通過壞死或者晚期凋亡的細胞膜而對細胞核進行染色,因此晚期凋亡到壞死細胞分布在左上象限。RBP對氧化損傷HUVEC細胞凋亡流式檢測結果顯示,在正常對照組和RBP對照組中細胞存活率較高,分別達到90.1 %、90%(圖3a、3b);而H2O2損傷組細胞存活率很低,僅有6.0 %,而晚凋壞死細胞占93.7%(圖3c),壞死率較高一部分是由于H2O2處理時間過長引起的,但絕大部分是由于H2O2對HUVEC產生了氧化損傷導致的;RBP保護組的細胞存活率占72.6%,比H2O2損傷組細胞存活率高出66.6 %,且晚期細胞凋亡數量明顯減少,僅占27.3 %,可以看出RBP保護作用明顯(圖3d)。
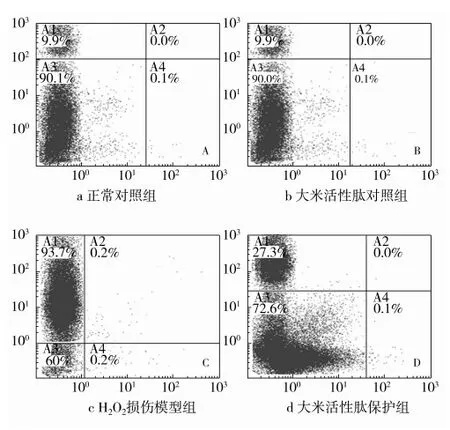
圖3 大米活性肽對氧化損傷HUVEC凋亡的檢測
2.4 大米活性肽對氧化損傷HUVEC細胞掃描電鏡檢測
掃描電鏡結果顯示,在300倍的視野范圍內,正常對照組與大米活性肽對照組細胞數量大致相同,數目較多,氧化損傷組數目明顯減少,大米活性肽保護組細胞數量介于這兩者之間。在2 000倍視野中的掃面圖片如圖4顯示,細胞處于正常生長狀態時,細胞平鋪,細胞連絲豐富,細胞生長旺盛(圖4a);氧化損傷組細胞整個細胞處于破裂狀態,細胞有凋亡小體流出,細胞間連接松散,胞間間隙較大,細胞解體,處于明顯損傷狀態(圖4c);大米活性肽對照組與正常對照組結果相似,細胞生長良好,胞間連接緊致,細胞生長狀況良好(圖4b);大米活性肽保護組雖然細胞有損傷但是完整性較好,細胞間連接也較緊密(圖4d),掃描電鏡觀察的結果直觀,說明了大米活性肽對氧化損傷的HUVEC細胞有很好的保護作用。
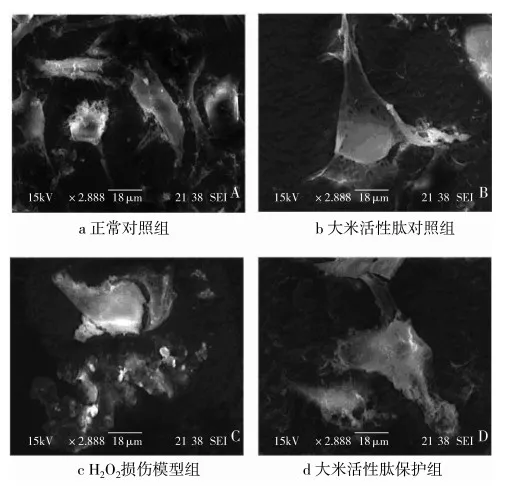
圖4 RBP對氧化損傷HUVEC細胞掃描電鏡檢測
3 討論
由于血管內皮細胞損傷在多種心血管疾病發生和發展過程中起著關鍵作用,對氧化損傷血管內皮細胞的保護作用成為近年來研究的熱點。楊麗娟[22]通過加入叔丁基氫過氧化物誘導HUVEC氧化損傷,損傷組的OD值為0.57±0.060,而加入50 mg/L的靈芝多糖肽保護組可減輕叔丁基氫過氧化物對HUVEC的氧化損傷,OD值達0.91±0.057;董靖[23]研究了護骨素對軟脂酸誘導血管內皮細胞凋亡的保護作用,發現與正常對照組相比,軟脂酸組HUVEC細胞活性明顯被抑制,流式細胞儀檢測顯示軟脂酸組HUVEC細胞凋亡率顯著增加,而加入護骨素后,其凋亡率明顯降低。本試驗重點研究了RBP在細胞水平的保護作用,從HE染色形態上觀察,可看出RBP保護組細胞保護作用明顯;從細胞凋亡流式檢測結果顯示:損傷組凋亡率為93.7%,RBP保護組的細胞存活率占72.6%,比H2O2損傷組細胞存活率高出66.6%,且晚期細胞凋亡數量明顯減少,僅占27.3%,保護作用明顯;掃描電鏡結果顯示:RBP保護組細胞損傷程度降低,完整性較好,胞間連接緊密,說明RBP對氧化損傷的HUVEC細胞有很好的保護作用。對于后續的體外蛋白水平(細胞全蛋白及核、質蛋白的提取及western blot分析)和分子水平(通過PCR擴增儀進行mRNA的損傷分析)的研究;以及對于體內過氧化損傷(建立動物樣本模型)的保護作用和機體免疫功能的研究也在進展中。通過更深入的對大米活性肽的功能和性質的研究工作,必將會為后續的開發利用,從而生產出有益功能性質的食品保健品、食品添加劑和多肽類藥物等產品做出成績。
[1]章海燕,王立,張暉. 大米蛋白研究進展[J]. 糧食與油脂,2010(4):4-6
Zhang Haiyan,Wang Li,Zhang Hui. Research progress in rice protein[J]. Grain and Oil,2010(4):4-6
[2]榮先萍. 米渣蛋白成分分析及蛋白提取研究[D]. 無錫:江南大學,2011
Rong Xianping.Study on component analysis and protein extraction of rice residue protein[D]. Wuxi:Jiangnan University,2011
[3]Sharif MK,Butt MS,Anjum FM,et al. Rice bran:a novel functional ingredient[J]. Crit Rev Food Sci Nutr,2014,54(6):807-16
[4]熊華. 米渣抗氧化肽的制備及特性研究[D]. 南昌:南昌大學,2010
Xiong Hua. Studies on the preparation and properties of antioxidant peptide from rice residue[D]. Nanchang:Nanchang University,2010
[5]吳衛國. 利用米渣制備大米肽的研究[D]. 長沙:湖南農業大學,2010
Wu Weiguo.The study of using rice residues to produce rice peptide[D]. Changsha:Hunan Agricultural University,2010
[6]史云麗. 酶法制備大米抗氧化活性肽的研究[D]. 長沙:中國林業科技大學,2011
Shi Yunli.Study on the Enzymatic Preparation of Rice Antioxidant Peptides[D]. Changsha:Central South University of Forestry and Technology,2009
[7]田蔚. 米渣霉菌發酵產物分離鑒定及抗氧化活性研究[D]. 長沙:湖南農業大學,2012
Tian Wei.Study on the isolation and identification of rice residue fermentation products from molds and its antioxidant property[D]. Changsha:Hunan Agricultural University,2012
[8]李綺麗,吳衛國. 大米抗氧化活性肽的研究進展[J]. 糧食加工,2010,35(4):43-45
Li Qili,Wu Weiguo.Research advance of rice antioxidation polypeptides[J]. Grain Processing,2010,35(4):43-45
[9]田蔚,林親錄,劉一洋. 米渣蛋白的提取及應用研究[J]. 糧食加工,2009,34(2):31-37
Tian Wei,Lin Qinlu,Liu Yiyang. Study on the extraction of rice residue proteins and application[J]. Grain Processing,2009,34(2):31-37
[10]申衍豪. 大米抗氧化活性肽的分離純化和性質研究[D]. 長沙:中南林業科技大學,2011
Shen Yanhao. Study on seperation and purification of rice antioxidantive peptides and its properties[D]. Changsha:Central South University of Forestry and Technology,2011
[11]梁盈,魯倩,方婧杰,等. 大米活性肽的抗氧化作用及其對HUVEC細胞增殖的影響[J]. 中國糧油學報,2014,29(7):1-6
Liang Ying,Lu Qian,Fang Jingjie,et al.The antioxidant effect and influence on HUVEC cell proliferation proliferation of rice bioactive peptide[J]. Journal of Chinese Cereal and Oils Association,2014,29(7):1-6
[12]Takajashi A,Hanson MG,et al. Preferential cell death of CD8+effector memory (CCR7-CD45RA-)Tcells by hydrogen peroxide-induced oxidative stress[J]. Immunologic,2005,174(10):6080-6087
[13]倪文澎,朱萱萱,王海丹,等. 黃精多糖對脂多糖(LPS)誘導人臍靜脈內皮細胞(HUVEC)損傷的保護機制研究[J]. 中華中醫藥學刊,2012,30(12):2644-2646
Ni Wenpeng,Zhu Xuanxuan,Wang Haizhou,et al.Research of polygonatum polysaccharide on the protective mechanism of LPS-Induced HUVEC injury[J]. Chinese Archives of Traditional Chinese Medicine,2012,30(12):2644-2646
[14]Bonomini F,Tengattini S,Fabian A,et al. Atherosclerosis and oxi-dative stress[J]. Histol Histopathol,2008,23(3):381-390
[15]Liu Q L,Xiao J H,Ma R,et al. Effect of 2,3,5,4’- tetra-hydroxystilbene-2-O-beta-D-glucoside on lipoprotein ox-ida-tion and proliferation of coronary arterial smooth cells[J]. J Asian Nat Prod Res,2007,9(8):689-697
[16]黃蘭蘭,石國慶,盧春霞. 影響動物細胞體外培養因素[J]. 黑龍江動物繁殖,2005,13(4): 16-18
Huang Lanlan,Shi Guoqing,Lu Chunxia.The factors affecting animal cells in vitro culture.[J]. Heilongiang Journalof Animal Reproduction,2005,13(4):16-18
[17]張臣,李形,侯躍龍,等. 人臍靜脈血管內皮細胞的高效分離與培養[J]. 天津醫藥,2010,38(7):605-607
Zhang Chen,Li Xing,Hou Yuelong,et al.Culture and isolation of human umbilical vein endothelial cells in vitro[J]. Tianjin Med J,2010,38(7):605-607
[18]何勝虎,張晶. 過氧化氫體外誘導人血管內皮細胞損傷與人參皂苷Rb1的保護效應[J]. 中國組織工程研究與臨床康復,2012,12(2):254-257
He Shenghu,Zhang Jing. Protective effects of panaxsaponin Rb1 on hydrogen peroxide-induced injury in human umbilical vein endothelial cells in vitro[J].Journal of Clinical Rehabilitative Tissue Engineering Research,2012,12(2):254-257
[19]郭春燕. 幾種中藥活性成分對H2O2誘導SH-SY5Y細胞氧化損傷的影響及其機制研究[D]. 石家莊: 河北醫科大學,2013
Guo Chunyan.Effects of active ingredients of chinese medicine on hydrogen peroxide-induced oxidative damage in SH-SY5Y cells[D].Shi jia zhuang:Hebei Medical University,2013
[20]劉博,路菊,江澈,等. RAW264.7巨噬細胞的掃描電鏡樣品制備與觀察[J]. 局解手術學雜志,2011,20(1):62-65
Liu Bo,Lu Ju,Jiang Che,et al.Preparation and observation of scanning electron microscopy specimen of RAW264.7 macrophages.[J]. Jreg Anat Oper Surg,2011,20(1):62-65
[21]邱寒梅. 乙醇對原代培養大鼠皮質神經細胞影響的掃描電鏡及CYP2E1、iNOS和NSE表達的研究[D]. 鄭州:鄭州大學,2011
Qiu Hanmei.A study on the influence of ethanol over the primary culture of rat cortical neuron by using the scanning electron microscopy and the expression of CYP2E1, iNOS and NSE[D]. Zhengzhou:Zhengzhou University,2011
[22]楊麗娟. 靈芝多糖肽對人臍靜脈內皮細胞氧化損傷的保護作用[D]. 福州:福建醫科大學,2010
Yang Lijuan.Protective effects of ganoderma lucidum polysaccharides peptide on human umbilical vein endothelial cells injury by reactive oxygen species[D]. Fuzhou:Fujian Medical University,2010
[23]董靖. OPG對軟脂酸誘導血管內皮細胞凋亡的保護作用及機制研究[D]. 廣州:南方醫科大學,2013
Dong Jing. The protective effects of OPG on apoptosis and its mechanisms in vascular endothelial cells induced by palmitic acid[D]. Guangzhou:Southern Medical University,2013.
The Protective Effects Research of RBP on Oxidative Damage in HUVEC Induced by H2O2
Liang Ying Wang Rong Tian Minghui Huang Ping Jiang Peng Wu Wei Lin Qinlu
(National Engineering Laboratory For Rice and By-Product Deep Processing;Center South University of Forestry and Technology, Changsha 410004)
This experiment observed and analyzed the influence of RBP on HUVEC cells growth which was damaged by H2O2growth, cycle and surface ultrastructure. The results of MTT test show the RBP protection group was similar to the normal control group in growth conditions, and growth tendency and multiplication capacity were the same. The results of HE staining showed that cellular morphology of the RBP protection group was similar, the overall integrity was good, cellular morphology and distribution were regular, and the number of cells was more compared with the he normal control group; the protection effects were obvious compared with the damage group. The results of flow cell apoptosis detection showed that the damage rate of oxidative damage group cells was 93.7%,however,the protection rate of RBP protection group cells was 72.6%.The results of scanning electron microscopy showed that RBP protection group was in a good integrity and integrity connections between cells were relatively close, and in a low damage rate. The results could directly showed that RBP on oxidative damage of HUVEC cells had good protection effects. The conclusion showsed that RBP could protect the HUVEC cells induced by oxidative damage of H2O2.
rice bioactive peptide, hydrogen peroxide, human umbilical vein endothelial cell, protective effect
TS201
A
1003-0174(2016)12-0001-06
國家自然科學基金(31201348/31571874),湖南省自然科學基金(13JJ4086),長沙市科技計劃(K140 3039-21),湖南省教育廳科學研究項目(12C0439)
2015-05-14
梁盈,女,1981年出生,副教授,分子營養學
林親錄,男,1966年出生,教授,稻谷深加工

