糖尿病腎病血液透析患者發生卒中的危險因素研究*
王新宇,何鳳,傅君舟
(廣州醫科大學附屬廣州市第一人民醫院腎內科,廣東 廣州 510180)
臨床論著
糖尿病腎病血液透析患者發生卒中的危險因素研究*
王新宇,何鳳,傅君舟
(廣州醫科大學附屬廣州市第一人民醫院腎內科,廣東 廣州 510180)
目的探討糖尿病腎病(DN)血液透析患者發生卒中的危險因素。方法選取2007年1月-2012年1月廣州市第一人民醫院、廣州軍區廣州總醫院及南昌大學第二附屬醫院的腎內科血液凈化中心收治的血液透析患者,根據患者有無合并DN病史,分為DN組及非DN組。主要終點事件是卒中,通過Cox回歸模型探討DN血液透析患者發生卒中的獨立危險因素。兩組間累積卒中事件采用Kaplan–Meier曲線分析。結果1 148例血液透析患者納入研究,平均隨訪時間23.8個月,最長隨訪時間72.0個月;DN組卒中發病率為63.5/1000人年,顯著高于非DN組的29.6/1 000人年。多因素分析發現,低血清白蛋白[HR=0.86(95%CI:0.76,0.97),P=0.011]是DN血液透析患者發生卒中的獨立危險因素。結論較低的血清白蛋白是DN血液透析患者發生卒中事件的獨立危險因素,該類患者應避免營養不良。
卒中;流行病學;糖尿病腎病;危險因素
終末期腎臟疾病(end-stage renal disease,ESRD)的全球發病率呈逐漸上升趨勢,血液透析(Hemodialysis,HD)已被廣泛應用于ESRD患者的治療[1]。心血管疾病(cardiovascular disease,CVD)是ESRD患者發生死亡的主要原因,占全因死亡的40%~50%[2]。卒中是ESRD患者心血管死亡的主要原因,在美國透析人群中,卒中是透析患者發生死亡的第2位病因[3-4]。美國和日本的研究報告顯示,透析患者的卒中風險比正常人群高2~10倍[5-6]。血液透析患者發生卒中危險因素有高血壓、糖尿病,動脈粥樣硬化,尿毒癥毒素,血管通路,以及體外使用抗凝治療等[7-8]。HERZOG等[9]研究表明,HD患者發生卒中相關的死亡率為未接受透析患者的3倍。大多數的研究都集中在探討血液透析患者發生卒中的風險。然而,目前關于糖尿病腎病(diabetic nephropathy,DN)血液透析治療患者卒中的發病率、危險因素的研究相對較少。本研究旨在探討合并DN的血液透析患者發生卒中的危險因素,現報道如下。
1 資料與方法
1.1 研究對象
選取2007年1月-2012年1月在廣州市第一人民醫院、南昌大學第二附屬醫院及廣州軍區廣州陸軍總醫院腎內科血液凈化中心進行規律血液透析治療的ESRD患者1 148例。ESRD的診斷符合中華醫學會腎臟病學分會編著的《臨床診療指南-腎臟病學分冊》的診斷標準。根據入組時是否合并DN分為DN組和非DN組。
DN組:選擇ESRD患者190例,占納入患者的16.6%,平均年齡(60.1±11.1)歲。其中,男性107例(56.3%),女性83例(43.7%);隨訪6~72個月,平均為23.8個月。非DN組:選擇ESRD患者958例,占納入患者的83.4%,平均年齡(46.0±15.5)歲。其中,男性566例(59.1%),女性392例(40.9%);隨訪6~72個月,平均23.8個月。上述患者均簽署知情同意書。
1.2 納入標準
①ESRD的診斷符合中華醫學會腎臟病學分會編著的《臨床診療指南-腎臟病學分冊》的診斷標準:有或無慢性腎臟病史;腎小球濾過率或估算腎小球濾過率(estimated glomerular filtration rate,eGFR)<15 ml/(min·1.73 m2)。②年齡≥18歲。③正在接受規律血液透析或既往曾行腹膜透析治療,但近期血液透析時間≥3個月。④患者近3個月未行外科手術治療。⑤簽訂知情同意書,且能跟蹤隨訪者。
1.3 排除標準
①近3個月行手術治療的患者。②合并嚴重肝損害(Child-Paugh改良分級C級)、心力衰竭、呼吸衰竭、重癥感染及惡性腫瘤者(見表1)。
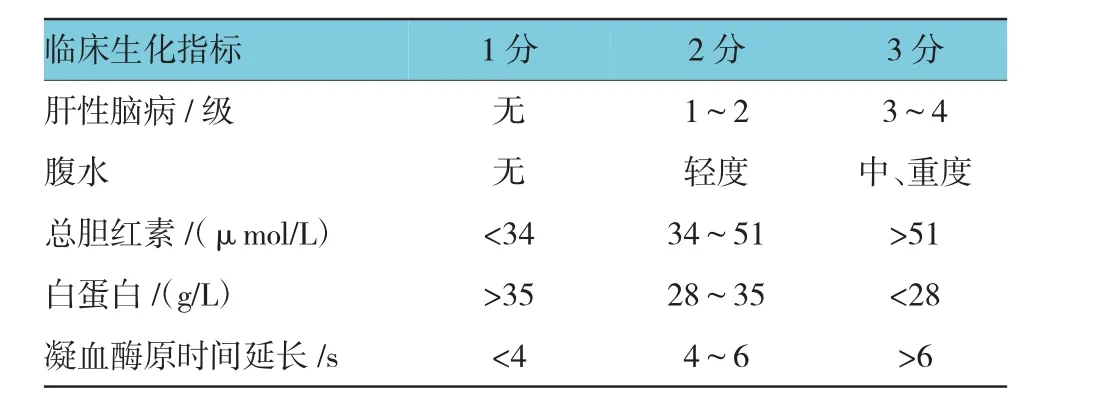
表1 肝功能Child-Paugh改良分級標準
1.4 實驗方法
1.4.1 血液透析ESRD患者接受2~3次/周,4~5h/次的規律血液透析。透析血流量200~300ml/min,所選透析液為碳酸氫鹽透析液,透析液溫度35.5~36.5℃,透析液流量500 ml/min,透析液含鉀離子濃度2.0 mmol/L、鈉離子濃度138 mmol/L、鈣離子濃度1.25~1.50 mmol/L。低分子肝素及普通肝素的選擇根據凝血功能判斷。
1.4.2 分組及研究方法分為DN組和非DN組(根據ESRD患者入組時是否合并DN)。收集入組時患者的人口學統計資料、腎功能、肝功能、血常規、血電解質、血壓、血清C反應蛋白(C-reactive protein,CRP)及eGFR等檢查結果。
1.5 統計學方法
采用SPSS 16.0統計軟件進行數據分析,計量資料以均數±標準差(x±s)表示,四分位數表示不符合正態分布的計量資料用秩和檢驗;正態分布的用t檢驗。計數資料以率表示,用χ2檢驗,兩組比較差異有統計學意義的實驗室數據及基線資料納入多因素Cox回歸模型分析。對兩組的累積卒中發生率采用壽命表。使用Poisson模型分析時間軸的發病率數據。對DN血液透析患者發生卒中的危險因素用Cox回歸分析。采用Cox回歸分析和Kaplan-Meier曲線兩組間累積的卒中發生率,P<0.05為差異有統計學意義。
2 結果
2.1 基線資料
符合本研究納入標準的患者共1 148例,年齡(48.34±15.78)歲,其中女性占41.4%,男性占58.6%。最短隨訪時間為6.0個月,最長隨訪時間為72.0個月,平均23.8個月。根據ESRD患者是否合并DN,分為DN組和非DN組。N組與非DN組患者相比較,DN組患者年齡較大,有高血壓(Hypertension,HP)和冠狀動脈粥樣硬化性心臟病(coronary heart disease,CHD)病史的患者比例比非DN組高,卒中的發病率也更高。DN組具有較高的BMI、eGFR、CRP,且平均動脈壓(mean arterial pressure,MBP)、舒張壓(diastolic blood pressure,DBP)及血清白蛋白(Albumin,ALB)水平較低。見表2。
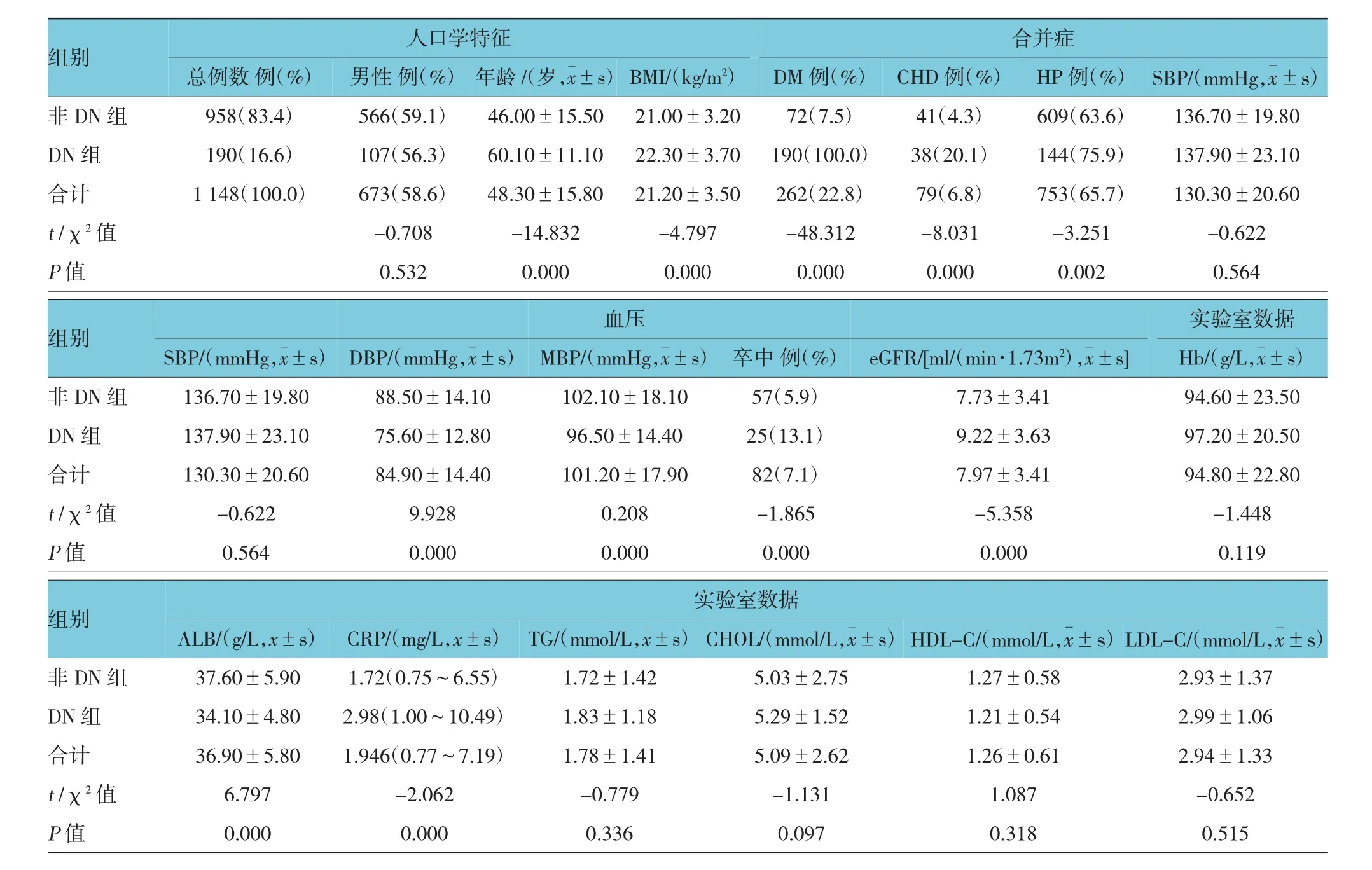
表2 兩組患者的基線資料比較
2.2 兩組患者的累積卒中發生率
在本研究中發生卒中的血液透析患者82例(7.1%),其中非DN組57例(13.1%),DN組25例(5.9%);非DN組卒中發病率為29.6/1 000人年,DN組卒中發病率為63.5/1 000人年,卒中在總體人群中的發病率為36.1/1 000人年。DN組較非DN組有更高的卒中發病率(P=0.001);非DN組第1年的累積卒中發病率為3%,第3年為10%,第5年為18%,DN組的第1年的累積卒中發病率為5%,第3年為19%,第5年為34%;DN組較非DN組的累積卒中發病率更高(Logrankχ2=10.584,P=0.001)。見附圖。
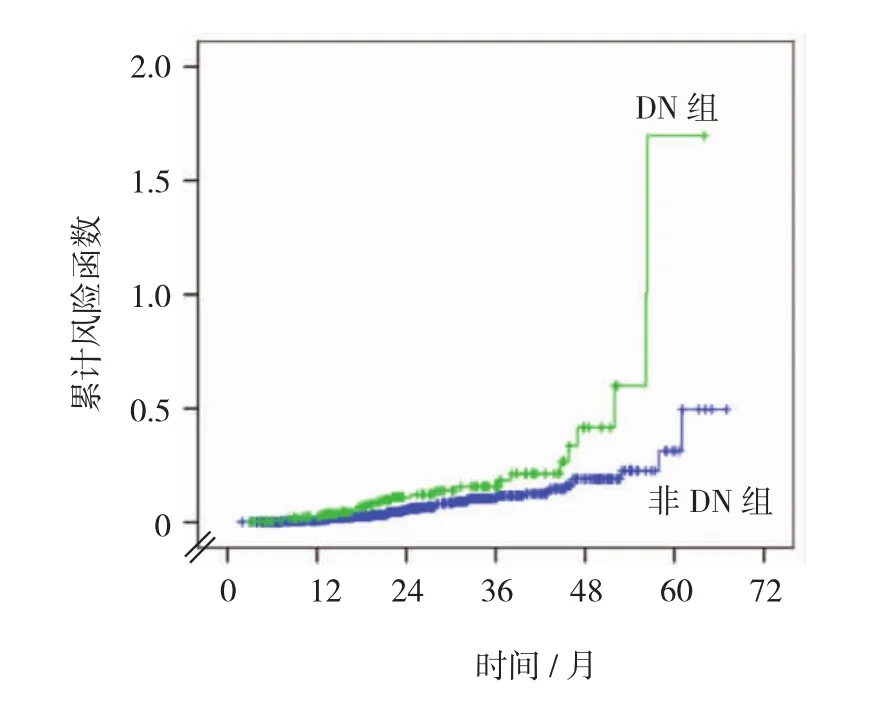
附圖兩組患者的累積卒中發生率
2.3DN血液透析患者發生卒中的危險因素
應用Cox回歸分析觀察表2中差異有統計學意義的變量,在單因素Cox回歸分析中未發現DN血液透析患者發生卒中的預測因素中差異有統計學意義的變量,通過多因素Cox回歸分析校正卒中病史、CHD、DBP、MBP、年齡、HP及eGFR后,發現低血清白蛋白[HR=0.86(95%CI:0.76,0.97),P=0.011]是DN血液透析患者發生卒中的獨立危險因素。見表3。
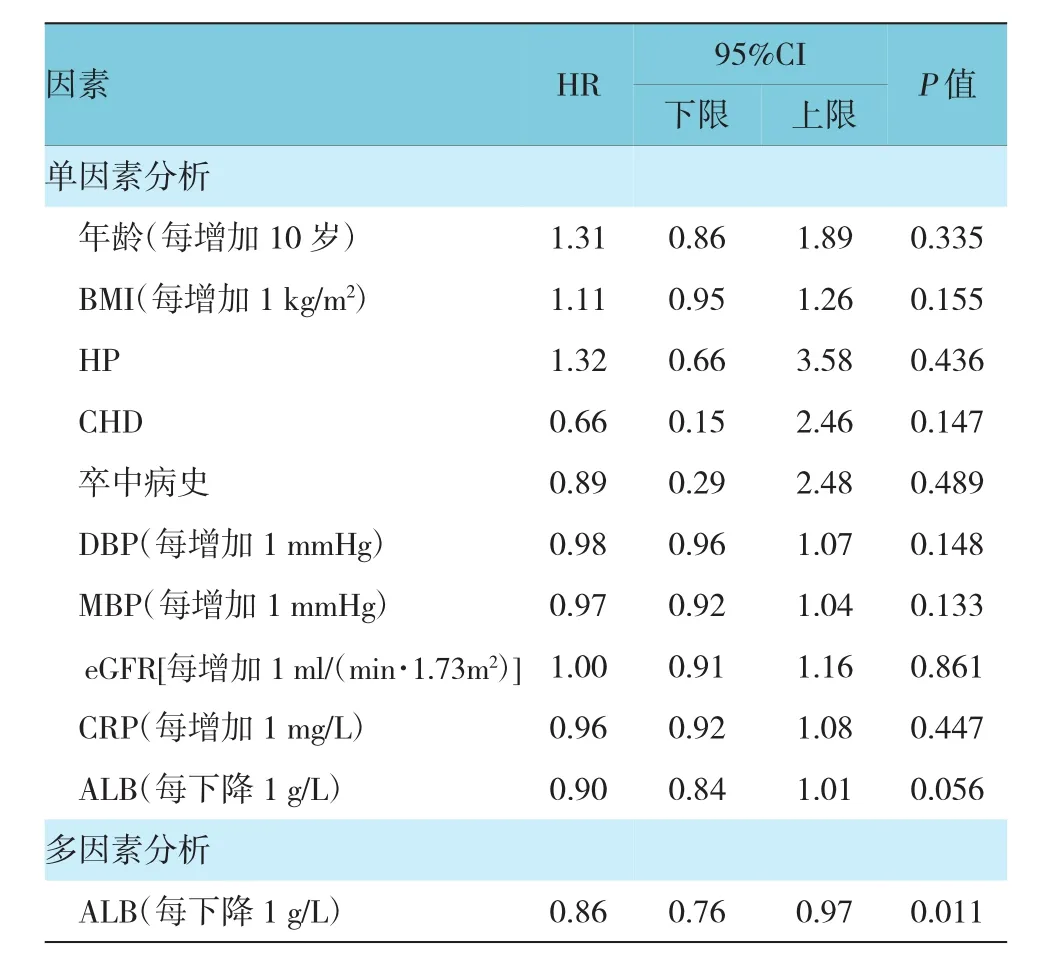
表3 DN血液透析患者發生卒中的危險因素
3 討論
本研究結果表明,合并DN的血液透析患者,其卒中的發病率明顯高于未合并DN的HD患者,為后者的2.15倍,并且較低的血清白蛋白是合并DN的血液透析患者發生卒中事件的獨立危險因素。
糖尿病是以慢性高血糖,伴隨因胰島素分泌和/或作用缺陷引起的糖、脂肪和蛋白質代謝紊亂的一種多病因代謝性疾病。DN在許多歐美國家已成為終末腎臟疾病的首位病因,在我國發病率也呈逐年發展趨勢。DN是糖尿病微血管并發癥之一,最終可發展為ESRD。DN損害可累及腎小球、腎血管、腎間質直至整個腎臟[10]。糖尿病常合并多種并發癥,這些并發癥在透析前就可出現,如缺血性心臟病、高血壓、心律失常、左心室肥厚、DN、糖尿病視網膜改變、動脈硬化性閉塞癥、脂質紊亂等[11]。在本研究中,合并DN的血液透析患者多為老年患者,且大多合并高血壓和冠狀動脈粥樣硬化性心臟病。本研究發現,合并DN的血液透析卒中患者中,較低的血清白蛋白水平是發生卒中事件的獨立預測因素(已校正人口學資料、實驗室檢查、合并癥)。研究結果與之前一些大型的研究(>1 000例患者、隨訪周期5~10年)結果大體相似,研究發現,較低的血清白蛋白可增加腹膜透析和血液透析患者的病死率[12-13]。
已有研究表明,高齡、糖尿病、冠狀動脈粥樣硬化性心臟病及較低的血紅蛋白是HD患者全因死亡的獨立危險因素[14]。另外,營養不良也被認為是普通透析患者全因死亡和CVD死亡的較強預測因素[15]。部分學者認為,對于ESRD患者,營養不良不僅反映較差的營養吸收狀態,更主要體現機體處于慢性炎癥狀態,而這種慢性炎癥狀態可導致CVD相關死亡率增加[16]。CKD患者的血管內皮功能可能由氧化應激、炎癥、高同型半胱氨酸血癥、貧血、氮質血癥、營養不良等因素損害,從而更容易并發腦血管并發癥。腦部血管與腎臟血管具有類似的血流動力學特征,如低阻力、高灌注,該特征也導致兩者發生內皮細胞功能障礙、脂質透明變性等類似病理改變。有研究顯示,腦微血管病變與CKD可能是同一病理生理過程導致的不同靶器官損害[17]。腦卒中不僅在HD人群中發病率高,缺血性性卒中發病率明顯低于出血性腦卒中[18]。其原因除了高齡、高血壓、糖尿病、慢性炎癥反應等風險因外,抗凝劑在血液透析人群的應用也成為HD人群出血性腦卒中發病率增高的高危因素。卒中的預后及嚴重程度與血清白蛋白水平相關,低血清白蛋白血癥為腦卒中的獨立危險因素[19]。健康成年人血清白蛋白正常范圍為35~50 g/L,如血清白蛋白<35 g/L,則診斷為低蛋白血癥。基礎疾病、年齡、營養狀況及內分泌激素水平與缺血性卒中的嚴重程度和預后相關。評價營養狀況的首要指標是血清白蛋白。人血清白蛋白并且具有減輕腦水腫、抗氧化、清除氧自由基、增加血流灌注、改善血管內皮功能等作用。肝硬化、腎病綜合征、長期慢性炎癥、消化道腫瘤、大面積的燒傷均可導致低蛋白血癥。缺血性卒中患者的輕至中度低白蛋白血癥大多與長期營養攝入不足、尿蛋白增多、慢性炎癥反應及卒中急性期反應相關,其均可導致卒中患者低蛋白血癥。
在本研究中,筆者發現類似的結果,相對于未合并DN的血液透析患者,合并DN的血液透析患者的卒中發病率更高,而且較低的血清白蛋白是合并DN的HD患者發生卒中的危險因素。
綜上所述,危險因素的嚴格管理,如低血清白蛋白的管理,有助于提高合并DN的血液透析患者的生活質量及延長生存時間,改善營養不良對減少卒中事件發生是相當必要的。
[1]KAROPADI A N,MASON G,RETTORE E,et al.The role ofeconomies of scale in the cost of dialysis across the world:a macroeconomic perspective[J].Nephrol Dial Transplant,2014,29(4): 885-892.
[2]LIU X,GUO Q,FENG X,et al.Alkaline phosphatase and mortalityinpatientsonperitonealdialysis[J].ClinJAmSoc Nephrol,2014,9(4):771-778.
[3]ZOCCALI C,MALLAMACI F,TRIPEPI G.Traditional and emerging cardiovascular risk factors in end-stage renal disease[J]. Kidney Int Suppl,2003,85:S105-S110.
[4]LLOYD-JONES D,ADAMS R J,BROWN T M,et al.Heart disease and stroke statistics-2010 update:a report from the American Heart Association[J].Circulation,2010,121(7):948-954.
[5]SELIGER S L,GILLEN D L,LONGSTRETH W T J R,et al.El evated risk of stroke among patients with end-stage renal disease[J]. Kidney Int,2003,64(2):603-609.
[6]ISEKI K,KINJO K,KIMURA Y,et al.Evidence for high risk of cerebral hemorrhage in chronic dialysis patients[J].Kidney Int, 1993,44(5):1086-1090.
[7]POWER A,CHAN K,SINGH S K,et al.Appraising stroke risk in maintenance hemodialysis patients:a large single-center cohort study[J].Am J Kidney Dis,2012,59(2):249-257.
[8]LOSITO A,PITTAVINI L,FERRI C,et al.Reduced kidney function and outcome in acute ischaemic stroke:relationship to arterial hypertension and diabetes[J].Nephrol Dial Transplant, 2012,27(3):1054-1058.
[9]HERZOG C A,ASINGER R W,BERGER A K,et al.Cardiovascular disease in chronic kidney disease.A clinical update from kidney disease:improving global outcomes(KDIGO)[J].Kidney Int,2011,80(6):572-586.
[10]O'SEAGHDHA C M,HWANG S J,UPADHYAY A,et al.Predictors of incident albuminuria in the framingham offspring cohort[J].American Journal of Kidney Diseases the Official Journal of the National Kidney Foundation,2010,56(5):852-860.
[11]MCDONALD S P,COLLINS J F,JOHNSON D W.Obesity is associated with worse peritoneal dialysis outcomes in the AustraliaandNewZealandpatientpopulations[J].JAmSoc Nephrol,2003,14:2894-2901.
[12]BEDDHU S,PAPPAS L M,RAMKUMAR N,et al.Effects of body size and body composition on survival in hemodialysis patients[J].J Am Soc Nephrol,2003,14:2366-2372.
[13]STACK A G,MURTHY B V,MOLONY D A.Survival differences between peritoneal dialysis and hemodialysis among large ESRD patients in the United states[J].Kidney Int,2004,65: 2398-2408.
[14]SIPAHIOGLU M H,AYBAL A,UNAL A,et al.Patient and technique survival and factors affecting mortality on peritoneal dialysis in turkey:12 years'experience in a single center[J]. Perit Dial Int,2008,28:238-245.
[15]FUNG F,SHERRARD D J,GILLEN D L,et al.Increased risk for cardiovascular mortality among malnourished end-stage renal disease patients[J].Am J Kidney Dis,2002,40:307-314.
[16]HARMS H,REIMNITZ P,BOHNER G,et al.Influence of stroke localization on autonomic activation,immunodepression, and post-stroke infection[J].Cerebrovasc Dis,2011,32:552-560.
[17]SOZIO S M,ARMSTRONG P A,CORESH J,et al.Cerebrovascular disease incidence,characteristics,and outcomes in patients initiating dialysis:the choices for healthy outcomes in caring for ESRD(CHOICE)study[J].American Journal of Kidney Diseases, 2009,54(3):468-477.
[18]IKRAM M A,VERNOOIJ M W,HOFMAN A,et al.Kidney function is related to cerebral small vessel disease[J].Stroke, 2008,39(1):55-61.
[19]SIPAHIOGLU M H,AYBAL A,UNAL A,et al.Patient and technique survival and factors affecting mortality on peritoneal dialysis in Turkey:12 years'experience in a single center[J]. Peritoneal Dialysis International Journal of the International Society for Peritoneal Dialysis,2008,28(3):238-245.
(童穎丹 編輯)
Risk factors for stroke in hemodialysis patients with diabetic nephropathy*
Xin-yu Wang,Feng He,Jun-zhou Fu
(Department of Nephrology,Guangzhou First People's Hospital Affiliated to Guangzhou Medical University,Guangzhou,Guangdong 510180,China)
Objective To assess the risk factors for stroke in hemodialysis(HD)patients with diabetic nephropathy(DN)and to provide clinically useful information for prevention and treatment of stroke.Methods A total of 1,148 patients who underwent hemodialysis from January 2007 to January 2012 were recruited,and divided into DN group and non-DN group according to diabetic nephropathy.The prognostic risks of stroke were evaluated by Cox regression analysis.Hazard ratio of stroke was also calculated by the Kaplan-Meier curves or the Cox proportional hazards model for DN patients and non-DN patients.Results In the 1,148 patients[58.6%male,(48.34±15.78)years],the mean follow-up time was 23.8 months with the longest period of 72.0 months.The stroke incidence was 63.5/1,000 patients per year in the HD patients with DN, which was significant higher than that of 29.6/1,000 patients per year in the non-DN patients.On multivariate analysis,independent predictor of stroke occurrence in the HD patients with DN was hypoalbuminemia[HR= 0.86(95%CI:0.76,0.97),P=0.011].Conclusions Hypoalbuminemia is independently associated with increased stroke risk in HD patients with DN,which suggests that these patients should avoid malnutrition.
stroke;epidemiology;diabetic nephropathy;risk factor
R587.2
A
10.3969/j.issn.1005-8982.2016.23.015
1005-8982(2016)23-0072-05
2016-03-22
國家自然科學基金(No:81360137);廣東省自然科學基金(No:2014A030310060)
傅君舟,E-mail:fujzhou@163.com

