信號分子對湯姆青霉PT95菌株菌核分化的影響
趙文婧,韓建榮
(1.太原師范學院生物系,山西太原030031;2.山西大學生命科學學院,山西太原030006)
信號分子對湯姆青霉PT95菌株菌核分化的影響
趙文婧1,韓建榮2
(1.太原師范學院生物系,山西太原030031;2.山西大學生命科學學院,山西太原030006)
從菌核分化入手,研究外源信號分子對湯姆青霉PT95菌株菌核分化的影響。使用MEA和PDA這2種不同的培養基培養湯姆青霉PT95菌株,并在2種不同的培養基上分別添加0,0.02,0.04,0.06 mmol/mL的cAMP;通過記錄菌核成熟的時間,測量菌落直徑、菌核生物量和類胡蘿卜素含量,以分析菌株生長發育情況。結果表明,在加入的cAMP濃度達到0.02 mmol/mL時菌核的生長發育狀態最佳;之后隨著cAMP濃度的增加,其生長狀況逐漸下降;當cAMP濃度達到0.06 mmol/mL時,其生長開始受到抑制,表明外界適當供給信號分子cAMP可促進湯姆青霉PT95菌株的生長,但cAMP濃度過高則會抑制湯姆青霉菌株的生長發育。
cAMP;湯姆青霉;菌核;類胡蘿卜素
菌核是由菌絲絞纏聚集而形成的堅硬的休眠結構,真菌學家和植物病理學家對真菌菌核發育和結構的研究主要集中在子囊菌和擔子菌[1-2]。據《中國真菌志》第三十五卷[3]記載,從我國分離到的8種能產生菌核的青霉中包括湯姆青霉(Penicillium thomii)。從土壤中分離到的一株經鑒定屬于Penicillium thomii的湯姆青霉PT95菌株,能在普通的固體培養基(即瓊脂平板)上形成大量堅硬的砂粒狀的微菌核[4],并在菌核的脂質小球中積累大量的以β-胡蘿卜素為主要成分的類胡蘿卜素。在進行青霉的形態觀測時,主要包括3個方面:菌落的生長速率,即在一定時間內一定的培養基上的菌落直徑;菌落的特征;顯微特征[5]。
有研究發現,一些外源信號分子可延緩果蔬衰老[6]。生物體病變衰老時體內的自由基會增加,類胡蘿卜素能夠抑制自由基的形成,延緩衰老和預防癌癥。近年來,利用微生物生產類胡蘿卜素也已經有了商業化應用[7]。β-胡蘿卜素可以提高種雞產蛋率和孵化率[8],是一種有效的過氧化自由基的捕獲劑。當活性氧(Reactive Oxygen Species,ROS)在體內積累濃度過高時會導致細胞損傷,而β-胡蘿卜素含多個共軛雙鍵,能淬滅單線態氧(1O2),以避免1O2對脂類雙鍵或共軛雙鍵的攻擊;清除自由基來阻礙或終止反應鏈的進行[9],使得其具有抗氧化損傷的能力。
菌絲中儲存的營養成分酶解后可以為菌核發育功能提供能量,形成菌核的大小、數量與培養基中的營養構成有關[10]。葡萄孢菌(Botrytis cinerea)野生型一般不產生菌核,但其突變株cAMP的水平顯著降低,可產生大量的菌核;若加入cAMP,會抑制菌核的形成,表現出野生型的性狀。說明cAMP對B.cinerea菌核發育起著負調控作用。cAMP參與菌核的發育在不同的種群中有差異,PT95菌株在各種不同的培養基上均表現出理想的選擇培養特性[11],而湯姆青霉PT95在菌核中可以積累大量的類胡蘿卜素[12]。故本試驗采用湯姆青霉PT95菌株進行研究,探索cAMP濃度對其菌核分化的影響。
通過查閱相關文庫發現,關于PT95菌株菌核分化與類胡蘿卜素在高氧脅迫光照條件下的產率[13]及生物誘導方面的理論研究[14]已有記錄,但沒有湯姆青霉PT95菌株對外源信號分子細胞響應的研究報道,所以,本研究有一定的創新性,不僅可對湯姆青霉PT95菌株菌核分化的信號傳遞機制有更多認識,也能對湯姆青霉PT95菌株的菌核分化提供更完整的依據,為產菌核真菌的研究奠定一定的理論基礎。
1 材料和方法
1.1 材料
1.1.1 菌株Penicillium thomii PT95菌株,分離自山西汾陽的混交林土壤,保存在查氏(CA)斜面上。
1.1.2 培養基麥芽汁培養基(MEA):麥芽膏20 g,蛋白胨1.0 g,葡萄糖20 g,瓊脂20 g,蒸餾水1 L。
馬鈴薯葡萄糖瓊脂培養基(PDA):20%馬鈴薯煮汁(稱取馬鈴薯200 g,加水1 000 mL,煮沸20 min后,過濾。在濾汁中補足水分到1 000 mL,即成20%馬鈴薯煮汁)1 000 mL,葡萄糖20 g,瓊脂18 g。
1.1.3 主要儀器設備滅菌鍋,培養箱,超凈臺,電子天平,Canon相機,電磁爐,高壓蒸汽滅菌鍋。
1.2 方法
1.2.1 配制培養基MEA培養基適合PT95菌株大量產生菌核,而在PDA培養基上其類胡蘿卜素產率最高[15]。按照配方配制好培養基后,分裝到若干個三角瓶中,封好放入高壓滅菌鍋中,在121℃條件下滅菌20 min。
1.2.2 不同濃度cAMP的設置在MEA和PDA培養基中添加cAMP,使得培養基中cAMP的濃度分別達到0.02,0.04,0.06 mmol/mL;同時以沒有添加cAMP的培養基作為對照。每個9 cm培養皿中倒入25 mL培養基。
1.2.3 接種MEA和PDA培養基按濃度梯度各分為4組,分別記為A,B,C,D,用移液槍分別添加0,0.02,0.04,0.06 mmol/mL的cAMP試劑5 μL,每組設置3個重復。在超凈工作臺上,用接種針挑取湯姆青霉PT95菌株的單菌核,以三點式接種方法接入培養皿中,分別置于25℃培養箱中黑暗培養。
1.2.4 菌落形態及特征觀察觀察不同培養基上PT95菌株的菌落特征,記錄滲出液出現和消失的時間,在第7天及菌核成熟后用Canon數碼相機自然光下照相。待滲出液漸漸消失,即菌核成熟之時,收集PT95菌株在不同培養基上的成熟菌核,用標尺測量2種培養基上的2株菌株成熟菌落的直徑。
1.3 測定項目及方法
1.3.1 菌核生物量測定用自來水將青霉PT95菌株的成熟菌核從平板上沖洗下來,收集到平皿中,烘干稱質量。
1.3.2 類胡蘿卜素的提取及含量測定根據韓建榮等[4]的方法提取青霉PT95菌株成熟菌核中的類胡蘿卜素,然后按王業勤等[16]的方法計算所提取菌核中的類胡蘿卜素含量。即將干菌核置于研缽中進行研磨,再加入5 mL丙酮、10 mL氯仿進行提取,4 000 r/min離心10 min。取上清液加10 mL蒸餾水,振蕩、靜置分層,取下層約5 mL收入容量瓶,用丙酮定容至10 mL。在475 nm下,以丙酮溶液作為空白對照,將提取好的液體用分光光度計測定吸光度值。
類胡蘿卜素含量(μg/g)=(吸光度值×總體積(mL)×稀釋倍數×10)/菌核干質量×2 500。
2 結果與分析
2.1 不同濃度cAMP對菌落特征和菌核分化的影響
在MEA和PDA培養基上PT95菌株的菌落表面幾乎由菌核覆蓋,只是在菌落邊緣部分有非常少量的分生孢子。在MEA培養基上,湯姆青霉PT95菌株在第4天出現了滲出液(大量菌絲集結形成菌核,生長發育使菌絲相互擠壓時,菌絲細胞液滲出,即為滲出液[17]);第6天滲出液漸漸消失,菌核出現,菌絲交纏聚集;第11天菌核成熟。在cAMP濃度為0.02 mmol/mL時,滲出液出現、消失及菌核成熟的時間較對照都提前了1~2 d,說明添加cAMP后對菌株生長有促進作用;但隨著cAMP濃度的增加,滲出液出現、消失及菌核成熟時間漸漸推遲;當cAMP濃度為0.06 mmol/mL時,菌核滲出液出現及菌核成熟的時間都較對照推遲了1 d,說明添加較高濃度的cAMP會抑制菌株的生長。
由表1可知,在PDA培養基上,湯姆青霉PT95菌株在第5天出現了滲出液;第7天滲出液漸漸消失,菌核出現,菌絲交纏聚集;第10天菌核成熟。在cAMP濃度為0.02 mmol/mL時,滲出液出現、消失及菌核成熟的時間都較對照有所提前;當cAMP濃度為0.04 mmol/mL時,菌核生長狀況與對照基本相同;當cAMP濃度為0.06 mmol/mL時,菌核滲出液出現及菌核成熟的時間都較對照推遲。
綜上所述,PT95菌株在MEA培養基上比在PDA培養基上滲出液和菌核出現的時間提早1 d;但菌核成熟的時間,MEA培養基比PDA培養基要推遲1 d。
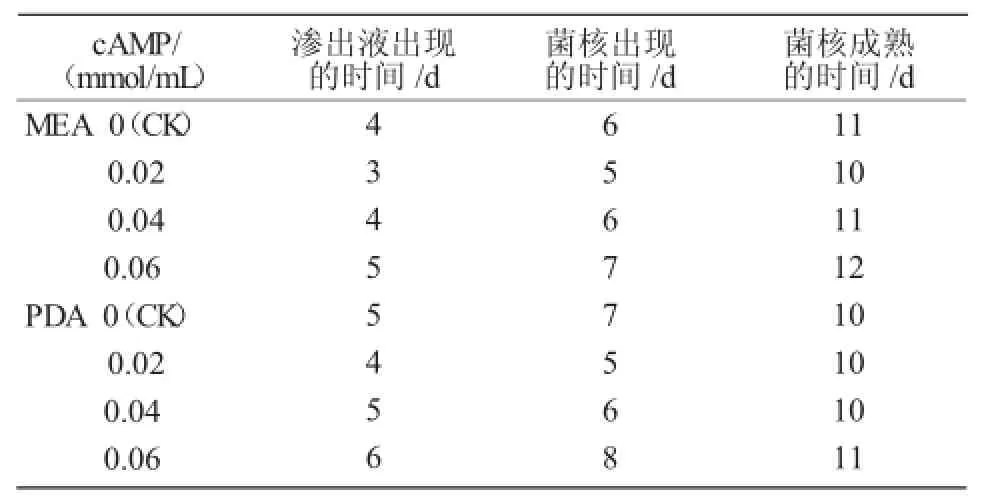
表1 不同濃度cAMP對PT95菌核分化的影響
2.2 不同濃度cAMP對菌核形態和菌核生物量的影響
通過測量,湯姆青霉PT95菌株菌核形狀以圓形為主(圖1)。

由表2可知,PT95菌株在MEA培養基比PDA培養基上的菌落直徑要大一些,且隨著cAMP濃度的增加,MEA和PDA培養基上的菌落直徑均先增后減,當cAMP濃度為0.02 mmol/mL時,MEA和PDA培養基上的菌核生長均最好;之后菌核生長不再受促進,當cAMP濃度為0.06 mmol/mL時,菌核生長受到抑制。
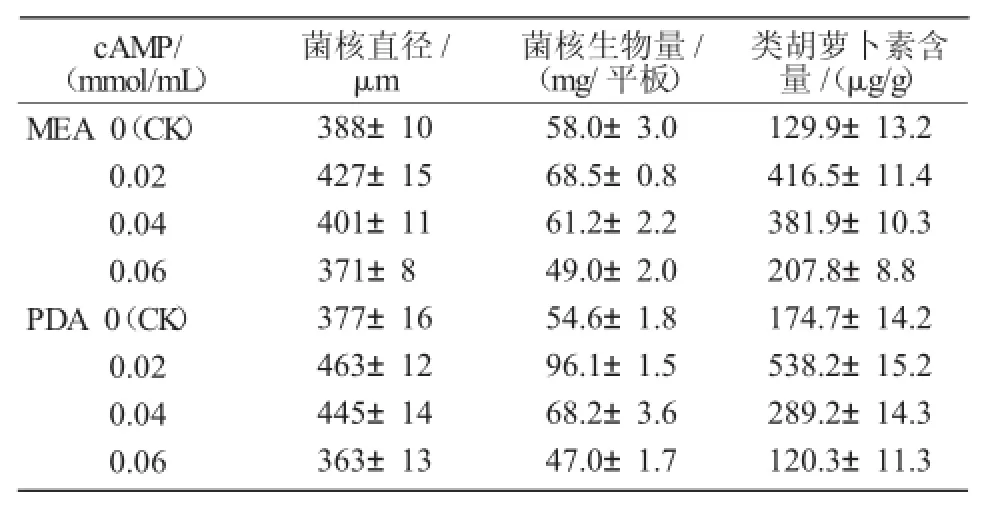
表2 不同濃度cAMP對PT95菌核分化的影響
從表2還可以看出,PT95菌株在MEA培養基上的菌核生物量比在PDA培養基上稍高一些,達到58.0 mg/平板;隨著cAMP濃度的變化,菌核的生物量也在變化。其中,在MEA培養基上,當cAMP濃度為0.02 mmol/mL時,菌核生物量達到最高值,為68.5 mg/平板,是對照的1.18倍;然后逐漸降低;當cAMP濃度為0.06 mmol/mL時降至最低值,是對照組的84%。在PDA培養基上,菌核生物量相對較低一些,為54.6 mg/平板;當cAMP濃度為0.02 mmol/mL時達到最高值,為96.1 mg/平板,是對照的1.76倍;當cAMP濃度為0.06 mmol/mL時降至最低值,低于對照組,是對照組的86%。
綜上所述,隨著外源信號分子cAMP濃度的增加,PT95菌株菌核直徑和菌核的生物量均呈先增大后減小的趨勢。
2.3 不同濃度cAMP培養基對菌核類胡蘿卜素含量的影響
由表2可知,在MEA培養基上,PT95菌株的類胡蘿卜素含量達到129.9 μg/g。在添加不同濃度的cAMP時,PT95菌株的類胡蘿卜素含量有所不同,當cAMP濃度為0.02 mmol/mL時,類胡蘿卜素含量達到最高值,為416.5 μg/g,是對照的3.2倍;然后隨著cAMP濃度的增加,類胡蘿卜素含量逐漸下降;當cAMP濃度為0.06 mmol/mL時,其含量降至最低值,為207.8 μg/g,但仍然高于對照,是對照的1.6倍。
在PDA培養基上,PT95菌株的類胡蘿卜素含量達到174.7 μg/g。當添加cAMP的濃度為0.02 mmol/mL時,類胡蘿卜素含量達到最高值,為538.2 μg/g,是對照組的3.1倍;隨著cAMP濃度的增加,類胡蘿卜含量逐漸下降;當cAMP濃度為0.06 mmol/mL時,其含量降至最低值,為120.3 μg/g,為對照組的70%。
綜上所述,隨著外源信號分子濃度的提高,類胡蘿卜素含量呈先升高后降低的趨勢;當cAMP濃度為0.02 mmol/mL時,類胡蘿卜素含量最高,明顯高于對照,表明cAMP對提高類胡蘿卜素含量有促進作用;當cAMP濃度繼續增加時,含量有所下降,cAMP濃度為0.06 mmol/mL時,類胡蘿卜素含量低于對照,說明菌核生長受到抑制。
3 結論與討論
本試驗結果表明,MEA培養基比PDA培養基培養菌落時滲出液出現時間早,菌核也較早出現;但PT95菌株在PDA培養基上成熟的時間要比在MEA培養基上更早一些。從培養效果上看,MEA培養基比PDA培養基更適合于使湯姆青霉PT95菌株產生大量的菌核。
有研究表明,使細胞內cAMP含量升高的因素會降低細胞生長速度,抑制細胞的增殖,使失去接觸抑制的細胞恢復控制性生長[18]。對巨大芽孢桿菌而言,外源cAMP幾乎不影響其生長;而對E.coli AS 1.797菌株以葡萄糖作碳源來講,外源cAMP的存在對生長有抑制作用,說明外源cAMP可能對不同菌株有著不同的作用[19]。
本研究結果表明,cAMP的濃度對湯姆青霉菌株的分化有一定的影響,在培養基上,隨著cAMP濃度的提高,2株菌株出現滲出液的時間、出現菌核的時間均提前1~2 d,而菌核成熟的時間出現不同程度的推遲現象。外源信號分子濃度對湯姆青霉PT95菌株的菌核形態也有一定的影響,隨著cAMP濃度的提高,菌株的菌落直徑先增加后減少。這種變化有可能是對cAMP濃度的一種適應性反應,較低濃度的cAMP會適當促進菌核生長,但是濃度增加到一定程度則會對菌核生長產生抑制作用。
在本試驗條件下,湯姆青霉PT95菌株的菌核生物量以及菌核中類胡蘿卜素的含量與外源信號分子濃度呈一定的正相關,隨著cAMP濃度的增加類胡蘿卜含量先升高后降低。可能是由于湯姆青霉PT95和Q1菌株的機體中其他抗氧化系統起到了一定的作用,并不需要合成太多的類胡蘿卜素來清除ROS,因此,類胡蘿卜素含量有少許下降。
一般來說,當真菌消耗完碳源的時候,也就同時失去了對其抗氧化保護機制的有效管理能力,所以,產菌核真菌通過分化形成菌核以備長期生存。本試驗結果表明,在外界適當供給cAMP條件下,湯姆青霉PT95菌株生長效果受到促進:一方面在菌核中積累類胡蘿卜素這種抗氧化劑來保護機體,另一方面也能形成大量的菌核或者增加菌核的大小來幫助其度過不良環境。但是如果供給cAMP的濃度過高,PT95菌株的菌核生物量和類胡蘿卜素含量反而會低于正常情況,其生長受到抑制。
今后在進行湯姆青霉PT95菌株的培養時,為了增強培養效果,可以使用MEA培養基添加適量濃度的cAMP,其中,0.02 mmol/mL的濃度下菌落生長狀況最佳,而后隨著其濃度增加而漸趨下降;當cAMP濃度達到0.06 mmol/mL時,菌株生長受到抑制。
[1]Luttrell E S.Host-parasite relationships and development of the ergot sclerotium in Claviceps purpurea[J].Canadian Journal of Botany,1980,58:942-958.
[2]Chet I,Henis Y.Sclerotial morphogenesis in fungi[J].Annual Review of Phytopathology,1975,13:169-192.
[3]孔華忠.中國真菌志(第三十五卷,青霉屬及其相關有性型屬)[M].北京:科學出版社,2007.
[4]韓建榮,王肖娟,原香娥.青霉PT95菌株菌核內產生類胡蘿卜素的研究[J].微生物學通報,1998,25(6):319-321.
[5]Pitt J I.An appraisal of identification methods for Penicillium species:novel taxonomic criteria based on temperature and water relations[J].Mycologia,1973,65:1134-1157.
[6]李姍姍,王明力,吳映梅.外源信號分子在果蔬保鮮中的應用[J].貴州農業科學,2013,41(8):160-162.
[7]姜文侯,單志萍,孟妤.β-胡蘿卜素的應用、市場和天然型產品的發酵法生產[J].食品與發酵工業,1994,20(3):65-71.
[8]范永仙,許堯興.微生物生產類胡蘿卜素的研究進展[J].食品與發酵工業,2003,29(7):69-74.
[9]周麗,梁新樂,勵建榮.類胡蘿卜素抗氧化作用研究進展[J].食品研究與開發,2003,24(2):21-23.
[10]Willetts H J,Wong A L.Ontogenetic diversity of sclerotia of Sclerotinia sclerotiorum and related species[J].Transactions of the British Mycological Society,1971,57:515-524.
[11]崔麗霞.青霉PT95菌株的鑒定和培養條件的研究[D].太原:山西大學,2004.
[12]韓建榮,李智偉,王宇,等.一株產菌核青霉的生物學特性研究[J].山西大學學報,2009,3(4):634-639.
[13]趙文婧.外源β-胡蘿卜素、光照對青霉PT95菌株菌核分化和類胡蘿卜素產率的影響[J].微生物學報,2005,45(2):279-282.
[14]韓建榮,高宇英,趙文婧.幾種誘導子對青霉PT95菌株固態發酵產生類胡蘿卜素的影響[J].應用與環境生物學報,2005,11(2):208-210.
[15]趙文婧,張澤清,龍丹丹,等.湯姆青霉PT95和Q1菌株產菌核培養基的篩選[J].山西大學學報,2013,36(4):622-627.
[16]王業勤,李勤生.天然類胡蘿卜素研究進展、生產、應用[M].北京:中國醫藥科技出版社,1997.
[17]戚敬.青霉PT95菌株滲出液的產生以及菌核發育和類胡蘿卜素代謝的關系[D].太原:山西大學,2006.
[18]高士爭,張曦,程美玲.環腺苷酸的生物學作用與動物營養代謝調控[J].中國畜牧獸醫,2003,30(6):21-23.
[19]顏日祥,段康明.環化腺苷酸對細菌生長的影響[J].微生物學報,1989,29(1):20-22.
Effects of Signal Molecule on Sclerotial Differentiation of Penicillium thomii PT95
ZHAO Wen-jing1,HAN Jian-rong2
(1.Department of Biology,Taiyuan Normal University,Taiyuan 030031,China;2.College of Life Sciences,Shanxi University,Taiyuan 030006,China)
The project was planned to start from sclerotia differentiation,effect of exogenous signal molecule on sclerotial differentiation of Penicillium thomii PT95 was studied.Using MEA and PDA two different culture medium of Penicillium thomii PT95, and 0,0.02,0.04,0.06 mmol/mL of cAMP separately on two different media,by recording the time to sclerotia mature,measuring the colony diameter,sclerotia biomass and carotenoid content,to analyze the growth and development of the strains.The results showed that when the cAMP concentration reached 0.02 mmol/mL,the growth state of sclerotium was the best;after increases cAMP concentrations growth status decreased;when the cAMP concentration reached 0.06 mmol/mL,the growth began to be suppressed.That indicated that under the low concentration of cAMP,Penicillium thomii PT95 strain's growth was promoted.But if the supply of cAMP concentration was toohigh,sclerotia biomass and carotenoid content ofPT95 strain would be lower than normal,the growth was inhibited.
cAMP;Penicillium thomii;sclerotia;carotenoids
Q935
A
1002-2481(2016)01-0019-05
10.3969/j.issn.1002-2481.2016.01.06
2015-07-30
國家自然科學基金項目(31070048)
趙文婧(1980-),女,山西榆次人,講師,博士,主要從事微生物生理生化研究工作。韓建榮為通信作者。

