NKG2D/RAE-1通路在介導NK/T細胞殺傷垂體瘤細胞中的作用及意義
孫其凱,馬立新,李珍珠,陳正,李澤福
(濱州醫學院附屬醫院,山東濱州256600)
NKG2D/RAE-1通路在介導NK/T細胞殺傷垂體瘤細胞中的作用及意義
孫其凱,馬立新,李珍珠,陳正,李澤福
(濱州醫學院附屬醫院,山東濱州256600)
目的 觀察NKG2D/RAE-1通路在介導自然殺傷(NK)細胞、CD8+T細胞(兩種細胞簡稱NK/T細胞)殺傷垂體瘤細胞中的作用,從細胞學水平探討垂體瘤的免疫逃逸機制。方法 以小鼠垂體瘤細胞系AtT20為研究對象,采用免疫熒光標記法檢測NKG2D配體RAE-1在垂體瘤細胞的表達水平及定位分布情況。采用NK/T細胞分選試劑盒分離NK/T細胞,將NK/T細胞放入Transwell小室的上室,靶細胞AtT20置入Transwell小室的下室,隨機分為對照組、實驗組。對照組在常規條件下共培養0、4、8、24 h,實驗組在培養液中加入阻斷RAE-1的抗體(Anti-RAE1 抗體)共培養0、4、8、24 h;采用MTT法檢測兩組各時間點細胞增殖抑制率。結果 RAE-1在AtT20細胞膜明顯表達,在細胞質內亦有弱表達。在AtT20細胞中RAE-1蛋白陽性表達率為100%,其中強表達率為30%、中表達率為60%、弱表達率為10%,無陰性表達。對照組培養4、8、24 h時細胞增殖抑制率明顯高于0 h時(P均<0.05);實驗組培養0、4、8、24 h時增殖抑制率逐漸升高(P均<0.05),培養8、24 h時增殖抑制率均明顯高于同時間點對照組(P均<0.05)。結論 NK/T細胞通過NKG2D/RAE-1通路殺滅垂體瘤細胞,RAE-1可負反饋作用于NK/T細胞,從而抑制免疫細胞對腫瘤細胞的殺傷活性。NKG2D/RAE-1通路可能作為垂體瘤的免疫治療靶點。
垂體瘤;NKG2D;RAE-1;自然殺傷細胞;CD8+T細胞
垂體瘤是目前臨床上最常見的鞍區腫瘤,患者預后較差;化療、放療和手術切除為其常用治療方法,但均不能明顯改善患者預后。免疫治療近年來應用于腫瘤的治療,其通過影響自然殺傷(NK)細胞、T細胞等效應細胞進而殺滅腫瘤細胞[1,2]。尋找可靠的治療靶點是腫瘤免疫治療的關鍵[2]。NKG2D是一種Ⅱ型膜蛋白,屬于NK細胞特異性很高的活化性配體,在NK細胞、CD8+T細胞(兩種細胞簡稱NK/T細胞)及其他免疫效應細胞中均有表達[3]。MICA是人類免疫效應細胞中能與NKG2D特異性結合的配體,是一種跨膜糖蛋白,具有高度糖基化[4]。目前已有研究在組織學水平證實NKG2D/MICA通路在機體抗腫瘤免疫中發揮重要作用,但尚無細胞水平的證據。小鼠細胞中RAE-1屬于NKG2D配體,可與NKG2D結合,具有類似MICA的免疫調節作用。2014年6月~2015年12月,本研究首次在細胞水平觀察NKG2D及其配體RAE-1在介導NK/T細胞殺傷垂體瘤細胞過程中的作用,探討垂體瘤的免疫逃逸機制。
1 材料與方法
1.1 材料 小鼠垂體瘤細胞系AtT20,購自中國科學院上海細胞所。主要試劑:RAE-1抗體(Abcam),熒光標記二抗(武漢博士德生物工程有限公司),NK/T細胞分選試劑盒、細胞磁珠分選試劑盒(德國美天旎公司),Transwell小室(美國康寧公司)等。
1.2 AtT20細胞培養及RAE-1蛋白表達檢測 將小鼠垂體瘤細胞系AtT20置于F-12K培養基(含15%馬血清、2.5%胎牛血清),于37 ℃、5% CO2環境下半貼壁培養,0.25%胰酶消化傳代。取第二代細胞常規條件下培養,采用免疫熒光標記法檢測RAE-1蛋白表達:將半貼壁培養的細胞消化吹打成細胞懸液;取細胞懸液涂于載玻片上,滴加羊血清室溫封閉1 h,滴加RAE-1抗體(1∶1 000)4 ℃過夜,滴加熒光標記二抗(1∶500)室溫孵育1 h,滴加DAPI標記細胞核,封片,顯微鏡下觀察細胞。RAE-1蛋白熒光信號位于細胞膜和細胞質。免疫熒光標記的分級標準(以熒光強度分級):0級即陰性:高倍鏡下隱約可見熒光信號,低倍鏡下不顯示;1級即弱表達:高倍鏡下可見熒光信號,低倍鏡下隱約可見;2級即中表達:高倍鏡下清晰可見熒光信號,低倍鏡下亦可見;3級即強表達:高倍鏡下可見耀眼熒光信號,低倍鏡下清晰可見;4級即超強表達:高倍鏡及低倍鏡下均可見刺眼熒光信號。1~4級均為陽性表達,3~4級為強表達。
1.3 NK/T細胞對AtT20細胞的殺傷活性檢測 采用Transwell共培養技術。采用NK/T細胞分選試劑盒,利用免疫磁珠負性篩選法分離NK/T細胞,并采用流式細胞儀進行鑒定,使分離的細胞純度分別達到80%以上,步驟參照試劑盒說明書。將NK/T細胞放入Transwell小室的上室,AtT20細胞(靶細胞置入Transwell小室的下室(效靶比20∶1,效應細胞密度為2×106個/mL、靶細胞密度為1×105個/mL);每批次樣本設置3個復孔,中間以0.4 μm孔徑聚碳酸酯膜隔開,重復3次;隨機分為對照組、實驗組,對照組在常規條件下共培養0、4、8、24 h,實驗組在培養液中加入阻斷RAE-1的抗體(Anti-RAE1抗體)共培養0、4、8、24 h;采用MTT法分別檢測兩組NK/T細胞在540 nm波長處的光密度(OD)值,計算細胞增殖抑制率。增殖抑制率(%)=(1-實驗組OD值/對照組OD值)×100%。

2 結果
2.1AtT20細胞RAE-1蛋白表達RAE-1在AtT20細胞膜明顯表達,在細胞質內亦有弱表達。在AtT20細胞中RAE-1蛋白陽性表達率為100%,其中強表達率為30%、中表達率為60%、弱表達率為10%,無陰性表達。見插頁Ⅰ圖1。
2.2NK/T細胞對AtT20細胞的殺傷活性 對照組培養4、8、24h時NK/T細胞增殖抑制率均較培養0h時增加(P均<0.05),但培養4、8、24h時增殖抑制率比較差異均無統計學意義(P均>0.05);實驗組培養0、4、8、24h時增殖抑制率逐漸升高(P均<0.05);實驗組培養8、24h時增殖抑制率均明顯高于同時間點對照組(P均<0.05)。見表1。
3 討論
垂體瘤是鞍區最常見的良性腫瘤,在顱內腫瘤中其發病率僅次于腦膠質瘤和腦膜瘤, 垂體瘤可發生在任何年齡,并無明顯性別差異(除泌乳素腺瘤多見于女性外)[5]。目前,臨床主要采用腫瘤全切并輔以放療和化療的方法來治療垂體瘤,但侵襲性垂體瘤患者術后復發率較高的難題仍未解決[6]。
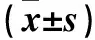
表1 兩組培養不同時間點NK/T細胞增殖抑制率比較
注:與對照組同時間點比較,*P<0.05;與同組0 h比較,△P<0.05;與同組4 h比較,#P<0.05;與同組8 h比較,▲P<0.05。
近年研究發現,腫瘤的發生、發展與機體免疫系統紊亂有關。NK細胞是一群大顆粒淋巴細胞,屬于一類與T、B淋巴細胞不同的大顆粒淋巴細胞[7]。NK細胞具有其他淋巴細胞無法比擬的優點,即腫瘤殺傷活性(無需抗原致敏)[8],可以快速、靈敏、直接殺傷腫瘤細胞[9,10]。目前利用NK細胞殺傷腫瘤細胞的方法正逐漸應用于臨床,如IL-2激活NK細胞殺傷腫瘤,IL-2能夠增加NK細胞數量,提高NK細胞殺傷腫瘤細胞(轉移性腎細胞癌、多發性骨髓瘤)的活性。但是,NK細胞殺傷腫瘤細胞的具體機制及其信號通路尚不清楚。NKG2D是一種Ⅱ型膜蛋白,屬于C型凝集素樣受體家族,NKG2D能夠結合特異的轉接蛋白通過跨膜區域的帶電殘基完成信號轉導[11];同時,NKG2D屬于NK細胞的特異性很高的活化性配體,在NK細胞、CD8+T細胞及其他免疫效應細胞中均有表達;但在正常生理條件下,NKG2D在人和小鼠CD4+T細胞中不表達[12]。本研究選用NK細胞、CD8+T細胞用于共培養實驗。
NKG2D可結合許多不同的配體,這些配體均屬于主要組織相容性復合體Ⅰ類(MHC-Ⅰ)相關蛋白,其中人NKG2D配體家族包括MICA和MICB。MICA是人類免疫效應細胞中能與NKG2D特異性結合的配體,是一種跨膜糖蛋白,具有高度糖基化。目前已有研究在組織學水平證明NKG2D/MICA通路在機體抗腫瘤免疫中發揮重要作用。Chen等[13]發現,相對于正常腦組織,MICA蛋白在垂體瘤組織中高表達,提示MICA蛋白高表達可能參與垂體瘤的發生、發展;MICA與NKG2D受體特異性結合激活NK/T細胞等效應細胞可能是其抑制腫瘤發生、發展的機制。
本研究以小鼠垂體瘤細胞系AtT20為研究對象,現已證實小鼠和人之間氨基酸序列同源性高達99%,因此該細胞系能夠充分替代人源垂體瘤細胞系[14]。但小鼠細胞缺少人類MICA同源基因,在其細胞中RAE-1基因充當MICA基因的角色。RAE-1屬于NKG2D配體,可與NKG2D結合,并且具有類似MICA的免疫調節作用。鑒于RAE-1在AtT20細胞的表達情況及其對垂體瘤生物學行為的影響尚不清楚,本研究首先觀察RAE-1在小鼠細胞系AtT20中的表達情況,結果發現RAE-1在垂體瘤細胞膜上明顯表達,同時細胞質內亦有弱表達;提示RAE-1高表達有可能參與垂體瘤的發生、發展,該結論為下一步檢測NKG2D/RAE-1通路在NK/T細胞殺傷垂體瘤細胞中的作用提供了前提。本研究在阻斷RAE-1配體后NK/T細胞對垂體瘤細胞的殺傷活性明顯增加,提示NK/T細胞可能通過NKG2D/RAE-1通路殺滅垂體瘤細胞;阻斷RAE-1配體后NK/T細胞的殺傷活性較前明顯增加,提示RAE-1負反饋作用于NK/T細胞,進而抑制免疫細胞對腫瘤細胞的殺傷活性。
有研究發現,在免疫力正常的動物體內表達NKG2D配體的腫瘤仍然能繼續發生、發展[15],故腫瘤發生、發展過程中可能存在依賴NKG2D/配體通路的免疫逃逸。本研究從細胞水平證明RAE-1不僅可與NKG2D結合介導NK/T細胞殺傷腫瘤細胞,也可負反饋作用于NK/T細胞,降低NK/T細胞的殺傷腫瘤細胞活性,上述結果為研究垂體瘤免疫逃逸機制提供了依據。NKG2D配體(包括MICA和RAE-1)在機體內有兩種存在形式,一種是存在于細胞膜表面的膜型配體,一種是活化脫落后被分泌到血液或腫瘤微環境中的分泌型配體。在大多數腫瘤,如骨肉瘤[16]、口腔鱗狀細胞癌[17],雖然NKG2D配體明顯表達,但由于膜型配體脫落為分泌型配體,分泌型配體與NKG2D結合后使NKG2D發揮消極作用,使NK/T細胞殺傷腫瘤細胞的活性降低,促進腫瘤細胞的免疫逃逸。
綜上所述,NK/T細胞通過NKG2D/RAE-1通路殺滅垂體瘤細胞,RAE-1可負反饋作用于NK/T細胞,從而抑制免疫細胞對腫瘤細胞的殺傷活性。NKG2D/RAE-1通路可能作為垂體瘤的免疫治療靶點。
[1] Whiteside TL. Immune modulation of T-cell and NK (natural killer) cell activities by TEXs (tumour-derived exosomes)[J]. Biochem Soc Trans, 2013,41(1):245-251.
[2] Osterburg AR, Nelson RL, Yaniv BZ, et al. NK cell activating receptor ligand expression in lymphangioleiomyomatosis is associated with lung function decline[J]. JCI Insight, 2016,1(16):e87270.
[3] Lanier LL. NKG2D Receptor and its ligands in host defense[J]. Cancer Immunol Res, 2015,3(6):575-582.
[4] Hizem S, Mtiraoui N, Massaoudi S, et al. Polymorphisms in genes coding for the NK-cell receptor NKG2D and its ligand MICA in recurrent miscarriage[J]. Am J Reprod Immunol, 2014,72(6):577-585.
[5] Athanasoulia AP, Ising M, Pfister H, et al. Distinct dopaminergic personality patterns in patients with prolactinomas: a comparison with nonfunctioning pituitary adenoma patients and age- and gender-matched controls[J]. Neuroendocrinology, 2012,96(3):204-211.
[6] Hansen TM, Batra S, Lim M, et al. Invasive adenoma and pituitary carcinoma: a SEER database analysis[J]. Neurosurg Rev, 2014,37(2):279-285,285-286.
[7] Locatelli F, Pende D, Maccario R, et al. Haploidentical hemopoietic stem cell transplantation for the treatment of high-risk leukemias: how NK cells make the difference[J]. Clin Immunol, 2009,133(2):171-178.
[8] Reeves RK, Li H, Jost S, et al. Antigen-specific NK cell memory in rhesus macaques[J]. Nat Immunol, 2015,16(9):927-932.
[9] Tsujimoto H, Uchida T, Efron PA, et al. Flagellin enhances NK cell proliferation and activation directly and through dendritic cell-NK cell interactions[J]. J Leukoc Biol, 2005,78(4):888-897.
[10] Konjevic G, Jurisic V, Jovic V, et al. Investigation of NK cell function and their modulation in different malignancies[J]. Immunol Res, 2012,52(1-2):139-156.
[11] Kasahara M, Sutoh Y. Comparative genomics of the NKG2D ligand gene family[J]. Immunol Rev, 2015,267(1):72-87.
[12] Dejaco C, Duftner C, Al-Massad J, et al. NKG2D stimulated T-cell autoreactivity in giant cell arteritis and polymyalgia rheumatica[J]. Ann Rheum Dis, 2013,72(11):1852-1859.
[13] Chen Z, Li Z, Chang Y, et al. Relationship between NF-kappaB, MMP-9, and MICA expression in pituitary adenomas reveals a new mechanism of pituitary adenomas immune escape[J]. Neurosci Lett, 2015(597):77-83.
[14] Savithri B, Khar A. A transmembrane-anchored rat RAE-1-like transcript as a ligand for NKR-P2, the rat ortholog of human and mouse NKG2D[J]. Eur J Immunol, 2006,36(1):107-117.
[15] Nakamura K, Nakayama M, Kawano M, et al. Fratricide of natural killer cells dressed with tumor-derived NKG2D ligand[J]. Proc Natl Acad Sci U S A, 2013,110(23):9421-9426.
[16] Lee BK, Kim MJ, Jang HS, et al. A high concentration of MMP-2/gelatinase A and MMP-9/gelatinase B reduce NK cell-mediated cytotoxicity against an oral squamous cell carcinoma cell line [J]. In Vivo, 2008,22(5):593-597.
[17] Sun D, Wang X, Zhang H, et al. MMP9 mediates MICA shedding in human osteosarcomas [J]. Cell Biology International, 2011,35(6):569-574.
Effect and significance of NKG2D/RAE-1 pathway in the process of NK/T cells killing hypophysoma cells
SUNQikai,MALixin,LIZhenzhu,CHENZheng,LIZefu
(AffiliatedHospitalofBinzhouMedicalCollege,Binzhou256600,China)
Objective To observe the effect of NKG2D/RAE-1 pathway on mediating natural killer (NK) cell and CD8+T cell (both cells were referred to as NK/T cells) killing hypophysoma cells and to investigate the immune escape mechanism of hypophysoma from the cytological level. Methods The hypophysoma cell line AtT20 was selected. The immunofluorescent labeling method was used to detect the expression level of NKG2D ligand RAE-1, its position and distribution in the hypophysoma cells. NK/T cells were isolated by NK/T cell sorting kit, and NK/T cells were placed in the upper chamber of the Transwell chamber, the target cells AtT20 were placed in the lower chamber of the Transwell chamber and then were randomly divided into the control group and experimental group. The control group was co-cultured under normal conditions for 0, 4, 8, and 24 h. In the experimental group, the anti-RAE1 antibody was added to the culture medium, and the cells were co-cultured for 0, 4, 8, and 24 h. MTT assay was used to detect the inhibitory rate of cell proliferation at each time point. Results RAE-1 was clearly expressed in AtT20 cell membrane, and there was a weak expression in the cytoplasm. The positive expression rate of RAE-1 protein in AtT20 cells was 100%, among which the strong expression rate was 30% (15/50), the moderate expression rate was 60%, the weak expression rate was 10%, and there was no negative expression. In the control group, at 4, 8 and 24 h after culture, NK/T cell proliferation inhibition rate increased as compared with that at 0 h (allP<0.05). In the experimental group, the proliferation inhibition rate gradually increased at 0, 4, 8 and 24 h (allP<0.05), and at 8 and 24 h, the proliferation inhibition rates in the experimental group were significantly higher than those of the control group (allP<0.05). Conclusions NK/T cells kill the hypophysoma cells through NKG2D/ RAE-1 pathway, meanwhile, RAE-1 has a negative feedback effect on NK/T cells and consequently inhibits the killing activity of immune cells against the tumor cells. NKG2D/RAE1 pathway can be used as immunotherapy target for hypophysoma.
hypophysoma; NKG2D; RAE-1; natural killer cells; CD8+T cells
國家自然科學基金資助項目(81171119)。
孫其凱(1989-),男,在讀碩士研究生,研究方向為垂體瘤的免疫治療。E-mail: sunqikai4453@163.com
簡介:李澤福(1969-),男,主任醫師,研究方向為垂體瘤的免疫治療。E-mail: lizefu163@163.com
10.3969/j.issn.1002-266X.2016.44.002
R736.4
A
1002-266X(2016)44-0004-04
2016-04-04)

