MK886對人結腸癌細胞HT-29增殖及Ascl2表達的影響
李仕宇,朱蓉,劉梅,周本剛,趙逵
(1 遵義醫學院附屬醫院,貴州遵義563000;2 遵義市第一人民醫院)
MK886對人結腸癌細胞HT-29增殖及Ascl2表達的影響
李仕宇1,2,朱蓉1,劉梅1,周本剛1,趙逵1
(1 遵義醫學院附屬醫院,貴州遵義563000;2 遵義市第一人民醫院)
目的 探討5-脂氧合酶活化蛋白(FLAP)抑制劑MK886對人結腸癌細胞HT-29增殖的影響及其作用機制。方法 分別采用12.5、25、50、75、100、200 μmol/L的MK886干預體外培養的HT-29細胞,分別于干預24、48 h時采用CCK-8法測定細胞增殖抑制率,結果顯示MK886抑制HT-29細胞增殖最佳作用時間為48 h、最佳濃度為48.12 μmol/L。選擇48.12 μmol/L MK886干預HT-29細胞(MK886組),另設對照組(不干預),干預24 h時采用Real-time PCR技術檢測Ascl2 mRNA表達,干預24、48、72 h時分別采用Western blotting法檢測 Ascl2 mRNA和蛋白表達。結果 經過48.12 μmol/L MK886干預24 h時HT-29細胞中Ascl2 mRNA相對表達量為0.35±0.02,對照組為0.72±0.02,兩組比較P<0.01。48.12 μmol/L MK886作用24、48、72 h時HT-29細胞中Ascl2蛋白相對表達量分別為1.75±0.13、1.10±0.15、0.71±0.19,均較對照組降低(P均<0.05);且隨著MK886作用時間延長,Ascl2蛋白相對表達量逐漸下調(P均<0.05)。結論 FLAP抑制劑MK886能抑制人結腸癌細胞HT-29增殖,其機制可能與下調Ascl2 mRNA和蛋白表達有關。
結腸癌;MK886;5-脂氧合酶活化蛋白;Ascl2
結直腸癌是發病率和病死率均較高的惡性腫瘤之一,近年來其發病呈年輕化趨勢[1,2]。花生四烯酸(AA)是人體必需脂肪酸,在體內代謝后可生成多種有生物活性的物質,如類二十烷酸等。這些代謝產物在腫瘤進展、轉移、血管生成等方面具有重要作用[3]。AA主要通過脂氧合酶(LOX)和環氧合酶(COX)途徑代謝[4],而非甾體類抗炎藥(NSAIDs)或其他抑制劑均能抑制這兩條代謝途徑,繼而抑制腫瘤細胞增殖并延緩腫瘤進展[5]。5-脂氧合酶活化蛋白(FLAP)抑制劑在臨床已廣泛用于治療哮喘、關節炎等慢性炎癥性疾病[6],但其對腫瘤細胞的作用鮮見報道。2015年5~8月,本研究觀察了FLAP抑制劑MK886對結腸癌細胞增殖的影響,現分析結果,并探討其可能的作用機制。
1 材料與方法
1.1 材料 人結腸癌細胞株HT-29,購自中國科學院上海細胞庫。超凈臺,蘇州凈化設備廠;二氧化碳培養箱、全波段酶標儀,美國Thermo公司;倒置顯微鏡,日本Olympus公司。MK886,美國Cayman公司,DMSO溶解后配成10 mmol/L溶液,-20 ℃儲存備用,實驗時用完全培養基稀釋;胰蛋白酶、雙抗、RPMI 1640培養基,美國Hyclone公司;胎牛血清,杭州四季青生物工程材料有限公司;CCK-8試劑盒,日本同仁化學研究所;Ascl2引物設計及合成,上海生工生物工程股份有限公司;TRIzol逆轉錄試劑盒、RT-PCR試劑盒、BCA蛋白定量試劑盒,北京全式金生物技術有限公司;Ascl2兔多克隆抗體,美國Abcam公司;山羊抗兔、鼠IgG-HRP,上海Abmart公司。
1.2 細胞傳代培養 取HT-29細胞置于含12%胎牛血清和1%雙抗的RPMI 1640培養基中,37 ℃、5% CO2培養箱中常規培養,待細胞貼壁生長至80%~90%融合時,0.25%胰蛋白酶消化傳代,繼續培養24 h。取對數生長期、生長狀態良好的細胞用于實驗。
1.3 MK886抑制HT-29細胞增殖的最佳濃度確定 取對數生長期HT-29細胞接種于96孔板中,細胞密度為8×103個/孔,每孔加入100 μL的細胞懸液。隨機分為空白對照組、陰性對照組及試驗組,試驗組分別加入6個濃度的MK886(分別為200、100、75、50、25、12.5 μmol/L)干預,每個濃度均設5個復孔。空白對照組加入不含細胞的完全培養基;陰性對照組加入含細胞的完全培養基,不加MK886;試驗組分別加入含細胞及相應濃度MK886的完全培養基,分別培養24、48 h。每孔分別加入CCK-8溶液10 μL,繼續培養1 h,酶標儀450 nm波長處檢測各孔吸光度(A)值,計算不同濃度MK886作用24、48 h時HT-29細胞的增殖抑制率。細胞增殖抑制率(%)=(陰性對照組A-試驗組A)/(陰性對照組A-空白組A)×100%。試驗至少重復3次,取平均值。結果見表1。根據半數抑制濃度(IC50)軟件,不同濃度MK886作用24、48 h時的IC50分別為44.21、48.12 μmol/L,選取48.12 μmol/L為最佳作用濃度。
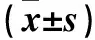
表1 不同濃度MK886作用24、48 h時HT-29細胞增殖抑制率比較
注:與12.5 μmol/L比較,*P<0.05;與25 μmol/L比較,△P<0.05;與50 μmol/L比較,▲P<0.05;與75 μmol/L比較,▽P<0.05;與100 μmol/L比較,▼P<0.05;與同濃度作用48 h比較,#P<0.05。
1.4 MK886對HT-29 細胞Ascl2 mRNA表達影響的觀察 采用RT-PCR法。取對數生長期HT-29細胞,以2×105個/mL密度接種于6孔板中常規培養。設對照組及觀察組,對照組不加MK886,觀察組加入48.12 μmol/L MK886,均培養24 h。采用TRIzol法提取各組總RNA,按說明書操作。采用酶標儀行定量檢測,RNA母液濃度=光密度(OD)260×0.04 μg/mL×50倍,OD260/OD280行純度評估(比值為1.8~2.2提示無RNA水解及蛋白污染)。按逆轉錄試劑盒說明書進行逆轉錄cDNA,反應條件:25 ℃ 10 min、42 ℃ 30 min、85 ℃ 5 min、4 ℃ 5 min。按擴增試劑盒說明書以cDNA為擴增模板。引物序列:Ascl2上游引物:5′-GGATGTACTCCACGGCTGAG-3′,下游引物:5′-CGTGAAGCTGGTGAACTTGG-3′,片段長度113 bp;β-actin內參上游引物:5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′,下游引物:5′-TGGCACCCAGCACAATGAA-3′,片段長度186 bp。PCR反應條件:95 ℃ 5 min、95 ℃ 15 s、60 ℃ 30 s、72 ℃ 10 s,共40個循環。擴增后的PCR產物經2%瓊脂糖凝膠電泳在凝膠成像系統下觀察目標條帶,結合擴增曲線及溶解曲線綜合分析有無非特異性擴增,以及結果是否可靠。采用2-ΔΔCT法計算mRNA相對表達量。試驗至少重復3次。
1.5 MK886對HT-29細胞Ascl2蛋白表達影響的觀察 采用Western blotting法。取對數生長期HT-29細胞,4×105個/mL密度接種于培養瓶中常規培養,并設對照組及觀察組。對照組加完全培養基,觀察組加入48.12 μmol/L MK886,分別作用24、48、72 h。收集細胞,加入細胞裂解液RIPA勻漿使其冰上充分裂解;4 ℃ 12 000 g/min離心30 min,收集上清液,BCA蛋白定量法檢測蛋白含量;加入等量的上樣緩沖液,沸水煮5 min至蛋白變性。以40 μg/μL的蛋白量上樣,常規電泳,轉膜,用5% BSA封閉;Ascl2多克隆抗體(1∶1 000)、小鼠抗人β-actin抗體(1∶1 000)作為一抗孵育4 ℃冰箱過夜,山羊抗兔、鼠IgG-HRP(1∶5 000)作為二抗孵育1 h,發光液發光,X線膠片感光,手動洗片機洗片。用全自動凝膠成像分析系統掃描膠片并測定各組蛋白電泳帶OD值,以Ascl2的OD值/β-actin的OD值計算Ascl2蛋白相對表達量。試驗至少重復3次。
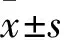
2 結果
2.1MK886對HT-29 細胞Ascl2mRNA表達的影響Ascl2擴增曲線光滑,溶解曲線呈單峰,PCR凝膠電泳顯示條帶單一,無雜帶及非特異性擴增,說明qRT-PCR結果特異性好,結果可靠。觀察組Ascl2mRNA的相對表達量為0.35±0.02,對照組為0.72±0.02,兩組比較P<0.01。
2.2MK886對HT-29 細胞Ascl2蛋白表達的影響 對照組Ascl2蛋白相對表達量為1.98±0.16,觀察組MK886作用24、48、72h時Ascl2蛋白相對表達量分別為1.75±0.13、1.10±0.15、0.71±0.19,與對照組比較均明顯降低(P均<0.05);且隨著MK886作用時間的延長,Ascl2蛋白相對表達量逐漸下調,存在時間依賴性(P均<0.05)。
3 討論
結直腸癌發病是多因素、多步驟、多階段共同作用的結果,但具體發病機制尚不十分清楚。大量研究證實,炎癥介質在結直腸癌的發生、發展過程中具有重要作用[7~10]。當炎癥因子刺激機體時,被激活的胞質型磷脂酶A2促使膜磷脂釋放AA,此時前體化合物AA經5-LOX途徑代謝最終產生白三烯類。其中5-LOX是AA生成白三烯類的關鍵限速酶,其數量和活性可調節下游產物的合成。有研究表明,5-LOX代謝通路中的蛋白在正常組織中不表達或低表達,在腫瘤組織中高表達,5-LOX與腫瘤細胞增殖、轉移及侵襲相關,并通過細胞外基質破壞、轉移、激活抗凋亡信號通路等促進腫瘤細胞增殖并抗凋亡,抑制該通路可以抑制腫瘤生長[11]。MK886是FLAP抑制劑,可阻止5-LOX的活化,抑制LOX途徑下游產物的形成從而發揮抑癌作用。近年來FLAP抑制劑已用于支氣管哮喘、類風濕性關節炎等炎癥性疾病的治療[12],但目前其用于結腸癌的報道少見。
Ascl2是一種基本的螺旋-環-螺旋結構的轉錄因子,在維持胚胎發展過程中滋養層細胞增殖方面發揮重要作用[13]。Jubb等[14]研究發現,Ascl2在結直腸腺癌中高表達,在正常組織中低表達甚至不表達;Ascl2的表達還具有部位特異性,只表達在胎盤和腸黏膜隱窩基底部Lgr5陽性的細胞中[13,14]。Ascl2是Wnt信號通路的靶基因,其轉錄因子的轉基因的過表達可誘導隱窩細胞的過度增殖和絨毛中異常隱窩的形成,敲除Ascl2基因可導致Lgr5陽性細胞的表達消失,故Ascl2基因功能的獲得或缺失可能控制著腸干細胞的“命運”[15]。Ziskin等[16]研究發現,在結直腸癌組織中Lgr5/Ascl2表達為74%~85%,且隱窩干細胞來源于Lgr5+/Ascl2+的細胞,主要依賴于Wnt/β-catenin信號通路參與結直腸癌的發生、發展[17]。腸黏膜上皮是哺乳動物中自我更新速度最快的上皮細胞,隱窩是細胞增殖最主要的場所,而干細胞循環池中的干細胞主要存在于隱窩基底部Lgr5陽性細胞中。研究表明,結直腸腫瘤干細胞來源于隱窩干細胞的異常增殖[18]。Ascl2基因能促進腫瘤細胞增殖、抑制其凋亡、促進其耐藥,具有腫瘤干細胞的特性;還可作為抑制結腸癌起始細胞的一個潛在靶點,其功能與miR-302b調控的相關機制有關,干擾Ascl2基因的表達可降低結腸癌細胞在體內外的成瘤能力。因此,Ascl2可作為結腸癌干細胞特異性的標志物之一,抑制Ascl2的表達可抑制結腸癌細胞增殖、侵襲及轉移。
本研究結果顯示,MK886不但可以抑制HT-29細胞增殖,還可下調Ascl2基因及其蛋白表達;說明MK886能抑制結腸癌細胞增殖,此為其應用于結直腸癌放化療的輔助靶向治療提供了理論基礎。腫瘤干細胞靶向治療是最近研究的熱點,但目前尚處于試驗階段,具體作用機制不清楚,有待后期進一步研究。
綜上所述,5-LOX活化蛋白抑制劑MK886能抑制結腸癌細胞增殖,其機制可能與下調Ascl2mRNA及其蛋白表達有關。
[1]DeSantisCE,LinCC,MariottoAB,etal.Cancertreatmentandsurvivorshipstatistics, 2014[J].CACancerJClin, 2014,64(4):252-271.
[2]RoyS,MajumdarAP.Signalingincoloncancerstemcells[J].JMolSignal, 2012,7(1):11.
[3]SteinhilberD,FischerAS,MetznerJ,etal. 5-lipoxygenase:underappreciatedroleofapro-inflammatoryenzymeintumorigenesis[J].FrontPharmacol, 2010(1):143.
[4]BrashAR.Arachidonicacidasabioactivemolecule[J].JClinInvest, 2001,107(11):1339-1345.
[5]AugustEM,NguyenT,MalinowskiNM,etal.Non-steroidalantiinflammatorydrugsandtumorprogression:inhibitionoffibroblasthyaluronicacidproductionbyindomethacinandmefenamicacid[J].CancerLett, 1994,82(1):49-54.
[6]DattaK,BiswalSS,KehrerJP.The5-lipoxygenase-activatingprotein(FLAP)inhibitor,MK886,inducesapoptosisindependentlyofFLAP[J].BiochemicalJ, 1999,340(Pt2):371-375.
[7]GrivennikovSI,GretenFR,KarinM.Immunity,inflammation,andcancer[J].Cell, 2010,140(6):883-899.
[8]RaoCV,JanakiramNB,MohammedA.Lipoxygenaseandcyclooxygenasepathwaysandcolorectalcancerprevention[J].CurrColorectalCancerRep, 2012,8(4):316-324.
[9]UllmanTA,ItzkowitzSH.Intestinalinflammationandcancer[J].Gastroenterology, 2011,140(6):1807-1816.
[10]RaoCV,ReddyBS.NSAIDsandchemoprevention[J].CurrCancerDrugTargets, 2004,4(1):29-42.
[11]GhoshJ.Inhibitionofarachidonate5-lipoxygenasetriggersprostatecancercelldeaththroughrapidactivationofc-JunN-terminalkinase[J].BiochemBiophysResCommun, 2003,307(2):342-349.
[12]Martel-PelletierJ,LajeunesseD,ReboulP,etal.Therapeuticroleofdualinhibitorsof5-LOXandCOX,selectiveandnon-selectivenonsteroidalanti-inflammatorydrugs[J].AnnRheumDis, 2003,62(6):501-509.
[13]MassariME,MurreC.Helix-loop-helixproteins:regulatorsoftranscriptionineucaryoticorganisms[J].MolCellBiol, 2000,20(2):429-440.
[14]JubbAM,ChalasaniS,FrantzGD,etal.Aehaete-scutelike2 (ascL2)isatargetofWntsignallingandisupregulatedinintestinalneoplasia[J].Oncogene, 2006,25(24):3445-3457.
[15]vanderFlierLG,vanGijnME,HatzisP,etal.Transcriptionfactorachaetescute-like2controlsintestinalstemcellfate[J].Cell, 2009,136(5):903-912.
[16]ZiskinJL,DunlapD,YaylaogluM,etal.Insituvalidationofanintestinalstemcellsignatureincolorectalcancer[J].Gut, 2013,62(7):1012-1023.
[17]CadiganKM,WatermanML.TCF/LEFsandWntsignalinginthenucleus[J].ColdSpringHarbPerspectBiol, 2012,4(11):a007906.
[18]FanaliC,LucchettiD,FarinaM,etal.Cancerstemcellsincolorectalcancerfrompathogenesistotherapy:controversiesandperspectives[J].WorldJGastroenterol, 2014,20(4):923-942.
貴州省高層次人才科研條件特助基金資助項目(TZJF-2011-32);貴州省科技計劃(黔科合S字[2007]1031)。
趙逵(E-mail: kuizhao95868@msn.com)
10.3969/j.issn.1002-266X.2016.44.014
R735.3
A
1002-266X(2016)44-0043-03
2016-01-20)

