miR-133b對骨肉瘤細胞MG-63增殖的抑制作用及其機制
林琰杰,于嘉智,魏傳銀
(1淄博市第一醫院,山東淄博255200;2濟南市兒童醫院)
?
miR-133b對骨肉瘤細胞MG-63增殖的抑制作用及其機制
林琰杰1,于嘉智2,魏傳銀1
(1淄博市第一醫院,山東淄博255200;2濟南市兒童醫院)
目的 探討miR-133b是否通過下調KLF4抑制骨肉瘤細胞系MG-63的增殖。方法 將MG-63細胞分為對照組、miR-NC組和miR-133bmimic組,對照組不做干預,miR-NC組轉染miR-NC,miR-133bmimic組轉染miR-133bmimic。24h后,Westernblotting法檢測MG-63細胞中與細胞增殖相關的蛋白p21、p27、PCNA、Ki-67以及KLF4的表達,12、24、48h后,MTT法觀察細胞增殖活力,利用熒光素酶試驗驗證KLF4是miR-133b的靶基因;將MG-63細胞隨機分為miR-133b組、miR-133b+KLF4組、miR-133b+空質粒組,分別轉染miR-133bmimic、miR-133bmimic+KLF4過表達質粒、miR-133bmimic+空質粒。檢測MG-63細胞中p21、p27、PCNA、Ki-67、KLF4的表達,并觀察細胞增殖情況。結果 相比于miR-NC組,miR-133bmimic組中,24、48hMG-63細胞的增殖活力降低(P均<0.01),PCNA、Ki-67、KLF4的表達減少,p21、p27表達增加(P均<0.05或<0.01)。熒光素酶試驗結果顯示,miR-133b能夠顯著降低KLF4-3′-UTR質粒的熒光素活性(P<0.05);相比于miR-133b+空質粒組,miR-133+KLF4組MG-63細胞中PCNA、Ki-67表達增加(P均<0.05),p21、p27表達減少(P均<0.01),細胞增殖率升高(P<0.01)。結論miR-133b通過下調KLF4表達從而抑制骨肉瘤細胞系MG-63的增殖。
骨肉瘤;miRNA-133b;Kruppel樣因子4;細胞增殖
微小RNA(miRNA)是一類長度為18~25個核苷酸的非編碼小RNA,主要作用于靶基因3′非翻譯區(3′ UTR),通過引起靶基因mRNA的降解或者抑制其翻譯,最終調節靶基因的表達[1]。miR-133b已被證實是一種抑癌miRNAs,可調節多種與腫瘤生長、轉移、侵襲有關的抑癌基因或蛋白,從而發揮抑制腫瘤進展的作用。但是miR-133b對骨肉瘤細胞增殖的影響尚未有研究報道。2015年2~8月,我們擬通過miR-133b轉染骨肉瘤細胞,探索miR-133b對骨肉瘤細胞增殖的作用及其可能的機制。
1 材料與方法
1.1 材料 人骨肉瘤細胞株MG-63購于上海拜力生物公司;DMEM培養液、胰蛋白酶(Sigma公司);胎牛血清(GIBCO公司) ;限制性內切酶BamHⅠ、XhoⅠ、T4DNA連接酶;RNA提取試劑(Invitrogen公司);Takara逆轉錄試劑盒(大連寶生物公司);SYBR Green熒光染料試劑盒(Roche公司);無內毒素質粒小、大提取試劑盒;兔或鼠抗人COL1A1、COL1A5、MMP-2、MMP-9、KLF4、β-actin、GAPDH多克隆抗體(ABCAM公司);脂質體2000(上海英駿公司);DAPI(Rcohe 公司);MTT(Emresco公司);辣根過氧化酶標記的山羊抗兔或者抗鼠二抗,FITC、FRITC標記的山羊抗兔IgG(jackson公司);細胞裂解液、蛋白濃度測定試劑盒、蛋白上樣緩沖液、凝膠配制試劑盒、預染蛋白質分子量標準、PVDF膜、封閉液、一抗稀釋液、二抗稀釋液(江蘇碧云天生物技術研究所)。
1.2 過表達質粒的構建 miR-133b-mimic由上海吉瑪公司設計合成,miR-133b-mimic序列:正義鏈:5′-UUUGGUCCCCUUCAACCAGCUA-3′,反義鏈:5′-UUCUCCGAACGUGUCACGUTT-3′。KLF4過表達質粒由上海吉瑪公司設計合成,通過Pubmed查找KLF4基因的序列,引物根據Genebank中KLF4 mRNA序列設計。其上游引物:5′-CGCGGATCCATGAGCAGCCACCTGGCGAGTC-3′;下游引物:5′-CCGCTCGAGTCATTAAAAATGCCTCTTCATGTGT-3′。KLF4基因和質粒DNA連接后,篩選重組質粒,測序驗證。
1.3 分組及處理 將MG-63細胞系接種至6孔板,生長至50%~70%密度時,以脂質體2000分別轉染miR-133bmimic或mimic-對照,KLF-過表達質粒或空質粒各100 pmol,24 h后提取總RNA后,PCR和Western blotting法鑒定轉染效率,進行后續試驗。 將一部分細胞隨機分為對照組、miR-NC組和miR-133bmimic組。對照組不做干預,miR-NC組轉染miR-NC,miR-133bmimic組轉染miR-133bmimic;將另一部分細胞隨機分為miR-133b組、miR-133b+KLF4組、miR-133b+空質粒組。miR-133b組細胞轉染miR-133bmimic,miR-133b+KLF4組細胞轉染miR-133bmimic和KLF4過表達質粒,miR-133b+空質粒組細胞轉染miR-133bmimic和空質粒。
1.4 各組MG-63細胞中miR-133b基因相對表達量的檢測 采用熒光定量RT-PCR法。采用TRIzol提取細胞中總RNA,將提取的RNA進行逆轉錄成cDNA。然后進行PCR反應。miR-133b引物:正義鏈5′-ACAGGCCGGGACAAGTGCAATA-3′;反義鏈:5′ -GCTGTCAACGATACGCTACGTAACG -3′。反應條件: 94 ℃ 15 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共循環40次;最后72 ℃延伸8 min。取內參照β-actin擴增產物及PCR產物進行瓊脂糖凝膠電泳,紫外燈下觀察結果。采用凝膠圖像分析系統對電泳條滯進行密度掃描。目的基因mRNA=2ΔΔCT。ΔCT=目的基因Ct-內參基因Ct。
1.5 各組MG-63細胞中p27、PCNA、Ki-67、KLF4蛋白相對表達量的檢測 采用Western blotting法。提取細胞總蛋白,BCA法定量蛋白,SDS-PAGE膠每孔加入30 μL樣品,70 V、30 min進行蛋白濃縮,100 V、2 h進行蛋白電泳,并用孔徑0.45 μm的PVDF膜250 mA 、90 min進行轉膜。轉膜后常溫下TBST洗膜3次、封閉1 h后,以1∶1 000濃度加入兔(鼠)抗人p21一抗(或抗p27、PCNA、Ki-67、KLF4、β-actin、GAPDH一抗),4 ℃孵育過夜,常溫下TBST洗膜3次,辣根過氧化物酶標記羊抗兔(鼠)二抗孵育后,ECL化學發光法檢測蛋白。柯達膠片暗室顯影,Quantity one軟件分析。 結果以目標蛋白與內參的灰度比值表示。
1.6 各組MG-63細胞增殖活力的檢測 采用MTT法。MG-63細胞按上述分組加入96孔板,每組設3個復孔,2個無細胞的空白孔。培養細胞24、48、72 h。培養結束后,每孔加入MTT液20 μL,37 ℃繼續孵育4~6 h,棄培養液,每孔加入150 μL DMSO,振蕩10 min,選擇492 nm波長在酶標儀測定各孔A值并記錄。以時間為橫軸,吸光值為縱軸繪制各組MG-63細胞生長曲線。A值代表細胞增殖活力。
1.7 miR-133b靶蛋白的檢測 采用熒光素酶試驗。由上海吉凱生物公司設計合成KLF4-3′-UTR的序列(5′GCAAACUGGCAUCGGACCAAAA3′)及突變序列(5′GCAUACUGACAUCGCAACAAUA3′),以KLF4質粒為載體,分別構建能夠表達熒光素酶的包含KLF4-3′-UTR和KLF4-3′-UTR突變序列的質粒,然后將MG-63細胞系按每孔1×105接種至24孔板,24 h后以脂質體2000共轉染200 ng 包含KLF4-3′-UTR(KLF4-3′-UTR組)或KLF4-3′-UTR突變序列(KLF4-3′-UTR突變組)的熒光素酶質粒和80 ng 海腎熒光質粒以及60 pmol miRNA-133b-mimic或對照,48 h后用熒光檢測儀檢測熒光強度,海腎熒光作為內參照,每組試驗重復3次。
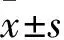
2 結果
2.1 各組miR-133bmRNA及p21、p27、PCNA、Ki-67、KLF4蛋白的相對表達量比較 見表1。相比于對照組和miR-NC組,miR-133bmimic組中miR-133b的表達升高(P均<0.01),PCNA、Ki-67、KLF4表達減少,p21、p27表達增加(P<0.01或<0.05)。
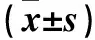
表1 各組MiR-133b mRNA及p21、p27、PCNA、Ki-67、KLF4蛋白相對表達量的比較
注:與miR-NC組比較,*P<0.05,**P<0.01。
2.2 各組不同時間A值比較 對照組12、24、48 h A值分別為 0.32±0.04、 0.54±0.08、 0.91±0.19, miR-NC組分別為0.34±0.08、0.62±0.11、0.97±0.14,miR-133bmimic組分別為0.31±0.05、0.39±0.11、0.61±0.09,與miR-NC組比較,miR-133bmimic組24、48 h A值低(P<0.05或<0.01)。
2.3 miR-133b對KLF4的抑制作用 miR-KLF4-3′-UTR突變組熒光素酶活性(0.92±0.14)顯著低于KLF4-3′-UTR組(0.34±0.05),兩組比較,P<0.01。
2.4 過表達KLF4對miR-133b抑制MG-63細胞侵襲的逆轉作用 miR-133b組12、24、48 h A值分別為0.34±0.05、0.44±0.09、0.61±0.09,miR-133b+空質粒組分別為0.31±0.08、0.42±0.12、0.57±0.14,miR-133b+KLF4組分別為0.36±0.06、0.62±0.14、1.21±0.29,與miR-133b+空質粒組比較,miR-133b+KLF4組升高(P<0.05或<0.01)。miR-133b組p21、p27、PCNA、Ki-67的相對表達量分別為0.95±0.14、0.73±0.05、0.22±0.01、0.32±0.02,miR-133b+空質粒組分別為0.97±0.15、0.76±0.06、0.27±0.01、0.37±0.06,miR-133b+KLF4組分別為0.71±0.12、0.38±0.04、0.74±0.12、0.82±0.09。相比于miR-133b組和miR-133b+空質粒組,miR-133b+KLF4組MG-63細胞中PCNA、Ki-67表達增加(P均<0.01),p21、p27表達減少(P均<0.01)。
3 討論
增殖和轉移是惡性腫瘤的基本生物學特征,不僅與腫瘤細胞的侵襲性增強、黏附能力下降有關,還與腫瘤的血管生成、細胞外基質的降解及間質重構等密切相關[2]。因此,抑制腫瘤細胞增殖對臨床治療腫瘤有重要意義。
miRNAs是一類進化上高度保守的非編碼小分子單鏈RNA,越來越多的證據顯示miRNAs參與了對腫瘤細胞遷移侵襲和細胞表型的調控[3]。miR-133b是一種抑癌miRNAs,可調節多種與腫瘤生長、侵襲、轉移調節有關的抑癌基因或蛋白,從而促進多種腫瘤的發生發展[4,5]。有研究通過篩查檢測31例結腸癌患者腫瘤標本和癌旁正常結腸組織中幾種miRNA表達,發現miR-133b在結腸癌組織中表達降低。最近也有研究證實,miR-133b可以調控卵巢癌細胞、惡性膠質瘤細胞的增殖和侵襲,并與腫瘤患者的預后密切相關[6]。與此同時,國內Liu等[7]的研究發現,miR-133bmimic可以通過下調肌動蛋白聚合蛋白1從而抑制胃癌細胞的增殖和侵襲。本研究結果顯示miR-133b可以抑制MG-63細胞的增殖,可以抑制MG-63細胞Ki-67、PCNA的表達,增加p21、p27的表達,提示miR-133b具有抑制MG-63細胞增殖的能力。
KLF4是真核鋅指蛋白轉錄因子,在細胞增殖分化、血管生成和腫瘤轉移進展等多種生理、病理過程中起著重要作用[8]。過去的研究顯示在肺癌、前列腺癌、結腸癌和胃癌等上皮源性腫瘤中KLF4表達升高,表明KLF4的表達與多種腫瘤的發生相關[9,10]。之后Yoshihama等[11,12]研究發現,KLF4的表達與腫瘤的預后相關,可作為腫瘤靶向治療的一個靶點。最近國內有研究顯示,miRNA-7通過抑制KLF4/PI3K/AKT/p21通路抑制前列腺癌細胞增殖。與此同時,Ma等發現miRNA-10也可以通過抑制KLF4從而抑制胃癌細胞的侵襲。與上述實驗結果相符,我們通過熒光素酶試驗發現miR-133b可以與KLF4的3′-UTR靶向結合,減少KLF4的表達。鑒于KLF4在腫瘤細胞增殖中的重要性,我們進一步用KLF4過表達質粒轉染MG-63細胞,發現KLF4過表達質粒的轉染可以逆轉miRNA-133b抑制MG-63細胞增殖的作用,最終證實miRNA-133b是通過抑制KLF4的表達,從而發揮抑制MG-63細胞增殖的作用。
[1] Iwakawa HO, Tomari Y. The functions of microRNAs: mRNA decay and translational repression[J]. Trends Cell Biol, 2015,25(11):651-665.
[2] Yio X, Diamond M, Zhang JY, et al. Trefoil factor family-1 mutations enhance gastric cancer cell invasion through distinct signaling pathways[J]. Gastroenterology, 2006,130(6):1696-1706.
[3] Zhao Y, Samal E, Srivastava D. Serum response factor regulates a muscle-specific microRNA that targets Hand2 during cardiogenesis[J]. Nature, 2005,436(7048):214-220.
[4] Yao C, Sun M, Yuan Q, et al. MiRNA-133b promotes the proliferation of human Sertoli cells through targeting GLI3[J]. Oncotarget, 2016,7(3):2201-2219.
[5] Lv LV, Zhou J, Lin C, et al. DNA methylation is involved in the aberrant expression of miR-133b in colorectal cancer cells[J]. Oncol Lett, 2015,10(2):907-912.
[6] Chang L, Lei X, Qin YU, et al. MicroRNA-133b inhibits cell migration and invasion by targeting matrix metalloproteinase 14 in glioblastoma[J]. Oncol Lett, 2015,10(5):2781-2786.
[7] Liu X, Li G. MicroRNA-133b inhibits proliferation and invasion of ovarian cancer cells through Akt and Erk1/2 inactivation by targeting epidermal growth factor receptor[J]. Int J Clin Exp Pathol, 2015,8(9):10605-10614.
[8] Liao X, Zhang R, Lu Y, et al. Kruppel-like factor 4 is critical for transcriptional control of cardiac mitochondrial homeostasis[J]. J Clin Invest, 2015,125(9):3461-3476.
[9] Ma Z, Chen Y, Min L, et al. Augmented miR-10b expression associated with depressed expression of its target gene KLF4 involved in gastric carcinoma[J]. Int J Clin Exp Pathol, 2015,8(5):5071-5079.
[10] Chang YL, Zhou PJ, Weil L, et al. MicroRNA-7 inhibits the stemness of prostate cancer stem-like cells and tumorigenesis by repressing KLF4/PI3K/Akt/p21 pathway[J]. Oncotarget, 2015,6(27):24017-24031.
[11] Yoshihama R, Yamaguchi K, Imajyo I, et al. Expression levels of SOX2, KLF4 and brachyury transcription factors are associated with metastasis and poor prognosis in oral squamous cell carcinoma[J]. Oncol Lett, 2016,11(2):1435-1446.
[12] Muller M, Hermann PC, Liebau S, et al. The role of pluripotency factors to drive stemness in gastrointestinal cancer[J]. Stem Cell Res, 2016,16(2):349-357.
魏傳銀(E-mail:weichuanyinsdzb@sina.com)
10.3969/j.issn.1002-266X.2016.45.012
R738.3
A
1002-266X(2016)45-0040-03
2016-06-06)

