拉米夫定對人肝癌細胞MMP-9及p53蛋白表達的影響
王雪,楊偉,李靖,馬存花
(1勝利油田中心醫院,山東東營257000;2中國人民解放軍第89醫院;3濰坊醫學院)
?
拉米夫定對人肝癌細胞MMP-9及p53蛋白表達的影響
王雪1,楊偉2,李靖2,馬存花3
(1勝利油田中心醫院,山東東營257000;2中國人民解放軍第89醫院;3濰坊醫學院)
目的 探討拉米夫定作用于人肝癌細胞系HepG2.2.15后對細胞中基質金屬蛋白酶9(MMP-9)及p53蛋白表達的影響。方法 不同濃度(100、200、300 μg/mL)拉米夫定(拉米夫定100、200、300 μg/mL組)作用于HepG2.2.15細胞不同時間(3、6 d),并設立不應用拉米夫定的HepG2.2.15細胞作為對照組。MTT比色法測定細胞增殖活性;ELISA法測定細胞培養上清及細胞中MMP-9及p53蛋白相對表達量。結果 拉米夫定100、200、300 μg/mL組與對照組不同時間細胞增殖活力比較差異無統計學意義(P均>0.05)。作用3、6 d,與對照組比較,拉米夫定各處理組HepG2.2.15細胞及其培養液中MMP-9及p53蛋白表達水平均明顯降低(P均<0.05)。結論 拉米夫定作用后HepG2.2.15細胞MMP-9及p53蛋白水平降低。
肝腫瘤;HepG2.2.15細胞;基質金屬蛋白酶9;p53蛋白;拉米夫定
肝癌(HCC)是臨床常見、惡性程度較高的腫瘤。在亞洲和非洲,HCC發病主要與感染乙肝病毒(HBV)有關[1]。HCC的特點是早期轉移,由腫瘤細胞和微環境中分泌的生物分子,如基質金屬蛋白酶9(MMP-9)、p53,在其發展和轉移的關鍵環節發揮了重要作用。拉米夫定作為核苷類似物,可通過終止HBV DNA鏈合成抑制HCC發展[2]。2015年6月~2016年5月,本研究用拉米夫定作用于人HCC細胞系HepG2.2.15,對其細胞內和細胞培養上清液中MMP-9及p53蛋白表達進行檢測,探討拉米夫定治療HCC的分子機制。
1 材料與方法
1.1 材料 人HCC細胞系HepG2.2.15(上海博谷生物科技有限公司),α-MEM培養基、胎牛血清(Gibco),G418(北京格林博遠生物科技有限公司),胰蛋白酶/EDTA、青鏈霉素混合液、PBS、MTT細胞增殖及細胞毒性檢測試劑盒(北京Solarbio公司),拉米夫定(葛蘭素史克公司),MMP-9及p53試劑盒(上海博谷生物科技有限公司)。
1.2 細胞培養及分組 常規復蘇HepG2.2.15細胞,用含10%胎牛血清的α-MEM培養基(含青霉素100 U/mL、鏈霉素100 μg/mL、G418 200 μg/mL),于5% CO2、37 ℃孵育箱中培養。3~4 d更換1次培養基。待細胞生長至80%~90%融合度時使用胰蛋白酶/EDTA消化,按比例1∶3傳代。取對數期HepG2.2.15細胞,用胰蛋白酶/EDTA消化,細胞計數,調整細胞懸液濃度,按照104/孔接種于96孔板。設對照組(加細胞、培養基)和拉米夫定100、200、300 μg/mL組。拉米夫定100、200、300 μg/mL組添加不同濃度(100、200、300 μg/mL)拉米夫定200 μL。每組設5個復孔,于5% CO2、37 ℃孵育箱中培養。
1.3 細胞增殖活力的檢測 采用MTT法。分別于拉米夫定干預后0、2、4、6、8 d采用MTT法測定每組細胞增殖情況。操作:吸棄上清,加入無血清培養基90 μL及MTT 10 μL,于5% CO2、37 ℃孵育箱中培養4 h。吸棄上清,每孔加入Formazan溶解液110 μL,振蕩10 min,待結晶物充分溶解后,用酶標儀測各孔波長490 nm處吸光度(A)值,計算均值。
1.4 細胞及其培養上清液中MMP-9、p53蛋白表達檢測 采用ELISA法。分別于拉米夫定干預后3、6 d收集細胞及其上清液。胰酶消化回收細胞,12 000 r/min離心5 min后棄上清液,加PBS 200 μL重懸。液氮 37 ℃水浴反復凍融法裂解細胞,重復3次。12 000 r/min離心10 min,留取上清液,-70 ℃凍存。嚴格按照ELISA試劑盒說明書測定細胞及培養上清液中MMP-9、p53蛋白表達。
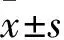
2 結果
2.1 各組不同時間細胞增殖活力比較 拉米夫定100、200、300μg/mL組與對照組不同時間細胞增殖活力比較差異無統計學意義(P均﹥0.05)。見表1。
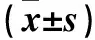
表1 各組不同時間細胞增殖活力比較
2.2 各組細胞及其培養上清液中MMP-9、p53蛋白表達比較 干預后第3、6天,與對照組比較,拉米夫定各處理組HepG2.2.15細胞及其培養上清液中MMP-9、p53蛋白表達水平均降低(P均<0.05)。見表2、3。

表2 各組細胞及其上清液中MMP-9蛋白表達比較
注:與對照組同時點比較,*P<0.05。

表3 各組細胞及其上清液中p53蛋白表達比較
注:與對照組同時點比較,*P<0.05。
3 討論
VEGF可以增強細胞通透性,尤其是微小血管的通透性,引起血漿蛋白滲漏到細胞外基質,在細胞外基質中沉著,為成纖維細胞和血管內皮細胞的遷入提供條件基質,為腫瘤細胞的生長和新生毛細血管網的建立提供營養。MMP-9作為一種明膠酶,可以有效降解細胞外基質中Ⅳ、Ⅴ型膠原和明膠。研究發現,MMP-9與多種惡性腫瘤侵襲轉移存在一定的關系[3~5]。Riedel等[6]報道,MMP-9可作為腫瘤血管形成的調控因素參與腫瘤血管形成。其發揮作用時能在細胞表面激活MMP-2,并促進MMPs家族其他因子的活化,共同發揮降解細胞外基質的作用[7,8]。在腫瘤細胞復雜的轉移和浸潤過程中,MMP-9可通過刺激腫瘤細胞遷移、侵襲,促進血管生成而在腫瘤的發生發展中起核心作用[9,10]。有研究發現,MMP-9與HCC、膠質瘤、乳腺癌等多種腫瘤的浸潤、轉移和術后復發相關[11,12]。此外,MMPs還可以增強血管生長因子的作用,促進新生血管形成[13,14],已逐漸成為抗腫瘤治療中重要的藥物作用靶點。p53基因是目前研究較早的抑癌基因,分為突變型和野生型。野生型p53是抑癌基因,對細胞增殖起負調控作用。野生型p53突變后失去抑癌基因功能,并且與野生型p53結合成復合物,抑制p53基因功能,導致細胞異常增殖,可誘導一些異常基因表達,促進腫瘤發生;可以下調抑制血管增生的凝血酶的反應素-1和上調促血管增生的VEGF,因而成為調控腫瘤血管形成的重要因素。
HCC的特點是早期轉移,MMP-9及p53基因在其中起了關鍵作用。HBV是HCC公認的致病因子,它在細胞內的復制有可能激發p53,使其表達升高、功能增強,進而可能導致細胞某些生物學活性(如細胞凋亡、細胞周期等)改變。有研究證實,p53失活與MMP-9的表達在HCC發展中起協同作用。Franchi等認為,p53的突變可以上調MMP-9基因轉錄,并且通過NOS和EGFR途徑影響MMP-9的表達。本試驗中,拉米夫定各處理組與對照組細胞增殖活力差異無統計學意義,而拉米夫定各處理組細胞及上清液中p53及MMP-9蛋白的表達均降低,提示拉米夫定并不是通過直接抑制腫瘤細胞的增殖來抑制腫瘤生長,而是通過某種機制導致p53、MMP-9的表達降低進而抑制HCC的侵襲轉移。試驗結果提示:核苷類藥物不僅可以抑制HBV復制,還可能通過某種機制降低p53及MMP-9的表達,從而抑制HCC的發生和進展。
[1] Lupberger J, Hildt E. Hepatitis B virus-induced oncogenesis[J].World J Gastroenterol, 2007,13 (1):74-81.
[2] Dienstag JL, Schiff ER, Wright TL. Lamivudine as initial treatment for chronic hepatitis B in the United States[J]. N Engl J Med, 1999,341(17):1256.
[3] Raghu H, Sodadasu PK, Malla RR, et al. Localization of uPAR and MMP-9 in lipid rafts is critical for migration,invasion and angiogenesis in human breast cancer cells [J]. BMC Cancer, 2010,24(10):647.
[4] Canete A, Gerrard M, Rubie H, et al. Poor survival for infants with MYCN-amplified metastatic neuroblastoma despite intensified treatment: the International Society of Paediatric Oncology European Neuroblastoma Experience[J]. J Clin Oncol, 2009,27(7):1014-1019.
[5] Park JR, Eggert A, Caron H. Neuroblastoma: biology, prognosis and treatment[J]. Pediatr Clin North Am, 2008,55(1):97-103.
[6] Riedel F, Gotte K, Schwalb J, et al. Expression of 92 KD type Ⅳ collagenase correlates with angiogenic markers and poor survival in head and neck squamous cell carcinoma[J]. Int J Oncol, 2000,17(6):1099-1105.
[7] Zarrabi K, Dufour A, Li J, et al. Inhibition of matrix metalloproteinase 14(MMP-14)mediated cancer cell migration[J]. J Biol Chem, 2011,286(38):33167-33177.
[8] Koyama Y, Naruo H, Yoshitomi Y, et al. Matrix metalloproteinase-9 associated with heparan sulphate chains of GPI anchored cell surface proteoglycans mediates motility of murine colon adenocarcinoma cells[J]. J Biochem, 2008,143(5):581-592.
[9] Chen JS, Huang XH, Wang Q, et al. Sonic hedgehog signaling pathway induces cell migration and invasion through focal adhesion kinase/AKT signaling-mediated activation of matrix metallo proteinase(MMP)-2 and MMP-9 in liver Cancer[J]. Carcinogenesis, 2013,34(1):10-19.
[10] Cockrada AM, Medjkane S, Janski N, et al. SMYD3 promotes Cancer invasion by epigenetic upregulation of the metalloproteinase MMP-9[J]. Cancer Res, 2012,72 (3):810-820.
[11] Chetty C, Ponnala S, Gujrati M, et al. Knockdown of MMP-9 inhibits radiation-induced invasive phenoltype, angiogenesis and tum or growth in glioma cancer stem cell [J]. Cancer Res, 2013,73(8s):4907.
[12] 夏慶安,付玉環,姜廣建.HSG、MMP-9和MMP-2在乳腺癌組織中的表達及意義[J].現代預防醫學,2012,39 (2):323-324,327.
[13]Yu C, Pan K, Xing D, et al. Correlation between a single nucleotide polymorphism in the matrix metallopro teinase-2 promoter and risk of lung cancer[J]. Cancer Res, 2002,62(22):6430-6433.
[14] Huo N, Ichikawa Y, Kamiyama M, et al. MMP-7(matrilysin)accelerated growth of human umbilical vein endothelial cells[J]. Cancer Lett, 2002,177(1):95-100.
楊偉(E-mail:ywcyw723@sina.com)
10.3969/j.issn.1002-266X.2016.45.013
R735.7
A
1002-266X(2016)45-0043-03
2015-09-28)

