高產洛伐他汀棒曲霉菌株的篩選、鑒定及發酵條件優化
章 婷, Bedelkhan Almagul, 鄭婕施, 韓肖飛, 任 浩, 蔣冬花
浙江師范大學 化學與生命科學學院, 浙江 金華 321004
高產洛伐他汀棒曲霉菌株的篩選、鑒定及發酵條件優化
章 婷, Bedelkhan Almagul, 鄭婕施, 韓肖飛, 任 浩, 蔣冬花*
浙江師范大學 化學與生命科學學院, 浙江 金華 321004
從不同生境(食品、土壤、空氣、有機質等)收集到的自然發酵樣品中分離得到150株曲霉屬菌株。用高效液相色譜(HPLC)法檢測發酵液中洛伐他汀(Lovastatin)含量,篩選獲得1株穩定高產Lovastatin的曲霉菌株(編號:Ac-32)。根據菌落形態特征并結合18S rDNA測序,鑒定其為棒曲霉(Aspergillusclavatus)。通過搖瓶發酵單因素實驗優化了碳氮源種類、碳氮源含量、碳氮比(C/N)、發酵溫度、初始pH、轉速、種齡和接種量,確定了棒曲霉菌株Ac-32 搖瓶發酵產Lovastatin的適宜條件為:乳糖為碳源、蛋白胨為氮源、碳源含量為100 g/L、氮源含量為12 g/L、碳氮比(C/N)為15∶1.8、溫度28 ℃、轉速180 r/min、初始pH 5.2、種齡4 d、接種量6%。采用Minitab 17 軟件的P-B實驗設計法,篩選對Lovastatin產量有顯著影響的因素為:溫度、pH、碳源含量和氮源含量。根據P-B實驗結果,運用響應面法分析,確定棒曲霉菌株Ac-32產Lovastatin的最優條件為:碳源含量100 g/L,氮源含量11.8 g/L,溫度28 ℃,pH 5.2。在此條件下,Lovastatin最高產量為236.221 μg/mL。
棒曲霉; 洛伐他汀; 響應面; 發酵條件
洛伐他汀(Lovastatin)是一種羥甲基戊二酞輔酶A還原酶的強效抑制劑,有強效的降膽固醇、降血脂作用,因在高血脂、動脈粥樣硬化及心腦血管疾病的防治中作用機理明確、臨床療效顯著,已成為治療心血管疾病的最暢銷藥品之一[1,2]。此外,其可通過限制膽固醇和脂肪酸合成而抑制腫瘤細胞增長,還有報道稱其可用于抑郁癥的治療[3-6]。
曲霉是重要的工業微生物資源[7,8]。Lovastatin是曲霉(Aspergillus)的次級代謝產物[2,4]。1980年,Alberts等[9]從土曲霉(A.terreus)中提取出Lovastatin。美國Merck公司將其作為降脂藥投放市場,成為降血脂藥物研究進展的里程碑[9,10]。隨后,美國、日本等國家以發酵方法開發出一系列Lovastatin藥物。相比之下,我國在利用降脂曲霉產Lovastatin的研發及生產中,普遍存在Lovastatin產量低、生產成本高等問題。因此,選育穩定高產Lovastatin的曲霉菌株對并其發酵工藝條件進行優化[10,11],具有現實意義[12]。
1 材料與方法
1.1 材料
1.1.1 菌株、試劑、及培養基
曲霉屬菌株:從不同生境(食品、土壤、有機質等)收集的自然發酵樣品,經分離篩選得到曲霉屬純菌株。
色譜級乙腈購自德國Fisher Scientific 公司,色譜級甲醇購自德國Merck公司,分析純磷酸購自國藥集團化學試劑有限公司。
PDA培養基(g/L):馬鈴薯200、葡萄糖20、瓊脂15、水、pH 5.5。
種子培養基(g/L):馬鈴薯200、葡萄糖20、牛肉膏5、水、pH 5.2。
發酵培養基(g/L):乳糖100、蛋白胨12、MgSO4·7 H2O 1、KH2PO41、NaCl 2、水、pH 5.2。
1.2 方法
1.2.1 曲霉菌株的分離純化
從食品、土壤、有機質等發酵樣品表面挑取少量菌絲接入PDA培養基平板表面,28 ℃培養2 d ~3 d,顯微鏡觀察具有曲霉的典型特征,挑出純化3次得性狀均一的曲霉純菌株,編號保存于25%的甘油中,放置-40 ℃冰箱中備用。
1.2.2 高產Lovastatin曲霉菌株的篩選
保存的曲霉屬各菌株在PDA培養基上28 ℃活化培養3 d后,取2菌餅(直徑0.8 cm)接種于種子培養基(裝液量50 mL/250 mL三角瓶)中,28 ℃、180 r/min培養2 d,然后按6%接種量轉接到發酵培養基中,28 ℃、180 r/min培養7 d,發酵液用于檢測Lovastatin的含量[13],從中篩選高產Lovastatin曲霉菌株。
1.2.3 HPLC法檢測發酵液中Lovastatin含量
取發酵液0.4 mL,加入甲醇1.6 mL,超聲20 min,50 ℃水浴2 h,3 000 r/min離心3 min,取上清液過有機膜,HPLC法檢測。色譜條件:Agilent Prep-C18 液相色譜柱,檢測波長:λ= 237 nm,柱溫28 ℃。
1.2.4 菌株鑒定
顯微鏡觀察菌絲、分生孢子頭、分生孢子梗、頂囊、分生孢子等形態特征,并拍照。提取曲霉菌株Ac-32的基因組DNA,擴增18S rDNA基因,送上海生物工程公司測序。根據形態特征、18S rDNA基因序列,參考曲霉屬《The GenusAspergillus》分種檢索表,確定目的菌株的分類地位。
1.2.5 培養基配方及搖瓶發酵條件優化
菌株活化、種子液和發酵液制備方法同1.2.2。采用單因素實驗對培養基配方(碳源種類,氮源種類,碳源含量,氮源含量,碳氮比C/N)和發酵條件(溫度、初始pH、搖床轉速、接種量、種齡)進行優化(實驗做3個平行)。
1.2.6 篩選影響Lovastatin產量的關鍵因素
采用Minitab 17 軟件的Plackett-Burman實驗設計法,以溫度(X1),pH(X2),碳源含量(X3),氮源含量(X4),轉接量(X5),轉速(X6),種齡(X7)進行7因子2水平的設計,以Lovastatin產量(Y)為響應值,篩選影響Lovastatin產量的關鍵因素。各因子的編碼水平和取值如表1所示。

表1 Plackett-Burman實驗設計
1.2.7 響應面方法優化培養基配方及發酵條件
根據所篩選出的影響顯著的關鍵因素,運用Design Expert軟件設計響應面Box-Behnken實驗,以Lovastatin產量為響應值,對實驗數據進行分析[14-16],建立回歸方程并描述各因子對響應值的影響,用響應面圖直觀呈現分析結果,同時求出響應值最大時各因子的水平[16]。
2 結果與分析
2.1 從不同生境中分離純化得到的曲霉菌株
從各地不同生境收集的自然發酵樣品(食品、土壤、有機質等)中分離純化得到150株曲霉。編號后加25%甘油保藏于-40 ℃冰箱中。不同曲霉菌株的菌落、分生孢子頭、分生孢子梗、頂囊、分生孢子等形態特征各不相同,表明來源于不同生境的曲霉菌株具有豐富的多樣性(圖1)。
2.2 高產Lovastatin曲霉菌株的篩選
用HPLC法對150株曲霉純菌株發酵液進行Lovastatin產量檢測,其中有46株曲霉菌株檢測不到Lovastatin,102株曲霉菌株Lovastatin產量分布在10 μg/mL ~50 μg/mL范圍,2株曲霉菌株產量達到70 μg/mL以上,圖2為50株代表性曲霉菌株的Lovastatin產量統計分析結果,表明不同曲霉菌株Lovastatin產量存在顯著差異。經比較分析32號曲霉菌株的Lovastatin產量最高最穩定,達75.382 μg/mL,并命名為Ac-32,后續以該菌株為實驗的出發菌株。
2.3 曲霉菌株Ac-32的鑒定結果
2.3.1 曲霉菌株Ac-32的形態特征
曲霉菌株Ac-32 在PDA平板上培養5 d后,菌落呈灰藍色,邊緣白色,菌落直徑約45 mm,質地粉粒狀,有環形溝紋(圖3A)。顯微鏡下觀察,菌絲光滑,有隔膜,直徑6 μm~8 μm分支狀;分生孢子頭呈棒形,長度達300 μm,直徑達200 μm;分生孢子梗莖長短不一,500 μm~ 1 000 μm不等,直徑30 μm~50 μm;頂囊膨大成為棍棒形,長度達250 μm,直徑50 μm~60 μm;產孢結構單層,瓶梗密集著生于頂囊的全部表面,(8~12) μm×(2~3) μm(圖3B、3C);分生孢子暗藍綠色,橢圓形,表面光滑,(3~4.5) μm×(2.5~3) μm(圖3D);未見菌核及有性階段。


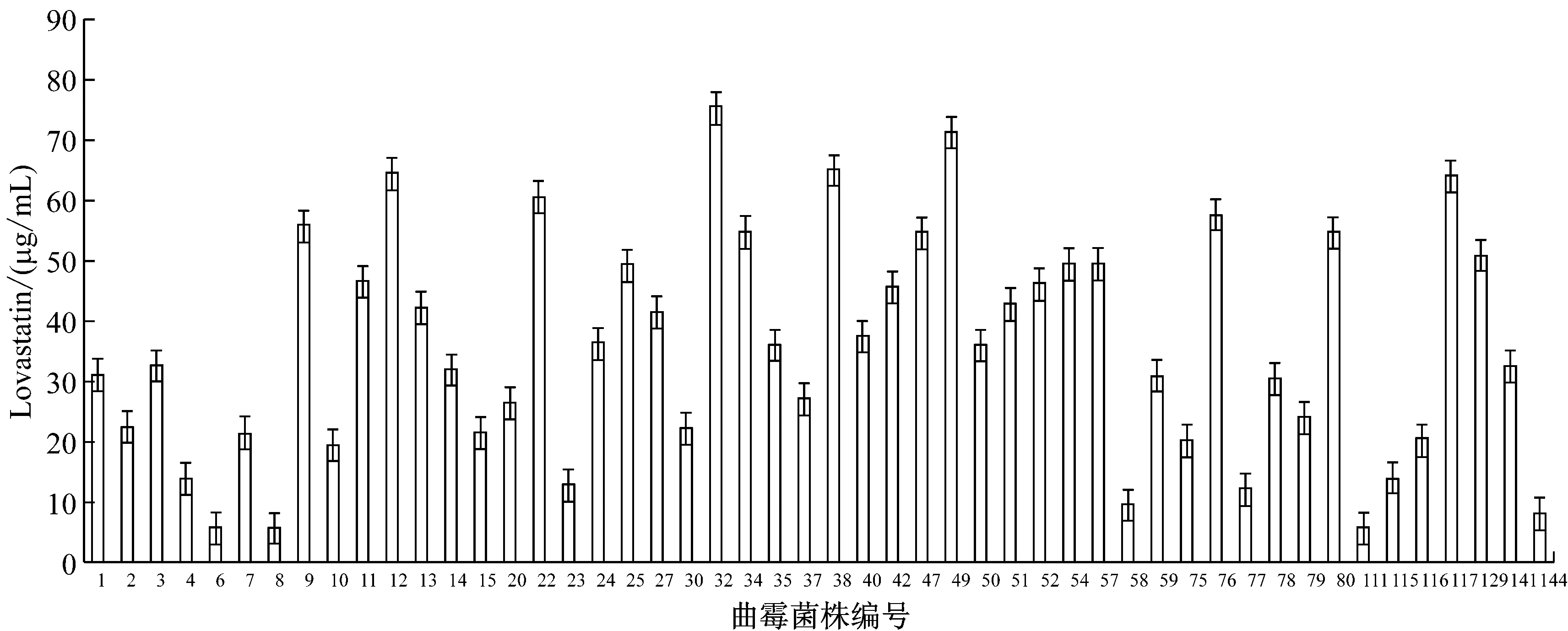
圖2 50株代表性曲霉菌株的Lovastatin產量
2.3.2 曲霉菌株Ac-32的18S rDNA序列分析
經上海生工公司測序,曲霉菌株Ac-32的18S rDNA序列長度為1 329 bp(圖3E,序列結果未顯示),系統發育樹分析表明,與棒曲霉(A.clavatus)的相似度最高,達99%(圖3F)。
2.3.3 曲霉菌株Ac-32的鑒定結果
根據曲霉菌株Ac-32的形態特征,參考曲霉屬分種檢索表,鑒定為棒曲霉(A.clavatus)。
2.4 培養基配方及發酵條件優化
以發酵液中Lovastatin含量為指標,經單因素實驗優化,曲霉菌株Ac-32產Lovastatin的適宜條件為:以乳糖為碳源、蛋白胨為氮源、碳源含量為100 g/L、氮源含量為12 g/L、C/N為15∶1.8、溫度為28 ℃、pH為5.2、搖床轉速為180 r/min、種齡為4 d、接種量為6%時,曲霉菌株Ac-32發酵產Lovastatin的水平最高,達144.021 μg/mL,比優化前提高了1.91倍(圖4)。
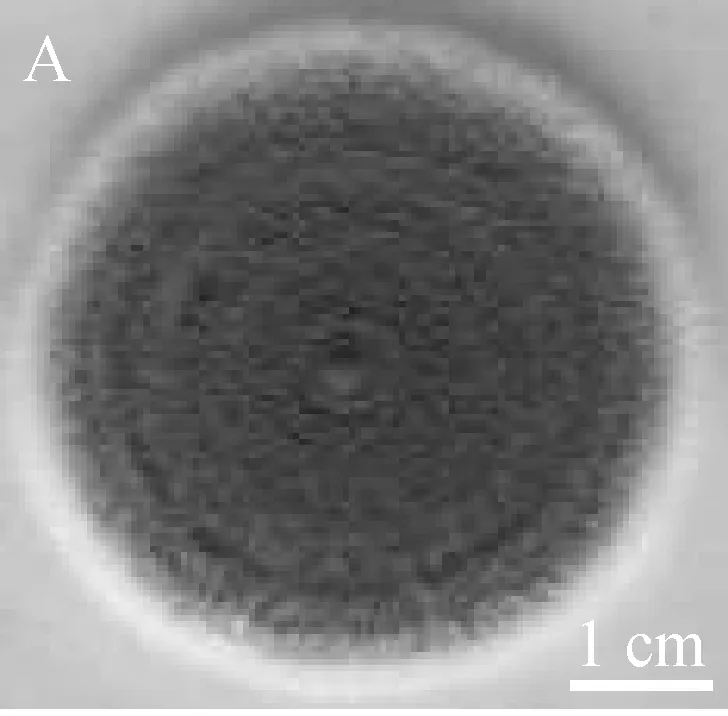
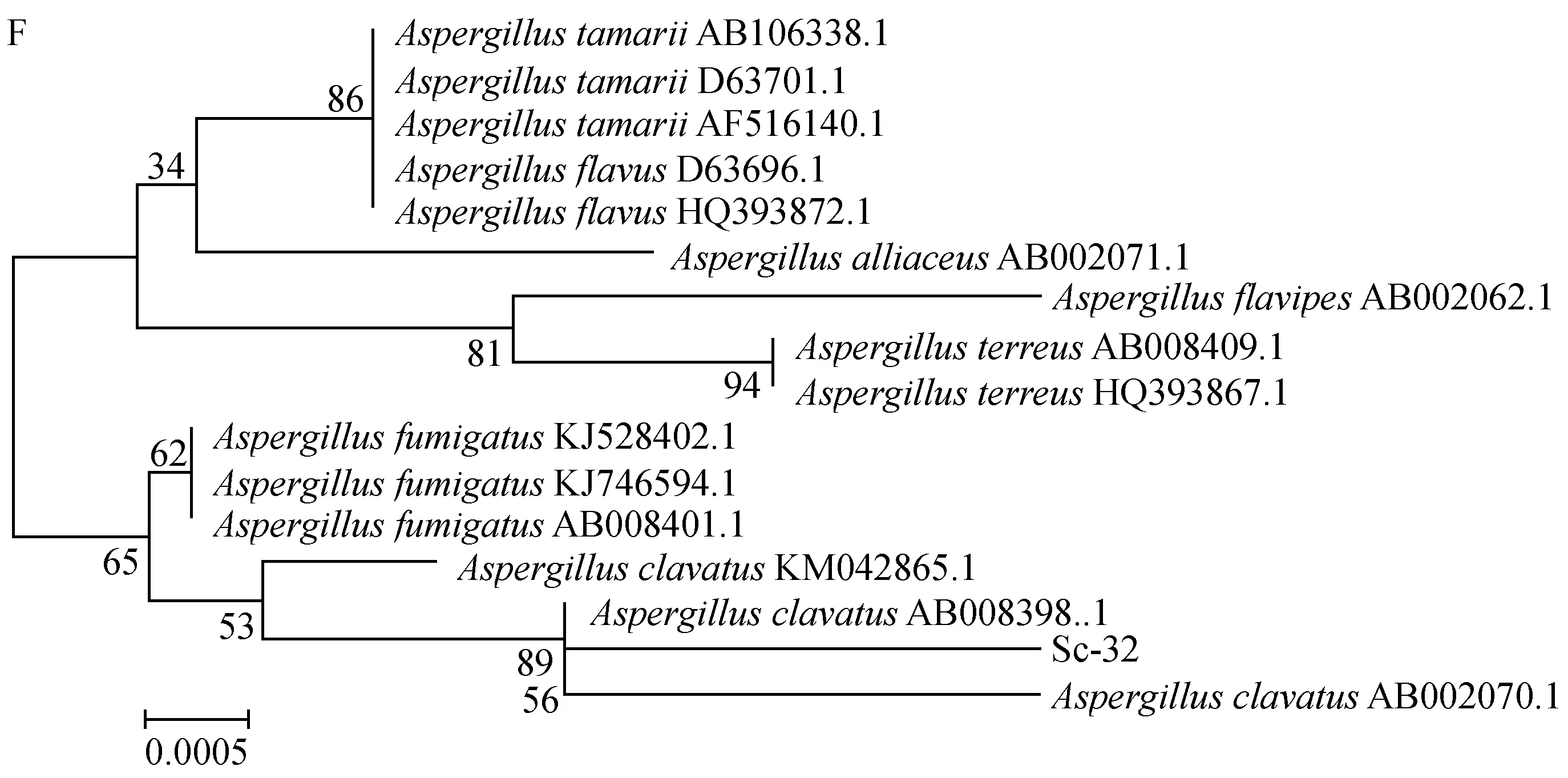
(A) 菌落形態; (B) 分生孢子頭自然生長形態; (C) 棒狀分生孢子頭; (D) 分生孢子; (E) 18S rDNA 的PCR產物; (F) 系統發育樹圖3 曲霉菌株Ac-32的菌落形態、顯微特征、18S rDNA擴增及系統發育樹分析
2.5 影響曲霉菌株Ac-32發酵產Lovastatin的關鍵因素
采用Minitab 17 軟件的P-B實驗設計法,以溫度(X1)、pH(X2)、碳源含量(X3)、氮源含量(X4)、接種量(X5)、轉速(X6)和種齡(X7)作為影響因素進行實驗設計,Lovastatin產量(Y)為響應值,進行7因子2水平的Plackett-Burman設計,篩選影響曲霉菌株Ac-32發酵產Lovastatin的關鍵因素。
實驗方案及結果如表2所示,用Minitab 17 軟件對實驗數據進行分析,建立一次回歸方程:Y = 72.317 + 5.155 X1+ 5.104 X2+ 3.583 X3+ 0.812 X4-1.389X5-1.117X6-1.283 X7。
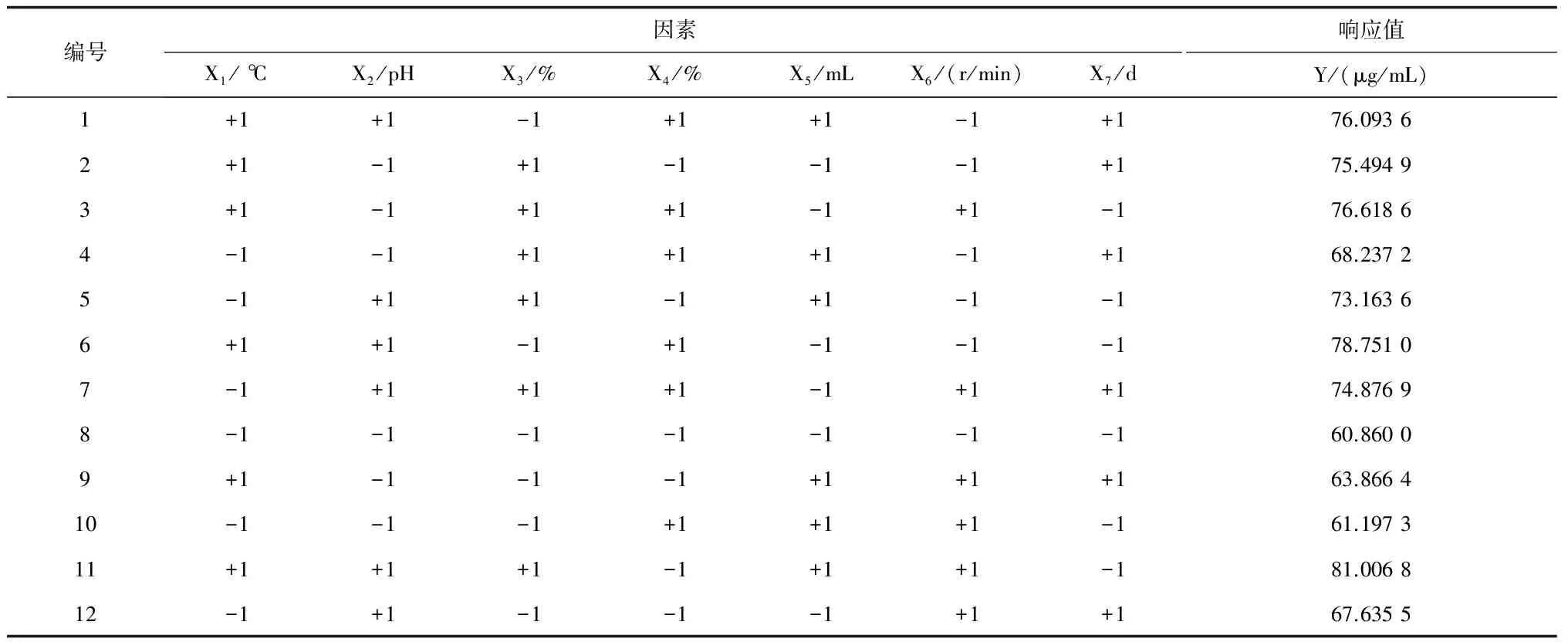
表2 Plackett-Burman設計實驗方案及結果

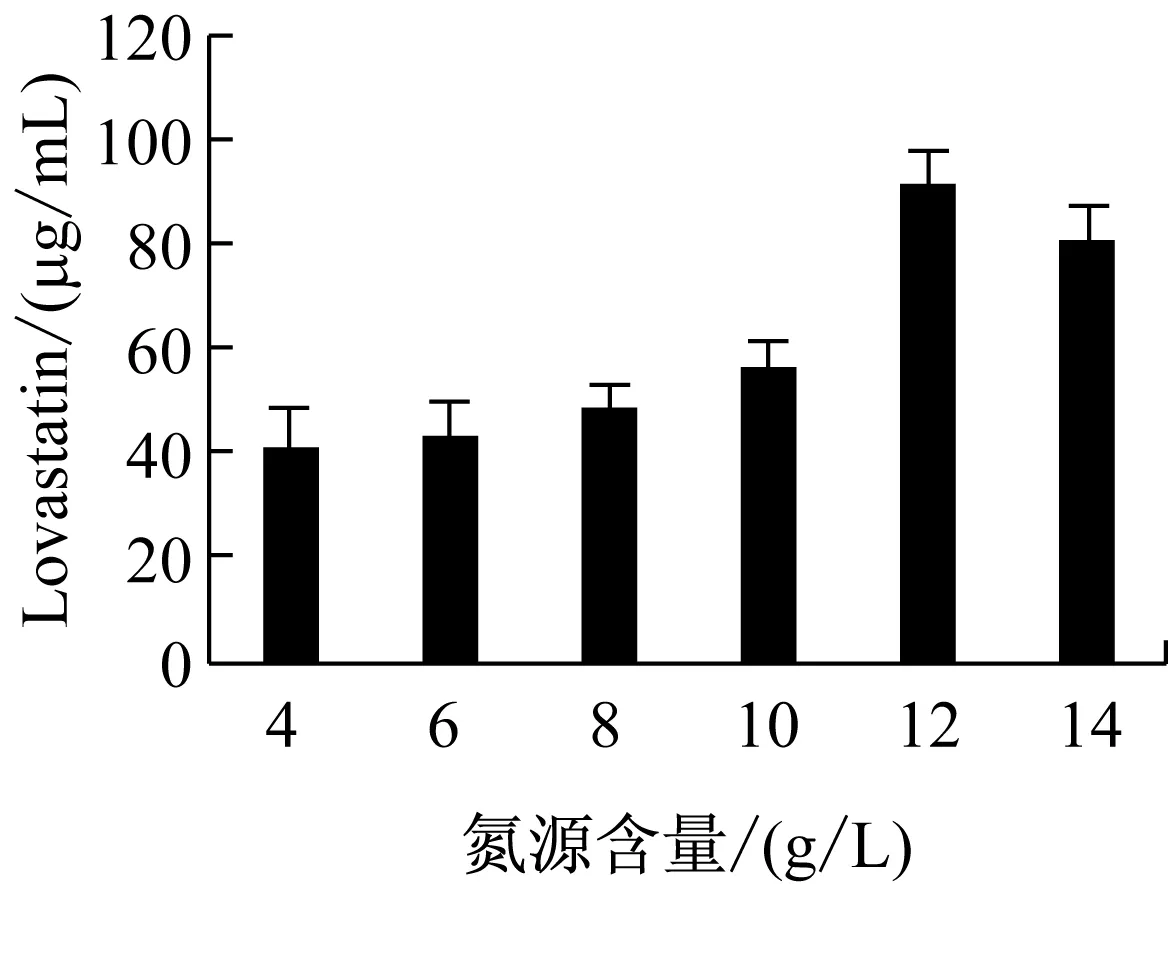

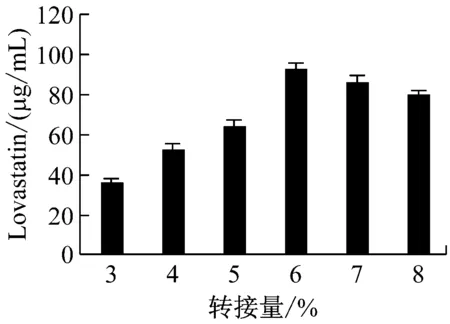
圖4 不同培養基配方和發酵條件對曲霉菌株Ac-32產 Lovastatin的影響
表3中溫度和pH的P值均小于0.01,差異極顯著;碳源含量和氮源含量的P值分別為0.001和0.027(P<0.05),差異顯著,確立這4個因素為影響Lovastatin合成的顯著因子。校正決定系數R-sq(adj)= 97.16%,表明Lovastatin產量的97.16%的變異分布在方程的七個因子中。相關系數R-sq(pred)= 90.71%,表明該方程的預測值與實際值之間擬合度較好。
除以上4個顯著因素外,其他因素的變化對Lovastatin的發酵產量影響不大,所以實驗采用同一結合P-B影響Lovastatin產量的單因素實驗,選溫度、pH、碳源含量、氮源含量 4種顯著的關鍵因素,分別用A、B、C、D來定義,編碼水平與取值如表4所示,運用Design Expert軟件設計響應面Box-Behnken實驗,以Lovastatin產量為響應值,設計4因素3水平共進行27組實驗,實驗結果如表5所示。
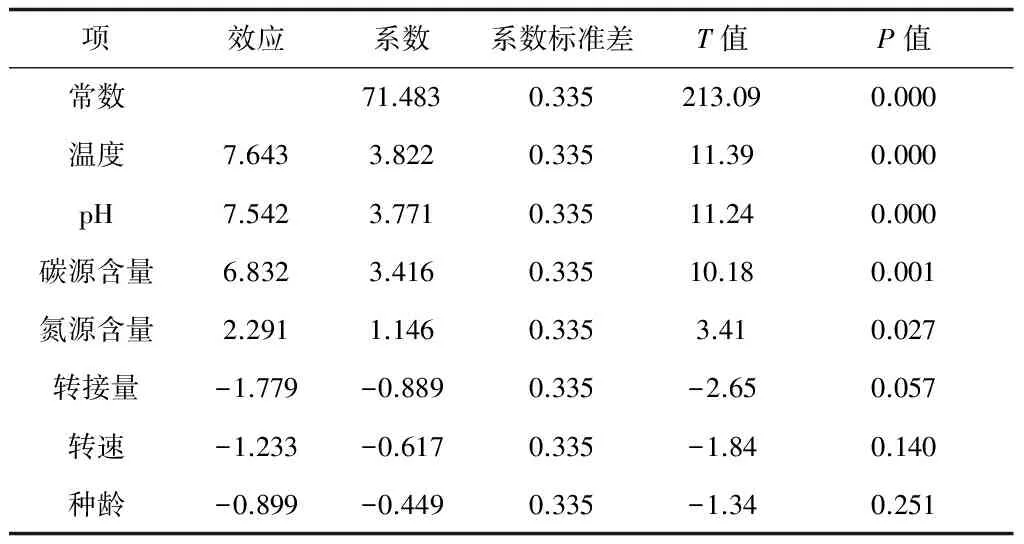
表3 P-B實驗設計因素回歸方程系數顯著性檢驗
注:R-sq=98.97%,R-sq(adj)= 97.16%,R-sq(pred)= 90.71%。
條件,即:轉接量為6%,轉速為180 r/min,種齡為4 d。
2.6 響應面法優化培養基配方和發酵條件
2.6.1 響應面回歸方程建立與方差分析
由Design Expert軟件設計響應面Box-Behnken以Lovastatin為響應值進行分析后,軟件給出的回歸方程為:Lovastatin=+234.14-7.05A+4.31B-13.41C+11.48D-3.20AB +9.19AC-8.65AD-5.40BC+5.80BD-3.96CD-21.53A2-32.51B2-11.11C2-12.30D2。
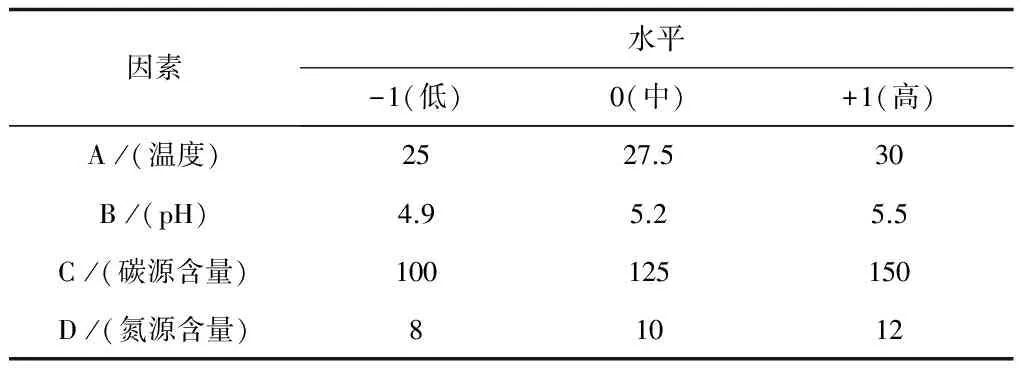
表4 響應面設計因子取值表
由表6方差分析表可知:失擬不足(P=0.1975>0.05),而模型P值<0.001,達到極顯著,說明該模型對實驗分析具有意義。各因子的P值均小于0.05,均有顯著性。模型R-Squared=0.9609,表明該方程的預測值與實際值之間擬合度較好,模型的矯正決定系數Adj R-Squared=0.9152,說明該模型可靠性高,能有效預測Lovastatin的總變異。
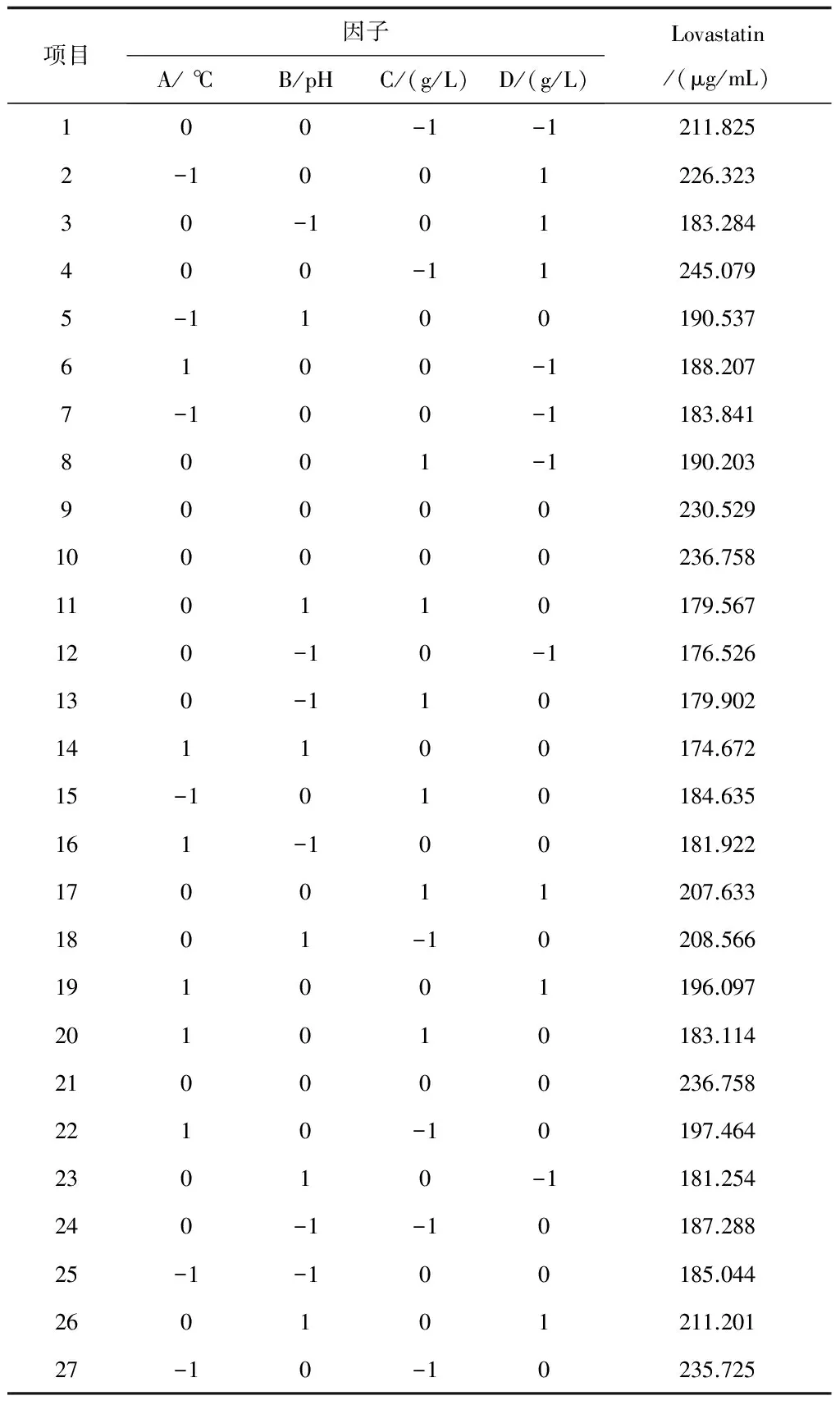
表5 響應面(RSM)實驗項目及結果
注:因子:4,基礎次數:27,中心點:3,每次實驗設置三個平行組。
2.6.2 響應面分析
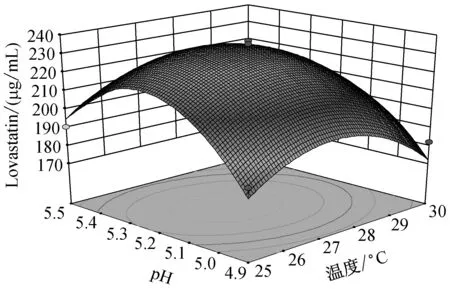
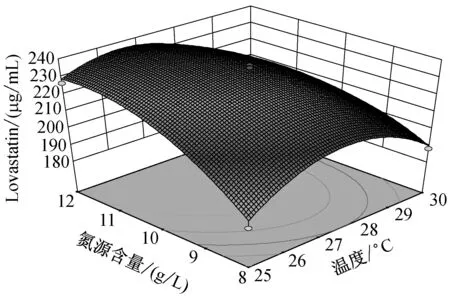
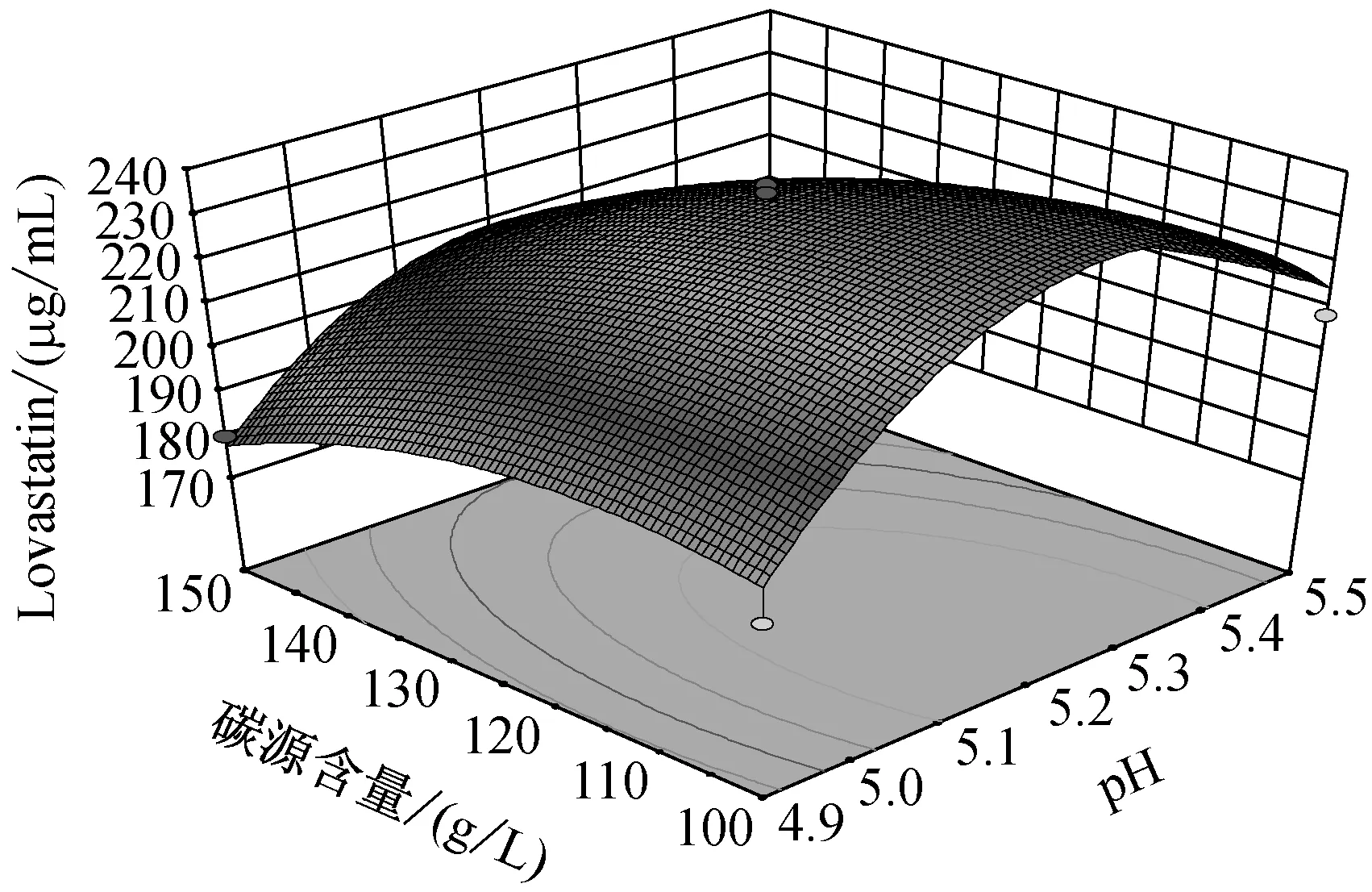
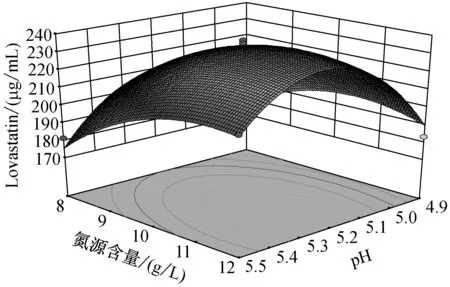
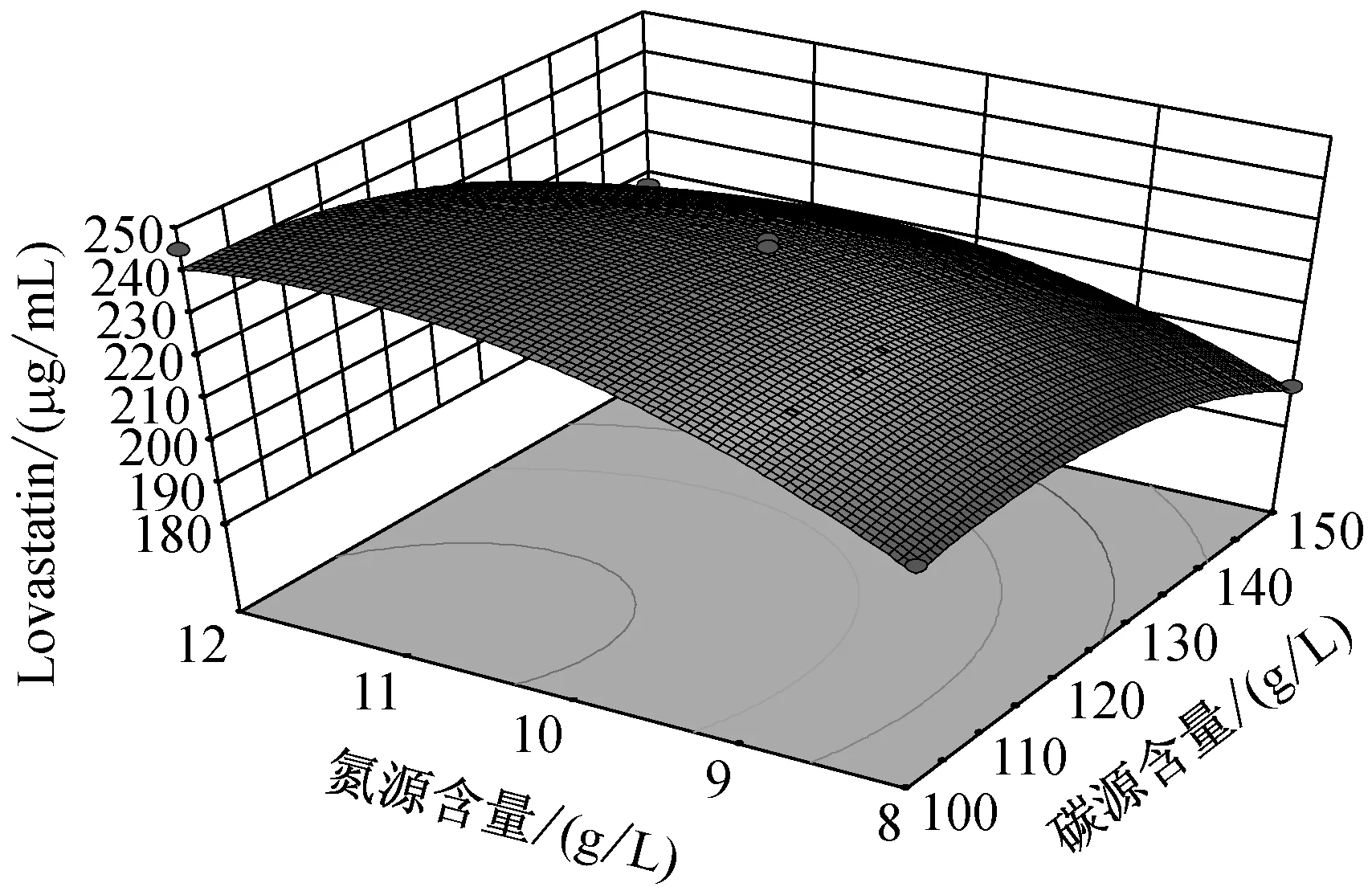
由圖5可知,當溫度在(25,27.5)區間,pH在(4.9,5.2)區間內,Lovastatin的單位產量隨著兩者的升高而升高,呈現正相關。而當溫度在(27.5,30)區間,pH在(5.2,5.5)區間內,Lovastatin單位產量隨著兩者的升高而降低,呈現負相關。
注:**極顯著(P<0.01);*顯著(0.01 由圖6中可知,當溫度在(25,27.5)區間,碳源含量在(100,125)區間內,Lovastatin的單位產量隨著兩者的升高而升高,呈現正相關。而當溫度在(27.5,30)區間,碳源含量在(125,150)區間內,Lovastatin單位產量隨著兩者的升高而降低,呈現負相關。 由圖7中可知,當溫度在(25,27.5)區間,氮源含量在(8,10)區間內,Lovastatin的單位產量隨著兩者的升高而升高,呈現正相關。而當溫度在(27.5,30)區間,氮源含量在(125,150)區間內,Lovastatin單位產量隨著兩者的升高而降低,呈現負相關。 由圖8中可知,當pH在(4.9,5.5)區間,碳源含量在(100,125)區間內,Lovastatin的單位產量隨著兩者的升高而升高,呈現正相關。而當溫度在(5.2,5.5)區間,碳源含量在(125,150)區間內,Lovastatin單位產量隨著兩者的升高而降低,呈現負相關。 由圖9中可知,當pH在(4.9,5.5)區間,氮源含量在(8,10)區間內,Lovastatin的單位產量隨著兩者的升高而升高,呈現正相關。而當溫度在(5.2,5.5)區間,氮源含量在(10,12)區間內,Lovastatin單位產量隨著兩者的升高而降低,呈現負相關。 由圖10中可知,當碳源含量在(100,125)區間,氮源含量在(8,10)區間內,Lovastatin的單位產量隨著兩者的升高而升高,呈現正相關。而當碳源含量在(125,150)區間,氮源含量在(10,12)區間內,Lovastatin單位產量隨著兩者的升高而降低,呈現負相關。 為了更清晰的了解實驗的優化結果,利用Box-Behnken軟件根據數據分析得出的理論最優條件為:溫度28.18 ℃,pH 5.24,碳源含量109.55 g/L,氮源含量11.78 g/L,此時達到最大值236.221 μg/mL。 2.6.3 響應面以及等高線結果驗證試驗 為驗證實驗的可靠性,采用上述最優發酵條件進行Lovastatin發酵驗證實驗,考慮到實際操作的現實性,將最佳條件修正為溫度28 ℃,pH 5.2,碳源含量100 g/L,氮源含量11.8 g/L,3次平行實驗的Lovastatin產量分別為210.645 μg/mL,233.813 μg/mL,229.421 μg/mL,Lovastatin平均產量為224.626 μg/mL,實際平均值與預測值無顯著差別,證明此次實驗參數可靠,具有實用價值。 從不同生境(食品、土壤、空氣、有機質等)的自然發酵樣品中分離篩選到1株高產Lovastatin曲霉菌株Ac-32,經培養基配方和培養條件優化,發酵液中Lovastatin產量可達224.626 μg/mL。目前國內外生產Lovastatin大多用紅曲霉和土曲霉,本文篩選到的菌株經鑒定為棒曲霉,豐富了生產Lovastatin的菌種資源。 Plackett-Burman法確定對棒曲霉液態發酵產Lovastatin影響顯著的四個因素分別是溫度,pH,碳源含量和氮源含量。響應面Box-Behnken法優化后的條件為:溫度28 ℃,pH 5.2,碳源含量100 g/L,氮源含量11.8 g/L,轉接量為6 %,轉速180 r/min,種齡為4 d。優化后的Lovastatin產量比優化前提高了2.98倍。 魏巍[17]確定了紅曲霉發酵合成Lovastatin的最優培養基配方和發酵工藝,Lovastatin產量為142.51 μg/mL。劉愛英[18]等用紫外誘變方式處理紅曲霉,誘變后菌株搖瓶發酵產Lovastatin水平為219.9 μg/mL。童振宇[19]等對紫色紅曲霉液態發酵培養基進行了優化,使Lovastatin產量達到297.4 μg/mL,而利用棒曲霉發酵產Lovastatin尚未見報道,試驗數據表明,選用的棒曲霉菌株具有良好的應用前景。 [1] Satoshi K. Lovastatin rescues human and mice cartilage disorders [J]. Journal of Cell Communication and Signaling, 2015, 9 (1): 95-98. [2] Guo CJ, Wang CCC. Recent advances in genome mining of secondary metabolites inAspergillusterreus[J]. Frontiers in Microbiology, 2014, 5(1): 1-13. [3] Guo CJ, Sun WW, Bruno KS,etal. Molecular genetic characterization of terreic acid pathway inAspergillusterreus[J]. Organic Letters, 2014, 16: 5250-5253. [4] Boruta T, and Bizukojc M. Culture-based and sequence-based insights into biosynthesis of secondary metabolites byAspergillusterreus ATCC 20542 [J]. Journal of Biotechnology, 2014, 175: 53-62. [5] Salagre E, Fernandes BS, Dodd S,etal. Statins for the treatment of depression: A meta-analysis of randomized, double-blind, placebo-controlled trials [J]. Journal of Affective Disorders, 2016, 200: 235-242. [6] Notarnicola M, Barone M, Francavilla A,etal. Lovastatin, but not orlistat, reduces intestinal polyp volume in an ApcMin/+ mouse model [J]. Oncology Reports, 2016, 36 (2): 893-900. [7] Robles JE, Suarez IR, Diaz JE,etal. Secondary metabolites isolated from the strainAspergillusterreus[J]. Chemistry of Natural Compounds, 2014, 50 (6): 1101-1102. [8] Krull R, Bley T, Filaments in bioprocesses preface [C]. Advances in Biochemical Engineering Biotechnology, 2015, 149: 5-7. [9] Alberts AW, Chen J, Kuron G,etal. Mevinolin, a highly potent competitive inhibitor of hydroxymethyl -glutaryl-coenzyme a reductase and cholesterol-lowering agent [J]. Proceedings of the National Academy of Sciences, 1980, 77(7): 3957-3961. [10] Huang XN, Lu XF, Li YM,etal. Improving itaconic acid production through genetic engineering of an industrialAspergillusterreusstrain [J]. Microbial Cell Factories, 2014, 13: 1-9. [11] Ahmed A, Mukhtar H, Gohar UF,etal. Production of Lovastatin fromAspergillusterreusthrough submerged fermentation [J]. Pakistan Journal of Botany, 2013, 45(5): 1795-1800. [12] 黃卓, 李東棟. 洛伐他汀最新研究進展[J]. 中國生化藥物雜志, 2010(2): 144-147. [13] Abd Rahim MH, Hasan H, Montoya A,etal. Lovastatin and (+)-geodin production byAspergillusterreusfrom crude glycerol [J]. Engineering in Life Sciences, 2015, 15(2): 220-228. [14] El-Naggar NE, Haroun SA, Owis EA,etal. Optimization of beta-glucosidase production byAspergillusterreusstrain EMoo 6-4 using response surface methodology under solid-state fermentation [J]. Preparative Biochemistry and Biotechnology, 2015, 45(6): 568-587. [15] 鄭虹. 紅曲霉固態發酵產洛伐他汀的響應面優化 [J]. 中國釀造, 2014, 33(10): 76-80. [16] Tepe O, Dursun AY. Exo-pectinase production byBacilluspumilususing different agricultural wastes and optimizing of medium components using response surface methodology [J]. Environmental Science and Pollution Research, 2014, 21(16): 9911-9920. [17] 魏巍. 紅曲霉發酵合成洛伐他汀的研究 [D]. 華中科技大學, 2013. [18] 劉愛英, 孫嘉龍, 鄒曉等. 提高紅曲霉發酵產品Monacolin K含量的研究 [J]. 貴州農業科學, 2007(6): 5-7. [19] 童振宇, 周立平, 陳旭峰. 響應面法優化紅曲霉菌株MonascuspurpureusWX液態發酵產Monacolin K工藝條件 [J]. 2007(1): 35-40. Screening and identification of Aspergillus clavatus strain with high-yielding lovastatin and its optimization of fermentation conditions ZHANG Ting, Bedelkhan Almagul, ZHENG Jie-shi, HAN Xiao-fei, REN-Hao, JIANG Dong-hua College of Chemistry and Life Science, Zhejiang Normal University, Jinhua 321004, China 150Aspergillusstrains were selected from different natural fermentation samples of food, soil, air and so on, and their products of lovastatin were measured by high performance liquid chromatography (HPLC) method. Among them, theAspergillusstrain Ac-32 producing higher-level lovastatin was screened. Based on 18S rDNA sequence and morphology characteristics, the strain Ac-32 was identified asAspergillusclavatus. Through analyzing the influence of C source, N source, C content, N content, C/N, temperature, initial pH and so on, the results indicated that optimal fermentation conditions were as follows: C source lactose, N source peptone, C content 100 g/L, N content 12 g/L, C/N 15∶1.8, temperature 28 ℃, shaking speed 180 r/min, initial pH 5.2, inoculating age 4 d and inoculum size 6%. Using Plackett-Burman (P-B) in Minitab 17, 4 significant effects (C content, N content, temperature and pH) on lovastatin yields were screened out. According to the P-B experiment results and analysis of response surface methodology in Design Expert, the optimum conditions were as follows: C content 100 g/L, N content 11.8 g/L, temperature 28 ℃, pH 5.2. Under the optimized conditions, the maximum lovastatin yield was 236.221 μg/mL. Aspergillusclavatus; Lovastatin; response surface methodology; fermentation conditions 10.3969/j.issn.1001-6678.2016.06.005 國家自然科學基金項目(NO.31270061;NO.31570013)。 章 婷(1991~),女,碩士研究生。研究方向:應用微生物。E-mail:704486377@qq.com。 *通信作者: 蔣冬花(1964~),女,教授。Tel:13566997832,E-mail:jdh@zjnu.cn。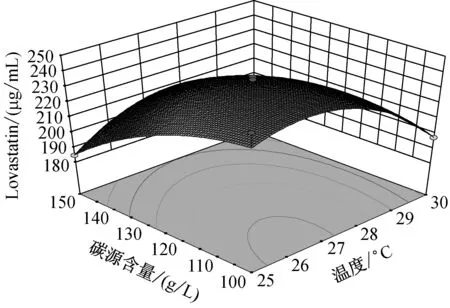
3 討論

