產氫產乙酸和產甲烷反應對厭氧消化的限速作用
王祥錕,閔祥發,李建政*,張玉鵬(.哈爾濱工業大學城市水資源與水環境國家重點實驗室,黑龍江 哈爾濱50090;.哈爾濱辰能工大環保科技股份有限公司,黑龍江 哈爾濱 50078)
產氫產乙酸和產甲烷反應對厭氧消化的限速作用
王祥錕1,閔祥發2,李建政1*,張玉鵬1(1.哈爾濱工業大學城市水資源與水環境國家重點實驗室,黑龍江 哈爾濱150090;2.哈爾濱辰能工大環保科技股份有限公司,黑龍江 哈爾濱 150078)
為明晰厭氧消化過程的主要限速步驟,分別以丁酸、乙酸、H2/CO2為基質,在37℃和pH 5.00~9.00條件下對厭氧活性污泥進行培養,依據Shelford耐受定律對食丁酸產氫產乙酸菌(SBOB)、乙酸營養型產甲烷菌(ACM)和氫營養型產甲烷菌(HTM)的pH值生態幅及基質轉化速率進行分析.結果表明,SBOB、ACM和HTM的pH值生態幅分別為6.19~8.59、5.50~7.74和4.39~9.23,其代謝最適pH值分別為7.39、6.62和6.81.在最適pH值條件下,厭氧活性污泥對丁酸、乙酸、H2/CO2的轉化速率分別為0.86、1.04和1.09gCODequ/(gMLVSS·d).可見,與產甲烷菌相比,產氫產乙酸菌的pH值生態幅更窄,基質轉化速率更慢,對厭氧消化過程具有更為顯著的限制作用.
厭氧消化;限速步驟;pH值;生態幅;基質轉化速率
有機物的厭氧消化是一個復雜的生物轉化過程,需要產酸發酵菌群、產氫產乙酸菌群和產甲烷菌群等多種微生物類群的協同作用共同完成[1].這些主要微生物類群在生理生態習性上差別懸殊,如,產酸發酵菌群能夠在較為寬廣的pH值生態幅內迅速增殖,而產甲烷菌群則要求近中性的pH值環境,而且增殖緩慢[2-3].所以,要保證系統的穩定運行,須維持各類菌群生長環境的協調和代謝速率的平衡[4].研究表明,產甲烷菌群可利用的基質僅有乙酸和一碳化合物,增殖和代謝速率緩慢,且對環境變化敏感,其產甲烷反應被認為是厭氧消化的限速步驟[5-6].有越來越多的研究表明,營養生態位居于產酸發酵菌群和產甲烷菌群之間的產氫產乙酸菌群,其環境適應能力和增殖能力都比較差,其低水平代謝也有可能成為厭氧消化進程的限制因素[7-8].然而,產氫產乙酸作用與產甲烷作用何者對厭氧消化的限速作用更顯著,至今尚不明確[9-11].
在有機廢水厭氧生物處理系統中,產酸發酵菌群代謝產生的揮發性脂肪酸(VFAs)主要有乙酸、丙酸和丁酸等[12].其中,丙酸和丁酸均須由產氫產乙酸菌群將其轉化為乙酸和H2/CO2后才能為產甲烷菌群利用.本文采用厭氧顆粒污泥的間歇培養方法,分別以丁酸、乙酸和H2/CO2為惟一碳源,研究了食丁酸產氫產乙酸菌(SBOB)、乙酸營養型產甲烷菌(ACM)和氫營養型產甲烷菌(HTM)的pH值生態幅及其基質轉化速率,并通過對比分析闡述了它們對厭氧消化的限速作用.
1 材料與方法
1.1 接種物
實驗所用厭氧顆粒污泥,取自哈爾濱市某大豆蛋白生產企業污水處理站的升流式厭氧污泥床(UASB)反應器.其混合液懸浮固體濃度(MLSS)和揮發性懸浮固體濃度(MLVSS)分別為63.98和36.79g/L,污泥顆粒直徑為1.0~1.2mm,發酵葡萄糖的比產甲烷速率為83.76mL/(gMLVSS·d).
將原顆粒污泥用無氧水稀釋,加玻璃珠震蕩破碎,清洗3次后形成的泥水混合物即為接種物,其MLSS、MLVSS、污泥沉降比(SV)、污泥體積指數(SVⅠ)和pH值分別為3.44g/L、2.89g/L、10%、29.10mL/g和7.83.
1.2 靜態搖瓶實驗
不同基質的甲烷發酵實驗,均在容積為180mL的厭氧瓶中進行.每個發酵體系均包含68mL營養液和7mL種泥.其中,以丁酸、乙酸為碳源的發酵體系,分別加有1.2g/L的丁酸和2.4g/L的乙酸,連續充氮5min后封瓶.以H2/CO2為惟一碳源的發酵體系,在營養液分裝和污泥接種完成后,連續充入H2/CO2(v:v=80:20)5min,封瓶.營養液的配制參照文獻進行[13].由于培養液中含有KH2PO4和Na2HPO4等酸堿緩沖劑,可保證培養體系在發酵過程中的pH值相對穩定.對丁酸、乙酸和H2/CO2的甲烷發酵測試,均設置5個pH值梯度,分別為5.00、6.00、7.00、8.00和9.00,每個pH值下設置3個平行發酵體系.所有發酵體系構建完成后,置于37℃、140rpm恒溫搖床中培養.對于以H2/CO2為惟一碳源的發酵體系,每12h測定發酵氣成分一次;對于以丁酸或乙酸為碳源的發酵體系,每48h測定發酵液中的VFAs及發酵氣成分一次.
1.3 分析項目及方法
發酵液中的VFAs利用SP6800A型氣相色譜儀(山東魯南虹化工儀器有限公司)檢測,毛細管柱30m×Φ0.32mm,填充物為FFAP,柱室溫度160℃,氣化室和檢測器溫度均為210℃[14].發酵氣組分(H2、CO2和CH4)利用SP6890型氣相色譜儀(山東魯南虹化工儀器有限公司)測定,不銹鋼填充柱2m×Φ3mm,填充物為Porapak.Q,進樣室、TCD檢測器和柱室溫度均為80℃[14].
發酵液的pH值由pH計(DELTA320, Mettler Toledo)測量,MLSS、MLVSS和SV采用標準方法測定[15].發酵體系的產氣量通過排氣法測量,累積產甲烷量按Owen法進行計算[16].
1.4 數據分析
1.4.1 污泥對基質的轉化速率 為比較活性污泥對不同基質的轉化速率,將基質丁酸、乙酸和H2換算成當量化學需氧量(CODequ,g/L)[17]. CODequ在線性反應階段的基質轉化速率[qCOD,gCODequ/(gMLVSS·d)]由式(1)計算.
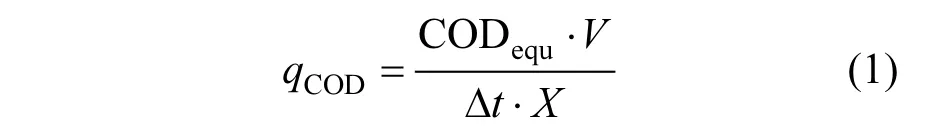
式中:V為發酵體系的體積,L;Δt為線性反應所需時間,d;X為反應體系的生物量MLVSS,g.
1.4.2 活性污泥功能菌群pH生態幅的定量表達 根據Shelford耐受定律,對活性污泥功能菌群的最大基質轉化速率與pH值之間的關系進行Gauss Amp非線性擬合[18].Gauss Amp方程的表達為:
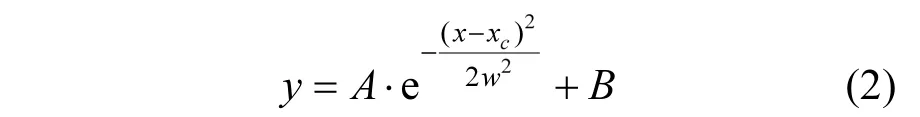
式中:y為最大基質轉化速率;x為發酵體系的pH值;xc為功能菌群代謝的最適pH值;w為功能菌群對pH值的耐受度;A和B為常數.xc和w可通過實驗數據的擬合獲得,菌群的pH值生態幅參數:適宜pH值為[xc-w,xc+w],耐受pH值為[xc-2w,xc+ 2w].
1.4.3 平行樣品的數據處理 氣體體積、發酵氣成分和揮發酸組分等數據,均取3個平行測試的平均值.
2 結果與討論
2.1 SBOB的基質轉化與產甲烷特性
在不同初始pH值條件下,厭氧活性污泥對丁酸的轉化和產甲烷特征如圖1所示.結果表明,當發酵體系初始pH值為7.00時,SBOB的活性較強,發酵體系中的丁酸在18d內有96%左右得到轉化,在降解曲線的線性階段(第8~12d),污泥的丁酸轉化速率達到了0.40g/(gMLVSS·d).隨著丁酸的降解,發酵體系的累積產甲烷量不斷增加,在第18d培養結束時達到了44.34mL.
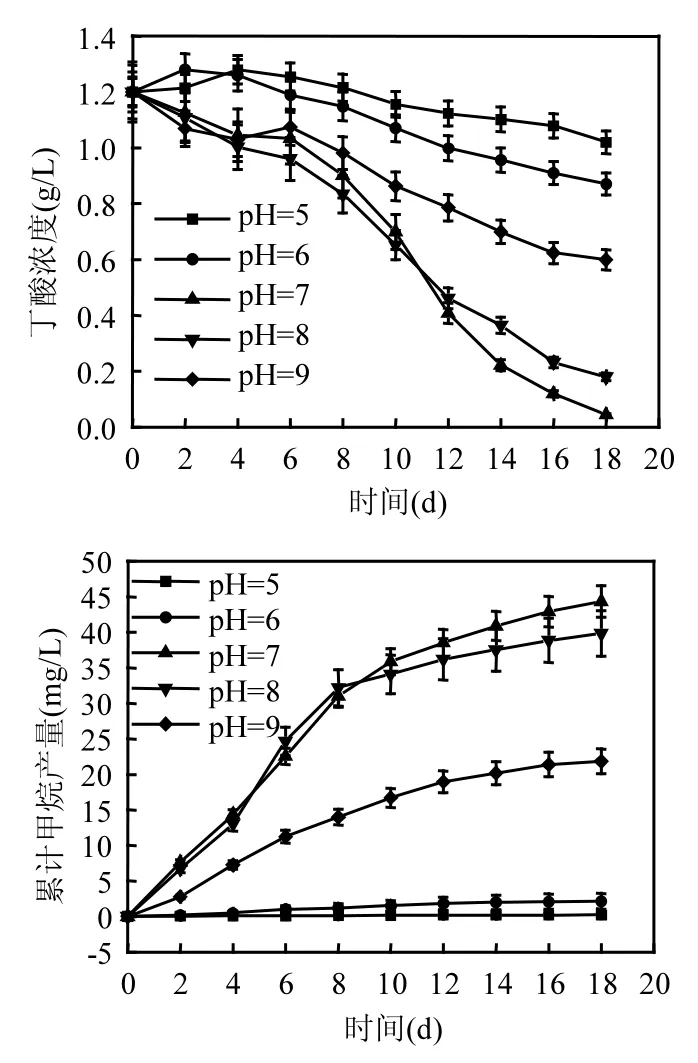
圖1 不同pH值條件下厭氧活性污泥的丁酸轉化和產甲烷特征Fig.1 Performance of the anaerobic activated sludge in butyric acid conversion and methane production with initial pHs
如圖1所示,過高或過低的pH值對活性污泥的丁酸轉化均有顯著影響.初始pH值分別為5.00、6.00、8.00和9.00的發酵體系,在第18d培養結束時,其丁酸轉化率分別為15.02%、27.49%、 85.02%和50.08%,污泥的最大丁酸轉化速率分別為0.04、0.07、0.30和0.13g/(gMLVSS·d),累積產甲烷量分別為0.22、2.15、39.84和21.84mL,均顯著低于初始pH值為7.00的發酵體系.
2.2 ACM的基質轉化與產甲烷特性
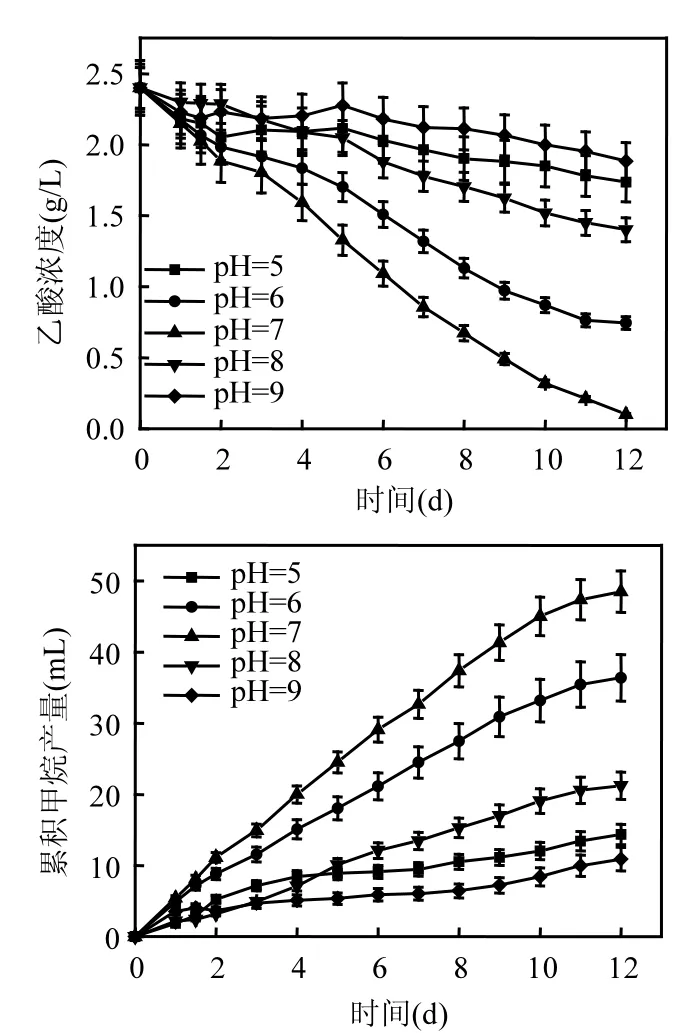
圖2 不同pH值條件下厭氧活性污泥的乙酸轉化和產甲烷特征Fig.2 Performance of the anaerobic activated sludge in acetic acid conversion and methane production with initial pHs
以乙酸為惟一碳源的測試結果表明,pH值對ACM的代謝活性也有顯著影響.如圖2所示,在初始pH值為7.00的發酵體系中,ACM的活性最強,在12d內可將95%左右的乙酸轉化.在降解曲線的線性階段(第4~7d),污泥的乙酸轉化速率高達0.82g/(gMLVSS·d).發酵體系的累積產甲烷量隨著乙酸的不斷轉化而增加,在第12d培養結束時累計48.49mL.過高或過低的pH值對活性污泥的乙酸轉化和產甲烷能力也有顯著影響.初始pH值分別為5.00、6.00、8.00和9.00的發酵體系,在培養結束時(第12d),污泥的乙酸轉化率分別為27.66%、68.96%、41.61%和21.54%,最大乙酸轉化速率分別為0.25、0.64、0.29和0.26g/(gMLVSS·d),累積產甲烷量分別為14.37、36.40、21.22和10.89mL,均顯著低于初始pH值為7.00的發酵體系.
2.3 HTM的基質轉化與產甲烷特性
厭氧活性污泥對H2/CO2的轉化和產甲烷特征(圖3)表明,HTM具有很強的代謝活性,在初始pH值為7.00的發酵體系中,發酵體系中的H2在4d內幾乎全部得到轉化.在線性反應階段(第1~2d),污泥對H2的轉化速率達到0.13g/(gMLVSS·d).發酵體系的累積產甲烷量隨著H2的不斷轉化而增加,在培養結束時(第4d)達到了19.38mL.初始pH值的改變,H2轉化速率和累積產甲烷量均受到顯著影響.初始pH值分別為5.00、6.00、8.00和9.00的發酵體系,在4d的發酵過程中,其H2轉化率分別為61.04%、88.36%、95.38%和30.71%,污泥的最大H2轉化速率分別為0.05、0.12、0.09和0.04g/(gMLVSS·d),累積產甲烷量分別為11.55、17.05、17.78和5.91mL,也都顯著低于初始pH值為7.00的發酵體系.
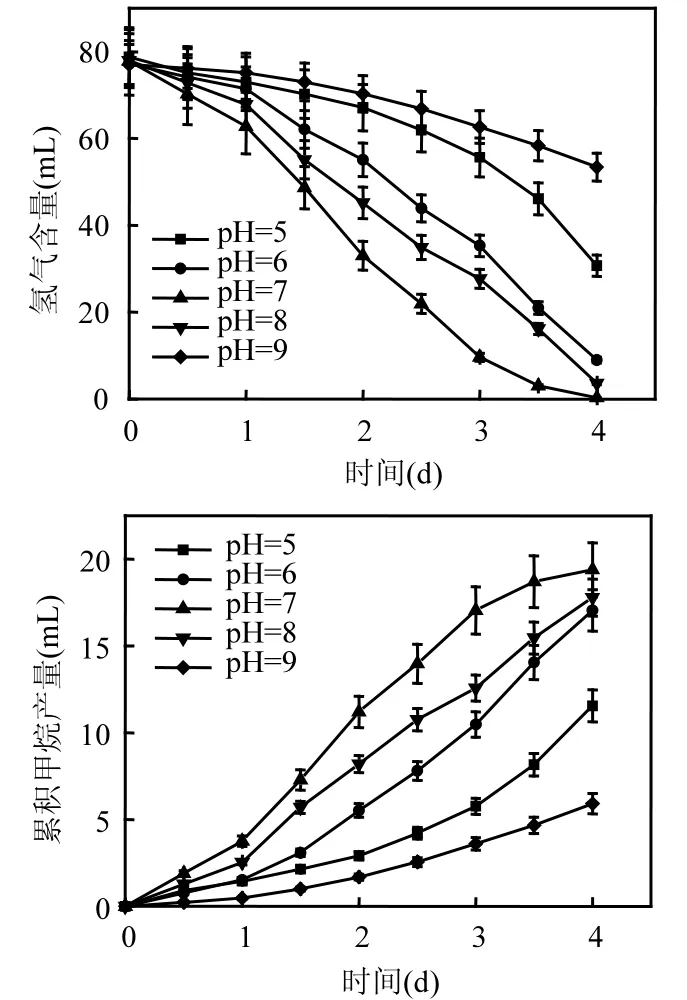
圖3 不同pH值條件下厭氧活性污泥的氫氣轉化和產甲烷特征Fig.3 Performance of the anaerobic activated sludge in hydrogen conversion and methane production with initial pHs
2.4 活性污泥功能菌群的pH值生態幅解析
根據式(1)計算不同pH值下的最大基質轉化速率qCOD,結果如圖4所示.當發酵體系初始pH值為7.00時,活性污泥中的SBOB、ACM和HTM 3種功能菌群均表現出了最大代謝活性,其qCOD分別為0.72、0.88和1.05gCODequ/(gMLVSS·d).當發酵體系初始pH值降低至6.00時,3種功能菌群的qCOD分別比初始pH值為7.00時降低了0.33、0.18、0.01gCODequ/(gMLVSS·d).而當初始pH值升高至8.00時,它們的qCOD分別降低了0.10、0.53、0.04gCODequ/(gMLVSS·d).可見,3種功能菌群的pH生態幅存在顯著差異,其中,SBOB的代謝在中性偏堿的條件下最好,而中性偏酸的環境更適合ACM和HTM的代謝.
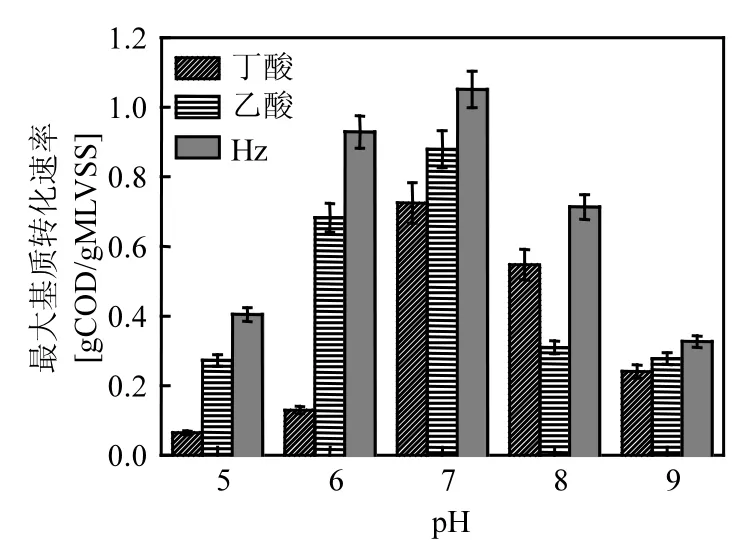
圖4 不同pH值條件下厭氧活性污泥的最大基質轉化速率Fig.4 Maximum substrate conversion rates of the anaerobic activated sludge under different pH
依據Shelford耐受定律,利用origin8.5軟件進行Gauss Amp非線性擬合(圖5),得到3種功能菌群qCOD與pH值之間的關系方程及相關參數(表1).利用表1中的參數,由式(2)得到SBOB、ACM和HTM的pH生態幅分別為6.19~8.59、5.50~7.74和4.39~9.23,pH值適宜范圍分別為6.79~7.99、6.06~7.18和5.60~8.02,最適代謝pH值分別為7.39、6.62和6.81.在最適代謝pH值條件下,活性污泥對丁酸、乙酸和H2的最大轉化速率分別為0.86、1.04和1.09gCODequ/(gMLVSS·d).可見,在厭氧顆粒污泥中,SBOB的代謝水平顯著低于ACM和HTM.
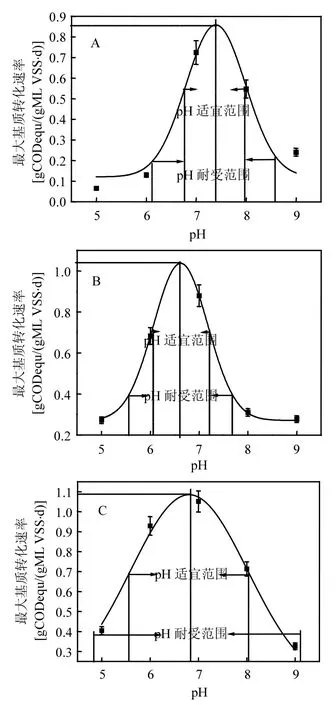
圖5 厭氧活性污泥中SBOB(A)、ACM(B)和HTM(C)的pH值生態幅Fig.5 pH ecological amplitude of SBOB (A), ACM (B)and HTM (C) in the anaerobic activated sludge
2.5 產氫產乙酸菌群和產甲烷菌群對厭氧消化的限速作用分析
由于產甲烷菌的特殊生理生態習性,其產甲烷作用一直被認為是厭氧消化的限速步驟[6].也有研究表明,產氫產乙酸菌對環境變化同樣敏感,增殖代謝速度同樣緩慢,其產氫產乙酸作用具備成為厭氧消化過程限速步驟的條件[19].
如圖1~圖3所示的實驗結果表明,厭氧活性污泥中的SBOB、ACM和HTM代謝活性,均會受到pH值改變的顯著影響.而且,3類功能菌群在pH值生態幅和基質轉化速率方面都存在明顯差異(表1,圖4和圖5).如圖5所示,SBOB、ACM和HTM的pH值生態幅分別為6.19~8.59、5.50~7.74和4.39~9.23,其中以SBOB的最為狹窄.而表1所示的結果表明,SBOB在最適代謝pH 7.39下的qCOD為0.86gCODequ/(gMLVSS·d),顯著低于最適代謝pH值下ACM的1.04gCODequ/(gMLVSS·d) (pH 6.62)和HTM的1.09gCODequ/(gMLVSS·d) (pH 6.81).可見,與ACM和HTM相比,SBOB具有更狹窄的pH值生態幅和更慢的基質轉化速率,對厭氧消化過程的限速作用更加顯著.
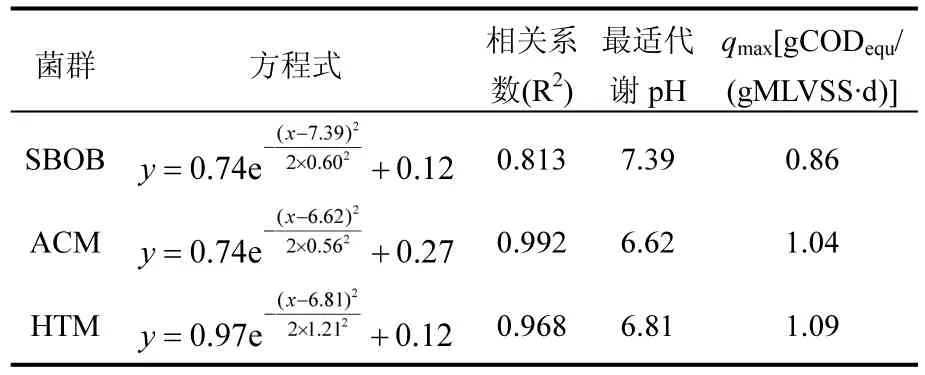
表1 厭氧活性污泥功能菌群在不同pH值條件下的基質轉化速率擬合方程及相關參數Table 1 Substrate conversion rate fitting equations of functional flora in the activated sludge with pHs and the relevant parameters
3 結論
3.1 SBOB的pH值生態幅較ACM和HTM的更為狹窄.在37℃條件下,SBOB、ACM和HTM代謝的pH值生態幅分別為6.19~8.59、5.50~7.74和4.39~9.23.
3.2 最適代謝pH值條件下,SBOB的最大基質轉化速率明顯低于ACM和HTM.SBOB、ACM和HTM的最大基質轉化速率分別為0.86、1.04和1.09gCODequ/(gMLVSS·d).
3.3 對于厭氧顆粒污泥系統,產氫產乙酸作用對厭氧消化過程的限速作用顯著高于產甲烷作用.
參考文獻:
[1] Kwietniewska E, Tys J. Process characteristics, inhibition factors and methane yields of anaerobic digestion process, with particular focus on microalgal biomass fermentation [J]. Renewable and Sustainable Energy Reviews, 2014,34:491-500.
[2] 任南琪,王愛杰,馬 放.產酸發酵微生物生理生態學 [M]. 北京:科學出版社, 2005.
[3] Whitman W B, Bowen T L, Boone D R. The Methanogenic Bacteria [M]//The Prokaryotes. Springer Berlin Heidelberg,2014:123-163.
[4] Kato S, Yoshida R, Yamaguchi T, et al. The effects of elevated CO2concentration on competitive interaction between aceticlastic and syntrophic methanogenesis in a model microbial consortium[J]. Frontiers in Microbiology, 2014,5:Article 575.
[5] Ueno Y, Yamada K, Yoshida N, et al. Evidence from fluid inclusions for microbial methanogenesis in the early Archaean era[J]. Nature, 2006,440(7083):516-519.
[6] Liu Y, Whitman W B. Metabolic, phylogenetic, and ecological diversity of the methanogenic archaea [J]. Annals of the New York Academy of Sciences, 2008,1125(1):171-189.
[7] Worm P, Müller N, Plugge C M, et al. Syntrophy in methanogenic degradation [M]. (Endo) symbiotic Methanogenic Archaea. Springer. 2010:143-173.
[8] Li J, Ban Q, Zhang L, et al. Syntrophic Propionate Degradation in Anaerobic Digestion: A Review [J]. Ⅰnternational Journal of Agriculture & Biology, 2012,14(5):668-673.
[9] Kato S, Watanabe K. Ecological and evolutionary interactions in syntrophic methanogenic consortia [J]. Microbes and Environments, 2010,25(3):145-151.
[10] Tang Y Q, Shigematsu T, Morimura S, et al. Dynamics of the microbial community during continuous methane fermentation in continuously stirred tank reactors [J]. Journal of Bioscience and Bioengineering, 2015,119(4):375-383.
[11] Plugge C M, van Lier J B, Stams A J M. Syntrophic communities in methane formation from high strength wastewaters[M]//Microbes at Work. Springer Berlin Heidelberg, 2010:59-77.
[12] 昌 盛,劉 楓.對比分析進水基質濃度對乙醇型和丁酸型發酵制氫系統的影響 [J]. 化工學報, 2015,66(12):5111-5118.
[13] Angelidaki Ⅰ, Sanders W. Assessment of the anaerobic biodegradability of macropollutants [J]. Reviews in Environmental Science & Bio/Technology, 2004,3(2):117-129.
[14] Ai B, Li J, Chi X, et al. Effect of pH and buffer on butyric acid production and microbial community characteristics in bioconversion of rice straw with undefined mixed culture [J]. Biotechnology and Bioprocess Engineering, 2014,19(4):676-686.
[15] American Public Health Association. Water Environment Federation [M]. Standard Methods for the Examination of Water and Wastewater, 1995,19.
[16] Owen W F, Stuckey D C, Healy J B, et al. Bioassay for monitoring biochemical methane potential and anaerobic toxicity[J]. Water Research, 1979,13(6):485-492.
[17] 施 恩,李建政,馬天楠.基于VFAs抑制系數的ABR基質降解與產甲烷預測模型 [J]. 化工學報, 2016,67(7):2979-2986.
[18] ter Braak C J F, Looman C W N. Weighted averaging, logistic regression and the Gaussian response model [J]. Vegetatio, 1986,65(1):3-11.
[19] Ban Q, Li J, Zhang L, et al. Quantitative analysis of previously identified propionate-oxidizing bacteria and methanogens at different temperatures in an UASB reactor containing propionate as a sole carbon source [J]. Applied Biochemistry and Biotechnology, 2013,171(8):2129-2141.
[20] Müller N, Worm P, Schink B, et al. Syntrophic butyrate and propionate oxidation processes: from genomes to reaction mechanisms [J]. Environmental Microbiology Reports, 2010,2(4): 489-499.
Rate-limiting of hydrogen-producing acetogenesis to anaerobic digestion compared with methanogenesis.
WANG Xiang-kun1, MIN Xiang-fa2, LI Jian-zheng1*, ZHANG Yu-peng1(1.State Key Laboratory of Urban Water Resource and Environment, Harbin Institute of Technology, Harbin 150090, China;2.Harbin Chenergy Hit Environmental Technology Co, LTD, Harbin 150078, China). China Environmental Science, 2016,36(10):2997~3002
To identify the rate-limiting degree of hydrogen-producing acetogenesis and methanogenesis in anaerobic digestion, anaerobic activated sludge sampled from an UASB was cultivated at 37℃ with a series of initial pH ranged from 5.00 to 9.00. With butyric acid, acetic acid and H2/CO2as substrate, respectively, the ecological amplitude of pH and the substrate conversion rate of syntrophic butyrate-oxidizing bacteria (SBOB), aceticlastic methanogens (ACM) and hydrogenotrophic methanogens (HTM) were evaluated according to the Shelford's tolerance law. The results showed that the ecological amplitudes of pH for SBOB, ACM and HTM were 6.19~8.59、5.50~7.74 and 4.39~9.23, with an optimal pH of 7.39, 6.62 and 6.81 for their metabolism, respectively. With the optimal metabolic pH, the specific conversion rate of butyric acid, acetic acid and H2/CO2by the sludge was 0.86, 1.04 and 1.09gCODequ/(gMLVSS·d), respectively. Obviously, the hydrogen-producing acetogens had narrower pH ecological amplitude and lower substrate conversion rate than the methanogens, indicating that hydrogen-producing acetogenesis in the anaerobic activated sludge had a stronger limitation on the anaerobic digestion.
anaerobic digestion;rate-limiting;pH;ecological amplitude;substrate convertion rate
X172,X703
A
1000-6923(2016)10-2997-06
王祥錕(1989-),男,黑龍江穆棱人,哈爾濱工業大學碩士研究生,主要研究方向為厭氧微生物生理生態學.
2016-02-25
國家自然科學基金資助項目(51478141);城市水資源與水環境國家重點實驗室(哈爾濱工業大學)自主課題 (2016DX06)
* 責任作者, 教授, ljz6677@163.com

