殼脂膠囊治療非酒精性脂肪性肝炎的效果觀察
寧惠明, 歐 強, 黃 玲, 湯 群
(上海市第八人民醫院 感染科, 上海 200235)
論著/其他
殼脂膠囊治療非酒精性脂肪性肝炎的效果觀察
寧惠明, 歐 強, 黃 玲, 湯 群
(上海市第八人民醫院 感染科, 上海 200235)
目的 觀察殼脂膠囊對非酒精性脂肪性肝炎的臨床療效及安全性。方法 選取2013年11月-2015年12月于上海市第八人民醫院就診的非酒精性脂肪性肝炎(NASH)患者100例,隨機分為治療組、對照組各50例,分別予殼脂膠囊和多烯磷脂酰膽堿膠囊,療程24周。觀察兩組治療前后肝功能、血脂水平及肝/脾CT值的變化。計量資料組間比較采用兩獨立樣本的t檢驗,組內比較采用配對樣本t檢驗,計數資料組間比較采用χ2檢驗。結果 兩組患者治療后AST[(49.2±21.7)U/L vs(119.5±44.2)U/L,t=10.0,P<0.01;(52.4±33.1)U/L vs(115.2±48.3)U/L,t=7.6,P<0.01]、ALT[(41.8±14.8)U/L vs(92.8±42.1)U/L,t=8.1,P<0.01; (42.9±16.6)U/L vs(95.3±40.4)U/L,t=8.5,P<0.01]、GGT[(52.3±23.7)U/L vs(168.4±85.9)U/L,t=9.2,P<0.01;(54.8±30.2)U/L vs(177.6±88.7)U/L,t=9.3,P<0.01]、TG[(1.78±1.01)mmol/L vs(3.52±2.35)mmol/L,t=4.8,P<0.01;(2.51±1.08)mmol/L vs(3.65±2.43)mmol/L,t=3.0,P=0.02]、TC[(3.81±1.28)mmol/L vs(6.13±5.22)mmol/L,t=3.0,P=0.02;(3.63±1.39)mmol/L vs(5.27±4.54)mmol/L,t=2.6,P=0.03]水平及肝/脾CT比值[肝/脾CT比值:(0.94±0.16)vs(0.74±0.18),t=5.8,P<0.01;(0.89±0.13)vs(0.70±0.20),t=5.6,P<0.01]均較各自治療前均明顯改善。治療結束時,治療組在TC、TG水平下降較對照組更為明顯,差異均有統計學意義(t值分別為3.5、2.8,P值均<0.01)。結論 殼脂膠囊能有效改善肝功能,降低血脂水平,減輕肝脂肪變性程度,且無明顯毒副作用。
脂肪肝; 殼脂膠囊; 多烯磷脂酰膽堿膠囊; 治療結果
非酒精性脂肪性肝病(NAFLD)是一種與胰島素抵抗和遺傳易感密切相關的代謝應激性肝損傷,疾病譜包括非酒精性單純性脂肪肝、非酒精性脂肪性肝炎(NASH)及其相關肝硬化和肝細胞癌[1-2]。目前,NAFLD已被認為是世界范圍內引起慢性肝病的第一位病因[3]。臨床上尚無有效的治療手段阻止其向非酒精性脂肪性肝纖維化及肝硬化進展[4]。筆者在常規基礎治療上配合殼脂膠囊治療NASH取得了較好的臨床療效,現匯報如下。
1 資料與方法
1.1 研究對象 選取2013年11月-2015年12月于本院脂肪肝門診就診的NASH患者,診斷符合2010年版《非酒精性脂肪性肝病診療指南》[5],排除酒精性肝病、自身免疫性肝病、藥物性肝病、病毒性肝炎、全胃腸外營養、肝豆狀核變性等可導致脂肪肝的特定疾病。隨機分為殼脂膠囊組(簡稱治療組)和多烯磷脂酰膽堿組(簡稱對照組)。所有患者均簽署知情同意書。
1.2 研究方法 所有患者均給予基礎治療,包括中等程度的熱量限制,肥胖成人每日熱量需減少2092~4184 kJ;低糖、低脂飲食,減少含蔗糖飲料以及飽和脂肪酸和反式脂肪的攝入并增加膳食纖維含量;每周有氧運動鍛煉至少150 min,4次以上。在上述治療基礎上,治療組加用殼脂膠囊(福瑞公司生產,規格0.25 g/粒)3次/d,5粒/次,療程24周;對照組加用多烯磷脂酰膽堿膠囊(商品名易善復,北京安萬特公司,規格228 mg/粒) 3次/d,2粒/次,療程24周。受試期間均不服用其他影響脂質代謝和護肝類藥物。
1.3 觀察指標 檢測所有患者治療前后AST、ALT、GGT、TG、TC水平及肝/脾CT比值。記錄患者治療過程中不良事件,如惡心、心悸、頭暈、腹瀉、血壓升高等。
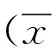
2 結果
2.1 一般資料 共納入NASH患者100例,其中男66例,女34例,年齡26.6~57.3歲,中位年齡42.7歲。治療組、對照組各50例,兩組患者的年齡、性別、BMI及各項檢測指標比較差異均無統計學意義(P值均>0.05)(表1)。
2.2 肝功能和血脂變化 兩組患者治療后血清AST、ALT、GGT、TC、TG水平較治療前均有明顯改善,差異均有統計學意義(t=2.6~10.0,P值均<0.05)。兩組患者治療后血清AST、ALT、GGT水平比較差異均無統計學意義(P值均>0.05)。而治療組TG、TC水平治療后下降較對照組更為明顯,兩組下降幅度比較差異均有統計學意義(t值分別為3.5、2.8,P值均<0.01)(表2)。
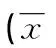
表1 兩組患者治療前各項指標比較±s)
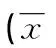
表2 兩組患者治療前后肝功能和血脂指標比較±s)
注:與同組治療前相比,1)t值分別為10.0、8.1、9.2、4.8、3.0、7.6、8.5、9.3、3.0、2.6,P<0.05
2.3 兩組肝/脾CT比值變化 治療組和對照組患者治療前后肝/脾CT比值比較,差異均有統計學意義(t值分別為5.8、5.6,P值均<0.01)。治療結束后,治療組肝/脾CT比值上升幅度較對照組更大,但兩組上升幅度比較差異無統計學意義(t=1.72,P=0.09)(表3)。

表3 兩組肝/脾CT比值變化情況比較
2.4 不良反應 治療組有1例患者服藥后出現輕度胃部不適,2例出現一過性腹瀉;對照組2例出現輕度胃部不適,上述患者經對癥處理后不良反應消失。所有患者均順利完成療程。
3 討論
單純非酒精性脂肪肝進展為NASH的機制尚未完全闡明,可能與以下幾個方面有關:(1)胰島素抵抗:胰島素抵抗可引起糖脂代謝紊亂,釋放大量游離脂肪酸,導致肝細胞線粒體腫脹和通透性增加而發生肝細胞變性壞死,進而進展至NASH。此外,胰島素抵抗也激活肝星狀細胞,從而導致肝纖維化進展[6]。(2)慢性炎癥:脂肪細胞能分泌多種脂肪細胞因子,如瘦素、TNFα等。這些細胞因子或直接促進HSC活化增殖或誘導TGFβ和血小板衍生生長因子過度表達,參與NASH纖維化的發生發展[7]。(3)氧化應激:氧自由基、活性氧的釋放可引起肝細胞脂質過氧化、細胞膜損傷,加重胰島素抵抗并導致促炎因子信號通路激活,進一步刺激脂質生成。(4)血管生成:炎癥反應、血管生成和纖維生成三者之間可相互作用影響。新生血管的增多與NASH纖維化的發生相平行。隨著肥胖及2型糖尿病人群的增加,NAFLD發病率越來越高,由此引起的終末期肝病及原發性肝癌大大地增加了社會負擔和挑戰[8]。因此對NASH的早期藥物干預,延緩肝纖維化的進展及肝癌的發生尤為重要。NASH的藥物治療主要包括胰島素增敏劑、抗氧化劑、肝細胞保護劑等,但保肝抗炎藥物在NASH防治中的作用和地位至今仍有爭論[9]。《非酒精性脂肪性肝病診療指南》[5]指出,在基礎治療的前提下,保肝抗炎藥物作為輔助治療可用于確診NASH患者,建議根據疾病活動度和病期以及藥物效能和價格,合理選用1~2種中西藥物,療程通常需要6~12個月以上。
根據NASH的發展特點和臨床表現可將其歸納為中醫的脅痛、痞滿、積聚、肝癖、肥氣等范疇[10]。病因多責之于飲食不節、嗜食肥甘厚味、好逸惡勞、情志失調或外感濕熱之邪等,引起脾失運化,痰濁內生;肝郁氣滯,血瘀阻絡;兼肝膽濕熱,久病損腎入絡[11]。因此有研究[12]發現NAFLD的整個病變過程可歸納為脾虛濕痰—濕熱內蘊—痰瘀互結—肝腎陰虛發展的趨勢。殼脂膠囊以甲殼為君藥,育陰潛陽、消積行瘀;制首烏滋補肝腎,丹參活血化瘀為臣藥;茵陳清熱利濕;牛膝既助君藥補益肝腎,又引藥下行為佐使藥。全方配伍,共奏補益肝腎,活血散結,清化濕濁之效[13]。
殼脂膠囊是目前為數不多的經國家藥監局批準用于治療NAFLD的中藥之一,既往有學者對殼脂膠囊治療NASH的作用機制進行了探索。王榮琦等[14]研究發現,NASH模型小鼠經殼脂膠囊干預后,肝脂肪變及炎癥、纖維化反應明顯減輕,轉氨酶下降,血清瘦素水平明顯降低,且殼脂膠囊可降低肝組織織血紅素氧合酶1和細胞色素P4502E1的表達,減輕氧化應激和脂質過氧化反應,阻止NASH 的發生發展。趙唯含等[15]研究發現,殼脂膠囊可能通過上調肝組織過氧化物酶體增殖物激活受體γ及其mRNA、胰島素受體及其mRNA的表達可改善胰島素抵抗,進而調解脂肪代謝,改善肝功能,達到防治NASH的目的。
本研究證實殼脂膠囊在改善肝功能、減輕肝脂肪變性程度方面療效與多烯磷脂酰膽堿膠囊相當,在降低血脂水平方面優于多烯磷脂酰膽堿膠囊,且觀察期間無明顯毒副作用,不良反應輕微,安全性較高,值得臨床進一步推廣。
[1] FANELL CC, LATER CZ. Nonaleoholie fatty liver disease:from steatosis to cirrhosis[J]. Hepatology, 2006, 43 (2): 99-112. [2] de ALWIS NM, DAY CP. NON-aleoholic fatty liver disease: the mist graduaJly clears[J]. J Hepatol, 2008, 48(Suppl 1): 104-112.
[3] Review Team, LABRECQUE DR, ABBAS Z, et al. World Gastroenterolopy Organiastion Global Guidelines: nonalcoholic fatty liver disease and nonalcoholic steatohepatitis[J]. J Clin Gastroenterol, 2014, 48(6): 467-473.
[4] SCHERER A, DUFOUR JF. Treatment of non alcoholic fatty liver disease[J]. Dig Dis, 2016, 34(Suppl 1): 27-31.
[5] The Chinese National Workshop on Fatty Liver and Alcoholic, Liver disease for the Chinese Liver Disease Association. Guidelines for the diagnosis and treatment of nonalcoholic fatty liver disease[J]. J Clin Hepatol, 2010, 26(2): 120-124. (in Chinese) 中華醫學會肝病學分會脂肪肝和酒精性肝病學組. 非酒精性脂肪性肝病診療指南[J]. 臨床肝膽病雜志, 2010, 26(2): 120-124.
[6] ROMBOMS K, MARRA F. Molecular mechanisms of hepatic fibrosis in non-alcoholic steatohepatitis[J]. Dig Dis, 2010, 28(1): 229-235.
[7] KUKLA M, CIUPINSKA-KAJOR M, KAJOR M, et al. Liver visfatin expression in morbidly obese patients with nonalcoholic fatty liver disease undrgoing bariatric surgery[J]. Pol J Pathol, 2010, 61(3): 147-153.
[8] PAIS R, BARRITT AS, CALMUS Y, et al. NAFLD and liver transplantation: current burden and expected challenges[J]. J Hepatol, 2016, 65(6): 1245-1257.
[9] DRAPKINA OM, DEEVA TA, VOLKOVA NP, et al . Current approaches to diagnosing and treating nonalcoholic fatty liver disease[J]. Ter Arkh, 2014, 86(10): 116-123.
[10] MA JM, WANG JQ. Treatment of non-alcoholic fatty liver disease from deficiency[J]. J Changchun Univ Tradit Chin Med, 2014, 30(5): 850-852. (in Chinese) 馬菁蔓, 王景朱. 從虛論治非酒精性脂肪肝[J]. 長春中醫藥大學學報, 2014, 30(5): 850-852.
[11] WANG RB. Traditional Chinese medicine treatment of liver diseases[J]. J Clin Hepatol, 2015, 31(1): 2-6. (in Chinese) 王融冰. 肝病的中醫藥治療[J]. 臨床肝膽病雜志, 2015, 31(1): 2-6.
[12] ZHANG Y, XU SH. Pathogenic mechanism associated with insulin resistance and adiponectin abnormality in carotid atherosclerosis patients complicated with nonalcoholic fatty liver disease and their relationships with traditional Chinese medical syndrome types[J] . J Guangzhou Univ Tradit Chin Med, 2009, 26(5): 499-504. (in Chinese) 張毅, 徐尚華. 頸動脈粥樣硬化與非酒精性脂肪肝的胰島素抵抗、脂聯素異常相關機制及與中醫證型關系分析[J]. 廣州中醫藥大學學報, 2009, 26(5): 499-504.
[13] YANG YW, XIAO GM, ZHAO BM, et al. Randomized study of kezhi capsules in treating non-alcoholic fatty liver [J]. The J Pract Med, 2014, 30(4): 638-640. (in Chinese) 楊躍武, 肖閣敏, 招柏明, 等. 殼脂膠囊治療非酒精性脂肪肝的隨機對照研究[J]. 實用醫學雜志, 2014, 30(4): 638-640.
[14] WANG RQ, NAN YM, ZHAO SX, et al. Effects of Kezhi capsule on oxidative stress in mice with non-alcoholic steatohepatitis[J]. Chin Hepatol, 2011, 16(3): 216-219. (in Chinese) 王榮琦, 南月敏, 趙素賢, 等. 殼脂膠囊對小鼠非酒精性脂肪性肝炎氧化應激的影響[J]. 肝臟, 2011, 16(3): 216-219.
[15] ZHAO WH, YU YQ, LIU LJ, et al. Experimental study of Kezhi capsule on PPAR-γ and IR expression in non-alcoholic steatohepatitis rats[J]. Chin J Integr Trad West Med Dig, 2014, 22(9): 8-10. (in Chinese) 趙唯含, 余軼群, 劉麗娟, 等. 殼脂膠囊對非酒精性脂肪性肝炎大鼠肝組織PPAR-γ、IR的作用研究[J]. 中國中西醫結合消化雜志, 2014, 22(9): 8-10.
引證本文:NING HM, OU Q, HUANG L, et al. Clinical effect of Kezhi capsules in treatment of nonalcoholic steatohepatitis[J]. J Clin Hepatol, 2017, 33(1): 137-140. (in Chinese) 寧惠明, 歐強, 黃玲, 等. 殼脂膠囊治療非酒精性脂肪性肝炎的效果觀察[J]. 臨床肝膽病雜志, 2017, 33(1): 137-140.
(本文編輯:王亞南)
Clinical effect of Kezhi capsules in treatment of nonalcoholic steatohepatitis
NINGHuiming,OUQiang,HUANGLing,etal.
(DepartmentofInfectiousDiseases,TheEighthPeople′sHospitalofShanghai,Shanghai200235,China)
Objective To investigate the clinical effect and safety of Kezhi capsules in the treatment of nonalcoholic steatohepatitis (NASH). Methods A total of 100 patients with NASH who visited The Eighth People′s Hospital of Shanghai from November 2013 to December 2015 were enrolled and randomly divided into treatment group and control group, with 50 patients in each group. The patients in the treatment group were treated with Kezhi capsules and those in the control group were treated with polyene phosphatidylcholine capsules. The course of treatment was 24 weeks for each group. The changes in liver function, blood lipid, and liver/spleen CT ratio after treatment were observed in both groups. The two-independent-samplesttest was used for comparison of continuous data between groups, and the paired-samplesttest was used for comparison of continuous data within each group. The chi-square test was used for comparison of categorical data between groups. Results After treatment, the treatment group and the control group had significant improvements in the levels of aspartate aminotransferase (49.2±21.7 U/L vs 119.5±44.2 U/L,t=10.0,P<0.01; 52.4±33.1 U/L vs 115.2±48.3 U/L,t=7.6,P<0.01), alanine aminotransferase (41.8±14.8 U/L vs 92.8±42.1 U/L,t=8.1,P<0.01; 42.9±16.6 U/L vs 95.3±40.4 U/L,t=8.5,P<0.01), gamma-glutamyl transpeptidase (52.3±23.7 U/L vs 168.4±85.9 U/L,t=9.2,P<0.01; 54.8±30.2 U/L vs 177.6±88.7 U/L,t=9.3,P<0.01), triglyceride (TG) (1.78±1.01 mmol/L vs 3.52±2.35 mmol/L,t=4.8,P<0.01; 2.51±1.08 mmol/L vs 3.65±2.43 mmol/L,t=3.0,P=0.02), total cholesterol (TC) (3.81±1.28 mmol/L vs 6.13±5.22 mmol/L,t=3.0,P=0.02; 3.63±1.39 mmol/L vs 5.27±4.54 mmol/L,t=2.6,P=0.03), and liver/spleen CT ratio (0.94±0.16 vs 0.74±0.18,t=5.8,P<0.01; 0.89±0.13 vs 0.70±0.20,t=5.6,P<0.01). There were significant differences in these parameters between the two groups. At the end of treatment, the treatment group had significantly greater reductions in TC and TG levels than the control group (t=3.5 and 2.8, bothP<0.01). Conclusion Kezhi capsules can effectively improve liver function, reduce blood lipids, and reduce the degree of fatty degeneration of the liver, without significant toxic and side effects.
fatty liver; Kezhi capusule; polyene phosphatidylcholine capusule; treatment outcome
10.3969/j.issn.1001-5256.2017.01.030
2016-08-12;
2016-09-12。
寧惠明(1979-),男,主治醫師,主要從事感染性疾病診斷和治療方面的研究。
歐強,電子信箱:ouqiang76@163.com。
R575.5; R286
A
1001-5256(2017)01-0137-04

