晚期眼MALT淋巴瘤單純放療后產生遠位效應1例
王蘊龍,朱珊珊,于 雷,邱 玲,馬 巖,賈曉晶
(吉林大學第二醫院 放療科,吉林 長春130041)
晚期眼MALT淋巴瘤單純放療后產生遠位效應1例
王蘊龍,朱珊珊,于 雷,邱 玲,馬 巖,賈曉晶*
(吉林大學第二醫院 放療科,吉林 長春130041)
1 病例資料
患者呂某某,男,81歲,5年前因雙眼框內腫物多次于我院眼科行手術治療,并于2010年3月10日再次行右眼框內腫物摘除術后病理確診為(右側框內)粘膜相關組織(MALT)型,節外邊緣區B細胞淋巴瘤,免疫組化染色結果:CD20(+)、CD79a(+)、CD3(灶狀+)、CD2(灶狀+)、CD21(灶狀+)、CK(AE1/AE3)(-)、Bcl-6(灶狀+)、Bcl-2(+)、CD10(-)、CD30(-)、MUM1(灶狀+)、Ki67(陽性率50%)、Kappa(+)、Lambda(-)。術后1年內雙眼腫物再次復發,收入我院放療科分別給予眼部腫物及手術瘤床區域放療,靶區劑量為56Gy/28F,放療后復查眼眶CT見腫物消失后出院。于2010-12-23發現后背部有一紅色斑片狀皮膚略隆起(追問病史后背皮膚紅斑腫塊病史1年半),考慮皮膚受侵,取病理確診為MALT淋巴瘤。于外院給予2周期chop方案化療后達CR。后患者病情控制良好,至2015年04月29日因“無明顯誘因出現呼吸困難1周,伴雙下肢水腫3天”再次入我院放療科,給予吸氧、利尿、抗水腫等對癥治療后,復查頸部、胸部CT檢查示:頸部、肺部、縱隔及腋窩淋巴結腫大,符合淋巴瘤。確診為遠地多處轉移,因患者病期晚、身體狀態差,僅針對縱隔及肺門較大病灶給予姑息性放療,靶區劑量DT:40Gy/20F,頸部及其他部位未給予放射治療(治療GTV范圍如圖1)。治療達處方劑量后復查頸部、肺部CT,見靶區內腫瘤明顯縮小,臨床療效達到CRu,頸部及腋窩轉移淋巴結區域雖未給予照射,淋巴結亦出現明顯縮小,頸部腫瘤體積由75.15 cm2減小至15.32 cm2,效果也達到CRu標準(如圖2)。治療結束后患者至今健在。
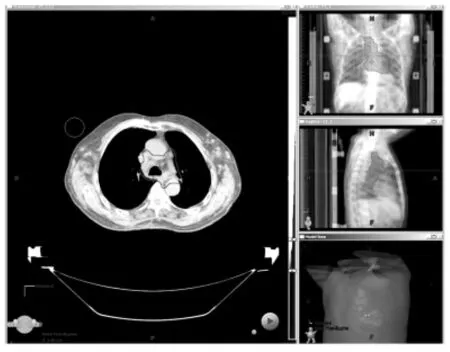
圖1 肺部、縱隔淋巴結治療GTV范圍
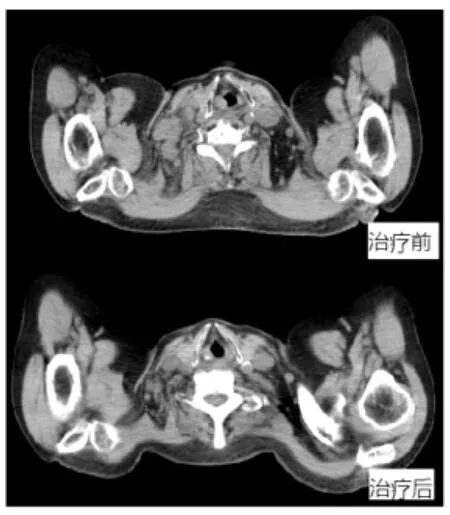
圖2 頸部淋巴結(放療區域外)放療前后對比
2 討論
眼黏膜組織相關性淋巴瘤(Mucosa-associated lymphoid tissue lymphoma,MALT)是一種罕見的惡性淋巴瘤,大約占所有附屬器淋巴瘤8%,其中大多數(80%以上)是黏膜相關淋巴組織型淋巴瘤(MALT淋巴瘤)[1]。它具有病程長、進展慢、對放、化療敏感等特點。一般患者生存期較長,5年總生存率大于90%。放射治療在疾病發展的整個治療過程中都有著重要的地位。遠位效應也是一種罕見的現象,即在腫瘤局部放療過程中,照射野外沒有接受放療的腫瘤病灶也出現了縮小甚至消失。本文患者確診后6年內多次治療后發生多處遠地轉移,末次治療僅給予局部姑息性放療后多處未經放療的轉移病灶亦出現縮小并達到CRu標準(依據惡性淋巴瘤的Cheson療效判定標準),符合典型的遠位效應現象。
放射治療作為治療MALT淋巴瘤的主要手段,無論早期局限腫瘤的根治性放療,手術切除后的術后放療,腫瘤復發的補救性放療都能達到良好的治療效果。而對于晚期多發轉移的患者,姑息性放療雖然可以達到良好的效果,但因病灶侵及不同組織器官,放療無法完全覆蓋,使得多發轉移成為影響預后的主要因素。隨著腫瘤免疫治療領域的發展,放療引起的免疫系統介導的遠位效應越來越受到大家的關注,遠位效應的發現使得單純通過放療或聯合免疫治療達到控制全身轉移病灶成為可能。
近期國內外成果逐漸證實,適當條件下給予合適劑量分割的局部放療,可激活全身抗腫瘤免疫系統[2]。尤為突出的2篇國外文獻[3,4]表明了通過局部放療,可以促進T細胞活化,使已存在的特異性抗體數量增加,全新的抗腫瘤特異性抗體出現,從而達到全身抗腫瘤作用。之后遠觀效應相關報道逐漸增多,放療引起遠觀效應的具體機制也產生了多種觀點,主要有以下幾種:①放射線可作用于腫瘤細胞,促使其原有抗原表達量增多,并產生新的特異性抗原,從而激活抗腫瘤免疫反應[5]。②局部放療后,死亡的腫瘤細胞會釋放出HMGB-1因子,它能與TLR4結合,促進抗原呈細胞(APC)的成熟,消除腫瘤的免疫抑制,使免疫系統恢復抗腫瘤作用。③放療(尤其是單次大劑量照射)可以對腫瘤的血管、基質造成巨大破壞,內皮細胞的損傷與腫瘤細胞的凋亡可以促進抗原的釋放、呈遞,增強免疫應答[6]。
雖然局部放療激活免疫系統殺傷腫瘤產生遠觀效應的現象的報道逐漸增多,但大多數都聯合應用了免疫治療,其中無法衡量免疫治療與放療引起遠觀效應的比重,免疫治療本身就具有全身治療的特性,而本例患者確診腫瘤多發轉移僅給予局部姑息放療,未給予其他全身治療即引起遠觀效應而使全身腫瘤產生消退在國內外未見報道,綜合分析此患者具有以下特點:①眼附屬器MALT淋巴瘤屬于低度惡性淋巴瘤,相對增值速度較慢,如果自身機體抗腫瘤免疫機制被激活,免疫逃逸狀態被解除,達到對全身病灶的控制是極有可能的。②淋巴瘤對放射治療敏感,放療作用于腫瘤組織后可在短期之內使一部分腫瘤死亡,腫瘤的迅速崩解壞死使得腫瘤具有抗原性的分子得以完整保留,繼而釋放后激活抗原的識別以及免疫反應。③接受放療次數多,使抗原暴露呈遞的機會增加,且易形成較多的記憶細胞,腫瘤通過釋放免疫抑制因子可以形成免疫抑制,但一旦放療引起免疫抑制解除,會迅速激活免疫系統形成全身免疫反應。④遠觀效應產生時4年內未行化療(因年齡較大)免疫系統,沒有受到化療影響。在放療引起腫瘤免疫應答需要的條件尚不明確的情況下,以上幾點可能為產生遠觀效應創造了條件。現階段放射治療聯合免疫治療已成為熱點,動物實驗與前期臨床試驗已獲得顯著成果,這也給腫瘤綜合治療帶來了新模式,但仍需探討放療激活抗腫瘤免疫反應的條件,為今后治療的療效提供保障。
[1]McKelvie PA.Ocular adnexal lymphomas:a review[J].Adv Anat Pathol,2010,17(4):251.
[2]Weiss EM,Wunderlich R,Ebel N,et al.Selected anti-tumor vaccines merit a place in multimodal tumor therapies[J].Front Oncol,2012,2:132.
[3]Postow MA,Callahan MK,Barker CA,et al.Immunologic correlates of the abscopal effect in a patient with melanoma[J].N Engl J Med,2012,366(10):925.
[4]Stamell EF,Wolchok JD,Gnjatic S,et al.The abscopal effect associated with a systemic anti-melanoma immune response[J].Int J Radiat Oncol Biol Phys,2013,85(2):293.
[5]于金明,滕菲菲.放療與免疫治療聯合應用的相關機制及研究進展[J].中國腫瘤臨床,2014,41(9):547.
[6]Shankar Siva,Michael P,et al.Abscopal effects of radiation therapy:A clinical review for the radiobiologist.[J].Cancer Letters,2015,356:82.
1007-4287(2017)01-0045-02
王蘊龍,吉林大學第二醫院腫瘤學在讀研究生.
2015-10-23)
*通訊作者

